修饰的滤膜和方法与流程
背景技术:
已经设计了各种过滤器和方法以将生物分子与杂质或污染物分离。基于尺寸排阻的过滤是一种理想的且有效的技术,用于从生物制造过程的生物反应器中清除源自哺乳动物细胞、血浆、动物/人类组织液或细胞培养液的小颗粒和病毒。当前的过滤技术可以清除各种污染物和直径超过15nm的病毒颗粒。然而,迄今为止,尚不存在有效或强大地清除小于该尺寸的颗粒和组织液的技术或过滤器。例如,小病毒和非包膜病毒(例如细小病毒和圆环病毒)很难从生物溶液中清除。这些小颗粒、病毒和痕量污染物会在生物制剂生产中引起问题,因为它们可以通过细胞培养和/或生产制造周期进行扩增。此外,当粗溶液或条件变化并且蛋白质分子大小较大且蛋白质浓度非常低时,通过病毒过滤器和方法很难获得高且一致的生物产品回收率。这些和其他问题已由本实施方案解决。
发明概述
实施方案提供了修饰的滤膜,用于清除小颗粒和其他未知或未鉴定的污染物,例如存在于粗溶液中的,需要将其与目标生物产品分离的病毒。
实施方案还提供了用于分离生物产品和病毒污染物的粗溶液的修饰的滤膜,其包括具有纤维素基多孔表面的滤膜,和至少一种二价金属离子结合在滤膜的纤维素基多孔表面上,以形成修饰的滤膜纤维素基多孔表面,其中所述修饰的纤维素基多孔表面通过截留直径大于15nm的病毒污染物同时允许直径小于15nm的生物产品通过来分离粗溶液。
实施方式还提供了使用修饰的滤膜过滤生物产品和病毒污染物的粗溶液的方法,包括在滤膜多孔表面上加入二价金属离子以形成孔径在1至15nm范围内的修饰的滤膜多孔表面;以及通过修饰的滤膜的多孔表面过滤生物产品和病毒污染物的粗溶液,其中修饰的滤膜将病毒污染物截留在多孔表面上,同时允许生物产品通过。
其他实施方案可任选地包括添加吐温80,以进一步增强滤膜分离的组合物和方法,并增加从粗溶液中分离的生物产品的产率。
附图简述
本领域技术人员将理解,以下描述的附图仅用于说明目的。附图无意以任何方式限制本教导或权利要求的范围。
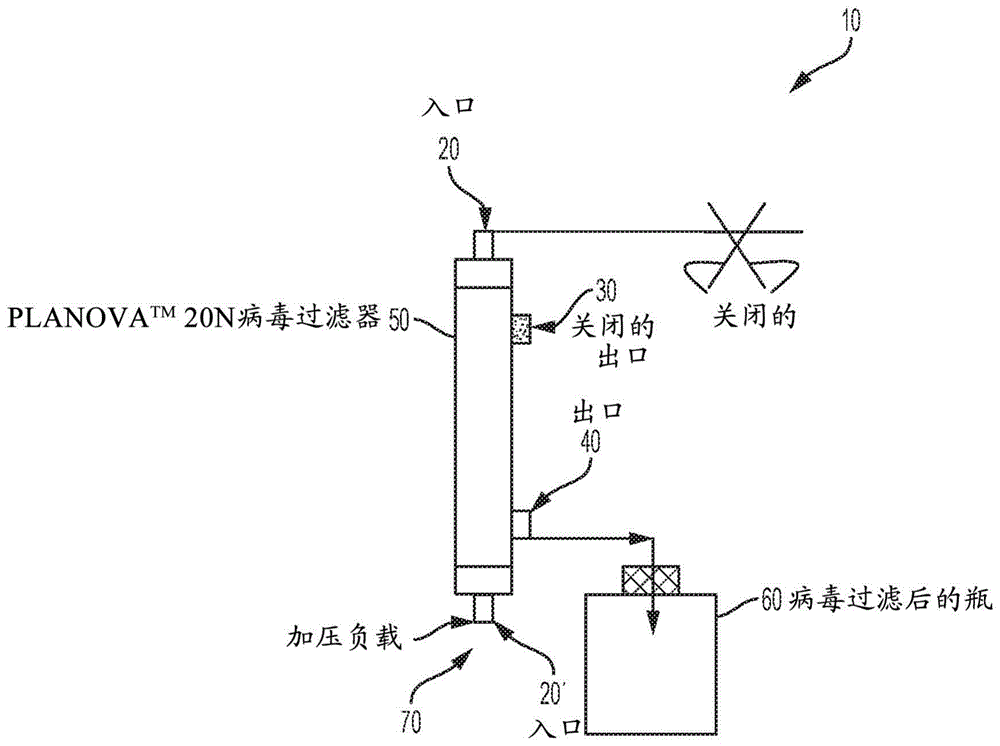
图1显示了使用病毒滤膜(例如planovatm20n)的过滤系统。经由压力源(例如压缩空气或蠕动泵)将过滤器负载材料施加到再生的硝酸纤维素中空纤维膜上。滤液收集在收集容器中。
图2显示了未修饰的病毒滤膜的多孔表面的增强部分。
图3显示了用于二价金属离子增强的病毒过滤的方法。
图4显示了二价金属离子纤维素基的过滤器的各种提出的机理。
图5显示了在负载中存在cacl2时,用病毒滤膜可增强掺入的ppv的清除。(a)过滤缓冲液为20mm咪唑,300mmnacl,43mmcacl2,ph=6.9-7.1。(b)过滤缓冲液为20mm咪唑,375mmnacl,ph=6.9-7.1。a和b均在环境温度恒定压力(12-14psi)下进行。
图6显示,吐温80的存在和过滤温度对病毒滤膜清除掺入的ppv的影响不大。(c)在环境温度(15-26℃)用20mm咪唑、300mmnacl、43mmcacl2、50ppm吐温80过滤,ph=6.9-7.1。(d)在2-8℃用20mm咪唑、300mmnacl、43mmcacl2、50ppm吐温80过滤,ph=6.9-7.1。(e)在室温用20mm咪唑、300mmnacl、43mmcacl2过滤,ph=6.9-7.1。(f)在2-8℃用20mm咪唑、300mmnacl、43mmcacl2过滤,ph=6.9-7.1。
图7显示不同的缓冲液系统的选择对病毒滤膜对掺入的ppv的清除没有显著影响。(g)在室温用20mm咪唑,300mmnacl,43mmcacl2过滤,ph=6.9-7.1。(h)在室温用20mmtris,300mmnacl,43mmcacl2过滤,ph=6.9-7.1。(i)在室温用50mmtris,50mmnacl过滤,ph=6.9-7.1。(j)在室温用50mm柠檬酸,50mmnacl过滤,ph=6.6-6.8.
图8显示了在不同的cacl2浓度下用病毒滤膜从掺入ppv的igg2抗体负载中(在50mmtris、50mmnacl中为5.7-8.1mg/ml,ph6.9-7.1)清除病毒作用的增强,以及edta螯合剂对增强作用的逆转。
图9显示了在不同的cacl2浓度下用病毒滤膜从掺入ppv的igg1抗体负载中(在50mm柠檬酸、50mmnacl中为4.9-13.1mg/ml,ph6.6-6.8)清除病毒作用的增强,以及egta螯合剂对增强作用的无逆转。
图10显示了用病毒滤膜从掺入ppv的rfviii过程中间体(在20mm咪唑、300mmnacl、43mmcacl2、50ppm吐温80中约0.1mg/ml,ph=6.9-7.1)中完全清除ppv(至低于检测极限)。
图11显示了当使用病毒滤膜时,吐温80对重组人因子viii的产率一致性的改善。
图12显示了在施加重组人因子viii负载的情况下吐温80对病毒滤膜容量(vmax)的增强。
发明详述
本公开内容提供了用于从溶液中清除小颗粒和病毒污染物的组成物,包括修饰的滤膜。
定义
为了解释本说明书,将采用以下定义。如果以下列出的任何定义与任何其他文件(包括通过引用并入本文的任何文件)中该词的用法相冲突,除非明确指出相反的含义(例如,在最初使用该术语的文档中),否则应始终以下文中列出的定义为准来解释本说明书及其相关权利要求。
只要适当,以单数形式使用的术语也将包括复数形式,反之亦然。除非另有说明,或者在使用“一个或多个”显然不合适的情况下,本文中“一个”的使用表示“一个或多个”。除非另有说明,否则“或”的使用表示“和/或”。“包含”,“包括”和“含有”的使用是可互换的,而不是限制性的。术语“如”和“例如”也并非是限制性的。例如,术语“包括”应表示“包括但不限于”。
如本文所用,术语“粗溶液”或“粗负载”通常是指包含一种或多种生物材料或分子的未加工或未纯化的溶液或材料。在此溶液或材料中还可能存在一种或多种先前可能已经识别或可能尚未识别的污染物。例如,病毒可能是“粗溶液”中存在的一种污染物。还可以预期,“粗溶液”还包含可能存在或希望与目标生物产品分离的其他病原体和污染物。
如本文所用,术语“约”是指所提供的单位值的+/-10%。
如本文所用,术语“基本上”是指表现出所关注的特征或特性的总体或近似程度的定性条件。生物学领域的普通技术人员将理解,由于许多影响生物产品、化学成分和材料的测试、生产和储存的变量,并且由于用于测试、生产和储存生物产品和化学成分及材料的仪器和设备存在固有误差,生物产品和化学现象很少(如果有的话)获得或避免绝对结果。因此,术语“基本上”在本文中用于表达许多生物学和化学现象中固有的潜在完整性缺乏。
过滤系统:
所描述的实施方案可以多种方式修改和改变。所描述的系统绝不应限制可能的应用和实施方案的范围。参考图1,本实施方案的过滤系统10提供入口20或20',关闭的出口30,开放的出口40,滤膜例如planovatm20n病毒过滤器50,以及至少一个收集容器60。过滤系统10还具有加压负载入口70,在该负载入口70中,可以将粗负载加载到系统中并置于压力下以将生物产品22与污染物分离(生物产品22未在图1中示出)。
滤膜:
实施方案提供了一个或多个可构造或购买的滤膜50的用途。例如,滤膜50可具有包含纤维素、再生纤维素和/或硝酸纤维素基材料或组合物的多孔表面。另外,本实施方案的滤膜可以包含asahi
具有包含未修饰的纳米孔径直径的多孔表面的再生的纤维素基滤膜具有相对较高的容量和低成本。再生纤维素膜的多孔表面的增强视图如图2所示。典型的多孔表面可包括形状和尺寸不同的孔径。例如,未修饰的多孔表面孔径的直径范围可以为1至500nm。其他可能的孔径也是可能的。多孔表面和孔径可以变化,并且通常不能有效地将生物产品与其他蛋白质或污染物分离。在许多情况下,过滤器孔径太大或病毒直径太小。在任一种情况下,从病毒或其他污染物中分离出生物产品22都特别困难。
可以预期的是,本实施方案可以包括各种类型的纤维素基过滤器。纤维素是具有不确定数目的葡萄糖部分的线性多糖。通过经典的粘胶技术或铜铵法或n-甲基吗啉-n-氧化物(nmmo)法将纤维素转化为纤维素衍生物(醚和酯)和再生材料(纤维,薄膜等)。通过铜铵(cuprammonium)法生产纤维素再生材料会引入通过cu2+桥与纤维素的羟基络合的铜氨(cuprammonia)(h2n-cu2+-nh2)。从理论上讲,这种结构可以为钙离子提供潜在的结合位点(见图4)。
修饰的滤膜:
需要对滤膜进行修饰,以使其能够有效地将生物产品与污染物分离。本实施方案要求将一种或多种二价离子键合或附着到滤膜50上,以产生本实施方案的修饰的滤膜50’。可以将二价离子添加到测定溶液中,并且可以包含cu2+、ca2+和zn2+。本领域已知的其他类似的二价离子可用于本实施方案。
提出的机制:
对于本实施方案而言重要的是,修饰的滤膜50'提供了能够从粗负载溶液中将污染物从目标生物产品22分离出的功能性能力。
通过二价金属离子(例如ca2+离子)提高病毒截留能力的机制尚不十分清楚。一种理论认为,在纤维素再生过程中发生氧化,导致纤维素链的还原端形成羧基。通过羧基的解离,再生纤维素纤维可以充当弱阴离子交换剂,因此所有类型的再生纤维素纤维(如莱赛尔(lyocell)纤维、粘胶纤维和莫代尔纤维(modalfiber))都显示独特的结合ca2+离子的能力。一种可能性是ca2+离子与羧基的结合可能明显“缩小”纤维素膜上的孔,并使病毒更难以通过。我们进一步提出,其他二价离子(例如cu2+)对于再生纤维素膜可能具有类似的增强病毒清除的效果,尤其是当使用铜铵法进行再生时,纤维素中仍存在少量的残留cu2+。一些提出的机制表明病毒污染物中的asp或glu残基与修饰的滤膜结合,如图4所示。二价金属离子,即cu2+或ca2+与再生的多孔纤维素膜中的羟基以及病毒污染物中asp或glu的羧基相互作用,导致病毒与滤膜结合。在生物溶液的过滤试验中,当使用再生纤维素过滤器时,单独的尺寸排阻通常会对细小病毒产生约3-5lrf。一旦使用一定水平的二价金属离子,就可以实现额外的2-4lrf和/或完全清除ppv。
如上所述的修饰的滤膜50'可以包括纤维素或再生的纤维素基多孔表面。在未修饰的形式中,滤膜的孔通常可以具有1-500nm范围内的孔直径。滤膜一旦被修饰,就可以改变其孔径。修饰后的孔径可能在1至15nm的范围内。应当理解,这些仅仅是一些一般的估计,并且其他可能性和尺寸在本实施方案的范围内。
病毒污染物和小颗粒:
此外,还可以预期的是,本实施方案的修饰的滤膜50'可以用于从污染物中分离出许多不同类型的生物产品。污染物可以包括任意数量的已知或未知的生物材料、小颗粒和/或病原体。例如,病毒呈现出一种特别困难的污染物类型,需要将其与生物产品小心分离。与本实施方案有关的各种类型的病毒可以是dna和/或rna病毒。例如,病毒污染物可包括选自环病毒科、腺病毒科、细小病毒科、乳多空病毒科、疱疹病毒科、痘病毒科(poxiviridae)和指环病毒科的dna病毒。
此外,病毒污染物还可以包括rna病毒,该rna病毒选自小rna病毒科、杯状病毒科、呼肠孤病毒科、披膜病毒科、沙粒病毒科、黄病毒科、布尼亚病毒科、正粘液病毒科、副粘液病毒科、纤丝病毒科、冠状病毒科、动脉炎病毒科、肝炎病毒科(hepeviridase)和逆转录病毒科。
其他可能的病毒污染物也是本领域中预期和已知的。本列表绝不应限制本实施方案的范围。
生物产品:
本实施方案和修饰的滤膜50'可以用于从生物产品22中分离各种污染物。可以分离的生物产品22可以包括抗体、蛋白质、肽、配体和受体。可以从病毒污染物中分离出各种类型的抗体类别。例如,本实施方案对于igg1和/或igg2抗体负载是有效的。此外,某些蛋白质和蛋白质片段可包括因子viii和相关的片段和/或截短或缺失的蛋白质和部分。
过滤方法:
上文中已经描述了过滤系统10和滤膜50以及修饰的滤膜50'的组成,此处是为了描述如何将本发明的实施方案用于从目标生物产品22中分离污染物。参考图3,现在将进一步描述本实施方案的方法。本实施方案的方法首先是制备要加载到过滤系统10中的粗负载溶液12(未示出)。粗负载溶液12包含具有一种或多种污染物的目标生物产品22。污染物可以是其他蛋白质或生物材料和/或病毒。还存在于粗负载溶液12中的是测定缓冲液,其可以包含吐温80或一种或多种其他赋形剂、以及至少一种二价金属离子,例如ca2+。
粗负载溶液12被加载在入口或进入口70处,在该处其可以处于压力下并暂时存储在收集室14中。然后将粗负载溶液12置于高压下并穿过第一连接管16直到其接触滤膜50。存在于粗负载溶液和测定缓冲液中的任何二价金属离子结合至滤膜50的多孔表面,从而将其变为修饰的滤膜50'。然后将病毒或污染物结合到修饰的滤膜50'上,同时目标生物产品22可以穿过第二连接管18进入收集容器60。然后可以从收集容器60收集目标最终生物产品22。
实施例
实施例1–过滤缓冲液
为了实现完全的病毒截留,生物溶液包含中性ph缓冲剂、氯化钠、至少一种二价金属离子,即ca2+、cu2+。其他成分(例如非离子型清洁剂)可能有助于过滤过程和病毒污染物的清除。以下缓冲液通常用于过滤缓冲液基质评估。也可以使用本领域已知的其他缓冲液。
20mm咪唑,300mmnacl,43mmcacl2,ph=6.9-7.1;
20mm咪唑,375mmnacl,ph=6.9-7.1;
20mm咪唑,300mmnacl,43mmcacl2、50ppm吐温80,ph=6.9-7.1;
20mmtris,300mmnacl,43mmcacl2,ph=6.9-7.1;
50mmtris,50mmnacl,ph=6.9-7.1;
50m柠檬酸,50mmnacl,ph=6.6-6.8。
过滤缓冲液可以是制备的或购买的。所有化学品(例如咪唑、tris、柠檬酸、氯化钠、氯化钙、吐温80、edta和egta)均购自fisherscientific。每种缓冲液的制备是在环境温度下进行的,方法是使用天平或量筒量取适量的每种组分,在500ml或1000ml容器中将所有成分溶解并混合于纯净水中,溶液体积接近制备目标。用ph计测量缓冲液的ph,并使用hcl或naoh溶液调节至目标ph范围。通过加入纯净水使最终的缓冲液达到目标体积。还用电导仪测量每种制备的缓冲液的电导率。使用前,将每种制备的缓冲液通过0.22μm过滤器过滤。
实施例2–igg1过滤负载材料
50mm柠檬酸、50mmnacl,ph6.6-6.8中的4.9-13.1mg/ml重组人igg1。该材料从拜耳制造工厂获得。它是一种过程中间体样品,即来自纯化过程中阳离子交换柱步骤的洗脱物。
实施例3–igg2过滤负载材料
在其他地方获得50mmtris、50mmnacl,ph6.9-7.1中的5.7-8.1mg/ml重组igg2。它是一种过程中间体样品,即来自纯化过程中阴离子交换膜吸附器步骤的流过物(flowthrough)。
实施例4–重组fviii负载材料
20mm咪唑、300mmnacl、43mmcacl2、0-100ppm吐温80,ph=6.9-7.1中的0.1mg/ml重组人因子fiii(rfviii)。该材料在其他地方获得。它是一种过程中间体样品,即来自纯化过程中阳离子交换柱步骤的洗脱物。
实施例5–病毒原种
ppv(nadl-2菌株,atcc#vr-742)原种购自bioreliance(rockville,md)。在使用前,使用50%组织培养物感染剂量(tcid50)测定法确认了供应商认证的病毒滴度(titer)。用于掺加病毒过滤器用的负载材料的病毒原种约为10log10tcid50/ml。
实施例6–细胞系和培养基
pk13(atcc#crl-6489)细胞系购自atcc。dulbecco的改良eagle培养基(dmem)、胎牛血清(fbs)和青霉素/链霉素(例如100x)购自fisherscientific。通过在无菌容器中混合适当体积的组分,然后通过0.22μm过滤器过滤,来制备用于pk13细胞培养和ppvtcid50测定的培养生长培养基和2x测定培养基。最终制备的生长培养基是dmem,10%fbs,100μg/ml青霉素/链霉素。最终制备的2x测定培养基为dmem,4%fbs,200μg/ml青霉素/链霉素。
测定实施例
实施例1–过滤过程
通过病毒滤膜的过滤过程是通过压缩空气或设置为恒定压力的蠕动泵(例如scilogfiltertec泵)驱动的(见图1)。在使用之前,使用本领域已知的气泡点法测试过滤器的膜完整性。用水冲洗病毒过滤器,并用适当的病毒过滤缓冲液平衡。
然后将生物负载材料以12至14psi的恒定压力施加到未经修饰的病毒过滤器上。加载完成后,进一步向过滤器追加(chasewith)病毒过滤缓冲液。收集来自追加液(chase)的流出物,并将其与负载步骤的滤液合并。
在每个过滤运行中,通过分析天平测量负载量和滤液量。还记录了每个步骤(加载和追加)的持续时间,以评估平均流速。
实施例2–病毒滴定
使用终点稀释测定法,即tcid50测定法,进行ppv滴定。将pk13细胞以每孔2000-4000个细胞的密度接种在96孔板中,并根据安全实验室标准操作程序,在37℃和4-6%co2的潮湿培养箱中温育过夜。将试验样品和阳性对照样品在dmem培养基中连续稀释(例如1:3.2连续稀释)。将每种稀释水平接种到接种的pk13细胞的8孔的相应列上(除去废培养基,每孔接种100μl接种物),并使其在上述培养箱中感染细胞1.5-2.5小时。最后,将100μl的2x测定培养基添加到每个孔中,并将测定板放回培养箱中,以持续感染并发展细胞病变效应(cpe)6-7天。对与每个样品稀释水平相对应的每个孔进行cpe评分,并使用在受控microsoftexcel工作表中实施的spearman
实施例3–rfviii活性的显色测定
使用
实施例4–病毒掺入的缓冲液的过滤
如上所述,通过将ppv测试病毒(例如1∶100掺入比)掺入到目标缓冲液中来制备过滤负载。将目标负载量在12-14psi恒压下施加到病毒滤膜上,并收集滤液(图1)。通过ppvtcid50测定确定掺入负载样品和滤液样品中的病毒滴度。log10折减系数(lrf)是病毒清除能力的衡量指标,计算为加载到过滤器上的总病毒感染性与滤液(filtrate)中总病毒感染性之间的log10差异。
图5显示,负载中的二价ca2+离子(43mmcacl2)显著增强了再生纤维素病毒滤膜对ppv的清除。滤液中的病毒滴度低于含有ca2+的检测的测试极限(图(panel)a),表明与负载中不含ca2+相比,ppv清除率有至少两个log10的改进(图b)。
图6显示,通过ca2+离子导致的病毒清除效果的增强不受吐温80(0相对于50ppm)的存在和过滤温度(环境温度相对于2-8℃)的影响。来自所有四个过滤运行的滤液中的病毒滴度均低于检测的测试极限。图e中显示的较高范围归因于使用大样品量的tcid50测定的改善的检测极限。
图7显示,不同缓冲液系统(20mm咪唑相对于20mmtris,或50mmtris相对于50mm柠檬酸)对ca2+导致的病毒清除效果的增强没有影响。使用ca2+时,滤液中的病毒滴度低于在咪唑(图g)或tris(图h)缓冲液中检测的测试极限。在没有ca2+的情况下,在两种缓冲液(图i和j)中都检测了滤液中的病毒滴度,表明通过ca2+离子至少有≥1000-10000倍或3-4log10折减系数(lrf)的病毒清除率提高。
实施例5–病毒掺入的igg2负载的过滤
通过将ppv测试病毒(例如1:100掺入比例)掺入纯化过程中间体样品的5.7-8.1mg/mligg2单克隆抗体溶液中来制备负载。将负载以12-14psi的恒定压力施加到病毒滤膜上,并收集滤液(图1)。通过ppvtcid50测定确定掺入的负载样品和滤液样品中的病毒滴度。lrf计算为加载到过滤器上的总病毒感染性与滤液中总病毒感染性之间的log10差异。
图8显示了在5.0、19.7和38.8mm浓度下ca2+离子导致的ppv清除率的提高,并且在负载中添加45.4mmedta螯合剂可有效逆转这种提高。ca2+离子在5mm时已达到最大效果,并在整个测试的ca2+浓度范围内达到稳定水平的病毒清除率的提高。通过加入edta作为ca2+的螯合剂,不再观察到病毒清除增强作用,这表明观察到的增强作用特别是由于ca2+的存在。
实施例6–病毒掺入的igg1负载的过滤
通过将ppv(例如1:100掺入比)掺入纯化过程中间体样品的4.9-13.1mg/mligg1单克隆抗体溶液中来制备负载。将负载以12-14psi的恒定压力施加到病毒滤膜上,并收集滤液(图1)。通过ppvtcid50测定确定掺入的负载样品和滤液样品中的病毒滴度。lrf计算为加载到过滤器上的总病毒感染性与滤液中总病毒感染性之间的log10差异。
图9显示了ca2+离子在1.0、4.8和10.0mm浓度水平下导致ppv清除率的提高,并且在负载中添加12.0mmegta螯合剂并没有明显逆转这种提高(可能是由于egta与钙离子的弱结合)。ca2+在1mm处达到最大效果,并在测试的ca2+浓度范围内达到稳定水平的病毒清除率的提高,表明通过ca2+有2-3log10病毒清除率提高。egta(不是edta)的添加(egta是mg2+的特定螯合剂而不是ca2+的特定螯合剂),并没有完全地显著逆转病毒清除率的提高,重申了这种增强作用是由ca2+离子特异性地实现的。
实施例7–rfviii负载的过滤
调整bayerrfviii过程中间体的未掺入的病毒过滤负载样品,使其包含各种浓度的吐温80(0-100ppm),并在12-14psi恒压下将其施加到病毒滤膜,并收集滤液(图1)。负载样品和滤液样品均进行显色测定以确定fviii活性。rfviii的产率计算为滤液中fviii总活性与负载中fviii总活性的百分比(见表1)。
表1.在存在cacl2的情况下,使用再生纤维素过滤器从重组人因子viii过程中间体中清除病毒
表中的lrf值是每种工艺条件的三个重复试验(n=3)的平均值。rfviii-wt:重组人因子viii(rfviii)野生型,且rfviii-bdd:fviii的rfviii结合域缺失(bdd)亚分子。nt:未测量ffviii-bdd的直径,但其大小与rfviii-wt近似。
病毒过滤负载溶液,其中在20mm咪唑、300mmnacl、43mmcacl2、50ppm吐温80,ph=6.9-7.1中制备了包含重组野生型(wt)人因子viii(rfviii-wt)或重组人因子viii结合域缺失(bdd)(rfviii-bdd)分子的过程中间体。首先分别将猪细小病毒(ppv)、reo3病毒(reo3)、异嗜性鼠白血病病毒(x-mulv)或猪伪狂犬病病毒(prv)掺入负载样品,然后分别通过0.45μm过滤器(corning目录号430320或类似产品)的预过滤器进行过滤。使用的铜氨再生病毒过滤器为
图10显示了通过病毒滤膜从掺入的rfviii过程中间体(在20mm咪唑,300mmnacl,43mmcacl2,50ppm吐温80,ph=6.9-7.1中约为0.1mg/ml)中完全清除ppv(至低于检测极限)。
通过将ppv(例如1:50掺入比)掺入从bayerrfviii制造活动过程中获得的rfviii病毒过滤负载样品溶液中来制备病毒掺入的负载。将负载在12-16psi恒压下施加到病毒滤膜上,并收集滤液(图1)。通过ppvtcid50测定确定掺入的负载样品和滤液样品中的病毒滴度。lrf计算为加载到过滤器上的总病毒感染性与滤液中总病毒感染性之间的log10差异。
图10显示了两种bayerrfviii产品的完全ppv清除结果(低于tcid50测定的检测极限)。图x是使用含有全长rfviii蛋白的负载材料进行的三次重复过滤运行的平均清除率结果。图y是使用含有b结构域缺失的rfviii蛋白的负载材料进行六次重复过滤运行的平均结果。两种负载材料在含43mmcacl2的缓冲液(与图3中图a所示相同的缓冲液系统)中均含有约0.1mg/mlrfviii。在图x中观察到的相对较低的lrf范围是由于在相应的过滤研究中使用了相对较低滴度的ppv原种病毒。这些结果与观察结果一致,即负载中ca2+离子的存在显著增强了滤膜的病毒清除率。
使用再生纤维素中空纤维膜过滤器分离重组fviii产品,具有优异的病毒去除效果和其他生物产品生产能力。在开发和优化过程中,意外发现了修饰的病毒滤膜和过滤器。此外,还发现二价金属离子,例如钙离子(ca2+)可以大大增强再生纤维素基病毒过滤器(asahikaseibioprocess,inc.生产的planovatm20n)的细小病毒清除能力。修饰的滤膜和多孔表面对蛋白质和抗体的粗负载均有效。在我们的研究中,使用猪细小病毒(ppv)评估修饰的病毒滤膜对病毒污染物的清除,因为细小病毒是一种小型无包膜病毒,代表难以清除的病毒。
猪细小病毒是细小病毒科中的一种非包膜单链dna病毒。该病毒通常被选作非特异性模型病毒,用于评估生物制造工艺步骤的病毒清除率,因为它对极端化学和物理环境具有很高的耐受性。ppv病毒颗粒非常小(15-24nm),这使得其很难通过基于尺寸排阻的病毒过滤来去除。
图11显示,存在25-100ppm的吐温80对应于始终如一的高收率(94-104%),而没有吐温80则收率的一致性较低(63-102%)。
图12显示,在存在25-100ppm吐温80的条件下,病毒滤膜的容量(vmax)(256-1250m/l2)相比在不存在吐温80的条件下(147-270l/m2)更高。
- 还没有人留言评论。精彩留言会获得点赞!