用于金属离子电池的电极和相关的材料、电池和方法与流程
相关申请的交叉引用
本申请要求于2017年03月23日提交的英国专利申请gb1704586.5的优先权,将其全部内容通过引用引入本文中。
本公开内容涉及无基底(基板)的、自支撑的和/或无粘合剂的硅材料,以及相关的制品、系统和方法。硅材料可具有相对大的空体积和/或相对低的密度。示例性制品包括电池电极,例如可再充电金属离子电池电极。示例性系统包括电池,例如可再充电金属离子电池。
背景技术:
可再充电锂离子电池通常用于便携式电子产品以及电动和混合动力车辆中。相对于某些其他电池,可再充电锂离子电池可表现出高的开路电压、很少或没有记忆(存储)效应以及低的自放电率。然而,在某些情况下,锂离子电池可表现出相对低的容量和/或相对长的再充电时间。
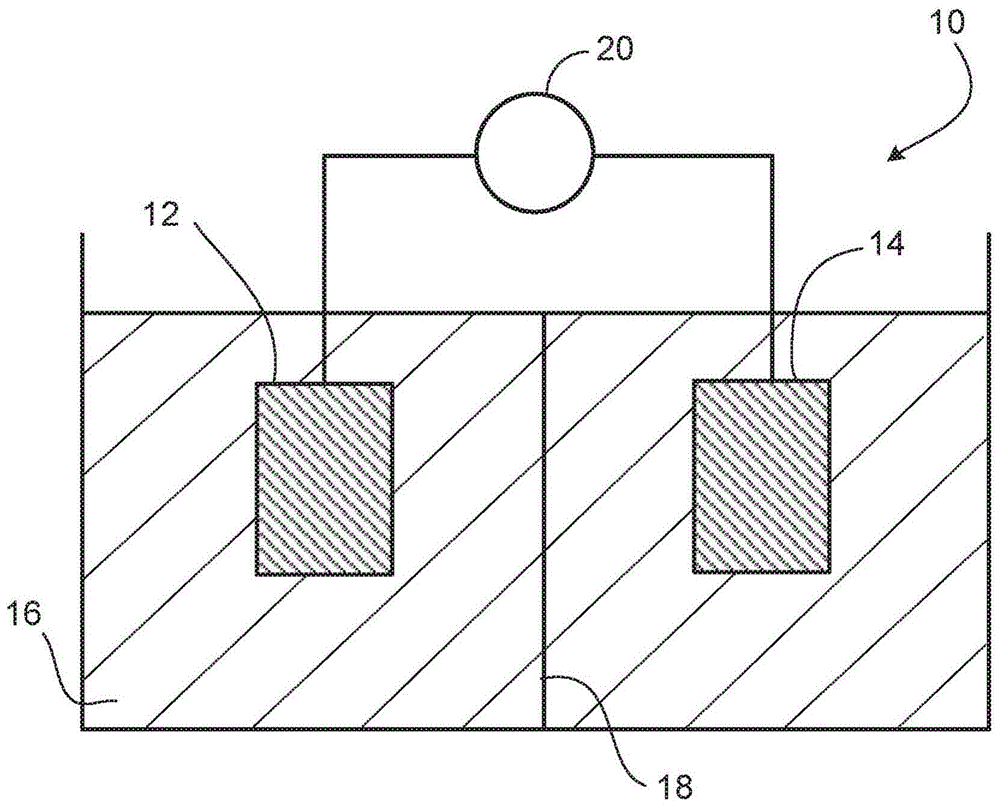
图1示出了示例性可再充电锂离子电池10,其包括含锂的阳极12、阴极14、电解质16、防止阳极12和阴极14彼此接触的半渗透性隔板18以及电连接至阳极12和阴极14的负载(load)20。图2显示,当使电池10放电以向负载20提供电能时,阳极12中的锂电离而形成锂离子22和电子24。锂离子22溶解在电解质16中、穿过隔板18、放电并作为锂原子进入阴极14。电子24穿过负载20并在阴极14处结合锂离子22,导致锂嵌入到阴极14内。电池10放电的净结果是锂从阳极12移动到阴极14。图3显示,当对电池10再充电时,基本上发生相反的过程:电子24从阴极14移动至负载20至阳极12,以及锂离子从阴极14流动到阳极12,在那里它们与电子24结合以在阳极12中提供锂。对电池10充电的净结果是锂从阴极14移动到阳极12。
对于可再充电锂离子电池,含锂的石墨是常见的阳极材料,而钴酸锂(licoo2)是常见的阴极材料。在这种可再充电锂离子电池中,在阳极和阴极处的反应可表示为如下。
阳极反应:
lic6=li++6c+e-
阴极反应:
li++li0.5coo2+e-=licoo2
相关背景信息可在以下中得到:
m.winter等人,advancedmaterials,第10卷,第10期,725-763(1998);
r.dasgupta等人,jcarbon,第70卷,142-148(2014);
w.chen等人,j.electrochem.soc,第158(9)卷,a1055-a1059(2011);
t.nohira,metallurgicalandmaterialstransactionsb,第49b卷,341-348(2019);
美国专利no.6,334,939;
美国专利no.6,514,395;
美国专利no.9,012,066;和
公布的pct专利申请wo2011/161479。
技术实现要素:
本公开内容提供硅材料,该硅材料具有合乎期望的性质使得其可有利地用于可再充电金属离子电池(例如可再充电锂离子电池)的电极(例如阳极)中。例如,由于存在可吸收膨胀的相当大的孔隙率,因而该材料可经历相对大量的充电/放电循环,同时经历相对有限的溶胀/收缩,使得该材料不会经历大幅度(实质性)的机械劣化(降解)或由机械劣化而导致的大幅度的电导率降低。作为另一实例,硅材料可与电池阳极(例如可再充电锂离子电池阳极)中的锂结合,以提供具有比石墨更高的重量容量和/或体积容量的金属间材料。包括所述硅材料的电极可表现出非常好的电学性质,同时还具有相对长的使用寿命。其他应用包括光伏、从溶液去除细菌、生物应用和组织工程。
本公开内容还提供制造这种硅材料的方法。该方法可包括:首先在基底(例如具有二氧化硅表面层的硅基底)上形成材料,然后从所述基底上移出材料(例如通过刮擦或超声移出)。作为替代,减少填充床或流化床中的二氧化硅颗粒。
如本文所用,术语“电池”涵盖单个单元(包括阳极、阴极和负载的单个单元电池)或多个单元(多个单元电池)。
在总的方面,本公开内容提供使用包括阳极、阴极和熔融盐电解质的电解池(电解槽)的方法。阴极包括与熔融盐电解质接触的二氧化硅(硅石)。该方法包括:向电解池施加电势以在不使来自熔融盐电解质的阳离子在阴极处沉积的情况下还原二氧化硅,由此提供硅材料;并从支撑物移出硅材料。
在总的方面,本公开内容提供使用包括阳极、阴极和熔融盐电解质的电解池的方法。阴极包括由基底支撑的二氧化硅,该二氧化硅与熔融盐电解质接触。该方法包括:向电解池施加电势以还原二氧化硅,从而提供硅材料;以及从基底移出硅材料。硅材料包括硅颗粒和硅针的混合物。
在一些实施方式中,与实心硅相比,硅材料具有至少50%的空体积。
在一些实施方式中,硅材料具有至多1.16g/cm3的密度。
在一些实施方式中,硅材料是自支撑的、无基底的和/或无粘合剂的。
在一些实施方式中,该方法还包括使用硅材料来制造包括该硅材料的电池电极。
在一些实施方式中,电池电极是金属离子电池电极。
在一些实施方式中,电池电极是碱金属离子电池电极。
在一些实施方式中,电池电极是选自锂离子电池电极、钠离子电池电极和钾离子电池电极的电极。
在一些实施方式中,电池电极是锂离子电池电极。
在一些实施方式中,基底是硅。
在一些实施方式中,所述方法进一步包括将二氧化硅施加到基底以提供二氧化硅的表面层。
在一些实施方式中,所述方法进一步包括将基底氧化以提供二氧化硅的表面层。
在一些实施方式中,二氧化硅的表面层还包括导电材料。
在一些实施方式中,硅材料不包含另外的导电材料。
在一些实施方式中,例如,当用作电池电极时,可用石墨烯涂覆(包覆)硅材料。
在一些实施方式中,收取硅材料包括从基底移出硅材料。
在一些实施方式中,从基底移出硅材料包括至少一个选自以下的过程:从基底机械地移出硅材料和从基底以超声的方式移出硅材料。
在一些实施方式中,硅材料包括硅针和硅颗粒的混合物。
在一些实施方式中,硅针具有小于1×10-6m的平均直径。
在一些实施方式中,硅针具有小于1×10-5m的平均长度。
在一些实施方式中,硅针具有至少5:1的纵横比(长径比)。
在一些实施方式中,硅颗粒具有小于1×10-6m的平均直径。
在一些实施方式中,硅颗粒具有小于1×10-7m的平均直径。
在一些实施方式中,硅材料包括硅颗粒的簇。
在一些实施方式中,硅针和硅颗粒的混合物是自支撑的。
在一些实施方式中,硅粉末和硅颗粒的混合物是无粘合剂的。
在一些实施方式中,硅粉末和硅颗粒的混合物是无基底的。
在一些实施方式中,阴极还包括与二氧化硅例如二氧化硅颗粒电接触的电导体。
在一些实施方式中,阴极还包括与硅颗粒混合的硅粉末。
在一些实施方式中,熔融盐电解质在500℃至1000℃的温度下是液体。
在一些实施方式中,熔融盐电解质包括钙、钡、锶或锂的卤化物。
在一些实施方式中,熔融盐电解质由钙、钡、锶或锂的卤化物组成。
在一些实施方式中,熔融盐电解质包括氯化钙。
在一些实施方式中,阳极是碳(例如石墨)阳极或惰性阳极。
在一些实施方式中,阳极为选自以下的成员:掺杂有氧化锑和氧化铜的氧化锡;钛酸钙中的钌酸钙;氧化钌和二氧化钛;铁酸镍(镍铁氧体);基于镍的合金;基于铁的合金;和铁镍合金。
在一些实施方式中,使用硅材料制造电池电极包括将硅材料沉积在集流体上。集流体可包括包含碳微纤维的碳纸。将硅材料沉积在集流体上可包括将浆料流延(浇铸)在集流体上。浆料包括硅材料。可在不使用粘合剂的情况下将硅材料沉积在集流体上。
在总的方面,本公开内容提供制造用于电池的电极的方法。该方法包括:i)提供包括阳极、阴极和熔融盐电解质的电解池,所述阴极包括与熔融盐电解质接触的二氧化硅;ii)向电解池施加电势以在不使来自熔融盐电解质的阳离子在阴极处沉积的情况下还原二氧化硅,其中二氧化硅的还原形成硅反应产物;iii)从电解池收取硅反应产物;和iv)使用收取的硅反应产物形成用于金属离子电池的电极的至少一部分。
在一些实施方式中,二氧化硅是基底上的表面层。
在一些实施方式中,基底包括硅。
在一些实施方式中,该方法还包括通过用二氧化硅涂覆基底来形成二氧化硅的表面层。
在一些实施方式中,该方法还包括通过氧化基底来形成二氧化硅的表面层。
在一些实施方式中,收取硅反应产物包括从基底移出硅反应产物。
在一些实施方式中,硅反应产物可用石墨烯涂覆。
在一些实施方式中,机械地或以超声的方式从基底移出硅反应产物。
在一些实施方式中,二氧化硅包括二氧化硅颗粒。
在一些实施方式中,阴极还包括与二氧化硅颗粒混合的硅颗粒。
在一些实施方式中,熔融盐电解质在500℃至1000℃的温度下。
在一些实施方式中,熔融盐电解质包括钙、钡、锶或锂的卤化物或由其组成。
在一些实施方式中,熔融盐电解质是氯化钙。
在一些实施方式中,电解池的阳极是碳(例如石墨)阳极或惰性阳极。
在一些实施方式中,电解池具有选自以下的惰性阳极:掺杂有氧化锑和氧化铜的氧化锡;钛酸钙中的钌酸钙;氧化钌和二氧化钛;铁酸镍;基于镍的合金;基于铁的合金;和铁镍合金。
在一些实施方式中,硅反应产物包括硅颗粒和硅针的紧密(充分)混合物。
在一些实施方式中,硅针具有小于1x10-6m的平均直径和小于1x10-5m的平均长度。
在一些实施方式中,硅颗粒具有小于1x10-6m的平均直径。
在一些实施方式中,在紧密混合物中硅颗粒和硅针充分地缠绕(entwin),使得紧密混合物是自支撑的。
在一些实施方式中,使用硅反应产物包括将收取的反应产物沉积在集流体上。
在一些实施方式中,集流体包括包含碳微纤维的碳纸。
在一些实施方式中,通过如下将收取的硅反应产物沉积在集流体上:形成包括收取的硅反应产物的浆料并将该浆料流延在集流体上。
在一些实施方式中,沉积在集流体上的收取的硅反应产物在没有粘合剂的情况下自身附着到集流体。
在总的方面,本公开内容提供可通过任何本文公开的方法获得的材料。
在总的方面,本公开内容提供电池电极,其包括可通过任何本文公开的方法获得的材料。
在一些实施方式中,电极是阳极。
在一些实施方式中,电极是可再充电金属离子电池阳极。
在一些实施方式中,电极是可再充电碱金属离子电池阳极。
在一些实施方式中,电极是选自可再充电锂离子电池阳极、可再充电钠离子电池阳极和可再充电钾离子电池阳极的电极。
在一些实施方式中,电极是可再充电锂金属离子电池阳极。
在一些实施方式中,电极进一步包括碳(例如石墨),和/或电极包括石墨烯涂层(包覆层)。
在一般方面,本公开内容提供包括以下的电池:阳极,其包括可通过任何本文公开的方法获得的材料;阴极,其包括能够在电池放电和再充电期间释放和再吸收金属和/或金属离子的活性材料;以及在所述阳极和所述阴极之间的电解质。
在一些实施方式中,电池是可再充电金属离子电池。
在一些实施方式中,电池是可再充电碱金属离子电池。
在一些实施方式中,电池是选自可再充电锂离子电池、可再充电钠离子电池和可再充电钾离子电池的电池。
在一些实施方式中,电池是可再充电锂金属离子电池。
在一些实施方式中,在电池的第一次锂化/脱锂循环之后,其具有对于50次锂化/脱锂循环变化小于5%的锂化/脱锂曲线。
在一些实施方式中,电池具有至少是其理论比容量的90%的的比容量。
在一些实施方式中,在50次锂化/脱锂循环后,电池具有至少90%的容量保持率。
在一些实施方式中,电池是可再充电电池。
在一些实施方式中,阳极进一步包括碳(例如石墨),和/或阳极包括石墨烯涂层。
在总的方面,本公开内容提供包括硅颗粒和硅针的混合物的材料。以下的至少一项(例如至少两项、至少三项、至少四项、每一项)成立(有效):与实心硅相比,硅颗粒和硅针的混合物具有至少50%的空体积,和/或所述材料具有至多1.16g/cm3的密度;硅针具有小于1×10-6m的平均直径;硅针具有小于1×10-5m的平均长度;硅针具有至少5:1的纵横比;和硅颗粒具有小于1×10-6m的平均直径。此外,以下的至少一项(例如每一项)成立:硅颗粒和硅针的混合物是自支撑的和/或无基底的;以及硅颗粒和硅酮(silicone)针的混合物是不含粘合剂的。
在一些实施方式中,硅材料包括硅颗粒的簇。
在一些实施方式中,硅颗粒和硅针的混合物被配置为与由金属离子的放电形成的金属原子结合(组合)。
在一些实施方式中,硅颗粒和硅针的混合物被配置为与由碱金属离子的放电形成的碱金属原子结合。
在一些实施方式中,硅颗粒和硅针的混合物被配置为与通过金属离子的放电形成的金属原子结合,所述金属原子选自锂原子、钠原子和钾原子。
在一些实施方式中,硅颗粒和硅针的混合物可涂覆(包覆)有石墨烯。
在总的方面,本公开内容提供电池电极,该电池电极包括包含硅颗粒和硅针的混合物的材料。以下的至少一项(例如至少两项、至少三项、至少四项、每一项)成立:与实心硅相比,硅颗粒和硅针的混合物具有至少50%的空体积,和/或所述材料具有至多1.16g/cm3的密度;硅针具有小于1×10-6m的平均直径;硅针具有小于1×10-5m的平均长度;硅针具有至少5:1的纵横比;和硅颗粒具有小于1×10-6m的平均直径。此外,以下的至少一项(例如每一项)成立:硅颗粒和硅针的混合物是自支撑的和/或无基底的;以及硅颗粒和硅酮(silicone)针的混合物是不含粘合剂的。
在一些实施方式中,电极是阳极。
在一些实施方式中,电极是可再充电金属离子电池阳极。
在一些实施方式中,电极是可再充电碱金属离子电池阳极。
在一些实施方式中,电极是选自可再充电锂离子电池阳极、可再充电钠离子电池阳极和可再充电钾离子电池阳极的电极。
在一些实施方式中,电极是可再充电锂金属离子电池阳极。
在一些实施方式中,用于熔融盐电解的电极还包括碳(例如石墨),和/或电极包括石墨烯涂层。
在一些实施方式中,用于熔融盐电解的电极还包括选自以下的成员:掺杂有氧化锑和氧化铜的氧化锡;钛酸钙中的钌酸钙;氧化钌和二氧化钛;铁酸镍;基于镍的合金;基于铁的合金;和铁镍合金,和/或电极包括石墨烯涂层。
在总的方面,本公开内容提供包括阳极的电池,该阳极包括包含硅颗粒和硅针的混合物的材料。以下的至少一项(例如至少两项、至少三项、至少四项、每一项)成立:与实心硅相比,硅颗粒和硅针的混合物具有至少50%的空体积,和/或所述材料具有至多1.16g/cm3的密度;硅针具有小于1×10-6m的平均直径;硅针具有小于1×10-5m的平均长度;硅针具有至少5:1的纵横比;和硅颗粒具有小于1×10-6m的平均直径。此外,以下的至少一项(例如每一项)成立:硅颗粒和硅针的混合物是自支撑的和/或无基底的;以及硅颗粒和硅酮(silicone)针的混合物是不含粘合剂的。所述电池还包括:阴极,该阴极包括能够在电池放电和再充电期间释放和再吸收金属和/或金属离子的活性材料;以及在阳极和阴极之间的电解质。
在一些实施方式中,电池是可再充电金属离子电池。
在一些实施方式中,电池是可再充电碱金属离子电池。
在一些实施方式中,电池是选自可再充电锂离子电池、可再充电钠离子电池和可再充电钾离子电池的电池。
在一些实施方式中,电池是可再充电锂金属离子电池。
在一些实施方式中,在电池的第一次锂化/脱锂循环之后,其具有对于50次锂化/脱锂循环变化小于5%的锂化/脱锂曲线。
在一些实施方式中,电池具有至少是其理论比容量的90%的的比容量。
在一些实施方式中,在50次锂化/脱锂循环后,电池具有至少90%的容量保持率。
在一些实施方式中,电池是可再充电电池。
在一些实施方式中,阳极进一步包括碳(例如石墨),和/或阳极包括石墨烯涂层。
附图说明
这里参考附图描述示例性实施方式,其中:
图1是可再充电锂离子电池的实施方式的截面图;
图2是图1的锂离子电池的放电过程的截面图;
图3是图1的锂离子电池的充电过程的截面图;
图4是用于制造本文公开的硅材料的装置的截面图;
图5是显示本文公开的硅材料的结构的电子显微图片;
图6是显示本文公开的硅材料的表面的电子显微图片;
图7是显示包括包含硅电极的阳极的可再充电锂离子电池的在第50次循环期间的放电/充电曲线的图;
图8是显示包括硅电极的可再充电锂离子电池的比容量和库仑效率的图;和
图9是显示包括硅电极的可再充电锂离子电池的针对若干电流密度的比容量随循环次数变化的图。
具体实施方式
本文公开的硅材料是硅针和硅颗粒的通常多孔的混合物,其中在该混合物中硅颗粒和硅针充分地缠绕,使得该材料是自支撑的。该材料可为无基底的(从该材料形成于其上的基底移出)。这样,该材料可在不包括粘合剂的情况下用作例如电池电极(无粘合剂的材料)。该材料可能够与例如锂的原子结合。
与实心硅相比,所述硅材料可具有大的空体积并且显著地不那么致密。如本文所用,术语“实心硅”是指具有2.32g/cm3的密度的硅。在一些实施方式中,与给定体积的实心硅相比,相同体积的本文公开的硅材料至少50%(例如至少60%、至少70%、至少80、至少90%、至少95%、至少96%)空,即不实心。在某些实施方式中,本文公开的硅材料具有至多1.16g/cm3(例如0.9g/cm3、0.7g/cm3、0.5g/cm3、0.25g/cm3、0.1g/cm3)的密度。
硅针可具有1x10-6米或更小(例如500纳米或更小)的平均直径和1x10-5米或更小(例如5微米或更小)的平均长度。硅针可具有5:1或更大(例如10:1或更大)的纵横比。典型地,硅针被熔融盐润湿。
硅颗粒可具有1×10-6米或更小(例如1×10-7米或更小)的平均直径。典型地,硅颗粒被熔融盐润湿。
硅颗粒可为簇的形式。
本文公开的硅材料可用作电池(例如可再充电金属离子电池,例如可再充电锂离子电池)的电极(例如阳极)。包含本文公开的硅材料的这种电极(例如阳极)可用于电池例如可再充电金属离子电池(例如可再充电锂离子电池)中。硅材料可包含粘合剂或可为不含粘合剂的。任选地,硅材料可包括导电材料,例如可形成单独的相的导电颗粒和/或石墨烯。在一些实施方式中,硅材料掺杂有n型导体(例如磷、砷、锑、铋)和/或p型导体(例如硼、铝、镓)。在一些实施方式中,硅材料可涂覆有石墨烯。
包含包括硅材料的阳极的电池(例如可再充电金属离子电池,例如可再充电锂离子电池)可表现出多种有利的性质。例如,包含包括硅材料的阳极的可再充电金属离子电池(例如可再充电锂离子电池)在其第一次锂化/脱锂循环之后可具有在其对于50次锂化/脱锂循环的锂化/脱锂曲线中的小于5%(例如小于2%、小于1%)的变化。作为另一实例,包含包括硅材料的阳极的可再充电金属离子电池(例如可再充电锂离子电池)可具有为其理论比容量的至少90%(例如至少95%、至少98%)的比容量。作为另一实例,包含包括硅材料的阳极的可再充电金属离子电池(例如可再充电锂离子电池)在50次锂化/脱锂循环后可具有至少90%(例如至少95%、至少98%)的容量保持率。
图4示出了可用于制造本文公开的硅材料的装置40。装置40包括对电极42、阴极44、参比电极46(参比电极通常小于阳极或阴极)和熔融盐电解质48,电极42、44和46布置在所述熔融盐电解质中。
在一些实施方式中,对电极42和/或参比电极46是石墨电极。在某些实施方式中,对电极42和/或参比电极46是惰性阳极,例如:掺杂有氧化锑和氧化铜的氧化锡;钛酸钙中的钌酸钙;氧化钌和二氧化钛;铁酸镍;基于镍的合金;基于铁的合金;或含有铝的铁镍合金。
阴极44包括具有二氧化硅表面层的硅基底。可例如通过硅基底的表面的电化学氧化或通过将二氧化硅沉积在硅基底上或自然地在空气中而形成二氧化硅层。阴极44与电连接到对电极42和参比电极46的电导体(例如钼框架)接触。任选地,二氧化硅表面层包含导电掺杂剂,使得得到的硅材料具有增强的导电性(例如以用于电池电极中)。示例性的导电掺杂剂包括n型掺杂剂和p型掺杂剂。
通常,熔融盐电解质48具有500℃至1000℃的熔点。优选地,熔融盐电解质溶解氧离子以允许氧从阴极44转移到熔融盐电解质48中,然后转移到阳极。熔融盐电解质48可包括例如钙、钡、锶或锂的卤化物。该卤化物可为氯化物。示例性的熔融盐电解质是氯化钙(cacl2)。
制备硅材料的方法包括加热熔融盐电解质(例如加热至高于其熔点约100℃的温度),并施加阴极电势,使得二氧化硅表面层被还原以产生硅材料和氧离子,如下所示。
sio2+4e-=2o2-+si(硅材料)
氧离子在放电时扩散到对电极42。当电极42由石墨形成时,产生的是二氧化碳。当电极42是惰性电极时,产生的是氧气而不是二氧化碳或一氧化碳。用这种方法制造的硅材料的微结构是硅颗粒和硅针的紧密混合物。如果原始的硅掺杂有n型掺杂剂或p型掺杂剂,或与导电金属形成合金,则产物将包含相应的导电材料(n型掺杂剂、p型掺杂剂或金属添加物)并呈现增强的导电性。
在制造硅材料之后,移出阴极54,并且从基底移出硅材料。在一些实施方式中,将硅材料从基底刮下来。在某些实施方式中,将硅材料以超声的方式从基底移出。
在从基底移出之后,可将硅材料沉积到集流体上以提供电极。集流体可由例如包括碳微纤维的碳纸形成。在一些实施方式中,将硅材料形成为浆料,并将该浆料流延到集流体上。如上所述,硅材料可为无粘合剂的,和/或它可包含一种或多种另外的导电材料。任选地,在沉积到集流体上之前,将硅材料与石墨和/或石墨烯混合。这种混合可包括涂覆(包覆)紧密混合物中的硅颗粒和/或针的至少一些。在一些实施方式中,施加石墨烯涂层(包覆层)。
得到的电池可用作可再充电锂离子电池中的阳极,该可再充电锂离子电池还包括阴极、隔板和电解质。
实施例
硅材料的形成
将cacl2用作电解质,并如下制备。使分析级无水cacl2在低于其熔点的温度下经受真空和加热程序(80℃进行3小时,120℃进行3小时,以及180℃进行18小时)以除去残留的水而不使cacl2与水反应形成cao。将得到的cacl2放入氧化铝坩埚(100mm的高度,壁厚3mm)中至4cm的深度。将含有cacl2的坩埚放在立式管式炉(instronsfl,uk)中的不锈钢反应器内。该盐在850℃下熔化。使用三个圆柱形石墨棒通过预电解将电解质纯化,所述石墨棒充当工作电极、准参比电极和对电极。在相对于石墨准参比电极极化δe=-1.0v下进行纯化20小时。
使用从<100>单晶(来自si-matgmbh,germany)切出的p型硅晶片。晶片的直径为约5cm,以及几何面积为22.8cm2。厚度为-275.+-.25μm,以及电阻率为1至30ohm/cm。使晶片涂覆有拥有2.0243μm的平均厚度的热氧化物层。将试样的一侧抛光。将样品附接到充当电导体的钼棒(0.5mm)框架。使用金刚石刀和机械破碎由晶片制备矩形试样(5cm2)。
将圆柱形石墨棒用作参比电极,以及将另一石墨棒用作对电极。通过测量钙沉积的电势来校准石墨电极。这为在约-1.5v下并且呈现良好的可再现性。
钼电极的循环极化测量指示低于约-1.5v(相对于石墨)的e的钙沉积(ca2++2e→ca)的开始。二氧化硅还原在高得多的正电势(大致为相对于e°ca2+/ca+0.9v或相对于石墨-0.6v)下开始。为了使二氧化硅层脱氧,在e=-1.0v至-1.25v(相对于石墨)下进行恒电势电解,这适合于还原二氧化硅并防止钙共沉积。熔融盐中的固体氧化物的电化学还原在三相界面线(3pi)处发生。初始的三相界面由电子导体(mo)、氧化物(sio2)和电解质(cacl2)构成。附着至二氧化硅表面的钼丝起着集流体的作用。电化学硅还原在mo--sio2--cacl2界面处开始。
sio2+4e-→si+2o2-
氧离子通过扩散到电解质而被除去,以及产生的硅通过形成新的三相界面si--sio2--cacl2而进一步发挥电子导体的作用。结果,还原区域的蔓延和薄硅膜的形成是可能的。一旦还原的硅或已经由二氧化硅还原的硅的其它区域与硅基底接触,整个晶片便开始充当电子导体。短时间后,硅圆片的表面变黑,表明产生精细的表面结构。在将该圆片从盐移出后,通过刮擦或通过施加超声波分散而收获深度在10nm至10微米范围内的表面层。如图5中所示,该结构包括大量具有不规则表面的针和一些包含直角的针,这些针物理相互作用以将结构固定在一起。背景点归因于载体(硅基底)。
硅材料得自一系列晶片,所述晶片通过在熔融的cacl2盐中在-0.9v(相对于石墨)下还原1小时而制得。还原后的晶片的扫描电子显微镜(sem)图像示于图6中,并且显示了无规地坑洼不平(表面有小点的,pitted)且多孔的表面层,该表面层由与硅针混合的硅颗粒的簇构成,具有相当大的孔隙率(开口体积)。该针在直径上为约500nm且在长度上为最高达5微米。该多孔层的深度为约10微米,并且每cm2产生约2.328mg的硅粉末。因此,在这些反应条件下,标准10cm直径的晶片产生约182mg的硅材料粉末。
床中或流化床中的二氧化硅粉末也可通过将阴极插入该床中来还原。
制造阳极
使用具有锂箔对电极和作为电解质的在碳酸亚乙酯(ec)/碳酸二甲酯(dmc)50/50(v/v)中的1mlipf6的2032型硬币单元电池研究硅材料的电化学性质。工作电极通过如下制造:将硅基底上的硅材料在二甲基甲酰胺(dmf)溶液中进行超声处理,并且滴铸在碳纸上。10x1cm2的晶片用于提供活性阳极材料。每个工作电极具有1.13cm2的表面积,并且电极中的活性材料的密度为约1-2mg/cm2。
恒电流充电-放电是其中施加恒定电流密度并且作为时间的函数测量响应电势的技术。在大多数全单元电池中,将装置初始充电(即,阳极被锂化)至预设电势,并监控放电过程。对于半单元电池而言,阳极中的锂化过程被认为是“放电”。由硅的总质量计算所有电极的比容量,并且使用恒电势仪/恒电流仪(landct2001a)在0.01-2.5v范围内测量其电化学特性。
结果
使用具有作为对电极的锂箔和作为电解质的在碳酸亚乙酯(ec)/碳酸二甲酯(dmc)50/50(v/v)中的1mlipf6的2032型硬币单元电池在0.01v-2.5v的电势范围内测量硅电极的电化学性质。基于电极中的硅材料的质量计算用含硅材料的电极制成的阳极的比容量。
在第50次循环期间的锂化(放电)/脱锂(充电)电压曲线示于图7中。当在0.05c倍率的恒定电流密度下测试时,第一次循环分别呈现出6660mahg-1和3645mahg-1的放电和充电容量,并且第一次循环的库仑效率为54.7%。这可能是由于不可逆的锂反应,其导致在电极表面上形成固体电解质界面(sei)层,以及在第一次锂化过程中在复合物中的经由结构缺陷的锂离子的增加的消耗。在第二次充电/放电循环后,由于结晶硅的电化学非晶化,在第一次锂化阶段后的曲线中明显的远程(长程)平台(plateau)变为倾斜的平台。可通过如下降低该影响:用石墨烯片涂覆硅颗粒,使得石墨烯与电解质而不是硅相互作用。锂化/脱锂曲线在随后的第50次循环期间没有变化,表明该电极在电极的电化学反应期间具有稳定的传导框架。
图8示出了硅电极在循环期间的在0.05c倍率下的锂化/脱锂比容量和库仑效率,并且结果证实了高度稳定的性能。在50次充电/放电循环后,保持了3680mahg-1的容量,并且相对于第50次循环中的容量值的容量保持率为约100%,这表明在循环期间没有容量损失并且容量略有增加。此外,在进一步的循环期间,库仑效率从54.7%(第一次循环)显著提高到最高达98%。
结果证实,用所述硅材料形成的电极产生用于容纳在合金化/脱合金化过程期间的si膨胀的合乎期望的自由体积网络与基本上稳定的传导网络。不希望受到理论的束缚,据信,通常,在第一次锂化过程期间,由于形成li-si合金相,硅经历约400%的体积膨胀。这种体积膨胀水平通常可导致电极失去接触并因此增加电极的电阻。据信,与基于不同形式的硅的电极相比,电极中的导电的针型硅结构可产生更稳定的导电网络。还认为,即使在第一次锂化过程之后,本文所述的硅材料的导电的自由体积网络结构也得到更好的保持,并且伴随着硅体积上而不是电极体积上的400%的增加,因为多余的体积被孔隙吸收。因此,还认为,在随后的脱锂过程期间,包含本文公开的硅材料的高度导电的电极由于其稳定的导电网络而可表现出低的容量损失,这导致较高的电子传导性和有利的自由体积网络,从而证实由本文所述的硅材料形成的高度导电的电极提供有效的导电/缓冲框架(结构)作为电极。
图9中示出了包含本文所述的硅材料的电极在范围0.05至2c倍率的多种电流密度下的锂化/脱锂容量。在0.05(在52次循环后)、0.5(在83次循环后)、1(在110次循环后)和2c(在130次循环后)倍率下的脱锂容量分别为3699、2054、1187和711mahg-1。包含该硅电极的电池不仅表现出提高的比容量(几乎是理论容量)、可循环性,而且当电流密度增加时还具有良好的倍率性能。该结果证实该硅电极在提供较高的电子传导性和必要的自由体积网络方面是有效的。这些值与对于石墨阳极的372mah/g相比非常有利。
- 还没有人留言评论。精彩留言会获得点赞!