基于合成线的侧流免疫测定的制作方法
本公开整体涉及用于检测生物样品中的分析物的侧流免疫测定系统、装置和方法。更具体地,本公开涉及基于合成线的侧流免疫荧光测定系统、装置和方法。
背景
诊断学的一个重要领域是使用快速免疫诊断测定来对受试者提供快速、准确且简单的诊断和检验,例如对疾病、病症、微生物或药物的检验。这种测定的常见形式为侧流免疫测定,侧流免疫测定常用于诸如妊娠测试试剂盒的装置中。
侧流免疫测定由于其简单、快速且可靠而广泛用于自行检验以及临床环境中,并且涉及用于快速检测液体样品中特定分析物的存在的非电方法,例如,如美国专利申请No.2005/0227371中所述。
侧流免疫测定通常涉及将怀疑包含预定分析物的液体样品施加到多孔载体上,液体样品然后通过毛细管作用横穿多孔载体。不同的多孔材料可用于多孔载体,并且可在诸如以下的方面不同:孔尺寸、芯吸或流速、蛋白结合方面和预处理。基本上,所有的物理活动和化学反应均在多孔载体中进行。将液体样品施加到多孔载体的取样端(例如‘近端’或‘润湿端’)上达测量的时间或体积(例如5秒或2滴)。然后,液体样品通过毛细管作用沿着多孔载体迁移至‘远’端或‘干燥’端。可用另外的试剂例如pH试剂或缓冲剂、表面活性剂和/或封闭剂对液体样品进行预处理以优化反应,这些另外的试剂通常浸渍到多孔载体中。可通过使用具有结合预定分析物的亲和力的标记试剂(例如‘检测试剂’)来‘标记’样品中的分析物以供检测。可将样品在与多孔载体接触之前进行标记,或替代地,多孔载体可包括‘标记区’,在标记区中,样品调动已可逆地(暂时地)固定化到多孔载体中的标记试剂。当分析物与调动的标记试剂反应时,液体样品和调动的标记试剂在多孔载体中进一步迁移至检测区(例如‘捕获区’),在捕获区中,结合相同分析物的捕获试剂(例如固定化捕获抗体)通常以线条的形式固定化到多孔载体。当分析物存在于液体样品中时,形成呈标记试剂:分析物:捕获抗体的‘夹心’,并且标记试剂的所得浓度导致出现于检测区中的可检测线条,其指示阳性结果。任何剩余的样品液体与其余标记试剂继续迁移至对照区和/或多孔接收区。未与预定分析物反应并且保留在多孔载体的未结合的标记试剂促成可降低检测准确性的背景信号。
硝酸纤维素膜在侧流免疫测定中通常用作多孔载体材料。然而,硝酸纤维素膜材料中存在由制备该材料的方法所引起的某种变异,这可导致测试的准确性和精确性降低。在生产硝酸纤维素膜时,这种导致芯吸速率变化的变异引起再现性问题,其中对于定量测量而言,侧流测试历来表现不佳,其中测定变异系数(CV)通常在20%至40%的范围内,如J Agric.Food Chem.2012年11月21日;60(46):11491-7和Anal.Chim.Acta.2013年4月15日;772:75-80中所述。25%的测定CV意指测试结果的95%置信区间为平均值+/-50%。在测定样品中目标分析物的浓度的过程中,此类不良的不精确性不适于准确测量,特别是不适于定量测量,而此类测量可为临床决策的基础。不正确的诊断可导致做出不正确的临床决策,这继而导致不利的健康结果。尽管已使用其他类型的多孔材料作为硝酸纤维素膜材料的替代物,但这些材料也通常具有不良的不精确性,特别是在分析物检测方法依赖于低背景噪声的情况下。
可使用一系列的方法来标记分析物以及检测样品中标记的分析物的存在,例如可使用对预定分析物具有结合亲和力的比色标签、放射性同位素和荧光标签。例如,使用比色胶乳珠粒进行标记在美国专利No.5,451,504中已有描述。已知使用可视标记物(例如胶体金标签)的常规侧流测试就灵敏度而言表现不佳。当用于检测样品中的少量特定分析物的快速诊断测定中时,其他标记技术也可存在问题。已在一些类型的免疫测定系统中使用荧光标签,但他们的灵敏度通常受限于天然发荧光的多孔载体及其组分的背景荧光,或受到未结合的荧光标签的存在的限制。
因此,需要鉴别替代的具有改善的侧流免疫测定装置和系统,所述侧流免疫测定装置和系统能够准确、高性价比且快速地实现样品中目标分析物的检测。
概述
本公开基于发明人对侧流免疫测定的研究和开发,其可用作准确测定样品中目标分析物的存在的快速且高性价比的诊断工具。
本公开提供基于合成线的免疫荧光测定系统、装置和方法,所述系统、装置和方法至少在一些实施方案中可用于目标分析物的定性鉴定和定量测量。发明人在他们的研究过程中发现了问题,这些问题与使用侧流免疫荧光测定以及具体而言涉及使用用于结合并且检测目标分析物的荧光微粒的测定来确定来自样品的目标分析物的准确性和水平相关。本公开因此涉及提供侧流免疫荧光测定装置,其包括通过毛细管作用用作流体样品的载体的一个或多个合成聚合物线;和包括所述装置的系统和方法,所述系统和方法涉及使用用于检测目标分析物的荧光标记的微粒。
在一个方面,提供一种用于对样品进行免疫荧光测定的系统,所述系统包括:
侧流免疫测定装置,其包括一个或多个合成聚合物线,所述合成聚合物线界定至少样品装载区;检测区,其包括对样品中的预定分析物具有亲和力的固定化捕获试剂;以及任选的中间区,其设置在样品装载区和捕获区之间,其中所述一个或多个合成聚合物线能够通过毛细管作用将流体样品从至少样品装载区运载至检测区;
荧光检测试剂,其用于与样品中的预定分析物结合以形成荧光标记的分析物,其中所述荧光检测试剂包含荧光标记的微粒,所述荧光标记的微粒与对样品中的预定分析物具有亲和力的分析物结合试剂缔合、配位或连接;和
荧光激发源和检测器,其用于检测预定分析物,所述预定分析物与荧光检测试剂结合并且通过捕获试剂固定化到装置的检测区中。
所述系统可用于检测样品中目标分析物的存在或水平。在一个实施方案中,所述系统用于定量测量样品中目标分析物的水平(例如浓度)。目标分析物的检测或测量可用于诊断病症或作为临床测定的基础。
免疫荧光测定系统可为一步免疫荧光测定系统。免疫荧光测定系统可为湿式免疫荧光测定系统,其中在样品接触装置的样品装载区之前将样品与荧光检测试剂混合。免疫荧光测定系统可为干式免疫荧光测定系统,其中免疫荧光测定装置包括荧光检测试剂。在一个实施方案中,免疫荧光测定装置的一个或多个合成聚合物线界定中间区,所述中间区设置在样品装载区和检测区之间。在另一个实施方案中,荧光检测试剂可逆地固定化到装置的中间区上以用于标记检测区中供检测的预定分析物。
样品可用选自pH试剂或缓冲剂、表面活性剂、过滤剂和封闭剂的一种或多种试剂进行预处理。装置的样品装载区可包括选自pH试剂或缓冲剂、表面活性剂、过滤剂和封闭剂的一种或多种试剂。所述一种或多种试剂可固定化到样品装载区上。检测区可包括包含固定化捕获试剂的一个或多个线条。捕获试剂可为捕获抗体。一个或多个合成聚合物线或装置还可包括一个或多个多孔接收区或另外的区,例如对照区、试剂区、散布区、封闭区或过滤区、阻挡区或缓冲区。
在一个实施方案中,分析物结合试剂为对预定目标分析物具有结合亲和力的抗体。在另一个实施方案中,捕获试剂为对预定目标分析物具有结合亲和力的固定化捕获抗体。
免疫荧光测定系统可提供单一或多重测定。例如,免疫测定装置可包括用于检测样品中的两种或更多种预定分析物的多个线。
在一个实施方案中,一个或多个合成聚合物线由选自聚酰胺、聚酯、聚醚、聚烯烃、聚碳酸酯和聚氨酯的合成聚合物形成。在另一个实施方案中,一个或多个合成聚合物线由合成聚酯形成。聚酯可选自聚乙醇酸(PGA)、聚乳酸(PLA)、聚己内酯(PCL)、聚羟基链烷酸酯(PHA)、聚羟基丁酸酯(PHB)、聚己二酸乙二醇酯(PEA)、聚丁二酸丁二醇酯(PBS)、聚(3-羟基丁酸酯-共-3-羟基戊酸酯(PHBV)、聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二醇酯(PBT、聚对苯二甲酸丙二醇酯(PTT)和聚萘二甲酸乙二醇酯(PEN)。在另一个实施方案中,一个或多个合成聚合物线由合成聚酰胺形成。聚酰胺可为尼龙,例如选自尼龙-6,6;尼龙-6;尼龙-6,9;尼龙-6,10;尼龙-6,12;尼龙-11;尼龙-12和尼龙-4,6的尼龙。
荧光标记的微粒可为荧光标记的聚合物微粒。可用荧光稀土金属络合物对微粒进行荧光标记。在一个实施方案中,荧光标记的微粒包括与荧光稀土金属络合物缔合、配位或连接的聚合物微粒。稀土金属络合物可包含镧系金属。镧系金属可选自铕、铽和钐。在一个实施方案中,稀土金属为铕。荧光稀土金属络合物可为铕、铽和钐的金属螯合物。
聚合物微粒可具有在100至5000、150至2000、200至1000或300至600范围内的平均直径(以nm计)。聚合物微粒的平均直径(以nm计)可为至少约100、200、300、400、500、600、700、800、900或1000。在一个实施方案中,聚合物微粒的平均直径为至少约200nm。
在另一方面,提供一种用于对样品进行免疫荧光测定的侧流免疫荧光测定装置,其中所述装置包括一个或多个合成聚合物线,所述合成聚合物线界定至少样品装载区;检测区,其包括对样品中的预定分析物具有亲和力的固定化捕获试剂;以及设置在样品装载区和捕获区之间的中间区,所述中间区包括用于与样品中的预定分析物结合以形成荧光标记的分析物的荧光检测试剂,其中所述荧光检测试剂包含荧光标记的微粒,所述荧光标记的微粒与对样品中的预定分析物具有亲和力的分析物结合试剂缔合、连接或配位,并且其中一个或多个合成聚合物线能够通过毛细管作用将流体样品从至少样品装载区运载至检测区。
免疫测定装置可包括用于支撑合成聚合物线的基板或壳体。
应当理解,上文针对免疫荧光测定系统描述的实施方案(其中这些实施方案涉及免疫测定装置)也可与针对上述装置的实施方案一样适用。
在另一方面,提供一种用于检测样品中的分析物的方法,所述方法包括以下步骤:
a)通如下方式获得包含荧光标记的分析物的预处理样品:使待测试预定分析物的存在的样品与荧光检测试剂接触,从而形成荧光标记的分析物,并且其中荧光检测试剂包含荧光标记的微粒,所述荧光标记的微粒与对样品中的预定分析物具有亲和力的分析物结合试剂缔合、连接或配位;
b)提供侧流免疫测定装置,其包括一个或多个合成聚合物线,所述合成聚合物线界定至少样品装载区;检测区,其包括对样品中的预定分析物具有亲和力的固定化捕获试剂;以及任选的中间区,其设置在样品装载区和捕获区之间;
c)使侧流免疫测定装置的样品装载区与获自步骤a)的预处理样品接触,由此通过毛细管作用将预处理样品从样品装载区运载至检测区,并且荧光标记的分析物与捕获试剂结合以固定化到检测区中;和
d)通过荧光光谱法来检测检测区中的荧光标记的分析物。
在另一方面,提供一种用于检测样品中的分析物的方法,所述方法包括以下步骤:
a)提供侧流免疫荧光测定装置,其包括一个或多个合成聚合物线,所述合成聚合物线界定至少样品装载区;检测区,其包括对样品中的预定分析物具有亲和力的捕获试剂;以及中间区,其设置在样品装载区和捕获区之间,其中所述中间区包括用于与样品中的预定分析物结合以形成荧光标记的分析物的可逆固定化的荧光检测试剂,其中所述荧光检测试剂包含荧光标记的微粒,所述荧光标记的微粒与对样品中的预定分析物具有亲和力的分析物结合试剂缔合、连接或配位;
b)使侧流免疫测定装置的样品装载区与待测试预定分析物的存在的样品接触,由此通过毛细管作用将样品从样品装载区运载至中间区并且样品与可逆固定化的荧光检测试剂结合以形成荧光标记的分析物,然后通过毛细管作用将所述荧光标记的分析物运载至检测区以与捕获试剂结合,从而固定化到检测区中;和
c)通过荧光光谱法来检测检测区中的荧光标记的分析物。
上述方法可用于检测样品中目标分析物的存在或水平。在一个实施方案中,所述方法可用于定量测量样品中目标分析物的水平(例如浓度)。目标分析物的检测或测量可用于诊断病症或作为临床测定的基础。
应当理解,上文针对免疫荧光测定系统和装置描述的实施方案也可与针对上述方法的实施方案一样适用。
本公开及其实施方案的其他特征、目的和优点将通过下文的详细描述、实施例和权利要求而变得显而易见。
附图简述
现将仅以举例的方式通过参照附图来对本公开的实施方案进行进一步的描述和阐释,在附图中:
图1提供以平面图示出根据本发明的第一实施方案的免疫测定装置的示意图;
图2提供以平面图示出用于免疫测定装置的盒的示意图;
图3提供以正视图示出用于免疫测定装置的盒的示意图;
图4提供以平面图示出用于免疫测定装置的盒中的测试区窗口和对照区窗口的放大图的示意图;
图5提供示出根据本发明的第二实施方案的免疫测定装置的示意图;
图6a提供两张照片,其示出根据本发明的一个实施方案的使用常规硝酸纤维素膜(图6a)相比于使用合成聚合物线(图6b)的侧流免疫测定中的C-反应蛋白的分析物检测;
图7提供当C-反应蛋白存在于滴定系列中时来自用于荧光微粒标记的免疫测定中的硝酸纤维素膜的荧光和背景信号的扫描的重复数据;
图8提供当C-反应蛋白存在于滴定系列中时来自用于荧光微粒标记的免疫测定中的棉线的荧光和背景信号的扫描;
图9提供当C-反应蛋白存在于滴定系列中时来自荧光微粒标记的免疫测定中的尼龙线(用于本发明中)的荧光和背景信号的扫描的重复数据;
图10提供用于侧流免疫测定中的常规硝酸纤维素膜的电子显微镜10,000倍放大图像;
图11示出当使用阴性C-反应蛋白样品时并且在检测标签为300nm铕微粒的情况下常规硝酸纤维素膜的纵向荧光扫描;
图12提供基于天然纤维的棉线的电子显微镜横截面;
图13提供合成尼龙线的电子显微镜横截面;以及
图14为在检测区位置处的合成尼龙线的呈2500倍放大图像的电子显微镜图像。
详述
在下列多个非限制性实施方案中描述本发明,这些实施方案涉及为发现用于快速且准确地测定样品溶液中目标分析物的水平的具有改善的替代侧流免疫测定装置、系统和方法而进行的研究。至少在一些实施方案中,已经意外地发现包括通过毛细管作用而用作流体样品的载体的一个或多个合成聚合物线的侧流免疫测定装置可提供目标分析物的具有改善的定性和定量检测,特别是使用基于微粒的荧光标签的免疫荧光测定装置、系统和方法。合成聚合物线在免疫测定装置中的使用可实现具有改善的芯吸速率一致性和再现性以及装置诊断能力,并且在至少在一些实施方案中,可通过减少可用于多孔载体中的未结合的荧光微粒的截留来减少背景荧光并从而改善目标分析物检测。
一般术语
在本说明书通篇中,除非另外特别地说明或上下文另有要求,否则提及单个步骤、物质构成、步骤的组或物质构成的组应当被理解成包括这些步骤、物质构成、步骤的组或物质构成的组的一个和多个(即一个或更多个)。因此,如本文所用,单数形式“一种”和“一个”包括复数个方面,除非上下文文中另外明确指示。例如,提到"一个"包括一个以及两个或更多个;提到"一种",包括一种以及两种或更多种;提到"所述(该)",包括一个(种)以及两个(种)或更多个(种)等等。
本领域的技术人员将理解本文的公开内容是容易进行改变和变更的,除外特别说明的那些。应当理解的是本公开包括所有此类改变和变更。本公开还包括在本说明书中逐个地或共同地提及或指出的所有这些步骤、特征、组合物和化合物,以及所述步骤或特征的任何和所有的组合或其中的任何两种或更多种。
本文所述的本公开的每个实施例加以必要的变通将适用于各个其他实施例,除非另外特别说明。本公开并不局限于本文所述的特定实例的范围内,这些实例仅旨在用于举例说明目的。功能上等效的产物、组合物和方法显然地在本公开的范围内,如本文所述。
除非另外指明,本公开使用侧流免疫荧光测定中使用的常规技术(包括荧光标记、激发和检测技术)来进行。此类工序描述于例如美国专利4719182或参考文献“Lateral Flow Immunoassay,Wong等,Humana Press,2007年,第170-181页”。
术语“和/或”例如“X和/或Y”应被理解为表示“X和Y”或“X或Y”,并且应当用来明确支持两种含义或任一种含义。
在本说明书全文中,词语“包含”或变型形式诸如“包括”或“含有”将被理解为意在包含所述的要素、整数或步骤,或要素、整数或步骤的群组,但不排除任何其他要素、整数或步骤,或要素、整数或步骤的群组。
将清楚地理解,尽管本文中提及许多现有技术公布,但此提及并不会构成对这些文献中的任一篇在澳大利亚或在任意其他国家形成本领域的公知常识的一部分的认同。
除非另有定义,本文所用的所有技术和科学术语的含义与本发明所属领域的普通技术人员所普遍理解的含义相同。虽然与本文所述的那些类似或等同的方法和材料可用于本发明的实施和测试,但合适的方法和材料在下文也有所描述。如有冲突,以本说明书(包括定义)为准。此外,材料、方法和实例仅出于示例性目的,而不旨在进行限制。
具体术语
本文中对“样品”的提及应理解为对来源于受试者的任何样品的提及,例如但不限于体液(例如,血液或血液级分如血清或血浆、泪液、尿液、腹水、泪液、汗液、唾液、排泄物、龈沟液、组织提取液、滑液或脑脊液)、细胞材料(例如,组织抽吸物)、组织活检样本或手术样本。“生物流体样品”、“流体样品”或“体液”是指可取自生物体作为样品的任何流体,其可包含可检测的分析物或遗传物质,例如,取自人或动物受试者的血液或血浆。对于侧流免疫测定,应当理解,施加于免疫测定装置的样品呈能够在装置中进行毛细流动的液体形式,并且样品可经处理或添加另外的试剂或化学物来促进这种液性和毛细流动。
“分析物”包括但不限于可在体液中检测到的蛋白、大分子和小分子,例如获自人或动物受试者的血液或血浆样品中存在的抗原或抗体。
如本文所用,术语“荧光标记的分析物”意指已被能够发出荧光的荧光物质例如荧光检测试剂标记的分析物。
如本文所用,术语“抗体”意指多克隆或单克隆全免疫球蛋白例如IgG、IgM、IgA、IgE等,或免疫球蛋白片段例如F(ab)2、F(ab')2、Fab、Fab'等,或它们的混合物,并且包括合成抗体。
如本文所用,术语“诊断”及其变型形式包括临床状态的任何初步诊断或复发性疾病的诊断。
如本文所用,术语“微粒”意指直径介于约0.1μm和100μm之间(例如大于约100nm)的颗粒。
如本文所用,术语“合成聚合物线”是指由多个单独的合成聚合物纤维形成的线。
术语“聚合物”包括共聚物,术语“单体”包括共聚单体。
诊断免疫测定系统、装置和方法
本文所述的侧流免疫测定系统可提供高性价比的便携且快速的诊断系统,该系统需要少量的样品体积进行检验,对目标分析物具有改善的检测,特别是当例如在侧流免疫荧光测定中与荧光检测方法一起使用时。
本文所述的免疫荧光测定系统包括使用侧流免疫测定装置,所述侧流免疫测定装置包括提供多孔载体系统的一个或多个合成聚合物线。合成聚合物线可被多种试剂涂布或浸渍并且被配置用于通过利用毛细管作用来测定流体样品。免疫荧光测定系统包括使用荧光检测试剂,所述荧光检测试剂包含荧光标记的微粒,所述荧光标记的微粒与分析物结合试剂缔合、连接或配位,以标记样品中的预定分析物并通过使用荧光光谱法来检测分析物。应当理解,在免疫测定中,分析物结合试剂和分析物将通常通过互补抗体和抗原来提供。还应当理解,用于将目标分析物固定化到装置中检测区中的捕获试剂将通产由互补抗体或抗原提供,这取决于目标分析物是抗原还是抗体。
合成聚合物线界定至少样品装载区,所述样品装载区用于将流体样品装载到线上;和检测区,所述检测区用于固定化和检测样品中目标分析物的存在。检测区包括对样品中的预定分析物具有亲和力的固定化捕获试剂。应当理解,合成聚合物线适用于将流体样品通过毛细管作用从至少样品装载区运载至检测区。然而,可提供线中的其他区以及构型的变型。其他区可包括一个或多个试剂区、散布区、封闭区或过滤区、阻挡区或缓冲区等。这些区通过毛细管作用彼此流体连通,这意味着除了固定化到检测区中的捕获试剂外,流体、试剂和反应产物可在各区间通过。这些区可分隔、叠置或相邻。
可通过使用具有结合预定分析物的亲和力的荧光检测试剂来‘标记’样品中的分析物以供检测。可将样品在与多孔载体接触之前进行荧光标记,或替代地,多孔载体可包括‘标记’或‘检测区’(例如中间区),在所述区中,样品调动已可逆地(暂时地)固定化到多孔载体中的荧光检测试剂。荧光检测试剂可包含与分析物结合试剂缔合、连接或配位的荧光标记的微粒。例如,当目标分析物为抗原时,分析物结合试剂通常为互补抗体。当分析物与调动的荧光检测试剂反应时,液体样品和调动的检测试剂沿着多孔载体进一步迁移至检测区(其可也被称为‘捕获区’或‘固定化区’),在所述区中,结合相同分析物(例如抗原)的捕获试剂(例如抗体)通常以线条的形式固定或固定化到多孔载体。当分析物存在于液体样品中时,通过捕获试剂与调动的荧光标记的分析物结合而形成复合物,并且所得荧光标记的分析物浓度导致出现于检测区中的可检测线条,其指示阳性结果。任何剩余的样品液体与其余荧光标记的试剂继续迁移通过检测区(例如)到达对照区,所述对照区可被配置成提供第二线条,所述第二线条指示样品已前移穿过检测区和对照区并且指示测定已提供有效的测试结果。其余样品和剩余的荧光标记的试剂可随后被配置成迁移至多孔接收区。应当理解,未与预定分析物反应并且在多孔载体的整个其他区域上被截留的任何流动的荧光标记的试剂促成可降低检测准确性的背景信号。
合成聚合物线可设有中间区,所述中间区设置在之间样品装载区和检测区之间。中间区可用于进一步将样品装载区和检测区分隔,并且可能包括或可能不包括任何另外的试剂。在一个实施方案中,荧光检测试剂可以可逆地固定化到装置的中间区上。所述方法包括通过毛细管作用从样品区运载至中间区的样品,在所述中间区中,样品中的分析物可结合并且调动可逆固定化的荧光检测试剂以形成荧光标记的分析物。荧光标记的分析物随后通过毛细管作用从中间区运载至检测区。荧光标记的分析物可随后通过与对预定分析物(例如抗原)具有亲和力的固定化捕获试剂(例如捕获抗体)结合而被固定化到(‘捕获’)捕获区中。
免疫测定装置可包括单个线或多个线。免疫测定装置可用于单一或多重测定中,例如用于测定一种或多种预定分析物。可提供多种构型的装置。例如,免疫测定装置可包括各自连接在中心点处的多个线,其中中心点提供样品装载区并且各线的远端构成检测区。至少在一些实施方案中,本文所述的侧流免疫测定装置和系统可被称为“一步”免疫测定。一步免疫测定可为“湿式”或“干式”免疫测定。
“湿式”一步免疫测定包括一个或多个合成聚合物线(作为多孔载体),其界定至少样品装载区,所述样品装载区可位于线的近端,和检测区,所述检测区可位于线的远端。可在各样品装载区和检测区之前、之间或之后提供其他区。在此“湿式”系统中,在样品接触线的样品装载区之前将样品与荧光检测试剂混合。在与样品装载区接触之前,荧光检测试剂(例如荧光标记的抗体)与样品溶液中的预定分析物(例如抗原)特异性结合而形成荧光标记的分析物。在将样品溶液置于线的样品装载区上时,样品溶液通过毛细管作用在整个检测区上移动,其中荧光标记的分析物被固定至检测区中的固定化捕获试剂(例如固定化抗体)。因为分析物是荧光标记的,所以如果溶液中存在任何分析物,则可检测到检测区的荧光。
“干式”一步免疫测定包括一个或多个合成聚合物线(作为多孔载体),其界定至少样品装载区、检测区和设置在样品装载区和检测区之间的中间(标记)区。“干式”测定与湿式测定的不同之处在于包括直接位于线上的荧光检测试剂,所述荧光检测试剂可逆地(暂时地)固定化到中间区中。将包含所关注分析物的样品溶液首先置于样品区上。通过毛细管作用,样品溶液横穿线。当样品中的分析物通过中间(标记)区时,任何分析物均被荧光检测试剂所标记以形成荧光标记的分析物。荧光标记的分析物被固定化并且连同样品溶液一起继续横穿线的长度而到达检测区。如针对“湿式”测定所论述,样品溶液通过毛细管作用在整个检测区上移动,其中荧光标记的分析物被固定至检测区中的固定化捕获试剂(例如固定化抗体)。因为分析物是荧光标记的,所以如果溶液中存在任何分析物,则可检测到检测区的荧光。
图1中示出用于干式“一步”免疫测定的免疫测定装置的第一实施方案。在此示意图中,免疫测定装置(1)由示例性的五个独立且平行的线道(2a-2e)组成以提供五重免疫测定测试。如前所述,免疫测定装置可由一个线道或多个线道组成,这取决于需要测量多少分析物靶标。
在图1中示出的实例中,第一,样品被装载到多孔样品垫(7)上。样品垫的作用是接纳样品,或对样品进行处理以使得样品与测定相容并且针对测定释放分析物。示例性样品垫可由纤维素、玻璃纤维、人造丝或其他过滤介质制成。
第二,样品从样品垫(7)释放,样品能够流入多个独立且平行的缀合物垫(3a-3e)中,其中每个缀合物垫与样品垫7流体连通。这些结合物垫中的每一个将包含干透的固定化缀合物,这种缀合物为与荧光标记的微粒结合的所关注的特定靶标的检测器抗体。当样品流入缀合物垫中时,干透的缀合物被再水化并且释放。随后,每个线道中的释放的再水化结合物将与对线道中的缀合物具有特异性的任何靶抗原形成免疫复合物。缀合物垫可由玻璃纤维、聚酯或人造丝制成。
第三,分析物(可能包含与靶抗原的免疫复合物)从缀合物垫(3a-3e)释放到线道(2a-2e)中,各线道与其各自的缀合物垫流体连通。各线道将允许分析物沿着每个线的纵向轴线芯吸直至抵达检测区(4a-4e)。在每个线道内的检测区处,干透的捕获抗体存在于线上,并且所述捕获抗体对靶抗原具有特异性。因此,在特定的线道中如果存在包含靶抗原的荧光标记的免疫复合物,则其将结合检测区处固定化到线上的捕获抗体,并且这将随后被检测为与阳性测试结果相关联的机器可读荧光信号。或者,如果不存在靶抗原,则检测区中应当不存在荧光标记的微粒的结合,并且这将随后被检测为与阴性测试结果相关联的机器可读的零(或近零)荧光信号。
第四,分析物流动通过检测区(4a-4e)到对照区(5a-5e)中。在对照区(5a-5e),另一捕获抗体被固定化到线上。此另一捕获抗体通常为种特异性抗体,对缀合物中的检测器抗体具有特异性。这样,对照区(5a-5e)处的阳性荧光信号被用作质量控制信号以确保测定已始终正确运行。
第五,分析物流动通过对照区(5a-5e)到吸芯或绒垫(8)中。吸芯与线道流体连通并且被设计成将流体从线中拉出(利用线内的毛细管作用),并且将其保持测定的持续时间。吸芯材料通常为高密度纤维素材料。
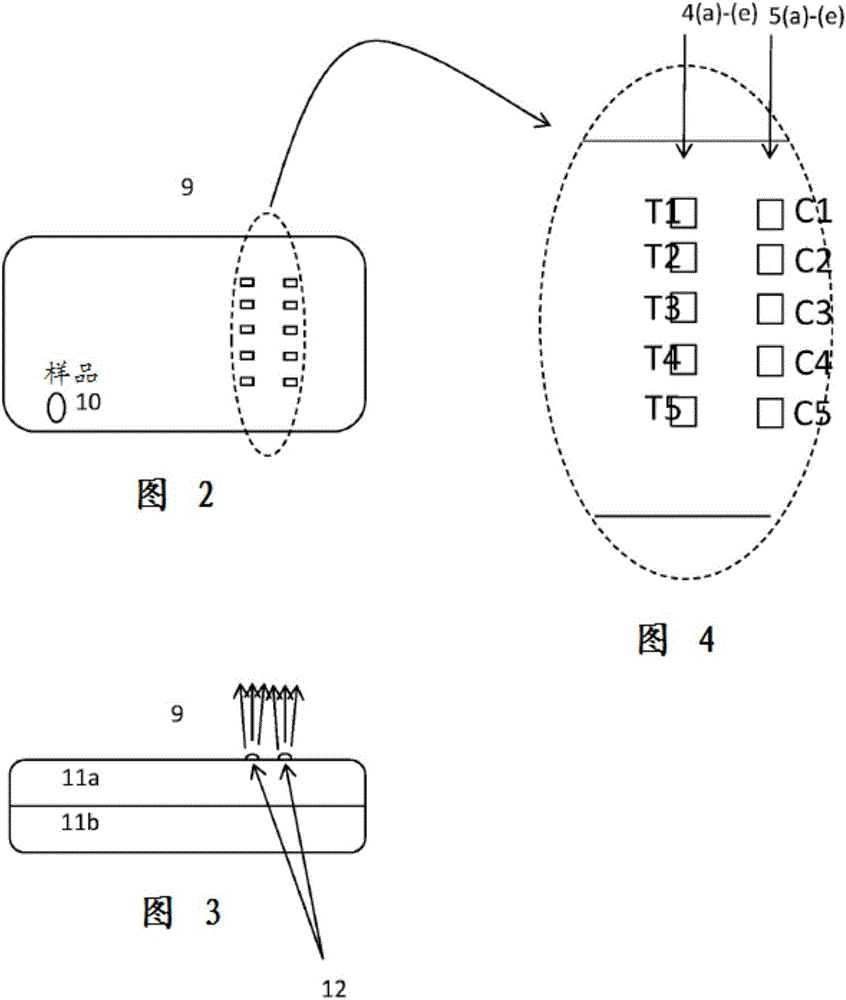
图1中示出的免疫测定装置可容纳在图2中示出的塑料盒(9)中。塑料盒在其上表面中可具有引入样品的孔口(10),此孔口使样品垫(7)暴露(如图1中所示)。塑料盒可由上半部和下半部(11a和11b)构成,如图3中所示。线上的检测区(4a-4e)和对照区(5a-5e)也通过盒上半部中的窗口暴露,如图4中所示。这些窗口中的每一个均可被来自外部器械(未示出)的荧光激发光照亮。因此,在位置(4a-4e,检测区)或位置(5a-5e,对照区)处存在于线上或存在于其中的任何荧光微粒将发出与这些区中的微粒量成比例的荧光射线信号。这些荧光射线可被外部器械(未示出)中的任何已知的光检测器读取。荧光射线可经由图3中示出的透镜12而被引导或聚焦到光检测器中。这样,示例性五重测定的结果可报导为图4中示出的独立读取的荧光射线T1-T5。出于质量控制的目的,图4中示出的对照C1-C5也必须各自被检测为阳性荧光信号以确认测试已正确运行。
图5中示出用于干式“一步”免疫测定的免疫测定装置的第二实施方案(100)。此实施方案使用与第一实施方案相同的条件,除省去了结合物垫3a-3e外。这些缀合物垫被缀合物区(103a-103b)代替,所述缀合物区为线道(2a-2e)内缀合物被干透进入线本身中的区。在此实施方案中,从样品垫(7)芯吸样品,穿过线道(2a-2e)并进入缀合物区(103a-103e)使得线中的区(103a-103e)内的缀合物再水化并释放。在所有其他方面,免疫测定装置的第二实施方案(100)以与第一实施方案(1)相同的方式工作,包括提供图2-4中示出的塑料盒(9)。
在免疫测定装置的第二实施方案(100)中,还可在“湿式”一步免疫测定的情况下省去缀合物区(103a-103e)。
可用另外的试剂例如pH试剂或缓冲剂、表面活性剂和/或封闭剂、添加剂以及其他试剂对液体样品进行预处理以优化反应,从而提高测定灵敏度。这些试剂通常浸渍到多孔载体中或浸渍到装置的其他部件(例如,缀合物垫)中,然而当免疫测定装置为测试试剂盒的一部分时,它们还可与液体样品混合作为单独的试剂。
样品可单独使用,如常常以尿液或血清相容的测试完成,或其可与测试专用的缓冲液混合。此缓冲液可仅为稀释剂/电泳缓冲液例如PBS或类似物,或者其可更加复杂并且具有有利于进行测试的特定组分或萃取特性,例如细胞溶解缓冲液。
样品装载区是含分析物样品的流体毛细流动开始的地方,并且是优选地表现出低分析物保持的区。通常,样品装载区可设有中性蛋白封闭试剂,然后进行处理以固定化封闭剂(例如冻干),这可增加芯吸作用。至少在一些实施方案中,如本文所述的合成聚合物线可在不使用封闭试剂的情况下提供合适的芯吸作用。样品区还可设有另外的固定化剂以通过截留样品溶液中任何不可取的颗粒来起到机械过滤器的作用。
样品区内的样品处理通常包括滤除颗粒或红血球;改变样品的pH;主动结合可妨碍测定的样品组分;以及破坏或裂解样品中的基质组分以针对测定释放分析物。
检测区可包括固定化捕获试剂(例如捕获抗体)的捕获线条。在检测区中提供捕获抗体的情况下,所述捕获抗体通常被选择来与目标分析物上的第二表位结合(例如靶抗原,因为抗原的第一表位与荧光检测试剂结合)。目标分析物从而通过与合成聚合物线上的抗体薄线条结合而在捕获线条处集中。当荧光标记的分析物在检测区上方运载时,分析物上的表位与捕获线条处的抗体结合。因此,如果样品中存在目标分析物,则捕获线条会发荧光。通过将捕获抗体置于薄线条中的合成聚合物线上,免疫测定系统可检测样品中的极少量的分析物。因为每个分析物分子可与荧光检测试剂结合,所以样品中的分析物浓度与结合于捕获线条处的荧光标记的微粒的浓度相关联。因此,包含目标分析物的样品将在整个线的捕获线条上产生荧光带,荧光带的水平与样品中的分析物的量成正比。
可通过一系列熟知的方法来进行检测区处的荧光检测。例如,可使用处于接近荧光微粒的激发波长的特定激发波长的LED来输送激发光。也可使用激发滤光片。来自捕获线条的发射光(可能被激发滤光片过滤)随后可被荧光检测器检测到。这种荧光检测器可由一个或多个光检测器组成,其中每个光检测器专门用于分析来自特定线道的荧光射线。荧光检测器可替代地由线(一维)或面(二维)像素阵列组成,其中来自特定线道的荧光响应专门针对所述阵列上的特定像素地址。光检测器可为将入射光转换成矩形波(例如TAOS T235装置)的类型,其中矩形波的频率与入射光强度成比例,并且该频率通过微处理器进行测量。光可经由光导装置从激发LED引导至检测区,所述光导装置可为例如一体模制部件或由纤维光束构成。发出的荧光可经由类似的光导装置从检测区引导至光检测器。激发和发射光导装置(就光导纤维而言)可束集在一起以在检测区处形成分叉的探头。扫描机构可用于将各检测区窗口移动穿过分叉的探头以检测测定结果。
在一个优选的实施方案中,来自LED的光应处于大约365nm(UV)的激发波长,并且应适于激发来自内部用铕染色的微粒的荧光响应。这些铕微粒在615nm处发出荧光响应(橙色),其可被光检测器捕获。常规荧光检测或时间分辨荧光检测可与方法一起使用。在使用时间分辨荧光检测的情况中,不需要发射和激发滤光片。
本文所述的免疫测定装置可包括用于支撑合成聚合物线的基板或壳体。基板或壳体可由不妨碍测定工序的任何惰性材料制成,例如柔性片材、带材或模制塑料。壳体可用作支撑件来在处理和储存期间将合成聚合物线维持成所需构型并且保护合成聚合物线免于污染和损坏。壳体还可用于密封合成聚合物线并且将合成聚合物线彼此分隔(例如用于多重测定)以防止交叉污染。壳体可由透明材料制成。
样品和目标分析物
本文所述的免疫测定装置、系统和方法可用于测定小体积的生物样品,例如流体液体样品。可使用本文所述的诊断系统测定的生物样品包括例如尿液、全血、血浆、血清、脑脊液、腹水、泪液、汗液、唾液、排泄物、龈沟液或组织提取液。在一些实施方案中,待测定的流体样品的体积可为例如来自指刺的血滴,或例如来自新生或小动物的小尿液样品。
通过如本文所述的免疫测定装置可检测的合适的分析物可以为可发现特异性结合搭配物的任何分析物。一般来讲,具有医学和生物学显著性的大多数分析物可在抗体中找到特异性结合搭配物,所述搭配物是针对这些抗体或其片段来制备。合适的分析物包括可溶性分析物例如激素、酶、脂蛋白、细菌或病毒抗原、免疫球蛋白、淋巴因子、细胞因子、药物、可溶性癌抗原等等。作为合适的分析物,还包括激素,例如人绒毛膜促性腺激素(hCG)、胰岛素、胰高血糖素、松弛素、促甲状腺激素、生长激素、促性腺激素(gonadotropiπ)、促卵泡激素、促胃液素、缓激肽(bradykiπin)、加压素和各种释放因子。还可例如由衣原体(Chlamvdia)、淋病奈瑟氏菌(Neisseria gonorrheae)、鼠疫杆菌(Pasteurella pestis)确定各种各样的抗原性多糖。痢疾志贺氏菌(Shigella dvsentereae)和某些真菌例如小孢子菌属(Mycosporum)和曲霉属(Aspergillus)。另一主群包括与其他寡核苷酸或蛋白质靶标特异性反应的寡核苷酸序列。可通过如本文所述的装置、系统和方法测定的可溶性分析物的清单在美国专利No.3,996,345中提供,该专利以引用的方式并入本文。
基于本文所述的任一方面和实施方案对分析物的第一示例性测定是针对沙眼衣原体(chlamydia trachomatis)(CT)。当前基于使用包括硝酸纤维素膜连同胶体金可视标记物的测定的CT的快速测试通常面临灵敏度不良。例如,在对772名妇女的研究中,发现典型的商业快速衣原体测试(Quidel Quickvue Chlamydia Test)与核酸金标检验相比具有27%的灵敏度[来源:“Alarmingly poor performance in Chlamydia trachomatis point-of-care testing”,van Dommelen等,J.Sexually Transmitted Infections 2010年;86;第355-359]页。因此,可对CT提供80-90%灵敏度的快速诊断装置将具有高临床实用性。此外,本发明还可用于同时诊断其他具有CT的性传播疾病,例如CT和NG(淋病奈瑟氏菌)的双重测定或CT、NG和阴道毛滴虫(Trichomonas vaginalis)的三重测定。本发明准确和快速地并行诊断若干种性传播疾病的能力也具有高临床实用性。
基于本文所述的任一方面和实施方案的对分析物的第二示例性测定是针对蛋白质生物标记物肌钙蛋白I,其在急诊室中使用以诊断急性心肌梗塞(AMI)。准确测量此生物标记物需要能够测量的低分析物浓度低至100pg/ml或更佳的分析物浓度,并且具有高再现性(变异系数<10%)。
基于本文所述的任一方面和实施方案的对分析物的第三示例性测定是针对蛋白质生物标记物原降钙素(PCT),其为急诊室中急性败血病的诊断标记物。PCT可在多重诊断形式中与其他标记物例如C-反应蛋白(CRP)和白介素-6(IL-6)结合来增强诊断特异性。
应当理解,(荧光检测试剂的)分析物结合试剂和捕获试剂各自对预定目标分析物提供互补的结合搭配物。例如,如果目标分析物为蛋白质性物质,则分析物结合试剂和捕获试剂各自对蛋白质性物质提供单独的互补结合搭配物。通常,蛋白质性物质为抗体或抗原。在目标分析物为抗原的实例中,则分析物结合试剂和捕获试剂可各自对单独的靶抗原表位提供结合搭配物,例如以下情况:分析物结合试剂提供用于与靶抗原的第一表位结合的第一抗体,捕获试剂提供用于与相同靶抗原的第二表位结合的第二抗体。应当理解,如本文所用,术语“抗体”意指多克隆或单克隆全免疫球蛋白例如IgG、IgM、IgA、IgE等,或免疫球蛋白片段例如F(ab)2、F(ab')2、Fab、Fab'等,或它们的混合物,并且包括合成抗体。结合多种配体的抗体和抗体片段是已知的,并且将易于被本领域的技术人员理解。
合成聚合物线
应当理解,单独的合成聚合物线是通过将多个单独的合成聚合物纤维捻在一起而形成。在将各单独的纤维扭绞在一起的过程中,在线中的各单独的纤维之间形成间隙。除了可存在于材料中的由线的各单独的纤维所形成的孔隙之外,形成合成聚合物线的过程中所产生的间隙也向线提供一定的孔隙度。间隙所提供的孔隙可横穿线的长度并且提供一个或多个毛细管(即,通道)。当液体沿着由位于各单独的纤维之间的间隙形成的毛细管移动时,单独的线中产生毛细管作用(或芯吸),这是由液体和环绕表面内的和两者间的分子间力所导致。如果空隙的直径足够小,则表面张力(其由液体内的内聚力,即,液体与液体之间的吸引力导致)和纤维/线的液体与表面间的粘合力(即,液体与表面之间的吸引力)的组合起作用以通过毛细管作用沿着线抽吸(即,芯吸)液体。
可通过已知的制造方法以高性价比再现地制备具有尺寸基本上均匀的毛细管的合成聚合物线,所述制造方法通常涉及形成合成聚合物纤维并将合成聚合物纤维纺成线。具有尺寸基本上均匀的毛细管的合成聚合物线可对侧流免疫荧光测定提供芯吸速率的一致性得以改善的多孔载体材料,这可对分析物提供更加准确的诊断例如定量测定。具有尺寸基本上均匀的毛细管的合成聚合物线还可对侧流免疫荧光测定提供较低背景荧光的多孔载体材料,特别是当使用呈荧光微粒形式的荧光检测剂时,这也导致更加准确的诊断。尽管不希望受任何理论束缚,但据信具有基本上均匀的尺寸分布的线可降低截留流动的未结合的荧光检测剂、特别是截留微粒的可能性。使用各单独的合成纤维还可提供另外的优点,所述合成纤维基本上无孔或至少具有相当小的孔尺寸(即,最大孔的直径)和孔尺寸分布(即,孔尺寸的范围)。同样,不希望受任何理论束缚,据信基本上无孔的纤维会进一步降低将流动的未结合的荧光检测剂截留在各单独的纤维内、特别是截留微粒的可能性。换句话讲,任何可能存在的微粒将横穿线的毛细管,这与可存在于单独纤维中的任何较小的孔或通道相反(其中微粒可能被截留)。
如上文所提及的,由纤维形成的合成聚合物线具有由纤维之间的间隙形成的毛细管所产生的孔隙。毛细管提供液体分子可通过其中的通道。由一个或多个毛细管提供的平均孔尺寸可在约5-30微米的范围内。应当理解,可使用电子扫描显微术容易地测定平均孔尺寸和孔密度。
应当理解,合成聚合物线的每个合成聚合物纤维是由合成聚合物形成。还应当理解,合成聚合物将不包括天然聚合物材料,例如木纤维素、棉、丝和天然橡胶。例如,合成聚合物纤维由通常获自石化来源的合成化学物(单体和共聚物)制成,并且可包括由下列制成的纤维:聚酰胺例如尼龙、聚酯例如聚对苯二甲酸乙二醇酯(PET)、丙烯酸类聚酯、芳族聚酰胺、苯酚-甲醛(PF)、聚氯乙烯(PVC)、聚烯烃例如聚丙烯(PP)和聚乙烯(PE)和聚氨酯。合成聚合物纤维通常由可特别适用于形成纤维和线材料并且可特别适用于免疫测定的合成聚合物(包括单体和共聚物)形成。例如,合成聚合物可具有合适的亲水性(由表面官能团所导致)和合适的机械特性(例如弹性和抗拉强度)。合成聚合物可经选择和/或改性以控制纤维和线的多孔特性以及特定的表面化学性质。
在一个实施方案中,(线的)各单独的合成聚合物纤维由选自聚酰胺、聚酯、聚醚、聚烯烃、聚碳酸酯和聚氨酯的合成聚合物形成。合成聚合物可为卤化的,例如氟化的,例如聚偏二氟乙烯或聚氯乙烯。在另一个实施方案中,线的各单独的合成聚合物纤维由选自聚酰胺和聚酯的合成聚合物形成。由一系列合成聚合物制备聚合物纤维和线的一般方法是为熟知的。可将聚合物纤维或材料进一步改性以增加亲水性。可将聚合物共混或组合不同类型的聚合物纤维。
在一个实施方案中,线的各单独的合成聚合物纤维由聚酯形成。应当理解,聚酯为包含被酯官能团连接的重复单元的聚合物。聚酯可为热塑性的或热固性的。聚酯可为均聚物或共聚物。聚酯可为脂族的、半芳族的或芳族的。脂族聚酯可选自聚乙醇酸(PGA)、聚乳酸(PLA)、聚己内酯(PCL)、聚羟基链烷酸酯(PHA)、聚羟基丁酸酯(PHB)、聚己二酸乙二醇酯(PEA)、聚丁二酸丁二醇酯(PBS)和聚(3-羟基丁酸酯-共-3-羟基戊酸酯(PHBV)。半芳族聚酯可选自聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二醇酯(PBT、聚对苯二甲酸丙二醇酯(PTT)和聚萘二甲酸乙二醇酯(PEN)。芳族聚酯可为vectran,其可由4-羟基苯甲酸和6-羟基萘-2-羧酸缩聚形成。
在一个实施方案中,线的各单独的合成聚合物纤维由聚酰胺形成。应当理解,聚酰胺为包含被酰胺官能团连接的重复单元的聚合物。聚酰胺可为脂族聚酰胺、聚邻苯二甲酰胺或芳族聚酰胺(芳族聚酰胺(aramide))。在一个实施方案中,脂族聚酰胺为尼龙。尼龙可选自尼龙-6,6;尼龙-6;尼龙-6,9;尼龙-6,10;尼龙-6,12;尼龙-11;尼龙-12和尼龙-4,6。
合成纤维可为由两种不同的形成纤维的聚合物共挤出的纤维。共挤出的纤维可以芯-皮或并列构型的形式提供。
在一些实施方案中,使用多种已知的物质和方法中的任一种对线进行功能化以增强吸收和/或芯吸特性。纤维或线可用试剂涂布或掺入以改变毛细管作用。还可提供此类试剂以增强蛋白质(例如抗体)与仅处于测试线位置处的纤维或线结合的能力,或阻碍蛋白质与仅处于远离测试线的位置处的纤维或线结合的能力。在形成纤维时可将试剂掺入聚合物材料或纤维可与试剂接触以在其上进行吸收。试剂可为可光活化的,例如通过紫外光。可在线的一个或多个选定的区(例如仅处于测试线位置处)中提供选定试剂中的一种或多种。
荧光检测试剂
荧光光谱法是熟知的、灵敏的且通用的光学分析技术。在免疫荧光测定中,用具有已知的在荧光物质的激发光谱内的光谱分布的光照射包含用荧光物质标记的分析物的样品。测定荧光物质的所得特征发射光谱的强度并且其与样品中的目标分析物有关。
如本文所述的侧流免疫荧光测定装置、系统和方法涉及使用‘荧光检测试剂’来通过线的检测区中的荧光射线对供检测的标靶的分析物进行标记。如前所述,荧光检测试剂可与样品在装载到线上之前进行混合(例如‘湿式’一步免疫测定)或可暂时地固定化到样品装载区和检测区之间的线的位置(例如中间区)处(例如‘干式’一步免疫测定),以与此前装载到线上的样品中的目标分析物结合。
应当理解,荧光检测试剂包含可选择性地与目标分析物结合的荧光标签。为了提供具有此类结合目标分析物的选择性的荧光标签,使荧光标签与对样品中的预定分析物具有亲和力的分析物结合试剂缔合、连接或配位。对于免疫测定,分析物结合试剂通常为经选择对样品中的预定目标分析物(例如抗原)具有亲和力的抗体。或者,在目标分析物为抗体的情况下,分析物结合试剂可为经选择对样品中的靶抗体具有亲和力的抗原。在分析物结合试剂为抗体的情况下,可通过熟知的技术来实现抗体与荧光标签的连接,例如使荧光标签与对抗体具有亲和力的抗原配位,然后抗体经缔合以与荧光标签的抗原结合,或可使用连接基团将抗体直接共价结合至荧光标签。
免疫测定中使用的范围广泛的包括荧光标签的荧光检测试剂为熟知的,例如美国专利No.4,058,732、No.4,283,382和No.4,719,182中所述,这些专利以引用方式并入本文。荧光标签可包括荧光标记的颗粒,例如荧光微粒。
应当理解,如本文所提及,术语“微粒”意指直径介于0.1μm和100μm之间,例如大于100nm的颗粒,这与指直径小于100nm的颗粒的术语“纳米粒子”相反。
用作标签的荧光颗粒的一个实例描述于美国专利No.4,283,382中,其中标签为包含与胶乳微粒结合的的铕的稀土镧系元素络合物的荧光微粒。包含铕(和其他镧系元素)的荧光标签已在商业免疫测定中使用一段时间。已开发出将所关注的特定信号与背景信号分离的时间分辨技术。遗憾的是,这些时间分辨技术要费时完成并且涉及测定荧光信号是从结合的分析物产生还是从背景荧光产生。这些技术未解决未结合的标记试剂在多孔载体的检测区中的任何截留所导致的问题。因此,在侧流免疫测定中使用荧光颗粒仍面临未结合的荧光标签在多孔材料中的截留相关的高背景噪声。在使用侧流免疫测定来检测少量的目标分析物或定量测定目标分析物的水平或浓度时,这种背景噪声是特别成问题的。
得自单个荧光微粒的荧光射线的量与微粒的直径相关联,因为较大的微粒可通过与更多的荧光物质缔合来标记,如Harma等的研究中所描述,该研究的题目为“Europium Nanoparticles and Time-resolved Fluorescence for Ultrasensitive Detection of Prostate-specific Antigen”,Clinical Chemistry,2001年3月,第47卷第3期第561-568页。例如,107nm直径的微粒可包含约3.1×104个螯合的铕离子,而408nm的微粒可包含约2×106个螯合的铕离子。因此,约400nm的较大直径微粒可引发的荧光响应为约100nm的较小直径微粒的大约100倍。鉴于此,可通过使用较大的荧光微粒来提高免疫荧光测定的灵敏度。例如,美国专利No.4719182描述了使用荧光微粒来在免疫测定中获得改善的灵敏度。然而,发明人已发现较大的荧光微粒可在侧流免疫测定中使用的常规多孔载体系统中导致较高的背景噪声,据推测这是由于较大的微粒在多孔载体材料中的截留所导致。因此,使用较大的微粒在提供目标分析物的检测准确性方面可能日益成问题并且造成妨碍。意外的是,发明人已发现使用合成聚合物线可减少此类免疫测定系统中的微粒截留导致的背景噪声。
在如本文所述的免疫荧光测定装置、系统和方法的一个实施方案中,提供一种包含荧光标记的微粒的荧光检测试剂,所述荧光标记的微粒与对样品中的预定分析物具有亲和力的分析物结合试剂缔合、连接或配位。在另一个实施方案中,分析物结合试剂为对样品中的预定目标分析物具有结合亲和力的抗体。
用于将抗体偶联至此类荧光微粒的方法为熟知的,并且进行这种偶联的示例性方案可见于Bangs Laboratories,Inc.的Technical Note#205。此工序导致形成检测器抗体/检测器微粒缀合物,所述缀合物可装载到如前所述的线的缀合物垫或缀合物区中。
荧光标记的微粒
如本文所述,荧光标记的微粒可为荧光标记的聚合物微粒(即,由聚合物、共聚物或单体形成的荧光标记的颗粒)。可通过用荧光稀土金属络合物标记聚合物微粒来形成荧光标记的聚合物微粒。换句话讲,荧光标记的聚合物微粒可包括与荧光稀土金属络合物缔合、配位或连接的聚合物微粒。
范围广泛的荧光稀土金属络合物可适于作为聚合物微粒的荧光标签。特别合适的稀土金属络合物为熟知的,其提供检测灵敏度并且具有相对长使用期的荧光。稀土金属络合物包含稀土金属例如镧系金属。镧系金属可选自铕、铽和钐。在一个实施方案中,稀土金属为铕。荧光稀土金属络合物可以金属螯合物的形式提供,例如铕、铽和钐的芳族二酮螯合物,例如苯甲酰丙酮铕和苯甲酰三氟丙酮酸铕。适于稀土金属的螯合剂的其他例子可包括1,3-二酮(例如乙酰丙酮酸盐、苯甲酰丙酮酸盐、苯甲酰苯甲酸盐、三氟-2-呋喃基乙酰丙酮)、邻苯二甲酸盐、萘甲酸盐(例如二萘酰甲基化物)、联吡啶(例如2,2'-联吡啶-1,1'-二氧化物、4,4'-二甲基-2,2'-联吡啶)、四吡啶(例如2,2',6',2"-四吡啶)和菲咯啉(例如异硫氰酸菲咯啉)。
应当理解,可选择、制备或加工聚合物微粒以提供低粒度分布。聚合物微粒的平均直径(以nm计)可在100至5000、125至2000、150至1000、175至500或200至400的范围内。聚合物微粒的平均直径(以nm计)可为至少约100、200、300、400、500、600、700、800、900或1000。可提供平均直径处于这些值的范围内或为这些值的微粒。在另外的特定实施方案中,聚合物微粒的平均直径为至少约200nm,在约200至400nm的范围内,或约300nm。
适用于形成可装载微粒的方法和聚合物为熟知的。例如,合适的聚合物可包括由一个或多个乙烯基芳族单体例如任选取代的苯乙烯和乙烯基萘基,或一个或多个任选取代的烯键式不饱和单体形成的那些。合适的单体可包括苯乙烯、丙烯酰胺和丙烯酸。应当理解,其他聚合物(以及单体和共聚物)可为合适的。
用于制备(装载)荧光标记的聚合物微粒的方法为熟知的,并且可通常涉及将稀土金属络合物掺入聚合物微粒中,方式是通过在未凝结、未溶解的可装载聚合物微粒的存在下将疏水物在水混溶性溶剂中的亲水性逐渐增加到基本上没有疏水物在水混溶性溶剂中保持溶解的时点。装载到微粒中的金属络合物的量可以变化。
荧光检测
用于检测装置中检测区处的荧光标记的分析物的合适的荧光检测器在本领域中为熟知的。
如本文所述的侧流免疫荧光测定装置、系统和方法可具有许多应用,包括低成本快速诊断,例如运动医学、婴儿/儿童诊断、糖尿病监测、军用、工业化程度较低的国家可负担起的诊断、环境或现场检验。此外,所述方法在临床上可用于辅助患者管理决策。就此而言,定量测量可改善关于药物剂量或治疗选择的临床决策。例如,使用如本文所述的装置和系统,所述方法可用于确定受试者的疾病进程。疾病进程是指疾病状态随时间推移的变化,包括诊断、疾病进展(恶化)和疾病退行或缓解(改善)。因此,所述方法可涉及在两个或更多个不同的时间点(例如第一时间和第二时间)对受试者进行诊断测量,并且比较量的变化(如果有的话),其中基于这些比较来确定疾病进程。
通过以下实施例对本发明进行进一步阐述。提供这些实施例仅仅是为了进行阐述。这些实施例不应理解为以任何方式限制本发明的范围或内容。
实施例
根据本公开的实施方案,包括合成聚合物线作为多孔载体材料的侧流免疫测定,特别是其中分析物检测试剂包含荧光微粒的免疫荧光测定,经证实可提供适用于定量测量目标分析物的准确诊断系统。以下实施例提供了包括根据本公开的一些实施方案的呈合成聚合物线形式的多孔载体材料的侧流免疫测定系统与包括常规硝酸纤维素膜和天然纤维棉线的多孔载体材料的侧流免疫测定系统之间的比较。
实施例1:目视可检侧流免疫测定中的多孔载体材料的比较研究
首先对两种类型的多孔载体材料,即基于天然棉纤维的线(DMC Cebelia)和硝酸纤维素膜进行侧流免疫测定比较研究。多孔载体材料构成近端处的样品装载区和远端处的包括捕获抗体的检测区(与取样区分隔)。比较研究涉及使用这样的样品,所述样品包括呈稀释系列的C-反应蛋白(CRP)形式的预定分析物,和包括与CRP抗体配位的胶体金标记物检测标签的检测试剂。所用的抗体对为得自R&D Systems Inc.的MAB17071人CRP单克隆抗体(克隆232007)的配对。
进行免疫测定研究以测定棉线和硝酸纤维素膜检测不同浓度的CRP的能力。
发现棉线和硝酸纤维素膜两者的检测限(LOD)为约12.5ng/ml。此结果表明,就检测目标分析物的存在的能力而言,使用棉线和使用硝酸纤维素膜基本上没有差别。然而,发现市售棉线的芯吸速率的变异系数(CV)为26%,这与甚至商业硝酸纤维素膜相比也是较不良的结果。芯吸速率的此不良CV导致检测器抗体-抗原复合物(标签-抗体-CRP复合物)横穿检验区的速度发生变化。在相同的分析物浓度下,快芯吸速率导致不太密集的测试线,而慢芯吸速率导致更加密集的测试线。测试线密集度的此变化(如使用硝酸纤维素膜出现的)无法提供获得准确定量测定的足够稳健的平台。
鉴于这些结果,认为作为快速侧流免疫测定中的多孔载体材料的天然棉纤维线和硝酸纤维素膜无法提供目标分析物水平的检测准确性,并且特别不适于作为其中需要定量测量目标分析物的快速侧流免疫测定中的多孔载体材料。
在尝试发现天然纤维棉线和硝酸纤维素膜的可能替代物的过程中,制备并测试了合成聚合物线。合成聚合物线的检测能力通过使用常规的着红色的胶体金标签和系列稀释的CRP来测定,如前所述。合成聚合物线在检测能力方面显示具有良好的性能。制备并测试两种类型的合成线,基于聚酯的线和基于尼龙-6的线。两种合成线均通过如下制备:通过喷丝头挤出圆形合成纤维,然后将纤维用机器捻成线。
尼龙-6合成线显示使用胶体金可视标记物的CRP的检测限为约12.5ng/ml(如图6b中所示),这与针对硝酸纤维素膜的结果相同(在图6a中并行示出)。然而,意外的是,合成线在芯吸速率的再现性方面有着显著更佳的表现。在竖直芯吸速率试验的多个平行测定中,发现尼龙纱表现出的CV为5%,这与棉线和硝酸纤维素膜中可得到的芯吸速率CV相比改善了2.5-5倍。因此,机器挤出和机器纺成的合成线例如尼龙中的高芯吸速率再现性导致进行可重复定量测定的能力。
实施例2:包括荧光标记的微粒的侧流免疫荧光测定中的多孔载体材料的比较研究
在作为多孔载体材料的合成聚合物线与常规硝酸纤维素膜和天然纤维棉线之间进行比较研究,该比较研究涉及在侧流免疫荧光测定中使用荧光标记的微粒。免疫荧光测定涉及使用包含荧光微粒的荧光检测试剂。此研究中使用的荧光标记的微粒为铕染色的微粒,如美国专利No.4719182中所述,并且根据前一实施例所述使用CRP免疫测定系统。
该研究涉及使用Millipore HFP 90硝酸纤维素膜、300nm铕染色的微粒和Ocean Optics USB2000+光谱仪并结合Ocean Optics365nmLED激发源以分析铕标记的CRP测定的荧光响应。将测试条装载到位于无光外壳中的夹具中,并且通过速度受控的伺服马达来驱动夹具。使用激发和激发滤光片来阻挡任何进入光谱仪的光,该光与来自615nm下铕微粒的发射无关。
在CRP测定中,使用BioDot可编程分配器将CRP捕获抗体固定化到测试条上(在如图1中所示的位置4)。在单独的步骤中使CRP检测器抗体缀合至300nm铕染色的微粒,然后在从150ng/ml低至0.15ng/ml的2倍稀释步骤中与CRP抗原混合,其中对单独的测试条运行这些稀释中的每一者(在6次平行测定中)。在通过测试条运行每次CRP稀释后,使用电泳缓冲液进行洗涤步骤以确保任何未结合的铕标记的抗体复合物(未结合的荧光检测试剂)脱离条。还实施膜封闭措施来减少铕标记的抗体(未结合的荧光检测试剂)的存在,所述铕标记的抗体通常结合至硝酸纤维素膜的全部区域(并且归因于问题较多的背景荧光)。将阴性样品(CRP=0ng/ml)用作对照以提供任何铕标记的抗体与硝酸纤维素膜结合的指示。
在分析不同CRP浓度的平行测定测试条后,意外地发现,远离测试线位置的区域中的背景的荧光读数较高并且还广泛变化。图7中包括示出这些结果的剂量响应曲线。开发诊断测试中的信号背景比的准则为信号背景比应高于比率3。在此基础上,仅发现高于9.375ng/ml的CRP浓度具有始终高于3.0的信号:背景比。因此,认为这是硝酸纤维素膜的铕微粒测定的LOD。
使用铕荧光微粒的硝酸纤维素的此LOD与常规胶体金标签相比大致相同,如实施例1中所述(LOD=12.5ng/ml),意外地发现,使用铕微粒的LOD不如预期那么低,并且仅优于胶体金结果1.3倍。这似乎归因于存在不需要的高背景荧光信号,该高背景荧光信号存在于远离测试线位置的区域中的膜上。尽管不希望受任何理论束缚,但据推测,高背景信号的出现是由于300nm铕微粒被卡在硝酸纤维素膜的高度可变的孔结构中。图10中示出硝酸纤维素膜的10,000倍放大率的电子显微镜图像。此膜为高流量膜(Millipore HF90),已知该膜对于侧流测试中所用的膜而言具有较大的孔尺寸。在图10中,我们意外地发现,膜中的一些孔小于铕微粒的直径(<300nm)(201),这将潜在地导致此类微粒不利地存纳在膜的除检测区或对照区之外的位置处。此外,我们还意外地发现,铕微粒可在芯吸期间簇集在一起(参照图14,以及下文所附描述),例如呈2或3个铕微粒的聚簇,并且此类聚簇更有可能不利地存纳在膜的除测试线或控制线之外的位置处。铕微粒在膜中这些位置处的不利存纳不太可能能够通过多个洗涤步骤,或通过传统的膜封闭措施(例如施加酪蛋白或类似物)来防止非特异性结合,或通过图像分析软件补偿来解决,因为这些颗粒的不利存纳是由膜结构本身的物理限制所致。这些颗粒的不利存纳有可能在除检测区或对照区之外的位置处引起高的不需要的背景荧光信号,并且这些高背景信号将显著降低测定的潜在灵敏度。
在图11中,我们示出沿着硝酸纤维素膜的纵向方向的扫描,其中使用C-反应蛋白的阴性样品(0ng/ml)。在此扫描可看到,在沿着测试条长度的所有位置处具有大量的荧光信号,并且测量的背景荧光在此扫描中具有高达6000次计数。此扫描示出上述的不利存纳问题,并且结果是,信号水平低于6000次计数的阳性CRP测定将不利地记录为假阴性。
不想要的存纳问题的唯一解决方案可为使用铕纳米粒子(例如50nm直径,类似于胶体金)。然而,较小的此类纳米粒子具有比较大微粒低数个数量级的荧光响应,因此这种解决方案将损失使用较大铕微粒的灵敏度益处。
对商业棉线(DMC Cebelia)进行相同的荧光CRP测定滴定系列,并且发现棉线的信号:背景比和LOD类似于常规硝酸纤维素膜,如图8中的剂量响应曲线中所示。同样,不希望受理论束缚,据推测这种情况的出现是由于棉线的横截面结构(图12中示出)是高度可变的,并且可不利地将较大的直径微粒截留在除测试区或对照区之外的位置处。
对由尼龙-6纤维形成的合成聚合物线进行相同的荧光CRP测定滴定系列,并且意外地发现LOD比针对硝酸纤维素或棉的LOD低得多。图9中包括示出这些结果的剂量响应曲线。通过对处于低至0.05ng/ml的不同稀释的平行测定尼龙线的测量,测量>3.0的信号:背景比。因此预期针对尼龙线的CRP的LOD将为大约50pg/ml-比常规硝酸纤维素膜低大约187倍。此意外发现的意义非常重大,因为许多诊断测定需要高诊断灵敏度。例如,心脏肌钙蛋白I标记物的测量(为诊断急性心肌梗塞)需要100pg/ml或更佳的灵敏度,因此认为合成线(例如尼龙)将允许将此诊断标记物的快速测试用于急诊室中,而常规硝酸纤维素膜将是不适合的。
尽管不希望受任何理论束缚,但据信获得尼龙线的高灵敏度,因为300nm铕珠粒未截留在尼龙长丝(203)之间的间隙(202)中,如图13中所示。这导致产生低背景读数,这进而又产生比硝酸纤维素膜更高的信号:背景比。此观察被以下事实验证,即就以0.1ng/ml测量的样品而言,远离测试线的背景读数在尼龙线的情况中为平均1085次计数,这比处于相同CRP浓度的硝酸纤维素膜的计数低大约10倍。
图14示出在以12.5ng/ml进行的CRP测定的情况中,具有与线表面结合的铕微粒的40微米直径尼龙线上的检测区位置的2500倍放大率的电子显微镜术图像。在此图像中可看出,一些铕微粒已与线表面单独结合(作为单一颗粒201),然而其他铕微粒已形成较大的聚簇206。尽管这些聚簇较大,但它们仍然能够通过毛细管芯吸作用透过线中的间隙202进行运送,而不会不利地存纳在线结构的除检测区或对照区之外的位置处。
除了合成线上的所需的低背景信号特征外,在使用合成线时的另一意外的发现是检测区和对照区处的荧光信号与使用硝酸纤维素膜所获得的那些荧光信号具有类似的强度。已知硝酸纤维素膜对于捕获检测区处的标记的分析物靶标而言具有非常高的表面积,并且已知这种高表面积为促进灵敏度增强的期望特征。相反,已知线具有较低的表面积,这在理论上应当会导致分析物靶标在测试区的相当低的荧光信号。然而,就硝酸纤维素膜而言,膜材料为不透明的白色,这意味着仅靠近膜的上表面的荧光微粒能够被激发源激发。然而,就许多类型的合成线(包括尼龙线)而言,能够使用透明纤维。如图13中所示,这意味着激发光204能够穿透若干个线203以激发所有间隙202中的铕微粒。此外,来自微粒的荧光发射光205能够穿透若干个线回到检测源。这样,本发明中使用的合成线允许透过线结构的整个深度读取荧光信号,而在硝酸纤维素膜中,这仅在表面处有可能。我们认为这种能够透过线的深度读取的能力可补偿线中可用于结合的表面积的损失。
因此,已意外低发现,当使用合成聚合物线而非常规硝酸纤维素膜作为多孔载体材料(即,芯吸基板)进行测定时,利用以荧光标记物包封的微粒的快速荧光侧流免疫测定具有显著改善的诊断灵敏度和再现性。包括合成聚合物线作为多孔载体材料(特别是当与荧光标记的微粒一起使用时)的免疫荧光测定因此可用于其中需要高灵敏度或也可能需要定量分析物靶标的快速诊断测定。
- 还没有人留言评论。精彩留言会获得点赞!