一种快速检测微孢子虫孢子的方法与流程
本发明属于病原菌检测技术领域,具体涉及一种基于单细胞拉曼光谱直接检测病原菌微孢子虫孢子的方法。
背景技术:
微孢子虫(Microsporidia)是一类细胞内专性寄生单细胞真核生物,目前将其归类为真菌。微孢子虫的生活史可分为侵染期(孢子发芽)、繁殖期(裂殖生殖)和孢子形成期等3 个阶段。孢子是微孢子虫的成熟细胞,随寄主粪便排泄到体外而到处扩散,感染新的寄主,而孢子的发芽是微孢子虫侵染寄主的关键起始。
微孢子虫的寄主很广泛,可以感染包括人类在内的无脊椎动物和脊椎动物,引起许多昆虫、水产动物甚至灵长类动物等的严重病害。目前已发现有150多属,1400余种。其中,家蚕微孢子虫(Nosema bombycis,简称N.b)是人类最早发现的微孢子虫,主要寄生于家蚕。家蚕微粒子病就是由N.b感染、寄生引起的一种传染性蚕病,可以通过食下传染或胚种传染,对家蚕具有很强的危害性,被各国列为蚕种生产唯一的检疫病害。随着我国蚕丝业的发展,蚕种生产规模不断扩大,家蚕微粒子病对蚕种和蚕业生产的威胁也日趋严重。家蚕微粒子病是蚕业生产上的毁灭性疫病,家蚕微孢子虫不仅可寄生在家蚕幼虫、蛹、蛾的多种组织内,并能经蚕卵垂直传播给下一代,对蚕业生产尤其是蚕种生产造成严重危害,而且极易导致蚕茧品质和产量的下降,严重影响蚕丝产业链下游经济的发展。因此,对家蚕微孢子虫检测技术的研究是养蚕业中一个非常重要的项目,既具有理论意义,也具有实用价值。
国内外研究者对微孢子虫的检测方法进行了大量的探索和研究,从最早的肉眼鉴定方法发展到显微镜检查以及目前以血清学检测和分子生物学检测为主的检测技术。而对家蚕微孢子虫的诊断方法的研究,包括光学镜检、电镜检查、血清学技术、分子生物学技术等,这些方法各有优缺点。光学镜检虽然相对比较可靠、简便,但是其检测灵敏度较低,一般需要在感染的晚期才能观察到,检测存在极大的滞后性。电镜检查必须经过超薄切片后再进行电镜观察,对技术设备和操作人员的技术要求比较高,目前主要用于科研,尚且不能实用地进行诊断鉴别。分子生物学中的对微孢子虫的检测方法虽然在灵敏度以及特异性等方面比传统的显微镜检法有很大的优势,但是该方法对操作人员的实验技术要求高,观察结果染色时使用的染液对人体也会造成较大的毒性。微孢子虫检测技术的研究方向是实时、快捷、高效、准确和低价。因此,如何建立一种既快速、简便、高效又能够在基层广泛使用的检测方法已迫在眉睫。
参考文献:
1. [1]李俊强,孙芳芳,王荣军,张龙现. 环孢子虫食源性感染及其检测技术研究进展[J]. 食品科学,2015,07: 261-267.
2. 王 丽,崔旭初,童永发,靳桂才,田向红,夏云婷,查玉娥,张 荣. 人畜粪便隐孢子虫快速检测方法研究[J]. 公共卫生与预防医学,2015,04:26-28.
3. 王永宾,刘吉平. 微孢子虫检测技术的研究进展[J]. 中国寄生虫学与寄生虫病杂志,2009,02:161-166.
4. 张 冰,张 杰,许 杰,何惠君,巴图艾德尼. 隐孢子虫检测方法研究进展[J]. 中国草食动物科学,2014,02:56-60.
5.刘清明,邱国祥,李林山,林忠芬,钟苏苑,张桂玲,胡智明. 图像识别技术检测家蚕微粒子孢子的研究概述. 广东蚕业,2013,(4): 45-47.
6.Fu Z, He X, Cai S, Liu H, He X, Li M, Lu X: Quantitative PCR for detection of Nosema bombycis in single silkworm eggs and newly hatched larvae. Journal of Microbiological Methods, 2016, 120: 72-78.
7. Yan W, Shen Z, Tang X, Xu L, Li Q, Yue Y, Xiao S, Fu X: Detection of Nosema bombycis by FTA cards and loop-mediated isothermal amplification (LAMP). Current Microbiology, 2014, 69(4): 532-540.
8.Ravikumar G, Raje Urs S, Vijaya Prakash NB, Rao CG, Vardhana KV: Development of a multiplex polymerase chain reaction for the simultaneous detection of microsporidians, nucleopolyhedrovirus, and densovirus infecting silkworms. Journal of Invertebrate Pathology, 2011, 107(3):193-197.
9.Shamim M, Ghosh D, Baig M, Nataraju B, Datta RK, Gupta SK: Production of monoclonal antibodies against Nosema bombycis and their utility for detection of pebrine infection in Bombyx mori L. Journal of Immunoassay, 1997, 18(4): 357-370。
技术实现要素:
目前,微孢子虫的检测方法虽然有各自的优点但是都存在着一定的缺陷。针对现有技术的不足,本发明旨在提供一种无需染色、操作简便、可靠,且能够快速直观判别微孢子虫孢子的方法。
具体的,本发明的技术方案是:
一种基于单细胞拉曼镊子检测病原菌微孢子虫孢子的方法,包括以下步骤:
(1)将含菌样品与无菌水混匀,进行10-1~10-2梯度稀释,吸取100~200 微升含孢子水到检测槽;
(2)采用激光镊子将单个待检样品细胞固定,并通过拉曼光谱仪采集拉曼光谱;
(3)通过拉曼光谱特征峰出现与否及其强度实现待检样品是否含孢子的判别。
拉曼镊子(英文:Raman tweezers),亦即拉曼光谱(Raman spectroscopy)与激光镊子(Laser tweezers)两种技术优势互补结合的单细胞分析技术。激光镊子就是用激光形成的镊子,是一种利用光压原理形成的光势力阱,能够固定单个细胞或者其他微小物体并可以移动的特定的位置。拉曼光谱仪由激光源、收集系统、分光系统和检测系统构成, 激光源一般采用能量集中、功率密度高的激光, 收集系统由透镜组构成, 分光系统采用光栅或陷波滤光片结合光栅以滤除瑞利散射和杂散光,并经由低温降噪的电荷藕合器件采集微弱的拉曼信号。通过拉曼镊子技术能够提供快速、简单、可重复、无损伤的定性定量分析,而且是实时的反应了细胞正常的生理机能和生理状态的单个细胞的分析。
本发明方法中,通过激光镊子将单个待检样品细胞移动并固定在光束的聚集中心,采集到的拉曼光谱是整个孢子的完整信号,比常规的共焦显微方法得到更强的信号,更好的信噪比。而且,孢子的某些拉曼光谱特征峰的出现与否直接反映了是否含有某些特殊物质,其强度直接反映了细胞内物质的含量。因此,通过对待检样品是否检测到特异的孢子拉曼峰,便能快速直观地判断出待检样品是否微孢子虫孢子。
本发明的有益效果是:
(1)本发明方法操作简便,无需染色,样品直接悬浮在无菌水中进行检测即可。
(2)本发明方法能够快速直观地判断出待检样品是否微孢子虫孢子,单个样品孢子进行光谱采集、数据处理等工序仅需要10~20 s,每个样品5 min即可。
(3)本发明方法对检测细胞不造成伤害,而且适用于所有单细胞微生物。
附图说明
图1是3种不同的孢子的平均拉曼光谱图。
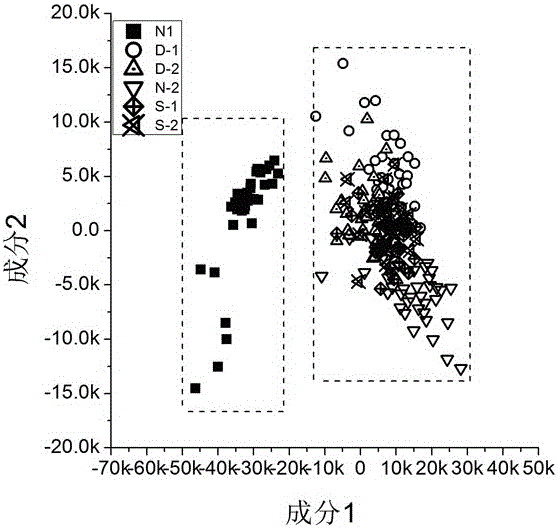
图2是几种孢子状细胞的判别分布图。
图3是影响几种孢子状细胞判别分布的载荷分析图。
具体实施方式
以下结合附图和实施例对本发明作进一步详细说明,本实施例仅是对本发明作更清楚的说明,而不是对本发明的限制。
一、不同家蚕微孢子虫孢子拉曼光谱分析
1、 实验材料
菌株:分离自感染家蚕微孢子虫病(Nosema bombycis,简称N.b)的蚕体。
2、实验方法
2.2 N.b侵染过程/方法
将供试的微孢子虫孢子液稀释成浓度为1×107 mL-1的悬浮液,取微孢子悬浮液涂抹于桑叶表面,饲喂3龄起蚕,待蚕儿吃尽带毒桑叶后,改饲正常无毒桑叶。
2.3 N.b孢子分离
取感染死亡的蚕体,解剖出的家蚕中肠用研钵研碎,经过过滤,取滤液在离心机上差速离心,获得家蚕微孢子。
2.4 光谱收集
将孢子用无菌水稀释,吸取200 μL置于用石英片密封而成的样品槽中,外加盖玻片密封。100倍油浸物镜寻找目标细胞,光镊随机俘获单个孢子,将目标细胞提升至石英片上方5μm左右,激光强度调整为50 mW,信号累积时间为10 s,收集目标孢子的拉曼光谱,此时收集到的是带有背景的孢子的拉曼光谱,于孢子附近以相同条件收集背景拉曼光谱,每个样品收集30个左右的孢子的拉曼光谱,3个背景拉曼光谱。上述光谱的收集于室温24℃的环境下进行。
2.4 数据处理方法
光谱数据先进行背景扣除和响应曲线的校正,其算法为Sact(v)=[Sacq(v)- Sbg(v)]/R(v) [其中Sact(v)为样品的实际光谱,Sacq(v)为带背景的光谱,Sbg(v)为背景光谱,R(v)为实验系统的响应曲线];采用vb 编程对数据进行平滑去噪,其算法是9 点Savitzky-Golay 卷积平滑法。
3、结果分析
以经基线校正的孢子拉曼光谱强度为纵坐标,拉曼位移为横坐标,构建成如图1所示的孢子拉曼光谱图。从图1可知,主要的拉曼峰为406、438、536、843、913、1081、1127和1343 cm-1,主要来自海藻糖溶液,以及来自核酸(718、785 cm-1)、蛋白质(1003、1450、1655 cm-1)和脂类物质(1304、1450 cm-1)。因此,图1中a、b两类孢子海藻糖峰显著,富含海藻糖;而c类细胞没有海藻糖峰,其胞内主要拉曼峰源自核酸、蛋白质和脂类物质,显然不含有海藻糖溶液。这说明成熟的N.b孢子其孢内主要成分是海藻糖溶液,以及其它生物大分子。
二、应用实施例
从生产现场收集的死蚕和感染了不同昆虫微孢子的虫体和一个非孢子类的细胞样品,共6种样品。分别解剖出的罹病虫体的中肠用研钵研碎,经过过滤,取滤液在离心机上差速离心,获得微孢子虫孢子。
将孢子用无菌水稀释,吸取200 μL置于样品槽中,激光镊子将待检样品的单个孢子固定,并通过拉曼光谱仪采集30-50个细胞的拉曼光谱。最后通过待检样品细胞拉曼光谱特征峰和化学计量学方法判别细胞是否是微孢子虫孢子。
图2、3是几种孢子状细胞的判别分布及其载荷分析图。图中显示,来自家蚕和昆虫的微孢子虫孢子集中分布在一个区域,而非孢子明显的分布于一个独立的区域,有效判别率达到100%。而影响其分布的主要因素是成分1,主要的特征峰为406、438、536、843、913、1081、1127、1350和1462 cm-1等来自海藻糖溶液的拉曼峰。
- 还没有人留言评论。精彩留言会获得点赞!