侧向流和相关免疫测定中的信号放大的制作方法
相关申请的交叉引用
本申请要求于2011年11月21日提交的美国临时申请第61/562,302号的权益,其通过引用以其整体并入本文。
发明背景
免疫测定用途广泛,并常用于鉴定感染原。某些免疫测定依赖于宿主对给定感染原的免疫反应,例如,通过测定特异性结合该感染原的一种或多种独特抗原的宿主抗体的存在。多种类型的免疫测定系统可用于诊断目的,包括大型、自动化的中央实验室系统和相对简易的柜台检测。这些免疫测定采用多种检测形式,例如凝集反应测定,沉淀素测定,酶联免疫测定,直接荧光测定,免疫组化检测,补体结合测定,血清学试验,免疫电泳测定以及侧向流和通流试验(即快速“条(strip)”检测)。免疫测定能对多种疾病提供快速、简便和高效的诊断。然而,本领域仍存在对具有高灵敏度的改进的免疫测定的需求。
发明概述
本发明部分基于发现添加可检测的Fc结合分子(例如蛋白A缀合物,蛋白G缀合物,第二抗体缀合物)可用于在免疫测定,例如基于抗原的捕获或夹心型测定中检测抗体。这些可检测的Fc结合分子可单独或与其他可检测实体组合用于在免疫测定中检测抗体。例如,一旦待测抗体被抗体特异性结合实体(例如抗原)捕获,这些Fc结合分子可用于检测该抗体。在另一个实例中,这些Fc结合分子可用作可检测信号的第二来源,例如与其他标记的或可检测的抗体结合实体(如抗原)组合。
该发现可用于本文所述的多种捕获型测定、相关方法、组合物以及试剂盒。
因此,某些实施方式包括用于检测测试样品中的抗体的方法,所述方法包含:(a)使所述测试样品与第一检测物接触以形成包含第一检测物和所述抗体的第一复合物,其中第一检测物包含与第一可检测实体缀合的Fc结合分子;(b)使第一复合物与固定于表面的测试区域的捕获实体接触,其中所述捕获实体能够与所述抗体特异性结合;以及(c)检测来自测试区域中的第一可检测实体的信号的存在,其中所述信号的存在表明测试样品中存在所述抗体。在某些实施方式中,第一检测物固定于表面的缀合区域,其中所述缀合区域与表面的测试区域不重叠。在具体实施方式中,Fc结合分子是蛋白A、蛋白G或二者。在某些实施方式中,第一检测物包含各自与可检测实体缀合的蛋白A和蛋白G。在这些实施方式中,可根据待测免疫球蛋白的类型调整蛋白A与蛋白G的比率,从而优化信号放大水平。例如,在一些实施方式中,蛋白A和蛋白G以约10:1至约1:10,更优选约5:1至约1:5的比率存在。
在某些实施方式中,捕获实体是抗原或抗原性肽。在具体实施方式中,所述抗原或抗原性肽来自选自以下的生物体:心丝虫,例如犬心丝虫,犬埃里希体(Ehrlichia canis),伯氏疏螺旋体(Borrelia burgdorferi),埃氏疏螺旋体(Borrelia afzelii),伽氏疏螺旋体(Borrelia garinii),嗜吞噬细胞无形体(Anaplasma phagocytophilum),猫白血病毒,细小病毒,流感A株,流感B株,禽流感病毒,呼吸道合胞体病毒,军团杆菌(Legionella),腺病毒,轮状病毒,猫免疫缺陷病毒,人免疫缺陷病毒和甲类链球菌(Streptococcus)。
在某些实施方式中,第一可检测实体是金属纳米颗粒,金属纳米壳,荧光团或有色乳胶颗粒。在某些实施方式中,金属纳米颗粒或金属纳米壳选自由金颗粒、银颗粒、铜颗粒、铂颗粒、镉颗粒、复合颗粒、金空心球、金涂覆二氧化硅纳米壳和二氧化硅涂覆金壳组成的组。
本文提供的某些方法进一步包含使测试样品与第二检测物接触,其中第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与抗体特异性结合。在某些实施方式中,第一和第二检测物固定于缀合区域,其中缀合区域与表面测试区域不重叠。在某些实施方式中,缀合区域进一步包含对照检测物。信号放大水平可通过调整第一检测物与第二检测物的比率来选择。在某些实施方式中,第一检测物与第二检测物的比率为约20:1至约1:20,更优选约20:1至约1:1。
在具体实施方式中,第一和第二可检测实体相同。在更具体的实施方式中,第一和第二可检测实体均为金纳米颗粒。在其他实施方式中,第一和第二可检测实体不同。
在某些实施方式中,所述表面是侧向流测定装置中的流动通道,微孔板的表面或分析转子中的流动通道。
如上所述,某些实施方式使用与可检测实体缀合的第二检测物,该第二检测物是抗原或抗原性肽。在这些及相关实施方式的一些中,抗原或抗原性肽来自选自由心丝虫,例如犬心丝虫,犬埃里希体,沙费埃里希体(Ehrlichia chaffeensis),伊氏埃里希体,伯氏疏螺旋体,埃氏疏螺旋体,伽氏疏螺旋体,嗜吞噬细胞无形体,扁平无形体(Anaplasma platys),猫白血病毒,细小病毒,例如犬细小病毒,流感A株,流感B株,禽流感病毒,呼吸道合胞体病毒,军团杆菌,腺病毒,轮状病毒,猫免疫缺陷病毒,人免疫缺陷病毒和甲类链球菌组成的组的生物体。
在某些实施方式中,所述表面是侧向流测定装置中的流动通道或分析转子中的流动通道。在具体实施方式中,测试样品是血液、血清或血浆。
还包括抗体检测装置,其包含上样区域;缀合区域,其中所述缀合区域包含可移动的第一检测物,所述第一检测物包括与第一可检测实体缀合的Fc结合分子;以及测试区域,其中所述测试区域包含能够与所述抗体特异性结合的固定的捕获实体;其中所述上样区域,缀合区域和测试区域被设置使得在操作中,液体样品被施加至上样区域时,与缀合区域和测试区域流体连通。在某些实施方式中,所述Fc结合分子是蛋白A和/或蛋白G。
在某些实施方式中,捕获实体是抗原或抗原性肽。在具体实施方式中,抗原或抗原性肽来自选自由心丝虫,例如犬心丝虫,犬埃里希体,沙费埃里希体,伊氏埃里希体,伯氏疏螺旋体,埃氏疏螺旋体,伽氏疏螺旋体,嗜吞噬细胞无形体,扁平无形体,猫白血病毒,细小病毒,例如犬细小病毒,流感A株,流感B株,禽流感病毒,呼吸道合胞体病毒,军团杆菌,腺病毒,轮状病毒,猫免疫缺陷病毒,人免疫缺陷病毒和甲类链球菌组成的组的生物体。
在具体实施方式中,第一可检测实体是金属纳米颗粒、金属纳米壳、荧光团或有色乳胶颗粒。在具体实施方式中,金属纳米颗粒或金属纳米壳选自由金颗粒、银颗粒、铜颗粒、铂颗粒、镉颗粒、复合颗粒、金空心球、金涂覆二氧化硅纳米壳和二氧化硅涂覆金壳组成的组。
在某些实施方式中,所述装置进一步包含对照区域,当液体样品施加至上样区域时,该对照区域与液体样品流体连通。在某些实施方式中,对照区域包含能够与对照检测物特异性结合的固定的结合配偶体。
在具体实施方式中,第一检测物包含与第一可检测实体缀合的蛋白A或蛋白G,且所述固定的结合配偶体是抗蛋白A或抗蛋白G抗体。
某些装置进一步包含位于测试区域下游的吸收垫(absorbent pad)。在某些装置中,缀合区域位于上样区域的上游。在某些实施方式中,缀合区域位于上样区域的下游。在某些实施方式中,上样区域包含血液分离材料。在某些情况下,缀合区域进一步包含可移动的第二检测物,其中第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与抗体特异性结合。可以调整第一检测物(例如与第一可检测实体缀合的Fc结合分子,如蛋白A和/或蛋白G)与第二检测物(与第二可检测实体缀合的抗原/抗原性肽)的比率,从而选择期望的信号放大水平。在某些实施方式中,第一检测物与第二检测物的比率为约20:1至约1:20。在其他实施方式中,第一检测物与第二检测物的比率为约20:1至约1:1。
在具体实施方式中,第一和第二可检测实体相同。在具体实施方式中,第一和第二可检测实体是金纳米颗粒。在其他实施方式中,第一和第二可检测实体不同。
在具体实施方式中,例如检测抗微生物抗体中,所述抗原或抗原性肽来自选自由心丝虫,例如犬心丝虫,犬埃里希体,沙费埃里希体,伊氏埃里希体,伯氏疏螺旋体,埃氏疏螺旋体,伽氏疏螺旋体,嗜吞噬细胞无形体,扁平无形体,猫白血病毒,细小病毒,例如犬细小病毒,流感A株,流感B株,禽流感病毒,呼吸道合胞体病毒,军团杆菌,腺病毒,轮状病毒,猫免疫缺陷病毒,人免疫缺陷病毒和甲类链球菌组成的组的生物体。
还包括试剂盒,其包含本文所述的一种或多种检测装置和系统,以及使用该装置或系统检测测试样品中的抗体的说明书。某些试剂盒进一步包含第二检测物和将第二检测物与测试样品在施加到检测系统的上样区域之前组合的说明书,其中所述第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与所述抗体特异性结合。在某些实施方式中,说明书规定将第二检测物与测试样品组合,这样第二检测物将以与第一检测物特定的比率存在,以实现期望的信号放大水平。
还包括检测测试样品中的抗体的方法,其包含将测试样品施加于本文所述的一种或多种检测装置或系统的上样区域,并检测来自测试区域中的第一可检测实体的信号的存在或不存在。某些方法进一步包含将第二检测物与测试样品在施加到检测系统的上样区域之前组合,其中所述第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与抗体特异性结合。
某些实施方式涉及一种或多种捕获复合物,其包含捕获实体,测试样品中的抗体,以及第一检测物,其中捕获实体与所述抗体结合,并且其中第一检测物包含与第一可检测实体缀合的Fc结合分子,并与所述抗体的Fc区域结合。这些及相关实施方式中的一些进一步包含第二检测物,其中第二检测物与所述抗体的可变区特异性结合。在某些实施方式中,捕获复合物固定于表面的测试区域。
具体地,本申请提供如下各项:
1.用于检测测试样品中的抗体的方法,其包含:
(a)使所述测试样品与第一检测物接触以形成包含第一检测物和所述抗体的第一复合物,其中第一检测物包含与第一可检测实体缀合的Fc结合分子;
(b)使第一复合物与固定于表面的测试区域的捕获实体接触,其中所述捕获实体能够与所述抗体特异性结合;以及
(c)检测来自所述测试区域中的第一可检测实体的信号的存在,其中所述信号的存在表明所述测试样品中存在所述抗体。
2.项1的方法,其中第一检测物固定于表面的缀合区域,并且其中所述缀合区域与表面的测试区域不重叠。
3.项1的方法,其中所述Fc结合分子是蛋白A和/或蛋白G。
4.项1的方法,其中所述捕获实体是抗原或抗原性肽。
5.项4的方法,其中所述抗原或抗原性肽来自选自由心丝虫、犬埃里希体(Ehrlichia canis)、沙费埃里希体(Ehrlichia chaffeensis)、伊氏埃里希体(Ehrlichia ewingii)、伯氏疏螺旋体(Borrelia burgdorferi)、埃氏疏螺旋体(Borrelia afzelii)、伽氏疏螺旋体(Borrelia garinii)、嗜吞噬细胞无形体(Anaplasma phagocytophilum)、扁平无形体(Anaplasma platys)、猫白血病毒、细小病毒、流感A株、流感B株、禽流感病毒、呼吸道合胞体病毒、军团杆菌(Legionella)、腺病毒、轮状病毒、猫免疫缺陷病毒、人免疫缺陷病毒和甲类链球菌(Streptococcus)组成的组的生物体。
6.项1的方法,其中第一可检测实体是金属纳米颗粒、金属纳米壳、荧光团或有色乳胶颗粒。
7.项6的方法,其中所述金属纳米颗粒或金属纳米壳选自由金颗粒、银颗粒、铜颗粒、铂颗粒、镉颗粒、复合颗粒、金空心球、金涂覆二氧化硅纳米壳和二氧化硅涂覆金壳组成的组。
8.项1的方法,其进一步包含使所述测试样品与第二检测物接触,其中第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与所述抗体特异性结合。
9.项8的方法,其中第一和第二检测物固定于缀合区域,其中所述缀合区域与表面的测试区域不重叠。
10.项2或9的方法,其中所述缀合区域进一步包含对照检测物。
11.项8的方法,其中第一和第二可检测实体相同。
12.项11的方法,其中第一和第二可检测实体是金纳米颗粒。
13.项8的方法,其中第一和第二可检测实体不同。
14.项8的方法,其中所述表面是侧向流测定装置中的流动通道、微孔板的表面或分析转子中的流动通道。
15.项8的方法,其中所述抗原或抗原性肽来自选自由心丝虫、犬埃里希体、沙费埃里希体、伊氏埃里希体、伯氏疏螺旋体、埃氏疏螺旋体、伽氏疏螺旋体、嗜吞噬细胞无形体、扁平无形体、猫白血病毒、细小病毒、流感A株、流感B株、禽流感病毒、呼吸道合胞体病毒、军团杆菌、腺病毒、轮状病毒、猫免疫缺陷病毒、人免疫缺陷病毒和甲类链球菌组成的组的生物体。
16.项8的方法,其中第一检测物与第二检测物以约20:1至约1:1的比率存在。
17.项16的方法,其中第一检测物包含与第一可检测实体缀合的Fc结合分子,并且其中所述Fc结合分子是蛋白A和/或蛋白G。
18.项16的方法,其中第一检测物包含各自与第一可检测实体缀合的蛋白A和蛋白G。
19.项18的方法,其中蛋白A和蛋白G以约10:1至约1:10的比率存在。
20.项1的方法,其中所述表面是侧向流测定装置中的流动通道或分析转子中的流动通道。
21.项1的方法,其中所述测试样品是体液、身体器官提取物、血液、血清或血浆。
22.抗体检测装置,其包含:
上样区域;
缀合区域,其中所述缀合区域包含可移动的第一检测物,所述第一检测物包括与第一可检测实体缀合的Fc结合分子;以及
测试区域,其中所述测试区域包含能够与所述抗体特异性结合的固定的捕获实体;
其中所述上样区域、缀合区域和测试区域被设置使得在操作中,当被施加至上样区域时,液体样品与缀合区域和测试区域流体连通。
23.项22的检测装置,其中所述Fc结合分子是蛋白A和/或蛋白G。
24.项22的检测装置,其中所述捕获实体是抗原或抗原性肽。
25.项24的检测装置,其中所述抗原或抗原性肽来自选自由心丝虫、犬埃里希体、沙费埃里希体、伊氏埃里希体、伯氏疏螺旋体、埃氏疏螺旋体、伽氏疏螺旋体、嗜吞噬细胞无形体、扁平无形体、猫白血病毒、细小病毒、流感A株、流感B株、禽流感病毒、呼吸道合胞体病毒、军团杆菌、腺病毒、轮状病毒、猫免疫缺陷病毒、人免疫缺陷病毒和甲类链球菌组成的组的生物体。
26.项22的检测装置,其中第一可检测实体是金属纳米颗粒、金属纳米壳、荧光团或有色乳胶颗粒。
27.项26的检测装置,其中所述金属纳米颗粒或金属纳米壳选自由金颗粒、银颗粒、铜颗粒、铂颗粒、镉颗粒、复合颗粒、金空心球、金涂覆二氧化硅纳米壳和二氧化硅涂覆金壳组成的组。
28.项22的检测装置,其中所述装置进一步包含对照区域,当液体样品施加至上样区域时,所述对照区域与液体样品流体连通。
29.项28的检测装置,其中所述对照区域包含能够与对照检测物特异性结合的固定的结合配偶体。
30.项29的检测装置,其中所述第一检测物包含与第一可检测实体缀合的蛋白A或蛋白G,所述固定的结合配偶体是抗蛋白A或抗蛋白G抗体。
31.项22的检测装置,其进一步包含位于所述测试区域下游的吸收垫。
32.项22的检测装置,其中所述缀合区域位于所述上样区域的上游。
33.项22的检测装置,其中所述缀合区域位于所述上样区域的下游。
34.项22的检测装置,其中所述上样区域包含血液分离材料。
35.项22的检测装置,其中所述缀合区域进一步包含可移动的第二检测物,其中第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与所述抗体特异性结合。
36.项35的检测装置,其中第一和第二可检测实体相同。
37.项36的检测装置,其中第一和第二可检测实体是金纳米颗粒。
38.项35的检测装置,其中第一和第二可检测实体不同。
39.项35的检测装置,其中所述抗原或抗原性肽来自选自由心丝虫、犬埃里希体、沙费埃里希体、伊氏埃里希体、伯氏疏螺旋体、埃氏疏螺旋体、伽氏疏螺旋体、嗜吞噬细胞无形体、扁平无形体、猫白血病毒、细小病毒、流感A株、流感B株、禽流感病毒、呼吸道合胞体病毒、军团杆菌、腺病毒、轮状病毒、猫免疫缺陷病毒、人免疫缺陷病毒和甲类链球菌组成的组的生物体。
40.项33的检测装置,其中第一可移动检测物与第二可移动检测物以约20:1至约1:1的比率存在。
41.项40的检测装置,其中第一可移动检测物包含与第一可检测实体缀合的Fc结合分子,并且其中所述Fc结合分子是蛋白A和/或蛋白G。
42.项40的检测装置,其中第一可移动检测物包含各自与第一可检测实体缀合的蛋白A和蛋白G。
43.项42的检测装置,其中蛋白A和蛋白G以约10:1至约1:10的比率存在。
44.试剂盒,其包含项22的检测系统,以及使用所述系统检测测试样品中的抗体的说明书。
45.项44的试剂盒,其进一步包含第二检测物和将第二检测物与测试样品在施加到检测系统的上样区域之前组合的说明书,其中所述第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与所述抗体特异性结合。
46.项45的试剂盒,其中第一可移动检测物与第二检测物以约20:1至约1:1的比率存在。
47.项46的试剂盒,其中第一可移动检测物包含与第一可检测实体缀合的Fc结合分子,并且其中所述Fc结合分子是蛋白A和/或蛋白G。
48.项46的试剂盒,其中第一检测物包含各自与第一可检测实体缀合的蛋白A和蛋白G。
49.项48的试剂盒,其中蛋白A和蛋白G以约10:1至约1:10的比率存在。
50.检测测试样品中的抗体的方法,其包括将测试样品施加于项22的检测系统的上样区域,检测来自测试区域中的第一可检测实体的信号的存在或不存在。
51.项50的方法,其进一步包括将第二检测物与所述测试样品在施加到检测系统的上样区域之前组合,其中所述第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与所述抗体特异性结合。
52.项51的方法,其中第二检测物被添加至测试样品,这样第二检测物将以与第一可移动检测物约20:1至约1:1的比率存在。
53.捕获复合物,其包含捕获实体、测试样品中的抗体、以及第一检测物,其中所述捕获实体与所述抗体结合,并且其中第一检测物包含与第一可检测实体缀合的Fc结合分子并与所述抗体的Fc区域结合。
54.项53的捕获复合物,其进一步包含第二检测物,其中第二检测物与所述抗体的可变区域特异性结合。
55.项53的捕获复合物,其中所述捕获复合物固定于表面的测试区域。
附图说明
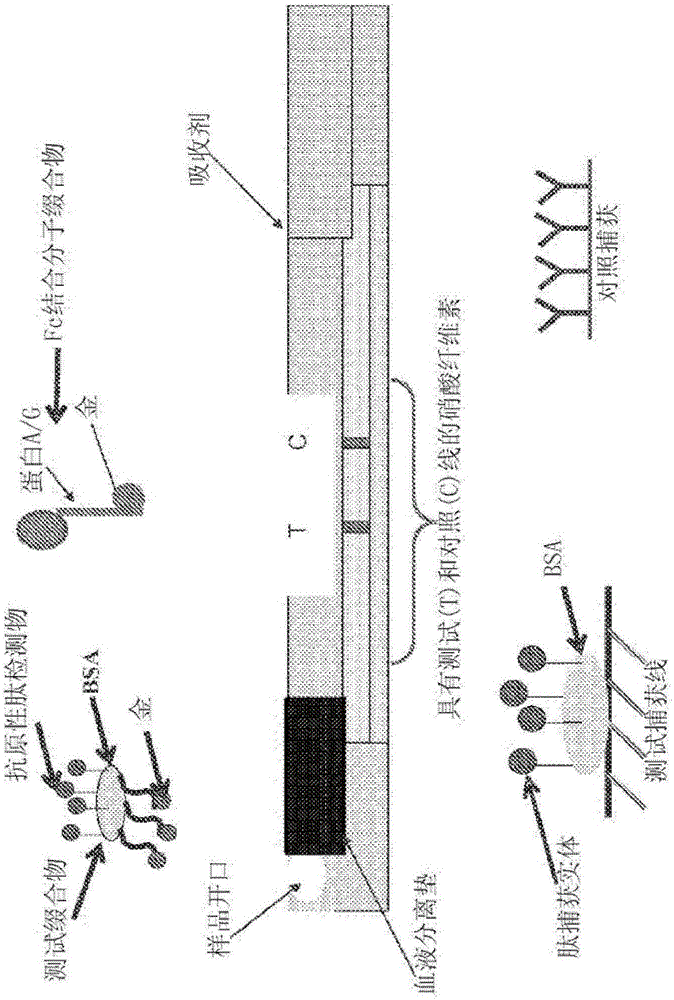
图1显示本发明捕获复合物的一个实例,其具有被固定于测试表面(例如硝酸纤维素)的捕获实体(例如与BSA缀合的抗体特异性抗原)捕获的感兴趣的抗体,与靶抗体的Fc区域结合的可检测的Fc结合分子-缀合物(例如蛋白A-或蛋白G-胶体金缀合物),以及任选存在的与感兴趣的抗体的可变区结合的第二可检测缀合物(例如抗原-胶体金缀合物)。
图2显示侧向流装置的一个实例,以及根据本发明的方法。感兴趣的抗体特异性的抗原性肽与载体蛋白牛血清白蛋白(BSA)连接,产生的BSA-肽缀合物在硝酸纤维素上用于捕获。该相同的抗原性肽进一步与胶体金缀合,其在该示例性测定中作为标记。通过向缀合物混合物中添加蛋白A/G-金缀合物,产生的信号被进一步放大。
图3显示随时间的莱姆病特异性的侧向流测定的样品流,其中使用图2所示的侧向流装置。在该示例性测定中,一滴血液,血清或血浆(约15-20μL,通过移液管)与四滴胶体金缀合物溶液(约30μL,来自滴瓶)在反应管中混合。生成的反应混合物的一滴转移至放置于平坦表面的测试盒的样品部分。血液分离垫从全血中过滤血细胞(参见图2)。血浆(或血清)和伯氏疏螺旋体抗体缀合复合物迁移至包含测试和对照区域的硝酸纤维素膜。滴加三(3)滴(约60μL,来自滴瓶)Chase缓冲液(施加样品后一分钟),使全部混合物通过硝酸纤维素,向上部吸收垫迁移,该吸收垫持续地牵引液体。阳性样品中存在的伯氏疏螺旋体特异性抗体已经与金标记的抗原缀合物复合。标记的抗原-抗体复合物向测试线迁移,此处固定的抗原通过抗体上的第二结合位点捕获标记的抗原-抗体复合物。缀合混合物中存在的蛋白A/G-金缀合物与靶抗体的Fc区域结合,并放大测试信号。游离的标记抗原和剩余反应混合物前行至对照线,此处蛋白A-金缀合物被包含鸡抗蛋白A抗体的对照捕获物捕获。在此情况下,装置约8分钟可观察结果。测试区域的一条红线和对照区域的第二条红线的出现,表明伯氏疏螺旋体抗体的存在。仅对照区域出现一条线表明不存在伯氏疏螺旋体抗体。如果(a)出现测试线,而未形成对照线,或(b)对照线或测试线均未形成,则该测试被视为无效。
发明详述
本文所用以下术语具有如下意思:
本文所用冠词“一(a)”和“一(an)”是指一个或多于一个(即至少一个)冠词的语法对象。以举例的方式,“元件”是指一个元件或多于一个元件。
本文所用的“大约”指数量、水平、数值、数字、频率、百分比、尺寸、大小、总数、重量或长度,其变化多达参照数量、水平、数值、数字、频率、百分比、尺寸、大小、总数、重量或长度的30、25、20、25、10、9、8、7、6、5、4、3、2或1%。
本说明书自始至终,除非上下文另有要求,词语“包含(comprise)”、“包含(comprises)”以及“包含(comprising)”将理解为意指包含陈述的步骤或成分,或步骤或成分的群组,但是并不排除任一其他的步骤或成分,或步骤或成分的群组。
本文所用的“由…组成(consisting of)”指包括并且限于,跟随短语“由……组成(consisting of)”的无论什么。因此,短语“由…组成(consisting of)”表明所列举的成分为必须的或强制的,并且没有其他的成分可能存在。本文所用的“基本上由……组成(consisting essentially of)”指包括任意该短语后所列举的成分并且限于不干扰或促进本公开中针对所列举的成分的指定的活性或作用。因此,短语“基本上由……组成(consisting essentially of)”表明所列举的成分为必须的或强制的,但是其他的成分为任选的并且取决于它们是否实质地影响所列举的成分的活性或作用,可以或不可以存在。
术语“肽”、“多肽”以及“蛋白质”在本文中可互换使用,指氨基酸残基的聚合物及其变体和合成及天然发生的类似物。因此,这些术语适用于其中一个或多个氨基酸残基是合成的非天然存在的氨基酸(例如相应的天然存在的氨基酸的化学类似物)的氨基酸聚合物,也适用于天然存在的氨基酸聚合物及其天然存在的化学衍生物。
“增加的”或“提高的”量任选地是“统计学显著的”量,并且可以包括相对于例如在无可检测的Fc结合分子时进行的抗体测试的量或值(例如信号或数值,如反应评分)的约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2、3、4、5、6、7、8、9、10、15、20、30或更大倍数(包括其间大于1的所有整数和小数,例如2.5、3.6、3.7)的增加。“增加的”或“提高的”值或量也可包括相对于例如在无可检测的Fc结合分子时进行的抗体测试的量或值的1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、200%、300%、400%、500%或更多的增加。
本文引用的所有出版物、专利和专利申请都以其整体通过引用并入本文。
方法
一方面,本发明包括用于检测测试样品中的抗体的方法。在某些实施方式中,这些方法涉及,在相关一部分,使测试样品与缀合第一可检测实体的Fc结合分子(即可检测的Fc结合分子缀合物)接触,形成第一复合物,使第一复合物与固定于表面的测试区域的捕获实体接触,其中捕获实体能够与所述抗体特异性结合,以及检测来自测试区域中的可检测的Fc结合分子缀合物的信号的存在。其中信号的存在表明测试样品中存在所述抗体。
这些方法的反应物可按任意顺序或序列接触。例如,测试样品可在施加到表面之前与可检测的Fc结合分子缀合物混合,或者这两种反应物可分别施加到表面,顺序地或同时,在表面上相同或不同的位置。当分别添加时,反应物将在例如通过毛细管或其他作用在测试表面扩散或流通时彼此接触。在具体实施方式中,可检测的Fc结合分子缀合物事先固定于表面的缀合区域,该缀合区域与表面的测试区域不重叠。在某些实施方式中,测试样品被施加于表面,通过毛细管或其他作用流过缀合区域和测试区域,从而与Fc结合分子和捕获实体接触。如果样品中存在感兴趣的抗体,其将与可检测的Fc结合分子和捕获实体形成可检测的复合物。在具体实施方式中,Fc结合分子是蛋白A、蛋白G、蛋白A/G、蛋白L或其任意组合,例如其混合物或融合蛋白。
本文提供的某些方法进一步包含使测试样品与第二检测物分子接触。在这些实施方式中,第二检测物可以是任意适合的抗体结合实体,例如与第二可检测实体缀合并且能够与抗体特异性结合的抗原或抗原性肽。如第二检测物缀合物和第二可检测实体的组合有时被称为“可检测的抗体特异性抗原缀合物”或“可检测的抗原缀合物”,其包括肽抗原和非肽抗原。在某些实施方式中,第一和第二可检测实体相同,即Fc结合分子缀合物和可检测抗原缀合物均与相同类型的可检测实体(例如金颗粒)缀合。在其他实施方式中,第一和第二可检测实体不同。在具体实施方式中,第一和第二可检测实体均为金纳米颗粒,生成胶体金缀合物(CGC)。在这些及相关实施方式中,可检测的Fc结合分子可被称为“Fc结合分子-CGC”,具体的实例包括蛋白A-CGC、蛋白G-CGC、蛋白A/G-CGC、以及蛋白L-CGC。在某些实施方式中,Fc结合分子是能与测试样品中的抗体的Fc区域结合的二抗或其片段,第二检测物可以是任意适合的抗体结合实体,例如抗原或抗原性肽等。
与之前类似,这些方法中的反应物可按任意顺序或序列接触。例如,测试样品可在施加到表面之前与可检测的Fc结合分子缀合物、可检测的抗原缀合物、或其二者混合,或者这三个反应物可分别施加到表面,顺序地或同时,在表面上相同或不同的位置。当分别添加时,反应物将在例如通过毛细管或其他作用在测试表面扩散或流通时彼此接触。
在某些实施方式中,Fc结合分子缀合物固定于表面的缀合区域,该缀合区域与测试区域不重叠,测试样品和可检测的抗原缀合物分别或共同施加至表面。在其他实施方式中,可检测的抗原缀合物固定于表面的缀合区域,该缀合区域与测试区域不重叠,测试样品和可检测的Fc结合分子缀合物分别或共同施加至表面。在某些实施方式中,可检测的Fc结合分子缀合物与可检测的抗原缀合物均固定于表面的缀合区域,该缀合区域与表面测试区域不重叠,测试样品施加至测试区域。在施加至表面后,测试样品(单独或与其他反应物结合)可通过毛细管或其他作用在表面流通或扩散,通过缀合区域(如果存在)和测试区域,从而与可检测的Fc结合分子缀合物、可检测的抗原缀合物和捕获实体接触。如果样品中存在感兴趣的抗体,其将与这些反应物形成一个或多个可检测复合物,从而表明样品中抗体的存在。本领域技术人员会意识到,这些示例性组合并非限制性的,还存在其他可能性。
在某些实施方式中,缀合区域进一步包含对照检测物,例如与Fc结合分子特异性结合的抗体。其他类型的对照区域对本领域技术人员是显而易见的。
测试样品通常是获自对象的生物学样品,其含有或疑似含有感兴趣的抗体,例如某感染原特异性的抗体。生物样品优选易于获得,并可包括源自静脉血样品,或甚至源于指血的血液,血清或血浆。来自其他身体部位的组织或其他体液(例如脑脊髓液(CSF)、唾液、胃液分泌、粘液、尿、粪便等)已知含有抗体,可用作测试样品来源。在其他实施方式中,样品是提取自身体器官的组织(例如组织匀浆)或细胞裂解物。在某些实施方式中,对象是野生动物(例如鹿或啮齿动物,如小鼠、花栗鼠、松鼠等)。在其他实施方式中,对象是实验室动物(例如小鼠、大鼠、豚鼠、兔、猴、灵长动物等)。在其他实施方式中,对象是家养或野生动物(例如狗、猫、马)。在仍其他实施方式中,对象是人。
抗体,又称作免疫球蛋白,是免疫系统的Y形的蛋白,其特异性识别外源物体或抗原,例如细菌、酵母、寄生虫和病毒组分。抗体的“Y”的每个尖端包含对抗原上的特定表位特异性的抗原结合位点,使得这两种结构精确地相互结合。当暴露于与抗体特异性结合的抗原(例如微生物抗原)时,该抗体的产量增加。因此,检测来自对象样品中的抗原特异性抗体可表明该对象当前是否接触,或之前是否曾接触某一微生物,例如病毒、细菌、真菌或寄生虫。
可结晶片段区域(Fc区域)是抗体的尾部区域,其与细胞表面的Fc受体和补体系统的某些蛋白相互作用。在IgG、IgA和IgD抗体同种型中,Fc区域由两个相同蛋白片段组成,其源自抗体两个重链的第二和第三恒定区。IgM和IgE的Fc区域的每个多肽链中包含三个重链恒定区(CH区2-4)。IgG抗体的Fc区域具有高度保守的N-糖基化位点。附着于该位点的N-聚糖主要是复合物类型的核心岩藻糖化的双触角结构。另外,少量的这些N-聚糖还具有等分的GlcNAc和α-2,6连接的唾液酸残基。抗体的Fab区域包含决定抗体靶特异性的可变区,相比之下,每个物种的所有同类抗体的Fc区域均相同,它们是恒定不变的。
抗体的“抗原结合位点”或“结合部分”指免疫球蛋白分子参与抗原结合的部分。抗原结合位点由重链(“H”)和轻链(“L”)N末端可变(“V”)区的氨基酸残基组成。重链和轻链V区中的三个高度差异化的区段被称为“高变区”,其位于更保守的名为“框架区”或“FR”的两侧区段之间。因此,术语“FR”指天然发现的位于免疫球蛋白高变区之间并与之邻近的氨基酸序列。在抗体分子中,轻链的三个高变区和重链的三个高变区在三维空间上彼此相对分布,形成抗原结合表面。抗原结合表面与被结合抗原的三维表面互补,每条重链和轻链的三个高变区被称为“互补决定区”或“CDR”。
典型地,抗体包含全部或部分Fc区域,有助于被Fc结合分子检测,抗体还可包含一个或多个抗原结合位点,有助于被抗体特异性结合剂,例如抗原或抗原性肽检测。抗体可以属于例如IgG、IgE、IgD、IgM或IgA类型。通常,检测IgM和/或IgA抗体,例如用于早期感染检测。
Fc结合分子包括特异性结合抗体的Fc区域或抗体可变区外的任意区域的任意结合剂。在某些实施方式中,Fc结合分子不是抗体或其抗原结合片段。在其他实施方式中,Fc结合分子是Fc特异性二抗,例如兔抗狗抗体,山羊抗狗抗体。在某些实施方式中,Fc结合分子是针对测试样品中待测抗体的二抗。Fc结合分子的一般性实例包括多肽、可溶受体、adnectin、小肽、肽模拟物、小分子、适体等,其特异性结合免疫球蛋白的Fc区域。Fc结合分子的具体实例包括蛋白A、蛋白G、蛋白A/G融合蛋白、蛋白L,及其片段和可变体,其保留与抗体Fc区域特异性结合的能力。
蛋白A是40-60kDa的MSCRAMM(识别粘连基质分子的微生物表面成分)表面蛋白,于金黄色葡萄球菌(Staphylococcus aureus)细胞壁中被发现,由spa基因编码。野生型蛋白A由五个同源的免疫球蛋白结合结构域组成,其折叠成三螺旋束,并能够分别与抗体的Fc区域结合。蛋白A与人IgG1和IgG2以高亲和性结合,并与人IgM、IgA和IgE以中等亲和性结合。
蛋白G是在C型和G型链球菌中表达的免疫球蛋白结合蛋白(参见,例如Sjobring et al.,J Biol Chem.266:399–405,1991)。蛋白G的核磁共振溶液结构(参见Lian et al.,Journal of Mol.Biol.228:1219-1234,1992)和晶体结构(参见Derrick and Wigley,Journal of Mol.Biol.243:906-918,1994)已经解析到了1埃。蛋白A和蛋白G是本领域熟知的,并以多种缀合和非缀合形式可供商购。
还包括全长或野生型蛋白A和蛋白G的功能性变体和片段。在某些实施方式中,变体多肽包括与蛋白A和/或蛋白G的野生型序列具有至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或更多的序列相同性或相似性的氨基酸序列。功能性片段可以是多肽片段,其为,例如,野生型蛋白A和/或蛋白G的10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200、220、240、260、280、300、320、340、360、380、400、450、500个或更多的连续或不连续残基。蛋白A和蛋白G的变体和片段通常保持与一个或多个免疫球蛋白同种型的Fc区域的特异性结合。
序列相同性百分比具有本领域公认的含义,有多种方法检测两个多肽或多核苷酸序列之间的相同性。参见,例如Lesk,Ed.,Computational Molecular Biology,Oxford University Press,New York,(1988);Smith,Ed.,Biocomputing:Informatics And Genome Projects,Academic Press,New York,(1993);Griffin&Griffin,Eds.,Computer Analysis Of Sequence Data,Part I,Humana Press,New Jersey,(1994);von Heinje,Sequence Analysis In Molecular Biology,Academic Press,(1987);以及Gribskov&Devereux,Eds.,Sequence Analysis Primer,M Stockton Press,New York,(1991)。用于比对多核苷酸或多肽的方法被编成计算机程序,包括GCG程序包(Devereux et al.,Nuc.Acids Res.12:387(1984)),BLASTP,BLASTN,FASTA(Atschul et al.,J Molec.Biol.215:403(1990)),以及Bestfit程序(Wisconsin Sequence Analysis Package,Version 8for Unix,Genetics Computer Group,University Research Park,575Science Drive,Madison,Wis.53711),其使用Smith和Waterman的局部同源性算法(Adv.App.Math.,2:482-489(1981))。例如,可使用利用FASTA算法的计算机程序ALIGN,进行仿射空位搜索,空位开放罚分为-12,空位扩展罚分为-2。
还涉及包含Fc结合多肽的融合蛋白,包括蛋白A融合和蛋白G融合。Fc结合分子可与另一个Fc结合分子的整体或部分融合,或与一个或多个异源多肽融合。一个蛋白A/G融合蛋白的具体实例将蛋白A的4个Fc结合结构域与蛋白G的2个Fc结合结构域结合(参见例如Sikkema,J.W.D.,Amer.Biotech.Lab,7:42,1989;以及Eliasson et al.,J.Biol.Chem.263,4323-4327,1988),然而,也可使用其他组合方式。融合配偶体(例如肽或其他配基)可用于改进纯化、改进溶解度、提高多肽在宿主细胞中的表达、辅助检测、以及稳定多肽等。融合配偶体的实例包括载体蛋白(例如血清白蛋白,如牛血清白蛋白)、β-半乳糖苷酶、谷胱甘肽-S-转移酶、组氨酸标签等。
捕获实体可以是与感兴趣的抗体特异性结合的任意结合剂,该抗体是由本文所述方法和装置检测的靶抗体,例如微生物特异性抗体。典型地,捕获实体与抗体可变区特异性结合,因而包含抗体的抗原结合位点特异性的一个或多个表位。在某些实施方式中,捕获实体不是抗体或其抗原结合片段。在具体实施方式中,捕获实体是与感兴趣的抗体特异性结合的抗原或抗原性肽。示例性的抗原和抗原性肽如下所述。还包括可溶受体、adnectin、肽模拟物、小分子、适体等,其与感兴趣的抗体即由本文所述方法检测的抗体特异性结合。
如上所述,捕获实体通常附着或固定于测试表面或底材上,例如固体或半固体支持物。附着可以是共价或非共价的,并可通过实现共价或非共价结合的与捕获实体结合的部分促进所述附着,例如对附着于载体、支持物或表面的组分具有高亲和力的部分。例如,捕获实体可以与配体(例如生物素)结合,与表面结合的组分可以是相应的配体受体(例如亲和素)。或者,捕获实体可以与配体受体(例如亲和素)结合,与表面结合的组分可以是相应的配体(例如生物素)。在免疫测定过程中,捕获实体可在添加包含抗体的样品之前或之后附着或固定在测试表面或底材上。
在具体实施方式中,测试表面是珠、斑点杂交、侧向流测定装置中的流动通道、或分析转子中的流动通道。例如,捕获实体可以附着或固定在多孔膜上,例如PVDF膜(如ImmobilonTM膜)、硝酸纤维素膜、聚乙烯膜、尼龙膜、或相似类型的膜。在其他实施方式中,测试表面或底材是试管或测试孔,例如适用于ELISA或其他夹心类型测定的平板(如微孔板)中的测试孔。在某些实施方式中,测试表面或底材是传感器,例如电化学、光学或光电传感器。
这些测试表面或底材可包含玻璃,基于纤维素的材料,热塑性聚合物,例如聚乙烯、聚丙烯、或聚酯,由微粒材料组成的烧结结构(例如玻璃或各种热塑性聚合物),或由硝酸纤维素、尼龙、聚砜等组成的浇筑膜。测试表面或底材可以是烧结的聚乙烯微粒,俗称多孔聚乙烯,例如来自Chromex Corporation(Albuquerque,NM),PorexTM等的0.2-15微米的多孔聚乙烯。所有这些测试表面或底材材料可以适当形状使用,例如薄膜、片状、或平板,或者它们可以涂覆或粘合或层压于适当的惰性载体,例如纸、玻璃、塑料薄膜、或纤维。
将捕获实体(例如肽)固定在固相上的适当方法包括离子、疏水、共价相互作用等。与固体或半固体载体、支持物或表面的特异性或半特异性结合可通过捕获实体实现,其具有与之结合的使得其与固体或半固体载体、支持物或表面共价或非共价结合的部分。例如,所述部分可以具有对附着于载体、支持物或表面的组分的亲和力。在这种情况下,所述部分可以是,例如,与肽的氨基酸基团(如6-氨基己酸)结合的生物素或生物素基或其类似物,而所述组分则是亲和素、链霉亲和素、中性亲和素、或其类似物。在另一个可选的情况下,所述部分具有6个连续的组氨酸残基(例如6x-His标签)的氨基酸序列,所述载体包含负载Ni++或Co++离子的氨三乙酸(NTA)衍生物。除此之外,适当的载体、支持物和表面包括,但不限于,珠(例如磁珠,胶体颗粒或纳米颗粒,如胶体金,或包含二氧化硅的纳米颗粒,乳胶,聚苯乙烯,聚碳酸酯,或PDVF),共聚物乳胶,例如苯乙烯二乙烯基苯,羟基化苯乙烯二乙烯基苯,聚苯乙烯,羧基聚苯乙烯,炭黑珠,未活化的或聚苯乙烯或聚氯乙烯活化的玻璃,环氧活化的多孔磁玻璃,明胶或多糖颗粒或其他蛋白颗粒。
如上所述,抗原和抗原性肽可用作捕获实体和/或抗体特异性检测物。选取的抗原或抗原性肽能够与靶抗体特异性结合,通常通过该抗体的一个或两个抗原结合位点。因此,本文的术语“抗原”指能够被抗体通过抗体的至少一个抗原结合位点特异性结合的分子。抗原可以包含一个或多个表位,即特别的抗原连续或非连续区域,其与抗体的抗原结合位点特异性结合。表位可以是线性表位、顺序表位、或构象表位。
抗原可以是,例如,肽或其修饰形式,或非肽抗原,例如小分子。如上所述,抗原也可以包括可溶受体、adnectin、肽模拟物、小分子、适体等,其与感兴趣的抗体特异性结合。
当用作捕获实体或“捕获抗原”时,抗原或抗原性肽通常是非标记的,并固定或附着于测试表面。对于某些实施方式,捕获抗原可以与一个或多个异源蛋白,例如牛血清白蛋白或多抗原性肽(MAPS)融合或缀合或复合,以利于附着到测试表面或其他目的。
用作抗体特异性检测物时,抗原或抗原性肽通常与可检测实体缀合,从而形成“可检测抗原缀合物”。在某些实施方式中,这些可检测抗原缀合物也与一个或多个异源蛋白,例如牛血清白蛋白或MAPS融合或缀合或复合。如下所述,可检测抗原缀合物可以设计用于直接或间接检测。
还涉及包含抗原性肽的融合蛋白。抗原性肽可与具有相同或不同结合特异性(例如具有一个或多个相同或不同的表位)的一个或多个抗原性肽的全部或部分融合,或与一个或多个异源多肽融合。融合配偶体(例如肽或其他部分)可用于改进纯化、改进溶解度、提高多肽在宿主细胞中的表达、辅助检测、稳定抗原性肽、促进在测试表面的固定等。融合配偶体的实例包括载体蛋白(例如血清白蛋白,如牛血清白蛋白)、β-半乳糖苷酶、谷胱甘肽-S-转移酶、组氨酸标签等。
抗原和抗原性肽,以及其他抗体特异性结合剂可来自不同来源。具体的实施方式包括那些来自微生物来源的,包括病毒、细菌、真菌和寄生虫。具体的实例包括来自心丝虫,例如犬心丝虫,犬埃里希体,伯氏疏螺旋体,埃氏疏螺旋体,伽氏疏螺旋体,嗜吞噬细胞无形体,猫白血病毒,细小病毒,例如犬细小病毒,流感A株,流感B株,禽流感病毒,呼吸道合胞体病毒,人免疫缺陷病毒(HIV),军团杆菌,腺病毒,甲类链球菌,猫免疫缺陷病毒(FIV),轮状病毒等的一种或多种的抗原。用于莱姆病抗体检测的疏螺旋体(Borrelia)抗原的实例可见于美国申请13/667,909、美国专利US2011/0136155、以及WO 2011/063003(均以其整体通过引用并入本文)。用于埃里希体抗体检测的埃里希体抗原的实例可见于美国申请61/712,578、美国专利2011/0124125和WO2011/063235(均以其整体通过引用并入本文)。
本文所述的方法使用的抗原性肽可通过合成化学制备(即“合成肽”)。在其他实施方式中,抗原性肽可用生物方法制造(即通过细胞机器,例如核糖体)。在某些实施方式中,抗原性肽是分离的。本文所用的“分离的”肽是通过合成或生物学方法制备,然后从用于制备该肽的化学物质和/或细胞机器中至少部分地纯化。在某些实施方式中,分离的肽是基本纯的。本文所用术语“基本纯”指分子(例如肽)基本不含细胞物质(蛋白质,脂质,糖类,核酸等)、培养基、化学物质前体、用于合成该肽的化学物质、或其组合。基本纯的肽具有少于约40%、30%、25%、20%、15%、10%、5%、2%、1%或更少的细胞物质、培养基、其他多肽、化学物质前体、和/或用于合成该肽的化学物质。相应地,基本纯的分子(例如肽)可以占感兴趣的分子的干重至少约60%、70%、75%、80%、85%、90%、95%、98%、或99%。分离的肽可在水中,缓冲液中,或是等待重建的干燥形式,例如,作为试剂盒的一部分。分离的肽可以药学上可接受的盐的形式存在。能够与本发明的肽形成盐的适当的酸和碱为本领域技术人员所熟知,包括无机和有机酸和碱。
如果感兴趣的抗体,或其抗原结合片段与捕获实体或抗体特异性检测物以可检测的水平反应(例如在侧向流测定、蛋白质印迹、或ELISA测定中),并且在相似条件下不与无关多肽或试剂以统计上显著的方式可检测地反应,则被称为与捕获实体或抗体特异性检测物(例如抗原或抗原性肽)“特异性结合”、“免疫性结合”、和/或“免疫性反应”。术语“特异性结合”也可指捕获实体或抗体特异性检测物对感兴趣的抗体比对样品中的其他抗体具有更高的亲和力(例如更高程度的选择性)。
本文所用的免疫性结合通常指非共价相互作用,其发生在免疫球蛋白分子和该免疫球蛋白特异性的抗原之间。结合,例如免疫性结合相互作用的强度或亲和力可用相互作用的解离常数(Kd)来表示,其中,Kd越小代表亲和力越高。可利用本领域已知的方法对选取的多肽的免疫性结合性能进行定量(参见例如Davies et al.,Annual Rev.Biochem.59:439-473,1990)。在某些示例性的实施方式中,抗体对捕获实体或抗体特异性检测物(例如抗原或抗原性肽)具有至少约0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、或50nM的亲和力。作为另一个实例,捕获实体或抗体特异性检测物对抗体的亲和力是对样品中其他抗体亲和力的至少约1.5倍、2倍、2.5倍、3倍或更高。
相似地,如果Fc结合分子与Fc区域以可检测的水平反应,并且在相似条件下不与无关多肽或试剂以统计上显著的方式可检测地反应,则被称为与免疫球蛋白的Fc区域“特异性结合”。在某些示例性的实施方式中,Fc结合分子对选取的免疫球蛋白同种型的Fc区域具有至少约0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、或50nM的亲和力。某些Fc结合分子相对于其他Fc结合分子,对一个或多个免疫球蛋白同种型具有更强或更弱的亲和力。
该亲和力或特异性程度可通过多种常规程序来确定,包括,例如竞争结合研究。在ELISA测定中,阳性反应被定义为比一个对照或一组对照的均值高2或3个标准差的值。
如前所示,某些检测物分子,例如Fc结合分子、抗原、和/或抗原性肽与可检测实体缀合。缀合通常通过共价结合实现。可检测实体包括“直接可检测实体”,例如金属纳米颗粒、金属纳米壳、彩色乳胶颗粒、放射性同位素和荧光团,以及“间接可检测实体”,其经常依赖于配体-受体相互作用产生信号。在前一情况下,检测物分子(例如抗原性肽,Fc结合分子,如蛋白A/G)与直接可检测实体缀合。在后一情况下,检测物分子与配体缀合,然后所述配体与其配体受体相互作用,配体受体与直接可检测实体缀合,或反之亦然。配体的实例包括生物素(例如通过半胱氨酸或赖氨酸残基),脂质分子(例如通过半胱氨酸残基),以及载体蛋白(例如血清白蛋白)。与配体(例如生物素)连接可用于将检测物与配体受体(例如亲和素,链霉亲和素或中性亲和素)结合。亲和素、链霉亲和素、中性亲和素继而可与直接可检测实体(例如可视的信号部分,如胶体金,荧光配基,或酶,例如辣根过氧化物酶或碱性磷酸酶)连接。或者,检测物分子可与配体受体,例如亲和素、链霉亲和素或中性亲和素融合或连接,从而有利于与相应配体的结合,其继而与直接可检测实体连接。其他配体-受体对的实例是本领域熟知的,可类似地使用。
直接可检测实体(或信号配基)的实例包括放射性同位素、荧光团、染料、酶、纳米颗粒、彩色乳胶颗粒、化学发光标记、发光染料、以及其他本文所述和本领域已知的。
可用作直接可检测实体的放射性同位素的实例包括32P、33P、35S、3H、和125I。这些放射性同位素具有不同的半衰期、衰变类型和能级,可对其进行调整以满足特定方案的要求。例如,3H是低能量放射体,其产生较低的背景水平,然而较低的能量也导致放射自显影和其他测量的时间较长。
可用作直接可检测实体的荧光团或荧光物的实例包括荧光素、四甲基罗丹明、德克萨斯红、以及很多其他的荧光团或荧光物(例如Haugland,Handbook of Fluorescent Probes-9th Ed.,2002,Molec.Probes,Inc.,Eugene OR;Haugland,The Handbook:A Guide to Fluorescent Probes and Labeling Technologies-10th Ed.,2005,Invitrogen,Carlsbad,CA)。还包括发光染料或其他可检测染料。染料发出的光可以是可见光或不可见光,例如紫外或红外光。在示例性实施方式中,染料可以是荧光共振能量转移(FRET)染料;吨染料(xanthene dye),例如荧光素和罗丹明;在α或β位具有氨基的染料(例如萘胺染料,1-二甲氨基萘基-5-磺酸,1-苯胺基-8-萘磺酸和2-对-甲苯胺基-6-萘磺酸);含有3-苯基-7-异氰酸酯香豆素的染料;吖啶,例如9-异硫氰酸酯吖啶和吖啶橙;芘,苯并恶二唑和芪;含有3-(ε-羧甲基)-3′-乙基-5,5′-二甲基氧杂甲花青(CYA);6-羧基荧光素(FAM);5(6)-羧基罗丹明110(R110);6-羧基罗丹明6G(R6G);N,N,N′,N′-四甲基-6-羧基罗丹明(TAMRA);6-羧基-X-罗丹明(ROX);6-羧基-4′,5′-二氯-2′,7′-二甲氧基荧光素(JOE);ALEXA FLUORTM;Cy2;德克萨斯红和罗丹明红;6-甲氧基-2′,4,7,7′-四氯荧光素(TET);6-甲氧基-2′,4,4′,5′,7,7′-六氯荧光素(HEX);5-甲氧基-2′,4′,5′,7′-四氯荧光素(ZOE);NAN;NED;Cy3;Cy3.5;Cy5;Cy5.5;Cy7;以及Cy7.5;IR800CW,ICG,Alexa Fluor 350;Alexa Fluor 488;Alexa Fluor 532;Alexa Fluor 546;Alexa Fluor 568;Alexa Fluor 594;Alexa Fluor 647;Alexa Fluor680,或Alexa Fluor 750。
非常小的颗粒,称为纳米颗粒,也可用作直接可检测实体。这些颗粒通常尺寸为1-1000nm,包括不同的化学结构,例如金和银颗粒,以及量子点。当被成角度入射的白光辐射时,40-120nm的银或金纳米颗粒会散射出高强度的单色光。散射光的波长取决于颗粒尺寸。四到五种紧密接近的不同的颗粒各自会散射出单色光,当其重迭时,会产生特定而唯一的颜色。衍生纳米颗粒,例如银或金颗粒可与一系列分子结合,包括蛋白质、抗体、小分子、受体配体和核酸。纳米颗粒的具体实例包括金属纳米颗粒和金属纳米壳,例如金颗粒、银颗粒、铜颗粒、铂颗粒、镉颗粒、复合颗粒、金空心球、金涂覆二氧化硅纳米壳和二氧化硅涂覆金壳。还包括二氧化硅、乳胶、聚苯乙烯、聚碳酸酯、聚丙烯酸酯、PDVF纳米颗粒、以及任意这些材料的有色颗粒。
量子点也可用作直接可检测实体。量子点是直径1-5nm的荧光晶体,可被大范围波长的光所激发。被具有适当波长的光激发时,这些晶体发光,例如单色光,其波长取决于它们的化学成分和尺寸。量子点,例如CdSe、ZnSe、InP、或InAs,具有独特的光学性能,这些和类似的量子点可从多种商业渠道获得(例如,NN-Labs,Fayetteville,AR;Ocean Nanotech,Fayetteville,AR;Nanoco Technologies,Manchester,UK;Sigma-Aldrich,St.Louis,MO)。
检测信号的存在可通过适于被测定所使用的标记或可检测实体的任意方式来实现。例如,检测步骤可包括可视化地检查捕获复合物的颜色变化,或检查捕获复合物的物理化学变化。物理化学变化可以随着氧化反应或其他化学反应出现。它们可经肉眼,使用分光光度计等检测。
当信号比阴性对照的信号强时,通常表明感兴趣的抗体存在;然而,并非所有的测试均需要阴性对照。在某些情况下,但也不必然,阳性信号的强度可被量化,当强度相对于对照在统计上显著时,表明抗体的存在。在某些情况下,关于具体测试类型的常规知识和经验确定何时信号为阳性或阴性,从而表明感兴趣抗体的存在或不存在。
作为一个实例,来自某些侧向流测定装置的信号可根据反应性评分来测量,分值为0-5(包括中间的小数点值),信号越强,越呈阳性,分值越高。阴性对照的分值通常接近于0,例如约0.25或更低。
检测信号可进行优化,例如,通过调整各反应物的比率。一个实例包括如下调整(i)可检测的Fc结合分子缀合物和(ii)可检测抗原/抗原性肽缀合物的比率:(i):(ii)的比率(例如摩尔比率)为约1:200、1:100、1:90、1:80、1:70、1:60、1:50、1:40、1:30、1:20、1:19、1:18、1:17、1:16、1:15、1:14、1:13、1:12、1:11、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1、或200:1,包括中间的所有比率和比率范围。在某些实施方式中,可检测的Fc结合分子缀合物与可检测抗原/抗原性肽缀合物的比率为约20:1至约1:20,优选约20:1至约1:1,更优选约16:1至约2:1。在某些实施方式中,可检测缀合物中的Fc结合分子是蛋白A、蛋白G、蛋白A/G融合蛋白、蛋白L、或其片段和变体,其保留与抗体Fc区域特异性结合的能力。
在某些实施方式中,蛋白A和蛋白G的混合物被用作Fc结合分子缀合物,其中各蛋白A和蛋白G分子与可检测实体缀合。在某些实施方式中,蛋白A和蛋白G均用作可检测的Fc结合分子缀合物,可根据待测免疫球蛋白的类型改变蛋白A与蛋白G的比率,从而优化检测信号。如上所述,蛋白A和蛋白G对不同免疫球蛋白类型(例如IgG、IgE、IgD、IgM、或IgA)的Fc区域具有不同的结合亲和力。相应地,蛋白A与蛋白G的比率可基于希望检测的免疫球蛋白类型进行调整。举例来说,如果希望主要检测IgM免疫球蛋白,可以使蛋白A与蛋白G的比率较低(即,相对于蛋白A缀合物,蛋白G缀合物的含量较高)。另一方面,如果希望主要检测IgG免疫球蛋白,可以使蛋白A与蛋白G的比率较高(即,相对于蛋白G缀合物,蛋白A缀合物的含量较高)。蛋白A与蛋白G缀合物的典型比率(例如摩尔比率)包括,但不限于,1:20、1:19、1:18、1:17、1:16、1:15、1:14、1:13、1:12、1:11、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、和20:1。在某些实施方式中,蛋白A缀合物与蛋白G缀合物的比率为约10:1至约1:10,优选约5:1至约1:5,更优选约2:1至约1:2。在一个实施方式中,蛋白A缀合物与蛋白G缀合物的比率为约1:1。
在某些实施方式中,可通过调整蛋白A与蛋白G与可检测抗原/抗原性肽缀合物的量的比率,进一步优化检测信号。例如,在某些实施方式中,蛋白A缀合物与蛋白G缀合物与可检测抗原/抗原性肽缀合物的比率(例如摩尔比率)可以为约20:20:1至约1:1:20,约10:10:1至约2:2:1,或约4:2:1至约1:2:1。
用抗原检测特异性抗体的免疫测定实验方案是本领域已知的。例如,可使用常规的夹心测定,或常规的竞争测定形式。对于某些适当类型的测定的讨论,参见Current Protocols in Immunology(Coligan et al.,editors,John Wiley&Sons,Inc)。在某些实施方式中,检测步骤包含进行侧向流免疫测定。在某些实施方式中,检测步骤包含进行ELISA测定。在其他实施方式中,检测步骤包含在分析转子中旋转样品。在其他实施方式中,检测步骤包含用光化学、光学、或光电传感器测定样品。
特别有用的测定形式是侧向流免疫测定形式。作为一个非限制性实例,包括Fc结合分子(例如蛋白A和/或G)的报告物或检测物分子以及任选地抗体特异性抗原被可检测实体(例如胶体金)标记,然后干燥并置于玻璃纤维垫上(上样垫或缀合垫)。未标记的抗原或抗原性肽(即捕获实体)固定于膜上,例如硝酸纤维素或PVDF(聚偏氟乙烯)膜(例如ImmobilonTM膜)。当样品(血液,血清等)溶液被施加到上样垫(或流经缀合垫)时,其溶解标记的检测物,其随后与样品中的抗体(如果存在)结合。产生的复合物随后经毛细管作用转运至下一个膜(包含捕获实体的PVDF或硝酸纤维素)。如果针对捕获实体的抗体存在,则其与膜上的检测物和诊断捕获实体复合,从而产生信号(例如可见或可视化的条带)。
作为另一个非限制性实例,样品垫不附着检测分子(即可检测的Fc结合分子,可检测的抗原缀合物),即,样品垫不包含预先固定检测物分子的缀合区域。所有其他组分与前述基本相同,未标记的抗原或抗原性肽(即捕获实体)固定于膜上,例如硝酸纤维素或PVDF(聚偏氟乙烯)膜(例如ImmobilonTM膜)。测试样品(血液,血清等)与一种或多种检测物分子预先混合,然后施加到样品垫上。可替换地,测试样品和检测物分子分别地,同时或顺序施加到样品垫上。其他组合对本领域技术人员是显而易见的。无论其混合或施加的顺序,样品中的抗体与检测物分子产生的复合物随后通过毛细管作用转运至下一个膜(包含捕获实体的PVDF或硝酸纤维素膜)。如果针对捕获实体的抗体存在,则其与膜上的检测物和诊断捕获实体复合,从而产生信号(例如可见或可视化的条带)。
在具体实施方式中,方法包括使测试样品与蛋白A和/或蛋白G-胶体金缀合物(CGC)接触,形成第一复合物,将第一复合物与固定在硝酸纤维素膜或PVDF膜的测试区域上的肽抗原接触,该肽抗原来自微生物来源,与感兴趣的抗体特异性结合(例如抗细菌、抗病毒、抗寄生虫、抗真菌抗体)。肽抗原可以与BSA缀合或合成为MAPS。测试区域中来自蛋白A-CGC和/或蛋白G-CGC的信号的存在表明测试样品中抗体的存在。
某些方法进一步包括使测试样品与肽抗原-CGC缀合物接触,其包含相同的上述肽抗原。在某些实施方式中,蛋白A/G-CGC或二抗-CGC或其组合以及肽抗原-CGC以不与测试区域重叠的方式固定在膜(或单独但连接的膜)的缀合区域。在其他实施方式中,蛋白A/G-CGC或二抗-CGC或其组合以及肽抗原-CGC不固定在膜上,而是与测试样品一起施加在表面,同时或顺序地施加。来自蛋白A/G-CGC和/或二抗-CGC以及肽抗原-CGC的组合信号表明测试样品中存在抗体,并且该信号通常比来自单用肽抗原-CGC(即没有蛋白A-CGC、蛋白G-CGC或二抗-CGC)进行的测试的信号要强。在具体实施方式中,肽抗原是疏螺旋体抗原(天然存在或合成的,例如与天然存在的抗原相同或相似),测试样品来自疑似患有莱姆病的对象。阳性信号表明样品中存在莱姆病特异性抗体。在其他实施方式中,肽抗原是埃里希体抗原(天然存在或合成的,例如与天然存在的抗原相同或相似),对象疑似患有埃里希体病,一种由无形小体科,埃里希体属和无形体属的细菌造成的蜱传播的细菌感染。
用于筛查血液制品或其他生理学或生物学液体的另一种测定是酶联免疫吸附法,即ELISA。通常在ELISA中,捕获实体(即抗体特异性抗原)直接或通过捕获基质(例如抗体)吸附在微量测试孔表面。然后用适当的试剂,例如牛血清白蛋白(BSA)、热灭活的正常山羊血清(NGS)或NLOTTO(脱脂奶粉的缓冲溶液,其还包含防腐剂,盐及消泡剂)封闭表面上剩余的非特异性蛋白结合位点。然后用疑似含有感兴趣的抗体的生物样品孵育测试孔。样品可以不经稀释而施加,或更多时候经稀释,通常用含有少量(0.1-5%重量计)蛋白,例如BSA、NGS或BLOTTO的缓冲溶液。经足够长时间孵育,使得特异性结合发生后,洗涤测试孔,去除未结合的蛋白,然后用一种或多种检测物分子孵育,包括Fc结合分子(例如蛋白A和/或蛋白G)以及任选的其他抗体特异性抗原(通常与捕获实体相同),其与酶或其他标记通过标准程序缀合并溶解在封闭缓冲液中。标记可选自多种酶,包括辣根过氧化物酶(HRP)、β-半乳糖苷酶、碱性磷酸酶、葡糖氧化酶等。充足的时间使得特异性结合再次发生,然后再次洗涤测试孔,去除未结合的缀合物,并添加酶的适宜底物。由此出现颜色,测试孔内含物的光学密度经可视化或仪器确定(在适宜的波长测量)。临界OD值可限定为至少50份血清样品的平均OD+3标准差(SD),样品采集自来自莱姆病并非其地方病的区域的个体,或以其他常规定义来限定。在非常特定的测定的情况下,可以OD+2SD作为临界值。进行ELISA测定的条件是本领域熟知的。
本领域技术人员应当理解,任意数量的常规蛋白测定形式,特别是免疫测定形式,可设计用于本文所述的不同实施方式。本发明并不因此受到具体测定形式选取的限制,并可包含本领域技术人员已知的测定形式。
诸如“包含抗体的样品”或“检测样品中的抗体”的措辞无意排除不包含抗体或未检测到抗体的样品或测定(例如检测尝试)。总体来说,本发明涉及确定样品中是否存在响应传染性微生物感染所产生的抗体的测定,无论其是否被检测。
使抗原/肽和抗体反应以便其特异性反应的条件是本领域技术人员所熟知的。参见,例如Current Protocols in Immunology(Coligan et al.,editors,John Wiley&Sons,Inc)。
装置和组合物
另一方面,本发明包括用于检测样品中的抗体的装置。某些实施方式包括抗体检测装置或抗体检测系统,其包含上样区域、缀合区域和测试区域。缀合区域通常不与测试区域重叠,然而,上样区域和这两个区域经过设置,使得操作中,当施加到上样区域时,样品与缀合区域和测试区域液体流通。通常,测试样品通过毛细管作用流经或与缀合区域和测试区域连通。缀合区域包含与第一可检测实体(即可检测的Fc结合分子缀合物,例如蛋白A和/或蛋白G缀合物,或Fc特异性二抗缀合物)缀合的可移动的Fc结合分子,测试区域包含能与抗体特异性结合的固定的捕获实体。这些特征在本文别处有述。
在某些实施方式中,装置进一步包含对照区域,当液体样品施加至上样区域时,其与液体样品流体连通。同样的,液体样品通过毛细管作用流经或与对照区域连通。在某些实施方式中,对照区域包含能够与对照检测物特异性结合的固定的结合配偶体。作为一个实例,对照区域包含抗蛋白A抗体、抗蛋白G抗体、或能与蛋白A或蛋白G反应的任意哺乳动物IgG。
某些装置进一步包含位于测试区域下游的吸收垫。在某些装置中,缀合区域位于上样区域的上游。在某些实施方式中,缀合区域位于上样区域的下游。在某些实施方式中,上样区域包含血液分离材料(blood separator material)。
在某些情况下,缀合区域进一步包含可移动的第二检测物,其中第二检测物包含与第二可检测实体缀合的抗原或抗原性肽,所述抗原或抗原性肽能够与抗体特异性结合。在某些实施方式中,第一(例如可检测的Fc结合分子)和第二(例如可检测的抗原缀合物)检测物具有相同类型的可检测实体。在其他实施方式中,第一和第二检测物具有不同类型的可检测实体。在具体实施方式中,调整第一检测物与第二检测物的比率(例如摩尔比率),从而获得期望的信号放大水平。例如,第一检测物(例如可检测的Fc结合分子,如蛋白A/蛋白G)与第二检测物(例如可检测的抗原缀合物)的比率可以是约1:200、1:100、1:90、1:80、1:70、1:60、1:50、1:40、1:30、1:20、1:19、1:18、1:17、1:16、1:15、1:14、1:13、1:12、1:11、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1、或200:1,包括中间的所有比率和比率范围。在某些实施方式中,可检测的Fc结合分子缀合物与可检测抗原/抗原性肽缀合物的比率为约20:1至约1:20,优选约20:1至约1:1,更优选约16:1至约2:1。在蛋白A和蛋白G缀合物均被用作可检测的Fc结合分子的实施方式中,可如上所述,根据待测免疫球蛋白的类型调整蛋白A缀合物与蛋白G缀合物的比率,从而优化检测信号。蛋白A缀合物与蛋白G缀合物的适当比率(例如摩尔比率)包括,但不限于,1:20、1:19、1:18、1:17、1:16、1:15、1:14、1:13、1:12、1:11、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、和20:1。在某些实施方式中,蛋白A缀合物与蛋白G缀合物的比率为约10:1至约1:10,优选约5:1至约1:5,更优选约2:1至约1:2。在一个实施方式中,蛋白A缀合物与蛋白G缀合物的比率为约1:1。
进行特定结合测定尤其是免疫测定的装置是已知的,并且可以很容易地经过调整而用于本方法。通常,固相测定比需要分离步骤,例如沉淀,离心、过滤、层析或磁力的异质测定方法容易操作,因为试剂分离更快,更简便。固相测定装置包括微孔板、流通测定装置(例如侧向流免疫测定装置)、浸测片(dipstick)、以及免疫毛细管或免疫层析免疫测定装置。
在某些实施方式中,装置是侧向流免疫测定装置。在某些实施方式中,装置是适于ELISA测定的微孔板。在其他实施方式中,装置适用于分析转子。在其他实施方式中,装置包含电化学、光学或光电传感器。
在某些实施方式中,侧向流装置由样品/血液分离垫、硝酸纤维素膜、以及上部的置于壳体内的芯(wick)构成。硝酸纤维素膜具有测试线或区域和任选的对照线或区域,所述测试线或区域包含捕获实体,例如未标记的抗体特异性抗原(例如肽抗原或非肽抗原),所述对照线或区域含有能与Fc结合分子反应的抗体(如下所述)。疑似含有感兴趣的抗体的样品可与可检测的Fc结合分子缀合物预先混合,然后施加到侧向流测定装置。或者不预先混合,样品和Fc结合分子可以任意顺序,同时或顺序施加到测定装置。
可替换地,硝酸纤维素膜如上制备,并进一步具有包含可检测的Fc结合分子缀合物的缀合线或区域,其中缀合区域和测试区域不重叠。在某些实施方式中,疑似含有感兴趣的抗体的样品施加到侧向流测定装置。在其他实施方式中,疑似含有感兴趣的抗体的样品可与特异性结合抗体(通常与捕获实体具有相同的结合特异性)的可检测的抗原缀合物预先混合,然后施加到侧向流测定装置。与之前类似,不预先混合,样品和可检测的抗原缀合物可以任意顺序,同时或顺序施加到测定装置。
在某些实施方式中,侧向流装置由样品/血液分离垫、硝酸纤维素膜、以及上部的置于壳体内的芯构成(参见例如图2)。硝酸纤维素膜具有测试线或区域、任选的对照线或区域、以及缀合线或区域,所述测试线或区域包含捕获实体,例如未标记的抗体特异性抗原(例如肽抗原或非肽抗原),所述对照线或区域含有能与Fc结合分子反应的抗体(如下所述),所述缀合线或区域包含与抗体(通常与捕获实体具有相同的结合特异性)特异性结合的可检测的抗原缀合物。缀合区域和测试区域通常不重叠。疑似含有感兴趣的抗体的样品可与可检测的Fc结合分子缀合物预先混合,然后施加到侧向流测定装置。也可以不预先混合,样品和Fc结合分子可以任意顺序,同时或顺序施加到测定装置。在一个示例性实施方式中,两开口装置也可用于顺序施加测试样品、缀合物和Chase缓冲液。
在某些侧向流装置中,硝酸纤维素膜具有测试线或区域、任选的对照线或区域、和缀合线或区域,所述测试线或区域包含捕获实体,例如未标记的抗体特异性抗原(例如肽抗原或非肽抗原),所述对照线或区域含有能与Fc结合分子反应的抗体(如下所述),所述缀合线或区域包含可检测的Fc结合分子和与抗体(通常与捕获实体具有相同的结合特异性)特异性结合的可检测的抗原缀合物。然后,疑似含有感兴趣的抗体的样品可被施加到侧向流测定装置。
在一个用于莱姆病特异性抗体检测的示例性装置中,侧向流装置由样品/血液分离垫、硝酸纤维素膜、以及上部的置于壳体内的芯构成(参见例如图2)。硝酸纤维素膜具有测试线或区域以及对照线或区域,所述测试线或区域包含模拟或模仿疏螺旋体抗原(参见例如美国申请12/948,209)混合物,所述对照线或区域包含任意蛋白A-或蛋白G-反应免疫球蛋白(例如,抗蛋白A IgG,鼠、人或其他蛋白A-反应IgG等)。疑似含有伯氏疏螺旋体抗体的样品可与胶体金缀合的蛋白A和/或G(蛋白A/G-CGC),或(ii)蛋白A/G-CGC和疏螺旋体抗原胶体金缀合物(疏螺旋体抗原-CGC)的混合物混合。然后,该样品缀合物混合物可被施加到侧向流测定装置。
可替换地,侧向流装置如上构成,但硝酸纤维素垫具有与测试区域分离的一个或多个缀合区域。所述缀合区域可包括,例如,(i)仅蛋白A/G-CGC,(ii)仅疏螺旋体抗原-CGC,或(iii)蛋白A/G-CGC和疏螺旋体抗原-CGC组合。此处或本申请其他地方所用的疏螺旋体抗原、埃里希体抗原或任意抗原或抗原性肽包括分别模拟或模仿天然疏螺旋体抗原、天然埃里希体抗原或任意天然抗原的合成肽混合物。在某些实施方式,例如(i)或(iii)中,测试样品单独施加到侧向流装置上,不进行预先混合。在其他实施方式,例如(i)中,样品可与疏螺旋体抗原-CGC预先混合,然后施加到侧向流装置上。在某些实施方式,例如(ii)中,样品可与蛋白A/G-CGC预先混合,然后施加到侧向流装置上。然而,这些示例性的组合并非限制性的,其他可能对本领域技术人员是显而易见的。
在通过样品/血液分离垫并迁移至任选的缀合线和测试线的过程中,形成捕获复合物,其包含蛋白A/G-CGC、样品中的抗体、以及任选的疏螺旋体抗原-CGC。根据情况(例如任选地使用疏螺旋体抗原-CGC),固定的和未标记的疏螺旋体抗原、抗体以及标记的蛋白A/G-CGC形成复合物或夹心。疏螺旋体抗原-CGC存在时,未标记疏螺旋体抗原、抗体、标记的疏螺旋体抗原-CGC以及标记的蛋白A/G-CGC形成复合物或夹心。向后一复合物中添加蛋白A/G-CGC进一步放大了来自标记疏螺旋体抗原-CGC的信号。在某些实施方式中,可如本文所述且本领域已知,通过调整所有反应物的比率实现放大的增加。
在一个用于埃里希体特异性抗体检测的示例性装置中,侧向流装置由样品/血液分离垫、硝酸纤维素膜、以及上部的置于壳体内的芯构成。硝酸纤维素膜具有包含埃里希体抗原的测试线或区域,以及包含任意蛋白A-或蛋白G-反应性免疫球蛋白(例如抗蛋白A IgG)的对照线或区域。疑似含有埃里希体(例如犬埃里希体、沙费埃里希体,伊氏埃里希体)抗体的样品可与胶体金缀合的蛋白A和/或G(蛋白A/G-CGC),或(ii)蛋白A/G-CGC和埃里希体抗原胶体金缀合物(埃立克体抗原-CGC)的混合物混合。然后,该样品缀合物混合物可被施加到侧向流测定装置。
可替换地,侧向流装置如上构成,但硝酸纤维素垫具有与测试区域分离的一个或多个缀合区域。缀合区域可包括,例如,(i)仅蛋白A/G-CGC,(ii)仅埃里希体抗原-CGC,或(iii)蛋白A/G-CGC和埃里希体抗原-CGC组合。在某些实施方式,例如(i)或(iii)中,测试样品单独施加到侧向流装置上,不进行预先混合。在其他实施方式,例如(i)中,样品可与埃里希体抗原-CGC预先混合,然后施加到侧向流装置上。在某些实施方式,例如(ii)中,样品可与蛋白A/G-CGC预先混合,然后施加到侧向流装置上。然而,这些示例性的组合并非限制性的,其他可能对本领域技术人员是显而易见的。
在通过样品/血液分离垫并迁移至任选的缀合线和测试线的过程中,形成捕获复合物,其包含蛋白A/G-CGC、样品中的抗体、以及可选的埃里希体抗原-CGC。根据情况(例如可选的使用埃里希体抗原-CGC)、固定的和未标记的埃里希体抗原、抗体以及标记的蛋白A/G-CGC形成复合物或夹心。埃里希体抗原-CGC存在时,未标记的埃里希体抗原、抗体、标记的埃里希体抗原-CGC以及标记蛋白A/G-CGC形成复合物或夹心。向后一复合物中添加蛋白A/G-CGC进一步放大了来自标记的埃里希体抗原-CGC的信号。在某些实施方式中,可如本文所述且本领域已知,通过调整所有反应物的比率实现放大的增加。
在一个适于ELISA的微孔板的实施方式中,捕获实体固定在表面,例如96孔ELISA板或等同固相上,其在碱性涂覆缓冲液中,以最适浓度4℃孵育过夜,涂覆链霉亲和素或等同生物素结合化合物,例如亲和素或中性亲和素。经过适当次数的标准洗涤缓冲液洗涤后,最适浓度的生物素化形式的Fc结合分子以及任选的用作捕获实体的相同抗原溶于常规封闭缓冲液,被施加到每个测试孔。然后添加样品,测定过程如本文所述且本领域已知。
另一方面,本发明提供与样品中的抗体检测相关的组合物。某些实施方式涉及一种或多种捕获复合物,其包含捕获实体、测试样品中的抗体、以及第一检测物,其中捕获实体与抗体结合,并且其中第一检测物包含与第一可检测实体缀合的Fc结合分子,并与抗体的Fc区域结合。某些实施方式进一步包含第二检测物,其中第二检测物与抗体的可变区域特异性结合。在某些实施方式中,捕获复合物固定在表面,例如固体或半固体支持物的测试区域。例如,在某些实施方式中,固体支持物是珠(例如胶体颗粒或纳米颗粒)、侧向流免疫测定装置中的流动通道、分析转子中的流动通道、或试管或测试孔(例如平板中的)。这些和相关实施方式的示例参见图1,包括任选的第二检测物缀合物和任选的测试表面。
在具体实施方式中,复合物包含感兴趣的抗体(例如抗微生物抗体,如抗病毒、抗细菌、抗真菌、或抗寄生虫抗体)、蛋白A-和/或蛋白G-缀合物、固定的抗体特异性抗原、以及任选的抗原缀合物。在某些实施方式中,蛋白A-和/或蛋白G-缀合物包含金纳米颗粒(例如,蛋白A-CGC或蛋白G-CGC“胶体金缀合物”),抗原缀合物包含金纳米颗粒(例如抗原-CGC)。在某些实施方式中,抗原缀合物或抗原-CGC包含微生物抗原,例如病毒、细菌、真菌或寄生虫抗原,如本文所述且本领域已知。在具体实施方式中,抗原缀合物或抗原-CGC包括莱姆病特异性抗原,例如疏螺旋体抗原(如上所述)。在其他实施方式中,抗原缀合物或抗原-CGC包括埃里希体病特异性抗原,例如埃里希体抗原。
试剂盒
另一方面,发明提供试剂盒。在某些实施方式中,试剂盒包含本文所述的发明的装置或系统。在某些实施方式中,试剂盒包含发明的2、3、4、或更多个装置或系统。
用于特定类型测定的试剂也可在发明的试剂盒中提供。因此,试剂盒可包括多种纳米颗粒、珠(例如适于凝集反应或侧向流测定)、或平板(例如适于ELISA测定的平板)。在其他实施方式中,试剂盒包含装置,例如侧向流免疫测定装置,分析转子,或电化学、光化学、或光电传感器。多种纳米颗粒、珠、平板和装置可用于进行免疫测定。例如,它们可用于检测抗体-肽复合物的形成,所述复合物包含来自样品的抗体、抗原性肽(标记和/或未标记)、以及Fc结合分子。
在某些实施方式中,抗原(或不同抗原的混合物)与可检测实体例如金纳米颗粒缀合,该相同抗原(或抗原混合物)也附着或固定于平板、硝酸纤维素测试表面、或其他测试表面或装置上,并且Fc结合分子与可检测实体例如金纳米颗粒缀合。在具体试剂盒中,抗原性肽与金纳米颗粒缀合,并任选地与BSA缀合,该相同抗原(不含金颗粒,但任选地与BSA缀合)固定在硝酸纤维素表面上限定的测试区域或条带上,蛋白A和/或蛋白G与金纳米颗粒缀合,任选地作为包含侧向流测定装置的试剂盒的一部分。在某些实施方式中,蛋白A-和/或蛋白G-金颗粒缀合物固定在硝酸纤维素表面上的单独区域,即缀合区域,其不与测试区域重叠。
另外,试剂盒可包括各种稀释剂和缓冲液、标记的缀合物或其他用于检测特异性结合抗原或抗体的试剂,以及其他信号产生试剂,例如酶底物、辅因子和发色团。试剂盒的其他组分可由本领域技术人员很容易地确定。这些组分可以包括涂覆试剂,对Fc结合分子例如蛋白A和/或蛋白G特异性的多克隆或单克隆捕获抗体,或者两种或更多种所述抗体的混合物,按照标准纯化或半纯化的抗原或抗体的提取物,单克隆抗体检测物抗体,缀合有指示分子的抗鼠、抗狗、抗鸡或抗人抗体,用于比色比较的指示图,一次性手套,去污说明书,上样棒或容器,样品制备杯等。在一个实施方式中,试剂盒包含缓冲液或其他试剂,其适于构成可形成肽-抗体复合物的反应介质。
该试剂盒为临床实验室提供便捷、有效的方式,以诊断如本文别处所述且本领域已知的微生物菌剂,尤其是病原微生物菌剂引起的感染。例如,某些自身免疫性疾病与某些类型的抗体有关。因此,在已知的疾病相关抗体/抗原组合的范围内,本发明可提供对该疾病灵敏而准确的诊断。具体的试剂盒提供对疏螺旋体,例如伯氏疏螺旋体进行检测,从而辅助莱姆病诊断。
在某些实施方式中,试剂盒进一步包含说明书。例如,在某些实施方式中,试剂盒包含说明书,其指导如何使用该试剂盒检测抗体,例如微生物抗原的抗体(例如疏螺旋体抗原,埃里希体抗原),或诊断疾病,例如微生物相关疾病(例如莱姆病,埃里希体病)。在某些实施方式中,试剂盒包含说明书,其指导如何使用多种珠、平板或装置(例如侧向流装置)检测针对微生物抗原,例如疏螺旋体抗原或埃里希体抗原的抗体,或诊断微生物相关疾病,例如莱姆病(莱姆疏螺旋体病)或埃里希体病。在某些实施方式中,试剂盒提供说明书,用于将可检测的Fc结合分子、抗体特异性的可检测抗原缀合物或抗原性肽缀合物、以及测试样品在施加到检测系统(例如侧向流测定装置,微孔板,分析转子)的上样区域之前,以任意顺序组合。在某些实施方式中,试剂盒包括说明书,用于将可检测抗原缀合物或抗原性肽缀合物与测试样品组合,这样可检测抗原缀合物或抗原性肽缀合物将以与可检测的Fc结合分子特定的比率存在,以实现期望的信号放大水平。试剂盒还可提供说明书,用于优化缓冲液,优化不同组分(例如Fc结合分子,抗原或抗原性肽,测试样品)的比率,优化混合及加样步骤的顺序(例如,加样前混合所有组分,仅混合某些组分,其他单独加样)。
本发明的肽、包含肽的组合物和装置、试剂盒和方法具有多种优点。例如,它们使得对感兴趣抗体的检测以及相关疾病的诊断简便、廉价、快速、灵敏和准确,无显著的假阳性或背景信号。由此可对抗体含量非常低,甚至其他方式无法检测的样品进行准确而灵敏的诊断。
实施例
实施例1:蛋白A增强莱姆病特异性侧向流测定中对抗体的特异性检测
检测阴性样品、莱姆病阳性样品、以及低含量的莱姆病阳性样品时,通过测试以确定添加蛋白A-CGC(胶体金缀合物)对莱姆病特异性侧向流测定的影响。目的在于保持足够的测定灵敏度的同时,就蛋白A-CGC对潜在假信号的影响进行观察和分级。相对于蛋白A-CGC阴性对照的不同蛋白A-CGC浓度进行测试。该测试中进行的侧向流测定与图2和3中所示的相似。结果见下表1,以反应评分示出(数值范围0-5,较高的数值代表阳性结果)。
表1:测试结果总结(反应评分)
如表1所示,添加蛋白A-CGC使所有测试的莱姆病阳性样品的信号得到放大,尤其能够检测“低”阳性的样品。没有蛋白A-CGC时,低阳性的样品无法检测,显示与阴性样品类似的反应评分(约0.25或更低)。相反,以1X浓度和1:2稀释添加蛋白A-CGC使信号显著放大,反应评分约3.5。因此,蛋白A-CGC显著改善莱姆病特异性侧向流测定中对靶抗体的检测。
实施例2:蛋白A增强应激生物样品侧向流测定中对抗体的特异性检测
通过测试以确定添加蛋白A-CGC(胶体金缀合物)对预先应激的48BSA(牛血清白蛋白)/DAG IgG缀合物混合物的影响。缀合物混合物在35℃的保温箱中预先应激15天。该实验测试蛋白A-CGC存在或不存在时的应激和非应激样品。该测试中进行的侧向流测定与图2和3中所示的相似。结果见下表1,以反应评分示出(数值范围0-5,较高的数值代表阳性结果)。结果如下表2所示。
表2:应激样品对比非应激样品的测试结果总结
如上表2所示,相对于不存在蛋白A-CGC,向侧向流测定混合物中添加蛋白A-CGC,使第15天的应激(35℃)生物样品的信号得到放大,可见反应评分由0.75增至1.75。第15天的非应激样品(2-8℃)也轻微地受到添加蛋白A-CGC的影响,可见反应评分由2.25增至2.75。同时,阴性样品不受蛋白A-CGC添加的影响。
如果作为参考文献引述的文献中的任何定义与本文的定义不一致,以本本文的定义为准。尽管根据当前优先实施方式对本发明进行了描述,应当理解的是,在不背离发明主旨的情况下,可进行对本领域技术人员是显而易见的不同变化和修改。相应地,发明仅由下述权利要求书限定。
- 还没有人留言评论。精彩留言会获得点赞!