一种纳米粒在细胞和组织内分布的检测方法及其应用与流程
本发明属于医药生物领域,特别是涉及一种纳米粒在细胞和组织内分布的检测方法及其应用。
背景技术:
纳米粒进入体内后,与体液中的蛋白(白蛋白、脂蛋白、免疫球蛋白等)、细胞(淋巴细胞、单核细胞、粒细胞)发生复杂的相互作用,从而导致纳米粒在形态、表面性质以及数量的变化。用于检测的常规手段包括流式细胞仪、激光共聚焦显微镜,但过程复杂而繁琐,提供的数据结果也无法量化,不能精确的展现出纳米粒自身的状态。由于血清蛋白、血细胞等的干扰,用于纳米粒分析的常规仪器如DLS也显得乏力。本发明应用纳米颗粒跟踪分析技术,对纳米粒的粒径以及颗粒数进行测定。同时,还可以通过对复杂体系中的特定纳米颗粒进行荧光标记,排除组分中其他粒子的干扰,使得检测结果更有针对性,荧光通道下的检测视野如图1所示。
技术实现要素:
为了克服现有技术中所存在的问题,本发明的目的在于提供一种一种纳米粒细胞内和组织内分布的检测方法。本发明通过使用纳米颗粒跟踪分析技术,提供了一种简单可靠的定性和/或定量检测方法,评价细胞对纳米粒的摄取情况,以及纳米粒在体内组织中的分布。通过将纳米粒进行荧光标记,用分离手段,对进入组织器官内纳米粒的数量和粒径进行针对性的分析,以考察纳米粒在体内的动态变化。本发明的检测方法具有操作简单、节约时间、提供有效数据多等特点。
为了实现上述目的以及其他相关目的,本发明采用如下技术方案:
本发明第一方面提供一种纳米粒在细胞内分布的检测方法,包括如下步骤:
1)纳米粒进行荧光标记;
2)将步骤1)得到的荧光标记的纳米粒与细胞共孵育;
3)将步骤2)得到的细胞分离得到上清;
4)将步骤3)得到的上清采用纳米颗粒跟踪分析仪进行定性和/或定量检测;
5)根据上清中纳米颗粒定性和/或定量检测的结果,获取纳米粒在细胞内分布状况。
优选地,步骤2)中,将步骤1)得到的荧光标记的纳米粒与介质孵育后,再加入到细胞内孵育,所述介质为PBS、白蛋白溶液或血清。
更优选,所述荧光标记的纳米粒与所述介质的体积比为0.5~1:1。
优选地,步骤3)中,所述分离为:先梯度离心分离,再qEV分离柱分离。
所述细胞可为外周血细胞或肿瘤细胞。
所述纳米粒包括脂质体、自组装纳米粒、纳米复合物、外泌体等纳米级别的颗粒。
优选地,步骤4)中,所述定性方法为:采用纳米颗粒跟踪分析仪获得上清中剩余纳米粒的量,与总纳米粒相比,来确认纳米粒是否被细胞摄取。
优选地,步骤4)中,所述定量方法为:采用纳米颗粒跟踪分析仪获得上清中剩余纳米粒的量,总纳米粒与剩余纳米粒的量的差为纳米粒被细胞摄取的量。
更优选地,所述纳米颗粒跟踪分析仪为搭载532nm激光器的NTA NS300,切换至荧光通道检测模块,特异性的检测荧光标记纳米粒的粒径及其数量。
本发明第二方面提供上述纳米粒在细胞内分布的检测方法用于观测纳米粒被不同外周血细胞或肿瘤细胞的摄取状态。
本发明第三方面提供一种纳米粒在组织内分布的检测方法,包括如下步骤:
1)纳米粒进行荧光标记;
2)将步骤1)得到的荧光标记的纳米粒注入组织;
可以将步骤1)得到的荧光标记的纳米粒注入离体的组织样本,也可以将步骤1)得到的荧光标记的纳米粒注入个体,如动物或植物;
3)将步骤2)得到的组织分离得到上清;
当步骤2)为将步骤1)得到的荧光标记的纳米粒注入个体时,步骤3)中所述步骤2)得到的组织需要先从个体中取出;
4)将步骤3)得到的上清采用纳米颗粒跟踪分析仪分进行定性和/或定量检测;
5)根据上清中纳米颗粒定性和/或定量检测的结果,获取纳米粒在组织内分布状况。
所述组织可为肿瘤组织、肝脏组织、脾脏组织、肾脏组织或肠道组织。
优选地,步骤3)中,所述分离为:将步骤2)得到的组织加入dispase溶液裂解为单细胞悬液,消化组织,然后离心,取上清过qEV分离柱分离。
更优选地,加入dispase溶液的浓度为0.6-2.4U/mL,加入量为每50mg组织加入750μLdispase溶液。
优选地,步骤4)中,所述定性方法为:采用纳米颗粒跟踪分析仪获得上清中剩余纳米粒的量,与总纳米粒相比,来确认纳米粒是否被组织摄取。
优选地,步骤4)中,所述定量方法为:采用纳米颗粒跟踪分析仪获得上清中剩余纳米粒的量,总纳米粒与剩余纳米粒的量的差为纳米粒被组织摄取的量。
更优选地,所述纳米颗粒跟踪分析仪为搭载532nm激光器的NTA NS300,切换至荧光通道检测模块,特异性的检测荧光标记纳米粒的粒径及其数量,屏蔽组织处理过程中引入以及本身存在的纳米级颗粒的影响。
本发明第四方面提供一种上述纳米粒在组织内分布的检测方法的用途,用于观测纳米粒在动物体内的组织分布。
本发明提供了一种简单可靠的定性和/或定量检测方法,评价细胞对纳米粒的摄取情况,以及纳米粒在体内组织中的分布。通过将纳米粒进行荧光标记,用分离手段,对进入组织器官内纳米粒的数量和粒径进行针对性的分析,以考察纳米粒在体内的动态变化。本发明的检测方法具有操作简单、节约时间、提供有效数据多等特点。
附图说明
图1是Nanosight荧光通道下检测纳米粒视野图。
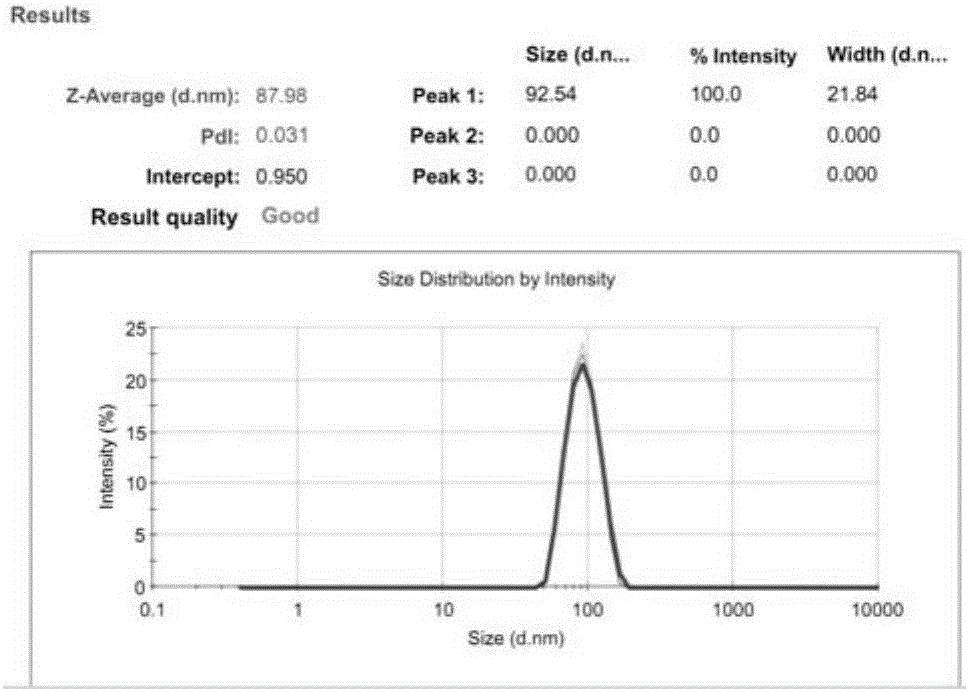
图2是制备好的荧光纳米粒在DLS Nanosizer粒径图。
图3是组织中分离的纳米粒在Nanosight检测结果。
图4是细胞在不同介质中对纳米粒摄取的流式细胞仪检测图。
图5是纳米粒从肿瘤组织中回收的标准曲线。
图6是纳米粒在组织处理过程中回收的标准曲线。
图7是纳米粒在肿瘤组织中的数量随时间变化曲线。
图8是纳米粒在肝脏组织中的数量随时间变化曲线。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
须知,下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置。
此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
本发明中,缩写符号表示如下:
缩写名称 中文全称
HSPC 氢化大豆卵磷脂
Chol 胆固醇
DSPE-PEG2000 二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000
DiI 细胞膜红色荧光探针
PBS 磷酸盐缓冲溶液
NTA NS300 纳米颗粒跟踪分析仪
DLS 马尔文激光粒度仪
PLD 空白阿霉素脂质体
Alb 血清白蛋白
FBS 小牛血清
Raw246.7 巨噬细胞系
dispase溶液 中性蛋白酶
实施例1纳米粒被细胞摄取的量化检测
(一)荧光纳米粒的制备
本发明采用脂质体作为纳米粒的模型。取HSPC、Chol、DSPE-PEG2000储备液质量比为3:1:1,按脂质质量比1%加入DiI,用乙醇注入法制备脂质体,PBS水合30min后,在60℃分别过200nm+100nm、80nm+50nm Nuclepore聚碳酸酯膜,各过13次,为防止荧光淬灭,制备过程避光。用DLS表征制备好的荧光脂质体的粒径。
(二)细胞摄取实验
细胞计数后铺板,将体积比为1:1的纳米粒与不同介质(PBS、白蛋白溶液、纯血清)孵育后,加入细胞培养液,37℃共孵育2h,其中白蛋白浓度为40mg/ml,纳米粒浓度为1mg/ml。
(三)流式细胞仪检测以及Nanosight计数
将细胞300g离心10min,PBS洗三遍,将细胞重悬后用流式细胞仪检测细胞吞噬,取上清液,稀释适当比例后用NTA NS300计数上清中剩余纳米粒的量。流式细胞仪细胞吞噬结果见图4所示,NTA NS300计数结果为表1。
实施例2分离检测组织纳米粒方法学考察
(一)荧光脂质体的制备
取HSPC、Chol、DSPE-PEG2000储备液质量比为3:1:1,按脂质质量比1%加入DiI,用乙醇注入法制备脂质体,PBS水合30min后,在60℃分别过200nm+100nm、80nm+50nm Nuclepore聚碳酸酯膜,各过13次,为防止荧光淬灭,制备过程避光。用DLS表征制备好的荧光脂质体的粒径,检测结果如附图2所示。
(二)组织中分离纳米粒
将50mg肿瘤组织剪碎,分别加入50ul 6mg/ml、0.6mg/ml、0.06mg/ml荧光脂质体混匀,加入750ul dispase溶液(浓度为2U/ml,U指的是一个蛋白酶活性单位),37℃恒温箱内,静止消化肿瘤组织4h,然后放入离心机中,通过梯度离心的方法分离荧光脂质体,离心300g、10min去除完整细胞;取上清离心2000g、10min去除死细胞以及细胞碎片、血小板等;取上清,过qEV柱,得到样品用NTA NS300检测。
为考察处理过程对检测结果的影响,作为对照,不加肿瘤组织,分别将50ul 6mg/ml、0.6mg/ml、0.06mg/ml荧光脂质体加入750ul dispase溶液,37℃恒温箱内,静止4h,然后放入离心机中,通过梯度离心的方法分离荧光脂质体,离心300g、10min,取上清离心2000g、10min,取上清,过qEV柱,得到样品用NTA NS300检测。
(三)标准曲线的建立
取分离好的样品,去离子水稀释适当倍数后,用Nanosight检测,仪器参数设置为
粒子计数与浓度标准曲线如图5(肿瘤组织)、图6(不加肿瘤组织)所示。
实施例3纳米粒在肿瘤的分布检测
(一)动物实验
将接种肿瘤的裸鼠随机分为6组,其中一组作为空白对照,另外5组尾静脉注射荧光标记的脂质体,分别在给药后2h、6h、9h、12h、24h后处死小鼠,解剖后得到肿瘤组织。
(二)肿瘤组织中分离纳米粒
分别称取2h、6h、9h、12h、24h的肿瘤组织50mg,加入750ul dispase溶液(浓度为0.6U/ml,U指的是一个蛋白酶活性单位),37℃恒温箱内,静止消化肿瘤组织4h,然后放入离心机中,通过梯度离心的方法分离荧光脂质体,离心300g、10min去除完整细胞;取上清离心2000g、10min去除死细胞以及细胞碎片、血小板等;取上清,过qEV柱,得到样品检测。为保证荧光脂质体荧光的特性,整个过程都严格避光操作。
(三)用Nanosight检测荧光脂质体
将分离后的样品,用去离子水稀释到适宜倍数,用搭载532nm激光器的NTA300检测,仪器参数设置为
NTA NS300检测到组织中分离的纳米粒粒径如图3所示,在肿瘤组织中分布随时间变化曲线如图7所示。
实施例4纳米粒在肝脏组织中的分布检测
(一)动物实验
将接种肿瘤的裸鼠随机分为6组,其中一组作为空白对照,另外5组尾静脉注射荧光标记的脂质体,分别在给药后9h、12h、24h、48h后处死小鼠,解剖后得到肝脏组织。
(二)肝脏组织中分离纳米粒
分别称取9h、12h、24h、48h的肿瘤组织50mg,加入750ul dispase溶液(浓度为2.4U/ml,U指的是一个蛋白酶活性单位),37℃恒温箱内,静止消化肿瘤组织4h,然后放入离心机中,通过梯度离心的方法分离荧光脂质体,离心300g、10min去除完整细胞;取上清离心2000g、10min去除死细胞以及细胞碎片、血小板等;取上清,过qEV柱,得到样品检测。为保证荧光脂质体荧光的特性,整个过程都严格避光操作。
(三)用Nanosight检测荧光脂质体
将分离后的样品,用去离子水稀释到适宜倍数,用搭载532nm激光器的NTA300检测,仪器参数设置为
纳米粒在肿瘤组织中分布随时间变化曲线如图8所示。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!