血液分析方法以及在其中使用的染色液及血液分析装置与流程
本发明涉及血液分析方法以及在其中使用的染色液及血液分析装置。
背景技术:
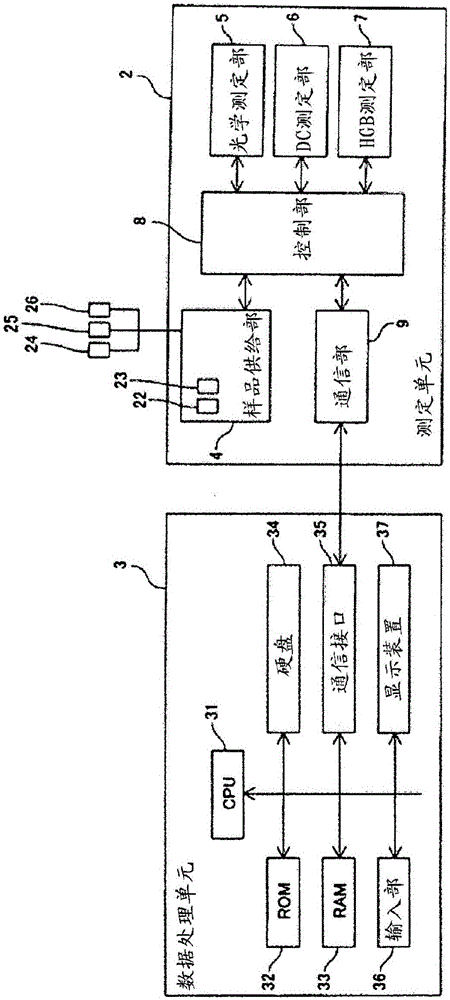
:在US2006/0223137中公开了为了在使疟疾原虫保持于红细胞内部的状态下可透过荧光染料而部分溶解红细胞的细胞膜的红细胞膜部分溶解试剂。另外,在实施例中记载了,使用向待测样品20μl添加2μl作为荧光染料将Hoechst34580用乙二醇溶解的染料液(0.5mg/ml)和1ml上述红细胞膜部分溶解试剂而调制的测定样品(Hoechst34580的浓度:1.80μM),经流式细胞仪检测疟疾感染红细胞。但是,在专利文献1中记载的疟疾感染红细胞的检测方法中,在例如网织红细胞(RET)高值样品等时有疟疾感染红细胞和其以外的粒子重叠的情况。另外,有在疟疾感染率的低的待测样品时与疟疾非感染红细胞的辨别困难的课题。因此,期望使疟疾感染红细胞与疟疾非感染红细胞的分离性进一步提高。技术实现要素:本发明的范围仅由随附的权利要求定义,不受此发明概述部分的任何影响。本次,本发明人发现,通过作为荧光染料不以高浓度使用Hoechst34580,相反以低浓度使用,能使疟疾感染红细胞与疟疾非感染红细胞的分离性进一步提高,从而完成本发明。即,由本发明提供血液分析方法,其具备:由血液、下式1所示的荧光染料及待测样品稀释液调制上述荧光染料的浓度0.15μM以上1.0μM以下的测定样品的工序;取得向上述测定样品照射光而得到的荧光信息的工序;及基于上述荧光信息,检测上述血液中的被疟疾原虫感染的红细胞的工序【化1】另外,由本发明提供疟疾分析用染色液,其含下式1所示的荧光染料,上述荧光染料的浓度是3μM以上200μM以下【化2】再者,由本发明提供血液分析装置,其具备:由血液、下式1所示的荧光染料及待测样品稀释液调制上述荧光染料的浓度0.15μM以上1.0μM以下的测定样品的测定样品调制部,向上述测定样品照射光的光源部,取得自照射光的上述测定样品得到的荧光信息的检测部,及基于上述荧光信息,检测上述血液中的被疟疾原虫感染的红细胞的控制部【化3】【发明效果】由本发明提供检测精度的好的疟疾感染红细胞的检测方法。【附图说明】图1是显示由本发明的一实施方式的血液分析装置的概略构成的正面图。图2是显示由图1所示的一实施方式的血液分析装置的构成的框图。图3是显示由图1所示的一实施方式的血液分析装置的测定单元的斜视图。图4是显示由图1所示的一实施方式的血液分析装置的测定单元的内部结构的斜视图。图5是显示由图1所示的一实施方式的血液分析装置的测定单元的内部结构的侧面图。图6是模式显示设在由图1所示的一实施方式的血液分析装置的测定单元的流动池的构成的斜视图。图7是显示设在由图1所示的一实施方式的血液分析装置的测定单元的光学测定部及向其供给荧光染料(染色液)及待测样品稀释液的室的构成的概略图。图8是显示设在由图1所示的一实施方式的血液分析装置的测定单元的光学测定部的构成的概略图。图9是模式显示设在由图1所示的一实施方式的血液分析装置的测定单元的DC测定部的构成的斜视图。图10是模式显示设在由图1所示的一实施方式的血液分析装置的测定单元的HGB测定部的构成的斜视图。图11是显示由图1所示的一实施方式的血液分析装置中的样品分析处理的流程图。图12是使用高浓度(18.0μM)的Hoechst34580时的散点图。图13是使用低浓度(0.45μM)的Hoechst34580时的散点图。图14是使用低浓度(0.45μM)的Hoechst34580时的散点图(增益变更)。图15是使用RET高值待测样品时的散点图。图16是使用疟疾感染率的低的待测样品时的散点图。图17A是代替Hoechst34580而使用DAPI(0.43μM)时的散点图。图17B是代替Hoechst34580而使用DAPI(0.87μM)时的散点图。图18A是将Hoechst34580浓度设为0.00μM得到的散点图。图18B是将Hoechst34580浓度设为0.02μM得到的散点图。图18C是将Hoechst34580浓度设为0.04μM得到的散点图。图18D是将Hoechst34580浓度设为0.07μM得到的散点图。图18E是将Hoechst34580浓度设为0.09μM得到的散点图。图18F是将Hoechst34580浓度设为0.18μM得到的散点图。图18G是将Hoechst34580浓度设为0.36μM得到的散点图。图18H是将Hoechst34580浓度设为0.45μM得到的散点图。图18I是将Hoechst34580浓度设为0.62μM得到的散点图。图18J是将Hoechst34580浓度设为0.89μM得到的散点图。【实施方式】以下参照附图说明本发明的优选实施方式。本发明的血液分析方法包括:由血液、下式1所示的荧光染料及待测样品稀释液调制上述荧光染料的浓度0.15μM以上1.0μM以下的测定样品的工序【化4】<测定样品>测定样品是用于流过流式细胞仪而进行测定的样品,作为待测样品含血液、上述的式1所示的荧光染料(Hoechst34580)及待测样品稀释液。测定样品中的荧光染料的浓度的下限是0.15μM、优选为0.16μM、更优选为0.18μM。测定样品中的荧光染料的浓度的上限是1.0μM、优选为0.95μM、更优选为0.89μM。测定样品中的荧光染料的浓度的具体数值可为,例如0.15、0.18、0.2、0.25、0.3、0.35、0.36、0.4、0.45、0.5、0.55、0.6、0.62、0.65、0.7、0.75、0.8、0.85、0.89、0.9、0.95、1.0(单位:μM)。在使用如专利文献1记载的流式细胞术的血细胞分类中,通过使荧光染料的浓度增大,染色对象的粒子整体向高荧光强度侧变动(例如,专利文献1的图3等)。因此,在要使某血细胞集团与别的血细胞集团的分离性提高时,通常,本领域技术人员自然要使荧光染料的浓度增大。从而,本发明人使用比专利文献1中记载的高的浓度(18.0μM)的荧光染料,以图提高分离性。但是,与预计不同,疟疾感染红细胞的荧光强度未升高(参照后述的图12)。另一方面,仅是显示比疟疾感染红细胞低的荧光强度的疟疾非感染红细胞的荧光强度升高,因此分离性反倒恶化了。本发明人意外发现,通过作为荧光染料不以高浓度使用Hoechst34580,相反以低浓度使用,可进一步提高疟疾感染红细胞与疟疾非感染红细胞的分离性。(荧光染料)上述的式1所示的荧光染料以CAS编号911004-45-0被本领域技术人员公知,也称为Hoechst34580。此荧光染料是相比RNA更强染色DNA的DNA选择性荧光染料。上述的荧光染料可由例如蓝紫色激光(波长约405nm)激发。上述的荧光染料可根据公知的方法合成,也可使用市售品。荧光染料在溶液中以离子的形态存在。在本说明书中,将这样的溶液也称为疟疾分析用染色液或染色液。染色液的溶剂只要不防碍血液分析,就不特别限定。溶剂优选为乙二醇、二乙二醇、聚乙二醇、水、生理盐水、碳原子数1~6的低级醇(乙醇等)及它们的混合物,更优选为乙二醇。对离子只要不防碍血液分析,就不特别限定。优选为卤离子、更优选为氯离子(Cl-)。染色液中的荧光染料的浓度的下限优选为3μM、更优选为10μM、再优选为50μM。染色液中的荧光染料的浓度的上限优选为200μM、更优选为180μM、再优选为150μM。染色液中的荧光染料的浓度的具体数值可为,例如3、5、10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200(单位:μM)。上述的染色液中的荧光染料的浓度的下限及上限的值,在通过如在本实施方式中使用的血液分析装置调制测定样品时,基于精度管理上的界限。即,在使用如在本实施方式中使用的血液分析装置调制测定样品时,可由移液器吸吐的染色液的容量是一般约5μL以上且约50μL以下。由于上述的血液分析装置中向染色液加的待测样品稀释液的容量是1.0mL,因此由染色液调制测定样品时的荧光染料的稀释倍率成为约20倍~约200倍。鉴于测定样品中的荧光染料浓度是0.15μM以上1.0μM以下,染色液中的荧光染料的浓度的下限及上限分别为3μM及200μM。再者,由于血液的容量是微量,由此在上述的浓度的下限及上限的算出中忽略。这样的染色液的调制方法不特别限定,可根据本领域技术人员公知的方法调制。例如,可通过将上述的荧光染料和上述的溶剂混合来调制。在染色液的调制中将荧光染料和溶剂混合时,也可搅拌混合物。搅拌速度及搅拌时间等的搅拌条件可由本领域技术人员适宜设定。(待测样品稀释液)待测样品稀释液含使红细胞增溶的溶血剂、优选为表面活性剂。作为表面活性剂,可举出例如月桂基三甲基铵氯化物、硬脂基三甲基铵氯化物、肉豆蔻基三甲基铵氯化物及鲸蜡基三甲基铵氯化物等的阳离子系表面活性剂、十二烷基硫酸钠等的阴离子系表面活性剂、CHAPS等的两性表面活性剂、PBC-44等的非离子系表面活性剂、或者这些的混合物。表面活性剂优选为月桂基三甲基铵氯化物、硬脂基三甲基铵氯化物及PBC-44。更优选为,溶血剂含对红细胞膜的溶解力不同的至少2种表面活性剂。作为这样的至少2种表面活性剂的组合,具体而言,可举出月桂基三甲基铵氯化物和硬脂基三甲基铵氯化物与PBC-44的组合、肉豆蔻基三甲基铵氯化物与鲸蜡基三甲基铵氯化物的组合等,优选为月桂基三甲基铵氯化物和硬脂基三甲基铵氯化物与PBC-44的组合。待测样品稀释液的pH的下限优选为5.0、更优选为5.5。待测样品稀释液的pH的上限优选为7.0、更优选为6.5。待测样品稀释液的pH的具体数值可为,例如5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0(无单位)。待测样品稀释液对红细胞的渗透压的下限优选为200mOsm/kg·H2O、更优选为220mOsm/kg·H2O。待测样品稀释液对红细胞的渗透压的上限优选为300mOsm/kg·H2O、更优选为280mOsm/kg·H2O。待测样品稀释液对红细胞的渗透压的具体数值可为,例如200、210、220、230、240、250、260、270、280、290、300(单位:mOsm/kg·H2O)。在红细胞中含疟疾感染红细胞时,疟疾原虫进入疟疾感染红细胞的内部。由溶血剂的作用而测定样品中的红细胞缩小。疟疾感染红细胞在内部保持疟疾原虫的状态下由溶血剂缩小。(血液)成为待测样品的血液只要是自血液流通的活体采集的血液,就不特别限定。活体可为人或鸡、猴等的人以外的动物,优选为人。活体可为网织红细胞(RET)高值待测样品或疟疾感染率低的待测样品。血液可由本领域技术人员公知的方法、例如采血等自活体取得。测定样品以测定样品中的荧光染料的浓度在下限及上限的范围内作为前提,也可由DC测定用稀释液稀释。DC测定用稀释液只要适宜于血液分析,就不特别限定,优选为Sysmex公司制CELLPACK。但是,在本实施方式中,疟疾测定用的测定样品优选为不由DC测定用稀释液进行稀释。再者,如后所述,在本实施方式中,DC测定用稀释液也可作为用于光学测定或DC测定的鞘液使用。在本发明的别的实施方式中,除了疟疾感染红细胞的检测或疟疾感染红细胞数的测定之外,进行红细胞数的测定或基于红细胞数进行疟疾感染红细胞率的算出。此时,与疟疾测定用的测定样品不同地,调制红细胞数测定用的测定样品。红细胞数测定用的测定样品优选由上述的稀释液进行稀释。(测定样品的调制方法)测定样品的调制方法不特别限定,可根据本领域技术人员公知的方法调制。例如,可通过将成为待测样品的血液、上述的荧光染料(优选为含上述的荧光染料的染色液)及待测样品稀释液混合来调制。测定样品的调制温度的下限优选为20℃、更优选为39℃。测定样品的调制温度的上限优选为45℃、更优选为43℃。测定样品的调制时间的下限优选为10秒钟、更优选为20秒钟。测定样品的调制时间的上限优选为60秒钟、更优选为30秒钟。在测定样品的调制中将血液、荧光染料及待测样品稀释液混合时、也可搅拌混合物。搅拌速度及搅拌时间等的搅拌条件可由本领域技术人员适宜设定。在测定样品含DC测定用稀释液时,在上述的血液、荧光染料及待测样品稀释液的基础上再混合DC测定用稀释液,除此以外,可与上述测定样品的调制方法同样地调制。本发明的血液分析方法包括取得向如上所述调制的测定样品照射光而得到的荧光信息的工序。照射光的波长只要是能激发上述式1所示的荧光染料的波长,就不特别限定。作为这样的波长域,例如是375nm以上420nm以下。照射光的强度可由本领域技术人员适宜设定。另外,在上述的取得工序中,也可取得向如上所述调制的测定样品照射光而得到的散射光信息。散射光信息及荧光信息的取得方法只要能提供有助于血液分析的信息,就不特别限定。散射光信息及荧光信息的取得方法优选为流式细胞术。散射光信息及荧光信息的取得可使用广泛使用的流式细胞仪进行。在本实施方式中,可使用内藏在后述的血液分析装置1的流式细胞仪进行散射光信息及荧光信息的取得。本发明的血液分析方法包括:基于如上所述取得的荧光信息及任意地散射光信息,检测血液中的被疟疾原虫感染的红细胞的工序。被疟疾原虫感染的红细胞的检测方法不特别限定。检测方法优选是使用能解析由流式细胞术得到的前方散射光信息及侧方荧光信息的计算机程序的方法。再者,只要使用图1所示的血液分析装置,就可持续进行上述的散射光信息及荧光信息的取得工序和被疟疾原虫感染的红细胞的检测工序。在本实施方式中,使用内藏在图1所示的血液分析装置的计算机程序,进行被疟疾原虫感染的红细胞的检测。更具体而言,使用上述的计算机程序,对前方散射光信息及荧光信息进行印迹而制成散点图,将成为待测样品的血液中的成分分类为疟疾感染红细胞、疟疾非感染红细胞及白细胞这3组。在本实施方式中,通过以指定浓度使用上述式1所示的荧光染料,在散点图上,可良好地分离疟疾感染红细胞和疟疾非感染红细胞。再者,本实施方式中使用的血液分析装置不仅进行疟疾感染红细胞的检测,也可进行其他血液分析。例如,如果使用这样的血液分析装置,就能将白细胞分类为更细的组(例如淋巴细胞、嗜酸性粒细胞等)或测定红细胞数及血染料量等。上述的疟疾感染红细胞的检测,在与白细胞分类或红细胞数及血染料量的测定等的其他血液分析同时进行时,也在本发明的范围内。在本发明的范围内也包括上述的测定样品本身。即,由本发明提供测定样品,其是含血液、下式1所示的荧光染料及待测样品稀释液的测定样品,且荧光染料的浓度是0.15μM以上1.0μM以下【化5】对于血液、荧光染料、染色液、待测样品稀释液、调制方法等如上所述。如上所述,测定样品以荧光染料的浓度在上述的下限及上限的范围内作为前提,也可由DC测定用稀释液稀释。对于DC测定用稀释液也如上所述。在本发明的范围内也包括上述的测定样品的调制方法。即,由本发明提供调制含上述的式1所示的荧光染料,且荧光染料的浓度0.15μM以上1.0μM以下的测定样品的方法,其包括由血液、上述的式1所示的荧光染料及待测样品稀释液调制测定样品的工序。对于血液、荧光染料、染色液、待测样品稀释液、调制方法等如上所述。在本发明的范围内也包括用于血液分析的测定样品的使用。即,由本发明提供测定样品用于血液分析的用途,所述测定样品为含血液、上述的式1所示的荧光染料及待测样品稀释液的测定样品,且荧光染料的浓度是0.15μM以上1.0μM以下。对于血液、荧光染料、染色液、待测样品稀释液、调制方法等如上所述。如上所述,测定样品以荧光染料的浓度在上述的下限及上限的范围内作为前提,也可由DC测定用稀释液稀释。对于DC测定用稀释液也如上所述。在本发明的范围内也包括上述的疟疾分析用染色液本身。即,由本发明提供疟疾分析用染色液,其含上述的式1所示的荧光染料,且荧光染料的浓度是3μM以上200μM以下。对于荧光染料、溶剂、调制方法等如上所述。在本发明的范围内也包括上述的疟疾分析用染色液的调制方法。即,由本发明提供含上述的式1所示的荧光染料、且荧光染料的浓度是3μM以上200μM以下的疟疾分析用染色液的调制方法,其包括自上述的式1所示的荧光染料及溶剂调制染色液的工序。对于荧光染料、溶剂、调制条件等如上所述。在本发明的范围内也包括用于血液分析的疟疾分析用染色液的使用。即,由本发明提供含上述的式1所示的荧光染料、且荧光染料的浓度是3μM以上200μM以下的疟疾分析用染色液用于血液分析的用途。对于荧光染料、溶剂、调制方法等如上所述。在本发明的范围内还包括用于进行上述的血液分析方法的装置。即,由本发明提供血液分析装置,其具备:由血液、上述的式1所示的荧光染料及待测样品稀释液调制上述荧光染料的浓度0.15μM以上1.0μM以下的测定样品的测定样品调制部,向上述测定样品照射光的光源部,取得自照射光的上述测定样品得到的荧光信息的检测部,及基于上述荧光信息检测上述血液中的被疟疾原虫感染的红细胞的控制部。上述的检测部也可构成为进一步取得向测定样品照射光而得到的散射光信息。另外,上述的控制部也可构成为基于上述的散射光信息,检测上述血液中的被疟疾原虫感染的红细胞。以下,基于附图说明上述的血液分析装置的实施方式。首先,参照图1~图10,对于作为一实施方式的血液分析装置1的构成进行说明。本实施方式的血液分析装置1,如图1所示,是在血液检查中使用的装置,主要由测定单元2和数据处理单元3构成。另外,血液分析装置1,例如,被设置在医院或病理检查设施等的医疗机关的设施内。另外,在血液分析装置1中,由测定单元2对血液中所含的成分进行指定的测定,由数据处理单元3接收此测定数据而进行分析处理。进而,测定单元2和数据处理单元3由数据传送线缆3a能互相数据通信地连接。再者,测定单元2和数据处理单元3可为由数据传送线缆3a直接连接的构成,也可例如经使用电话线路的专用线路、LAN或互联网等的通信网络而连接。测定单元2,如图2所示,含样品供给部4、光学测定部5、DC测定部6、HGB测定部7、控制部8和通信部9。另外,如图3所示,在测定单元2的正面右下部分设有能设置收容血液的采血管20地构成的采血管设置部2a。此采血管设置部2a构成为通过使用者按下设在其近傍的按钮开关2b,向近前方向推出。使用者能在采血管设置部2a被推出的状态下设置采血管20。进而,设置采血管20后,构成为使用者通过再次按下按钮开关2b,采血管设置部2a返回测定单元2的内部。在测定单元2的内部,如图4及图5所示,设有抽吸血液的移液器21、及用于混合调制血液和荧光染料等的室22、23(参照图5)等。移液器21形成为上下方向延伸的管状,其前端尖突。另外,移液器21构成为与未图示的注射器泵连接,能由此注射器泵的动作仅将指定量液体抽吸并且吐出。另外,移液器21构成为,与移动结构连接,能上下方向及前后方向各自移动。另外,移液器21构成为通过向密闭采血管20的橡胶制的帽20a穿刺锐利的尖端,抽吸收容在采血管20的血液。另外,移液器21构成为,抽吸血液后,由移动机构移动至指定的位置,向室22或23内供给血液。再者,在本实施方式中,对于具备2个室的实施方式进行说明,但设在血液分析装置的如上述一样的室可为1个,可为2以上。样品供给部4是有室22及23、多个电磁瓣、隔膜泵等的流体单元。室22及23设为用于调制测定样品。另外,试剂容器与由样品供给部4构成的流体单元连接。具体而言,用于收容DC测定用稀释液的DC测定用稀释液容器24、用于收容待测样品稀释液的待测样品稀释液容器25及用于收容疟疾检测用的测定样品中使用的染色液的染色液容器26与流体单元连接。由此,能将DC测定用稀释液、待测样品稀释液及染色液供给到室22或23。DC测定用稀释液可根据需要向室22或23供给,或者也可不供给。光学测定部5是光学式的流式细胞仪,设为由使用半导体激光的流式细胞术进行疟疾感染红细胞检测(以下称为疟疾检测)。另外,光学测定部5有形成测定样品的液流的流动池51(参照图6)。流动池51由有透光性的石英、玻璃、合成树脂等的材料构成为管状,其内部成为流通测定样品及作为鞘液的DC测定用稀释液的流路。在此流动池51设有,内部空间较其他部分狭窄的孔口51a。另外,孔口51a的入口附近成为双管结构,其内侧管部分成为样品喷嘴51b,经其供给在室22等中调制的测定样品(图7)。另外,样品喷嘴51b的外侧的空间是流通作为鞘液的DC测定用稀释液的流路51c,作为鞘液的DC测定用稀释液在流路51c流通,被导入孔口51a。如此向流动池51供给的作为鞘液的DC测定用稀释液以包围自样品喷嘴51b吐出的测定样品的方式流动。进而,由孔口51a而测定样品的流动变狭窄,测定样品中所含的白细胞、红细胞等的粒子被作为鞘液的DC测定用稀释液裹着1个1个地通过孔口51a。另外,在光学测定部5中,半导体激光源52配置为向流动池51的孔口51a发射激光。此半导体激光源52有蓝紫色半导体激光元件52a,构成为能发射波长约405nm的蓝紫色激光。另外,在半导体激光源52和流动池51之间配置有由多个透镜组成的照射透镜系统53。成为由此照射透镜系统53而自半导体激光源52发射的平行光束聚光为光束点。另外,在自半导体激光源52直线延伸的光轴上,光束遮挡器54a被设为夹流动池51而面对照射透镜系统53,光束遮挡器54a构成为对来自半导体激光源52的直接光进行遮光。另外,在光束遮挡器54a的光轴下游侧还配置有光电二极管54。光电二极管54构成为接收由流过流动池51的测定样品发生的激光的散射光。具体而言,在沿自半导体激光源52直线延伸的光轴进行的光之中,由于半导体激光源52的直接光被光束遮挡器54a阻断,由此光电二极管54构成为仅接收大致沿光轴方向行进的散射光(以下也称为前方散射光)。另外,光电二极管54构成为,对由流动池51发的前方散射光进行光电变换,将由此发生的电信号(以下称为前方散射光信号)传递到扩增器54b。进而,扩增器54b构成为扩增传递的前方散射光信号,输出到控制部8。再者,光信号的增益(扩增率)或光接收灵敏度等可由本领域技术人员适宜设定或改变。再者,改变增益是指取得光信息时,变更扩增器54b及/或58b的扩增率。另外,在流动池51的侧方、对于自半导体激光源52向光电二极管54直线性地延伸的光轴直交的方向配置有侧方聚光透镜55,此侧方聚光透镜55构成为对向通过流动池51内的血细胞照射激光时发生的侧方光(向对于上述光轴交叉的方向发射的光)聚光。在侧方聚光透镜55的下游侧设有二向色镜56,二向色镜56构成为将自侧方聚光透镜55发送的信号光分为散射光成分和荧光成分。在二向色镜56的侧方(与连接侧方聚光透镜55和二向色镜56的光轴方向交叉的方向)设有侧方散射光光接收用的光电二极管57,在二向色镜56的光轴下游侧设有光学滤器58a及雪崩光电二极管58。另外,光电二极管57构成为,对用二向色镜56分光的侧方散射光成分进行光电变换,将由此发生的电信号(以下称为侧方散射光信号)传递到扩增器57a。进而,扩增器57a构成为扩增传递的侧方散射光信号,输出到控制部8。再者,光信号的增益(扩增率)或光接收灵敏度等可由本领域技术人员适宜设定或改变。再者,由于在本实施方式的疟疾检测中不使用经光电二极管57及扩增器57a而得到的侧方散射光信息,因此不能说其对于本发明的血液分析装置的构成是必须的,但具备光电二极管57及扩增器57a的流式细胞仪是更常规的。除了疟疾检测之外,在进行红细胞数测定或血染料量测定等时,可使用经光电二极管57及扩增器57a而得到的侧方散射光信息。另外,雪崩光电二极管58构成为对由光学滤器58a选择波长后的侧方荧光成分进行光电变换,将由此发生的电信号(侧方荧光信号)传递到扩增器58b。进而,扩增器58b构成为扩增传递的侧方荧光信号,输出到控制部8。再者,光信号的增益(扩增率)或光接收灵敏度等可由本领域技术人员适宜设定或改变。DC测定部6构成为能由鞘流DC检测法测定红细胞数(RBC)及血小板数(PLT)。另外,DC测定部6构成为也能由红细胞脉冲波高值检测法得到用于算出血细胞容量值(HCT)的测定数据。另外,DC测定部6有流动池,构成为自室22向此流动池移送测定样品。例如,如图9所示,在室22中血液和DC测定用稀释液混合调制的测定样品与作为鞘液的DC测定用稀释液一同自样品供给部4被移送到流动池。进而,在流动池内,形成测定样品被作为鞘液的DC测定用稀释液包围的状态的液流。再者,由于在本实施方式的疟疾检测中不使用DC测定部6,因此不能说其对于本发明的血液分析装置的构成而言是必须的,但具备DC测定部6的血液分析装置是更一般的。特别是,除了疟疾检测之外,在进行红细胞数测定等时,或基于红细胞数算出疟疾感染率时,优选为具备DC测定部6。在使用DC测定部6算出红细胞数时,测定样品,如图9所示,优选由DC测定用稀释液稀释。HGB测定部7构成为由正铁血红蛋白法测定血染料量(HGB)。HGB测定部7,如图10所示,有收容稀释样品的池,构成为自室22向此池移送测定样品。进而,HGB测定部7有照射波长约555nm的光的发光二极管,构成为通过向上述池中的测定样品照射来自发光二极管的光,测定其吸光度。再者,由于在本实施方式的疟疾检测中不使用HGB测定部7,因此不能说对本发明的血液分析装置的构成而言是必须的,但具备HGB测定部7的血液分析装置是更一般的。除了疟疾检测之外,在进行血染料量测定等时,可使用HGB测定部7。控制部8由CPU、ROM、RAM等构成,构成为进行测定单元2的各部的动作控制。通信部9,例如,是RS-232C接口、USB接口、Ethernet(注册商标)接口,构成为在与数据处理单元3之间能进行数据的发送接收。数据处理单元3,如图2所示,由具备CPU31、ROM32、RAM33、硬盘34、通信接口35、键盘及鼠标等的输入部36、及展示装置37的计算机构成。在数据处理单元3的硬盘34上安装有操作系统和用于分析处理自测定单元2接收的测定数据的应用程序。在本实施方式中,数据处理单元3的CPU31构成为通过实行此应用程序,分析处理测定数据,使用前方散射光信号及侧方荧光信号制成散点图。通信接口35,例如,是RS-232C接口、USB接口、Ethernet(注册商标)接口,构成为在与测定单元2之间能进行数据的发送接收。接下来,参照图11,对于血液分析装置1中的样品分析处理的一实施方式说明。首先,一旦血液分析装置1起动,则在进行应用程序等的初期化后,在步骤S1中,由数据处理单元3的CPU31判断是否有来自使用者的测定开始指示,重复此判断至有指示。进而,在有测定开始指示时,在步骤S2中,自数据处理单元3向测定单元2发送测定开始指示信号。进而,在步骤S21中,由测定单元2的控制部8判断是否接收到测定开始指示信号,重复此判断至接收。当测定单元2接收测定开始指示信号时,在步骤S22中,由移液器21自设置于采血管设置部2a的采血管20抽吸血液。进而,在步骤S23中,由样品供给部4调制测定样品。具体而言,通过向室22或23中供给含血液、荧光染料的染色液、待测样品稀释液及根据需要的DC测定用稀释液,在室22或23内混合来调制测定样品。也可通过将室22或23加温及/或振荡而整备测定样品的调制温度或搅拌速度等的调制条件。其后,在步骤S24中,室22或23内的测定样品与作为鞘液的DC测定用稀释液一同被移送到光学测定部5,由光学测定部5进行疟疾检测。除了疟疾检测之外,进行红细胞检测时,红细胞检测用的测定样品与作为鞘液的DC测定用稀释液一同移送到DC测定部6,由DC测定部6进行红细胞检测。除了疟疾检测之外,在进行血染料(HGB)检测时,血染料检测用的测定样品被移送到HGB测定部7,由HGB测定部7进行血染料检测。进而,在步骤S25中,在各检测部测定的测定数据自测定单元2被发送到数据处理单元3。在数据处理单元3中,在步骤S3中,判断是否接收到测定单元2发送的测定数据,重复此判断至接收。进而,如果接收测定数据,则在步骤S4中,由CPU31,基于由在步骤S24中测定的疟疾检测的测定数据,将疟疾感染红细胞自疟疾感染红细胞以外的集团分类。具体而言,CPU31使用前方散射光信号及侧方荧光信号制成散点图,根据此散点图自疟疾感染红细胞以外的集团分类疟疾感染红细胞。更具体而言,在散点图中,未被疟疾感染的红细胞呈现在荧光强度小的区域,另一方面,疟疾感染红细胞呈现在荧光强度比较大的区域。另外,白细胞,由于其尺寸及DNA量,呈现在荧光强度及散射光强度均大的区域。由此,判断疟疾感染的有无变得可能。另外,由以往技术无法达成的疟疾感染红细胞数的测定也变得可能。在步骤S24中进行红细胞检测及/或血染料检测时,也可基于它们的测定数据,算出红细胞数及/或血染料量。在进行疟疾感染红细胞检测及红细胞检测这两者时,也可基于它们的测定数据,算出疟疾感染红细胞比率。疟疾感染红细胞比率可由以下的式算出。【数1】(疟疾感染红细胞比率)=(疟疾感染红细胞数)/(红细胞数)×100(单位:%)其后,在步骤S6中,判断来自使用者的关闭指示的有无,在无指示时,进到步骤S1。在有关闭指示时,血液分析装置1中的样品分析处理的数据处理单元3的动作结束。另外,在测定单元2侧,在步骤S25中将测定数据发送到数据处理单元3后,在步骤S26中,判断是否有来自使用者的关闭指示,在无指示时,进到步骤S21。在有关闭指示时,血液分析装置1中的样品分析处理的测定单元2的动作结束。接下来,由实施例详细地说明本发明,但本发明不限于这些实施例。【实施例】【比较例1】向添加培养疟疾原虫(自国立大学法人大阪大学微生物病研究所得到;以下有称为“疟疾”时)的人全血(ACD采血·O型)(GoldenWest公司制)17μl添加染色液20μl及待测样品稀释液1ml,于41℃20秒钟混合,调制测定样品。染色液及待测样品稀释液如下调制。待测样品稀释液使用以下的组成。【表1】月桂基三甲基铵氯化物2.95mM硬脂基三甲基铵氯化物1.11mMPBC-44(非离子系表面活性剂)2.90mMADA20mM(pH6.1)NaCl适量(277mOsm)纯化水1L染色液使用在乙二醇1ml中溶解了荧光染料(Hoechst34580、Sigma-Aldrich公司)的染色液。再者,使用各染色液调制下述的测定样品时的测定样品中的浓度也示于以下的表2。【表2】Hoechst34580乙二醇测定样品中的浓度染色液150μg1ml1.80μM染色液2500μg1ml18.0μM使用作为光源有405nm的蓝色发光二极管的流式细胞仪取得对如上所述调制的测定样品的前方散射光信号及侧方荧光信号,基于得到的信号制成散点图。将Hoechst34580的测定样品中的浓度设为比专利文献1中记载的1.80μM高的18.0μM而检测疟疾感染红细胞的结果示于图12。由于Hoechst34580是核酸染色染料,所以预计比不含核酸的红细胞,更好地染色含核酸的白细胞或疟疾感染红细胞。在图12中,右上显示的表示为“WBC”的集团是白细胞的集团,自左下至中央显示的表示为“疟疾”的集团是疟疾感染红细胞的集团,呈现在疟疾感染红细胞的左侧的集团是疟疾非感染红细胞的集团。在图12中,白细胞(WBC)如预计荧光强度升高,散点图的出现位置向右移动。但是,疟疾感染红细胞(疟疾)的荧光强度的升高少,相反与因高浓度的Hoechst34580受到影响而荧光强度升高的疟疾非感染红细胞的分离性恶化。【实施例1】使用以下的表3所示的组成的染色液,进行与比较例1同样的实验。【表3】Hoechst34580乙二醇测定样品中的浓度染色液150μg1ml1.80μM染色液312.5μg1ml0.45μM将Hoechst34580的测定样品中的浓度设为比专利文献1中记载的1.80μM低的0.45μM而检测疟疾感染红细胞的结果示于图13。从图13可知,通过使用低浓度(0.45μM)的Hoechst34580,疟疾感染红细胞与疟疾非感染红细胞的分离性提高。再者,在图13等中,疟疾感染非红细胞的前方散射光比疟疾感染红细胞的变得更大,但这缘于为了排除正常红细胞而排除荧光强度在指定的阈值以下的粒子,另外,发无法由此遮断的RET等的若干的荧光的正常红细胞显示在散射仪上。接下来,改变增益而取得的散点图示于图14。在图14中也可确认,在使用0.45μM的Hoechst34580时,疟疾感染红细胞和疟疾非感染红细胞良好地分离。在图14中,通过改变增益,在使用1.80μM的Hoechst34580时的散点图中,在与0.45μM的情况大致相同的位置可确认白细胞集团。比较1.80μM的散点图和0.45μM的散点图,则在1.80μM的散点图中确认疟疾感染红细胞与疟疾非感染红细胞的分离。另一方面,在0.45μM的散点图中可确认,疟疾感染红细胞和疟疾非感染红细胞更良好地分离。在以下的实施例2及3中,对于使用1.80μM的Hoechst34580时的散点图,显示改变增益而取得的散点图。【实施例2】代替疟疾感染人全血,使用自感染疟疾并且网织红细胞(RET)值高的患者采集的血液,进行与实施例1同样的实验。结果示于图15。自图15可知,在用专利文献1中记载的1.80μM的Hoechst34580时,疟疾感染红细胞以外的粒子和疟疾感染红细胞重叠,但通过使用低浓度(0.45μM)的Hoechst34580,疟疾感染红细胞与其他粒子的分离性提高。【实施例3】代替疟疾感染人全血,使用自疟疾的感染率低的患者采集的血液,进行与实施例1同样的实验。结果示于图16。从图16可知,在专利文献1中记载的1.80μM的Hoechst34580中,疟疾感染红细胞与疟疾非感染红细胞的辨别是困难的,与此相对,通过使用低浓度(0.45μM)的Hoechst34580,可更明确地确认疟疾感染红细胞的存在。【比较例2】代替Hoechst34580,利用使用4',6-二脒-2-苯基吲哚二氢氯化物(DAPI、LifeTechnologies公司)调制的以下的表4所示的组成的染色液,进行与实施例1同样的实验。【表4】DAPI乙二醇测定样品中的浓度染色液410μg1ml0.43μM染色液520μg1ml0.87μM结果示于图17A及B。DAPI与Hoechst34580同样是DNA选择性荧光染料,但确认不到通过使浓度降低而进行的疟疾感染红细胞与疟疾非感染红细胞的分离性提高。因此得知,随浓度降低的疟疾感染红细胞与疟疾非感染红细胞的分离性提高的效果见于以指定浓度使用Hoechst34580时。【实施例4】使用有以下的表5所示的组成的染色液,进行与实施例1同样的实验。再者,调制测定样品时,添加染色液至成表5的右栏所示的“测定样品中的浓度”的值。【表5】结果示于图18A~J。从图18A~J得知,自0.18μM起疟疾感染红细胞与疟疾非感染红细胞的分离变得可能。另外得知,白细胞(WBC)随着Hoechst34580的浓度升高而荧光强度升高而分布向坐标图右侧移动(0.89μM在坐标图右侧饱和)。另一方面得知,自0.36μM起即使浓度升高,疟疾感染红细胞的荧光强度的升高也低,几乎无分布的移动,与此相对,由于伴随浓度升高而疟疾非感染红细胞的荧光强度升高,如果使浓度过度升高,则疟疾感染红细胞和疟疾非感染红细胞变得难以分离。这些结果表明,如果测定样品中的荧光染料浓度过低,则疟疾感染红细胞的荧光强度不充分,所以难以分离疟疾感染红细胞与疟疾非感染红细胞,相反如果过高,则疟疾非感染红细胞的荧光强度与疟疾感染红细胞近似,所以疟疾感染红细胞和疟疾非感染红细胞变得难以分离。从而认为,测定样品中的荧光染料的浓度只要是0.15μM以上1.0μM以下,就能实现疟疾感染红细胞与疟疾非感染红细胞的良好的分离。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1