一种测定脂质囊泡中蛋白或多肽类药物包封率的方法与流程
本发明涉及一种测定脂质囊泡中蛋白或多肽类药物包封率的方法,属于药物分析技术领域。
背景技术:
多肽、蛋白类药物脂质囊泡的研究是当前一个十分活跃的领域。脂质囊泡是由脂质组成、内部为水相的闭合囊泡,其内水相和膜内分别可包裹亲水和疏水性物质。根据组成的不同,脂质囊泡有脂质体、传递体、类质体、醇质体等种类,但其结构均为球形闭合囊泡。蛋白口服后会受到胃肠道酸、碱条件,体液及酶的破坏而发生降解和失活。而以脂质囊泡为载体口服后由于脂质双层的保护作用,可降低各种因素对蛋白类药物的降解程度,提高药物的稳定性;同时口服脂质囊泡还具有种类多样,选择性和辅佐性强,不良反应低的特点,尤其作为黏膜免疫抗原载体而倍受青睐。目前包封率是脂质囊泡质量评价中的重要指标之一。目前报道的测定方法有以下几种:(1)透析法:利用半透膜分子大小差别,通过及时更换外相达到分离的目的。该方法简单、准确、重复性好,缺点是耗时较长,所耗介质较多,易造成药物渗漏。(2)超速离心法:利用自由药物与含药脂质囊泡的重力差异进行分离。但该方法成本较高,且各批样品间重现性差,由于离心力较大会使脂质囊泡中药物渗漏丢失而导致药物的包封率偏低。(3)凝胶柱色谱法:常用的色谱柱为葡聚糖凝胶 (Sephadex) 柱和琼脂糖凝胶 (Sepharose)柱,利用脂质囊泡和游离药物相对分子质量的差异进行分离,但存在洗脱时间长、洗脱体积大、药物浓度低等问题。(4)超滤膜过滤法:利用游离药物能通过滤膜,而含药脂质囊泡被截留在滤膜上来分离游离药物与脂质囊泡。该方法的缺点是膜上药物体积小,膜对药物的吸附较强,导致包封率偏高。上述各种脂质囊泡药物包封率测定法存在一个共同的问题,即所得包封率均存在一定的误差。如透析法、层析法及滤膜法,都是利用分子大小差异进行分离,故较难将脂质囊泡与药物晶体和/或脂质囊泡碎片分离,影响包封率测定的结果;且三种方法都耗时较长,与药物浓度有很大关系,在层析柱或者滤膜的选择上也存在困难;离心法虽相对测量速度较快,但易造成脂质囊泡中药物的渗漏,对仪器存在明显依赖,使用成本较高。因此,非常有必要寻找其他的测量方法,既快速简便,又能准确地反映药物的包封情况。
目前实验室研究测定蛋白质含量的常用方法主要有Folin-酚试剂法( Lowry法)、考马斯亮蓝(Coomassie Brilliant Blue G-250,CBB) 染色法,二喹啉甲酸(Bicinchoninic acid,BCA)法等,其中Lowry法与BCA法属于化学法。Lowry法的测定原理为蛋白质与碱性硫酸铜作用形成铜-肽键络合物,后者与色氨酸和酪氨酸共同作用使酚试剂中的磷钼酸和磷钨酸还原生成蓝色化合物;BCA 法的测定原理为蛋白质价铜离子还原成亚铜离子,后者在碱性溶液中与BCA 结合生成紫红色络合物。Bradford 法属于染料结合法,即考马斯亮蓝 G-250在酸性溶液中呈红棕色,与蛋白质结合后转变为蓝色,颜色深浅与蛋白浓度呈正比关系。
各种方法测定蛋白浓度的范围如下:Lowry法标准蛋白浓度设置范围为10~100 μg/mL;BCA 法标准蛋白浓度设置在20~1000 μg/mL;Bradford法为31.25~2000 μg /mL。每种方法都有其优点和局限性,在蛋白质样品中往往会含有一些化学试剂,会干扰蛋白浓度测定。影响 Lowry法测定蛋白的主要因素有某些氨基酸、非离子表面活性剂、蔗糖、含硫化合物;影响 BCA法测蛋白的主要因素有蔗糖、尿素、EDTA,影响Bradford法的主要因素有甘油、乙酸、去污剂和一些碱性缓冲系统。对于脂质囊泡蛋白药物而言,选择BCA法可以减少非离子表面活性剂对蛋白浓度检测时的干扰。据文献报道,BCA法测定蛋白浓度不受绝大部分样品中的化学物质的影响,可以兼容样品中高达5%的SDS、Triton X-100、Tween-20、Tween-60、Tween-80等表面活性剂。
技术实现要素:
本发明的目的是解决现有脂质囊泡中蛋白或多肽类药物包封率测定方法的不足,提供一种快速简便的包封率计算方法。
根据本发明的包封率计算方法,其特征在于,利用脂质囊泡内外蛋白或多肽与显色试剂的反应速率差异实现包封率的计算,所述方法包括以下步骤:
(1)常规制备包裹有蛋白或多肽的脂质囊泡溶液;
(2)将步骤(1)中的脂质囊泡溶液中的总蛋白浓度稀释到合适范围内;
(3)取一定量步骤(2)中的脂质囊泡溶液,加入破乳剂,使脂质囊泡溶解;
(4)将步骤(2)和步骤(3)的脂质囊泡溶液,分别按每孔20 μL加至96孔板,再在每孔中加入200 μL 能与蛋白或多肽进行显色反应的试剂;
(5)在步骤(4)96孔板的标准品孔中分别加入0.5 mg/mL的牛血清白蛋白标准品,按0、1、2、4、8、12、16、20 μL加样,再加入200 μL能与蛋白或多肽进行显色反应的试剂;
(6)将步骤(4)和(5)的96孔板在一定温度下反应一段时间,直至出现颜色变化;
(7)将步骤(6)的96孔板放置于酶标仪,选择562 nm处读取吸光度值。根据标准曲线计算步骤(4)各孔蛋白浓度。
(8)根据公式 脂质囊泡蛋白包封率=(C总-C游)/C总×100%
计算包封率,式中,C总表示破乳脂质囊泡的蛋白总浓度,C游为未处理脂质囊泡所测得的蛋白浓度。
其中,步骤(1)所述脂质囊泡中包裹的物质可替换为其他能与检测试剂发生相互作用的物质;所述脂质囊泡,系能够形成囊泡结构的脂质分子,其成分包括磷脂、胆固醇、表面活性剂和其他类脂分子等。
步骤(2)所述脂质囊泡稀释后的总蛋白浓度范围应处于20~1000 μg/mL。
步骤(3)所述破乳剂为包括且不限于Triton X-100、Tween 20或Tween 80等非离子表面活性剂和其他类型的破乳剂;所述破乳剂终浓度为0.1%~0.5%。
步骤(4)或(5)中所述能与蛋白或多肽进行显色反应的试剂为BCA反应试剂;
所述BCA反应试剂由购于上海碧云天生物技术有限公司的BCA蛋白浓度测定试剂盒中的按50体积BCA试剂A加1体积BCA试剂B(50:1)配制而成。
步骤(6)中所述反应温度为37 ºC~60ºC;所述反应时间为20~40分钟;
其中的96孔板也可以换成普通石英比色皿进行检测。
与现有技术相比较,本发明具有如下有益效果:
本发明方法可避免常规的游离蛋白/多肽分子的分离或去除步骤,能一步快速直接测量出脂质囊泡中游离蛋白和总蛋白的含量,从而计算出脂质囊泡中的蛋白包封率,适合大规模脂质囊泡包裹蛋白/多肽的处方工艺筛选时,包封率的快速测定和比较。其原理是BCA反应试剂中含有铜离子,已知二价铜离子在碱性的条件下,被蛋白质还原成一价铜离子,一价铜离子和二喹啉甲酸(BCA)相互作用产生敏感的颜色反应。两分子的BCA螯合一个铜离子,形成紫色的反应复合物。该水溶性的复合物在562 nm处显示强烈的吸光性,吸光度和蛋白浓度在广泛范围内有良好的线性关系,因此由吸光值可以推算出蛋白浓度。根据上述反应原理,一方面利用脂质囊泡外游离蛋白的催化作用,使BCA与铜离子发生显色反应,根据吸光度值可以计算出游离蛋白的浓度C游;另一方面,由于脂质囊泡结构的密封性,铜离子无法顺利与脂质囊泡内的包裹蛋白发生作用,只有当通过表面活性剂对脂质囊泡进行溶解破坏,释放出脂质囊泡中包裹的蛋白之后,才能与游离蛋白一起与铜离子和BCA发生化学显色反应,从而再根据吸光度值获得总蛋白的浓度C总,因此根据以下公式可达到快速计算脂质囊泡蛋白药物包封率的目的。
脂质囊泡蛋白包封率=(C总-C游)/C总×100%
另外,该法还可用于评价游离蛋白的分离效果。例如,用透析或离心超滤管将游离蛋白除去后,可对处理后的脂质囊泡取样直接加入显色剂,并另取样加表面活性剂破乳后再加显色剂,如两者所测得的数值差别明显,表明所用分离方法对游离蛋白的清除效果较好,即分离有效,反之则反;同时可以据此计算出分离后游离蛋白的残余量,如图4所示。
综上所述,根据本发明提供了一种联合BCA检测蛋白原理和表面活性剂对脂质囊泡蛋白药物包封率的方法。该方法解决了常规方法在测量脂质囊泡蛋白药物包封率时,需要预先分离游离蛋白药物的问题,省时省力。利用酶标仪和该方法,可进行大规模脂质囊泡蛋白药物包封率的测定和计算,操作方便,重复性好,为需要脂质囊泡蛋白药物的相关生产应用和研究领域提供了一项有效的方法依据。
附图说明
图1为本发明脂质囊泡蛋白包封率测定原理示意图;
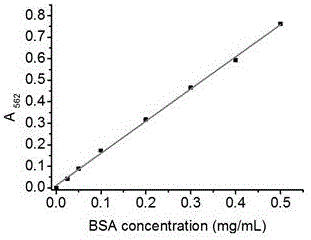
图2为本发明实施例1中脂质囊泡蛋白浓度测量标准曲线;
图3为本发明实施例2中脂质囊泡总蛋白浓度(+Triton X-100)和游离蛋白浓度(-Triton X-100)测量值随时间变化结果;
图4为本发明实施例3使用离心超滤法(UF)分离游离蛋白后,起始总蛋白浓度(Initial+Triton)与超滤分离后总蛋白浓度(UF+Triton)测量值随时间变化结果。
具体实施方式
本发明实施例中所述BCA反应试剂由购于上海碧云天生物技术有限公司的BCA蛋白浓度测定试剂盒中的按50体积BCA试剂A加1体积BCA试剂B(50:1)配制而成。
实施例1:
按常规反相蒸发法制备包裹牛血清白蛋白(BSA)的脂质体,具体如下:称取20 mg大豆卵磷脂与5 mg胆固醇,用9 mL乙醚溶解后加至圆底烧瓶,加入3 mL 1 mg/mL 的牛血清白蛋白(BSA)溶液,水浴超声2~5分钟形成稳定的白色乳悬液,旋转蒸发仪蒸干除去有机溶剂,取出剩余液体,冰水浴探头超声处理,至溶液变澄清即得脂质体溶液。将脂质体溶液稀释10倍后浓度为0.1 mg/mL。取96孔板,将稀释后的脂质体溶液按每孔20 μL加样;另取稀释后的脂质体溶液,加入Triton X-100至终浓度为0.5%,同样按每孔20 μL加样;标准品孔中每孔加入0.5 mg/mL的BSA标准品,按0、1、2、4、8、12、16、20 μL加样,不足20 μL加标准品稀释液补足;所有孔加200 μL BCA反应试剂后,在40 ºC放置40 min出现颜色改变,迅速置于酶标仪,选择562 nm处读取吸光度值。根据标准孔的蛋白浓度和相应吸光值绘制标准曲线,如附图2所示,经线性拟合后所得回归方程为 y=0.015+1.483 x (y为吸光度,X为蛋白浓度,单位为mg/mL),再根据此方程计算样品浓度。以加Triton X-100的脂质体孔所得为总蛋白浓度C总= 0.455,以无Triton X-100的脂质体孔所得为游离蛋白浓度C游= 0.176,根据公式计算包封率为61.2%。
脂质囊泡蛋白包封率=(C总-C游)/C总×100%
实施例2:
按常规薄膜分散法制备包裹牛血清白蛋白(BSA)的传递体,具体如下:称取30 mg大豆卵磷脂,6 mg胆固醇,2 mg脱氧胆酸钠,用适量氯仿溶解后加至圆底烧瓶,旋转蒸发仪蒸干除去有机溶剂,使烧瓶底部形成一均匀的薄膜;将烧瓶置于真空干燥器抽真空至少3小时,以完全除去残余的有机溶剂,加入5 mL 1 mg/mL 的BSA溶液,振荡使薄膜水化,水浴超声处理30分钟,至溶液变澄清即得传递体溶液,取适量传递体溶液稀释10倍备用。取96孔板,将稀释后的传递体溶液按每孔20 μL加样;另取稀释后的传递体溶液,加入Triton X-100至终浓度为0.25%,同样按每孔20 μL加样;标准品孔中每孔加入0.5 mg/mL的BSA标准品,按0、1、2、4、8、12、16、20 μL加样,不足20 μL加标准品稀释液补足;所有孔加200 μL BCA反应试剂后,在50ºC放置20 min,迅速置于酶标仪,选择562 nm处读取吸光度值。每隔10 min扫板一次,连续记录一个小时,之后在室温下,显色后第3、7、24小时复扫一次,记录不同时间下的吸光度变化。根据每次测量所得标准曲线计算各孔蛋白浓度,如附图3所示为游离蛋白浓度(-Triton X-100)与总蛋白浓度(+Triton X-100)的时间变化曲线。该图可看出当测量时间超过1h后,游离蛋白和总蛋白浓度的开始发生明显改变,因此需要选取在1h内所测值,根据公式计算包封率。此例中,根据测量30分钟时所得数值进行包封率的计算,以加Triton X-100的传递体孔所得为总浓度C总= 0.434,以无Triton X-100的传递体孔所得为游离浓度C游= 0.298,根据公式计算包封率为31.2%。
脂质囊泡蛋白包封率=(C总-C游)/C总×100%
实施例3:
按照实施例1制备脂质体溶液,取1 mL脂质体溶液采用截留分子量为100 kD的超滤离心管将游离的蛋白通过离心除去,再用终浓度为0.1% Triton X-100将分离前后的脂质体破乳,各取20 μL,加200 μL BCA反应试剂后,在50ºC放置20 min,迅速置于酶标仪,选择562 nm处读取吸光度值。同样每隔10 min扫板一次,连续记录一个小时,之后在室温下,显色后第3、7、24小时复扫一次,记录不同时间下的吸光度变化。根据每次测量所得标准曲线计算各孔蛋白浓度,如附图4所示为起始总蛋白浓度(Initial+Triton)与超滤分离后总蛋白浓度(UF+Triton)的时间变化曲线。该图可看出经过超滤离心后,总蛋白浓度明显降低,且数值不随时间的改变而改变,说明游离蛋白的分离效果很好,本实施例选取在30 min时所测值,起始总蛋白浓度为0.375,分离后总浓度值为包裹蛋白浓度C包=0.148,根据公式计算包封率为39.5%。
脂质囊泡蛋白包封率=C包/C总×100%
实施例4:
将牛血清白蛋白换用卵清蛋白,按实施例2制备传递体溶液。对所制备的脂质体溶液,先采用截留分子量为100 kD的透析袋透析除去游离的卵清蛋白,再取一定量分离前后的传递体溶液用终浓度0.5 % Tween 80破乳,如实施例3所述加BCA反应试剂显色,测得包裹蛋白浓度C包,根据公式计算包封率为38.2%。
脂质囊泡蛋白包封率=C包/C总×100%
实施例5:
将牛血清白蛋白换用人血清蛋白,按实施例1制备脂质体溶液。对所制备的脂质体溶液,采用凝胶色谱柱分离除去游离的卵清蛋白,再取分离前后一定量脂质体溶液,用终浓度0.5 % Tween 20破乳,如实施例4分别加入BCA反应试剂,显色,测得包裹蛋白浓度C包,根据公式计算包封率为66.7%。
脂质囊泡蛋白包封率=C包/C总×100%
实施例6:
将牛血清白蛋白换用人血清白蛋白,按实施例2制备脂质体溶液,计算包封率。同时,对所制备的脂质体溶液,采用常规超速离心法将脂质体与游离蛋白分开,再取一定量上清,加BCA反应试剂,显色,测得游离蛋白浓度C游,根据公式计算包封率为35.4%。
脂质囊泡蛋白包封率=(C总-C游)/C总×100%
- 还没有人留言评论。精彩留言会获得点赞!