一种用于ADRB1‑1165G>C基因多态性检测的电化学传感器制备方法与流程
本发明涉及一种在临床上指导华法林用药的ADRB1-1165G>C基因多态性检测的电化学传感器的制备方法及应用,尤其是基于二氧化铈纳米复合材料作为信号探针制备的夹心型生物传感器,用于检测ADRB1-1165G>C基因多态性,属于电化学检测领域。
背景技术:
:
美托洛尔作为常用的β受体阻滞剂,常用于治疗高血压、心绞痛、心肌梗死、心律失常、心脏神经官能症等。然而,由于缺乏病人的个体遗传信息支持而导致每个病人对美托洛尔预测剂量可能偏高或偏低。因此,针对个体差异来精确调整美托洛尔的用药剂量是非常必要的。这种用药差异因素是由针对美托洛尔作用靶位点和个体的药物代谢酶的基因型来决定的。研究表明,β1肾上腺素受体(ADRB1)多态性对美托洛尔的用药剂量有很大的影响,而多态性主要表现为145A>G和1165G>C,其中,1165G>C突变导致编码蛋白389位由甘氨酸变为精氨酸(Gly389Arg)使美托洛尔的用量高于其他基因型个体。基于此,基因型可以被简化为通过使用-1165G>C多态性作为预测美托洛尔药效敏感性主要标志物。因此,依据病人的基因型来精确调整不同个体美托洛尔的用药剂量,进而防止副作用的发生非常重要。
传统对于ADRB1突变基因的检测主要依赖于聚合酶链式反应(PCR)和测序的方法。然而PCR的方法容易受到生物样品中复杂成分的影响,检测效率低和易出现假阳性而使其应用受到了限制。而DAN测序不仅需要专门的仪器设备,训练有素的工作人员而且检测过程繁琐费时,因此不适用于常规临床检测。最为主要的是,患者样品中突变序列相对于高水平野生型序列显得寡不敌众,很难获得较高的特异性。因此制备灵敏度高,特异性强的检测方法对于患者样品中低丰度突变基因的检测显得至关重要。近年来,基于纳米材料电化学生物传感器由于简便,快速,成本低,灵敏度高等优势而被广泛应用于生物样品的检测。
在电化学生物分析中,信号放大对于提高DNA传感器的灵敏度是非常重要。但是核酸分子由于其本质是惰性分子,在生物测定反应中不能作为氧化还原电对。因此,氧化还原分子的有效固定在夹心型DNA生物传感器的构建中对于决定传感器的线性范围和检测限是关键的步骤。最近,纳米材料本身用作为氧化还原探针已被广泛研究,因为它不仅可有效克服氧化还原分子的泄漏,而且做为纳米载体可提高生物分子的固载量。二氧化铈(CeO2),由于其独特的催化活性和表面氧空位高的迁移率而备受关注。最重要的是,CeO2具有一定的催化过氧化氢的能力其表面的氧空位有利于催化反应,这使其可作为理想的物质用于构建夹层型生物传感器。
本发明基于CeO2纳米复合材料构建氧化还原探针,建立了一种ADRB1-1165G>C基因多态性检测的电化学DNA生物传感器的制备方法与应用,为华法林的个体化用药提供了证据。
技术实现要素:
:
本发明的目的是提供一种指导华法林用药的ADRB1-1165G>C基因多态性检测的电化学DNA生物传感器的制备方法与应用,其特征包括以下步骤:
(1)氧化石墨烯(GO)-二氧化铈(CeO2)-铂纳米粒子(PtNPs)-单链脱氧核糖核酸(ssDNA)检测探针的制备;
(2)建立电化学DNA生物传感器,测定ADRB1-1165G>C基因,绘制标准曲线。;
本发明所述GO-CeO2-PtNPs-ssDNA复合物的制备过程具体包括以下步骤,其特征在于包括以下步骤:
(1)GO-CeO2纳米复合材料的制备:
首先10mg GO分散于5mL超纯水中形成悬浊液,其次10mL,0.025M Ce(NO3)3·6H2O与10mL,0.025M乌洛托品(HTMA)混合,然后将上述两种混合好的溶液置于80℃水浴加热反应5h,所得溶液经10000r/min,离心5分钟,用超纯水和乙醇分别清洗3次,所得沉淀在恒温干燥箱中60℃减压干燥,备用。
(2)氨基化的GO-CeO2纳米复合材料的制备:
20mg GO-CeO2分散于5mL无水乙醇,接着加入0.1mL氨丙基三乙氧基硅烷(APTES),70℃回流加热1.5h。上述溶液冷却至室温后,经8000r/min,离心5分钟,用超纯水清洗3次。所得沉淀在恒温干燥箱50℃干燥12h,备用。
(3)GO-CeO2-PtNPs复合物的制备:
1mL H2PtCl6(1%)加入1mL,2mg mL-1氨基化的GO-CeO2溶液中,超声10min,接着逐滴加入2mL,0.1M NaBH4于磁力搅拌器上搅拌反应30min。经10000r/min,离心5min,用超纯水清洗3次,所得沉淀溶于1mL超纯水中备用。
(4)GO-CeO2-PtNPs-ssDNA复合物的制备:
用100倍多余的TCEP室温处理巯基修饰的单链DNA,1h。将处理后的检测探针加入GO-CeO2-PtNPs溶液中4℃搅拌过夜后离心,并用PBS(0.1M,pH=7.4)清洗。将合成的GO-CeO2-PtNPs重新分散在1mL杂交液中,4℃保存备用。
本发明中所述的建立电化学DNA生物传感器,测定ADRB1-1165G>C基因的DNA片段,绘制标准曲线,其特征在于包括以下步骤:
(1)分别用0.3和0.05μm的Al2O3粉末将电极抛光成镜面,然后分别按超纯水、无水乙醇、超纯水的顺序超声电极各5min,室温干燥备用;
(2)将干燥后的电极浸入1%的氯金酸溶液中,恒压法-0.2V沉积30s。
(4)用超纯水将电极冲洗干净后滴加10μL,100μg mL-1亲和素溶液并置于4℃孵育12h。
(5)用超纯水将孵育后的电极冲洗干净后滴加10μL,1μM亲和素标记的DNA捕获探针溶液,4℃孵育12h。
(6)用超纯水将孵育后的电极冲洗干净后滴加6μL,1%的BSA溶液室温孵育30min。
(7)将上述BSA封闭后的电极用清洗缓冲液(10mM Na2HPO4,2mM KH2PO4,37mM NaCl,2.7mM KCl,pH 7.4)冲洗并在氮气中干燥。
(8)将不同浓度的目标DNA滴加在电极上并置于37℃杂交2h。
(9)在干燥后的电极上滴加10μL检测探针混合液置于37℃孵育2h。
(10)将孵育后的电极用清洗缓冲液冲洗干净后置于氮气中干燥。
(11)将电极置于7mL,0.1M PBS(0.1M Na2HPO4,0.1M KH2PO4,0.1M KCl)中进行表征,每隔50s加入20μL,1.4M H2O2,测量其计时电流变化电流值。
(12)根据所得电流变化值与ADRB1-1165G>C基因DNA片段浓度呈线性关系,绘制工作曲线。
与现有技术相比,本发明的一种指导华法林用药的ADRB1-1165G>C基因多态性检测的电化学DNA生物传感器的制备方法,其突出的特点是:
(1)将基于CeO2的纳米复合材料作为信号探针引入到电化学DNA生物传感器的制备中,不仅有效的增强了信号探针的催化活性,而且提高了生物分子的固载量,进而提高了电化学DNA生物传感器的灵敏度和生物相容性;
(2)引入生物素-亲和素系统,提高了DNA探针的捕获量,从而提供了生物传感器的灵敏度;
(3)本方法制备的电化学DNA生物传感器可为临床根据不同病人基因型调整美托洛尔用药剂量,进而避免美托洛尔用药过程副作用的发生;
(4)使用完全相同的纳米材料和修饰方法,利用捕获探针,信号探针与目标DNA的特异性识别,只需通过改变探针的核酸序列即可实现多种疾病(如肿瘤)个体化用药基因的特异性,高灵敏检测,另外,此方法简便,快速,便于实现商品化,从而推进转化医学的发展。
附图说明:
图1为本发明的电化学DNA生物传感器的构建示意图。
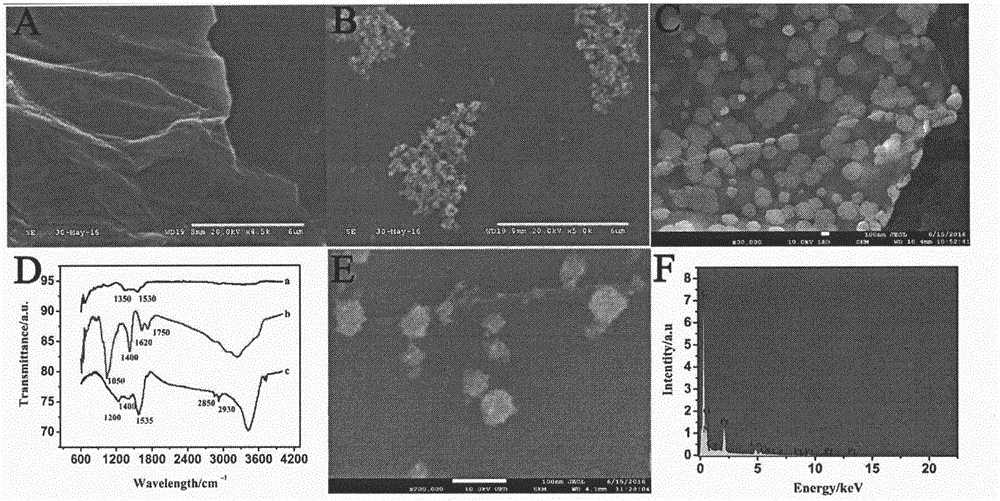
图2为本发明的信号探针不同合成步骤的扫描电镜图,GO-CeO2红外分析和GO-CeO2-PtNPs的能谱分析。
图3为本发明的电化学DNA生物传感器在检测ADRB1-1165G>C基因多态性时得到的即使电流与目标物浓度的线性关系,以及传感器的特异性与稳定性。
具体实施方式:
下面结合具体实施例对本发明进行进一步阐述,应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1
步骤1.10mg GO分散于5mL超纯水中形成悬浊液,其次10mL,0.025M Ce(NO3)3·6H2O与10mL,0.025M乌洛托品(HTMA)混合,然后将上述两种混合好的溶液置于80℃水浴加热反应5h,所得溶液经10000r/min,离心5分钟,用超纯水和乙醇分别清洗3次,所得沉淀在恒温干燥箱中60℃减压干燥,备用;
步骤2.20mg GO-CeO2分散于5mL无水乙醇,接着加入0.1mLAPTES,70℃回流加热1.5h。上述溶液冷却至室温后,经8000r/min,离心5分钟,用超纯水清洗3次。所得沉淀在恒温干燥箱50℃干燥12h,备用;
步骤3.1mL H2PtCl6(1%)加入1mL,2mg mL-1GO-CeO2溶液中,超声10min,接着逐滴加入2mL,0.1M NaBH4于磁力搅拌器上搅拌反应30min。经10000r/min,离心5min,用超纯水清洗3次,所得GO-CeO2-PtNPs沉淀溶于1mL超纯水中备用;
步骤4.用100倍多余的TCEP室温处理巯基修饰的单链DNA,1h。将处理后的检测探针加入GO-CeO2PtNPs溶液中4℃搅拌过夜后离心,并用PBS(0.1M,pH=7.4)清洗。将合成的GO-CeO2-PtNPs重新分散在1mL杂交液中,4℃保存备用。;
步骤5.分别用0.3和0.05μm的Al2O3粉末将电极抛光成镜面,然后分别按超纯水、无水乙醇、超纯水的顺序超声电极各5min,室温干燥备用;
步骤6.将干燥后的电极浸入1%的氯金酸溶液中,恒压法-0.2V沉积30s;
步骤7.用超纯水将电极冲洗干净后滴加10μL,100μg mL-1亲和素溶液并置于4℃孵育12h;
步骤8.用超纯水将孵育后的电极冲洗干净后滴加10μL,1μM亲和素标记的DNA捕获探针溶液,4℃孵育12h;
步骤9.用超纯水将孵育后的电极冲洗干净后滴加6μL,1%的BSA溶液室温孵育1h;
步骤10.将上述BSA封闭后的电极用清洗缓冲液(10mM Na2HPO4,2mM KH2PO4,37mM NaCl,2.7mM KCl,pH 7.4)冲洗并在氮气中干燥;
步骤11.在干燥后的电极上滴加10μL上述不同浓度的目标DNA置于37℃孵育2h;
步骤12.用超纯水将孵育后的电极冲洗干净后滴加10μL检测探针溶液在37℃杂交2h;
步骤13.将孵育后的电极用清洗缓冲液冲洗干净后置于氮气中干燥;
步骤14.将电极置于7mL,0.1M PBS(0.1M Na2HPO4,0.1M KH2PO4,0.1M KCl)中进行表征,每隔50s加入20μL,1.4M H2O2,测量其计时电流变化电流值;
步骤15.根据所得峰电流与ADRB1-1165G>C基因DNA片段浓度呈线性关系,绘制工作曲线;测定结果表明ADRB1-1165G>C基因DNA片段浓度在1fM-100fM和100fM-10nM范围内成线性关系,线性相关系数为0.9992和0.9990,检测限位33fM;
步骤16.将本发明上述传感器于4℃保存,间断检测传感器电流响应,储存30天后电流响应仍为初始电流的94.7%,表面传感器具有良好的稳定性;
步骤17.本发明取同一批次制备的DNA生物传感器5支,在相同条件下对100fM的ADRB1-1165G>C基因DNA片段分别进行测定,每一浓度测定5次,结果响应电流的相对标准偏差少于1.28%;同时,取不同批次制备的DNA生物传感器2支,在相同条件下对100fM的ADRB1-1165G>C基因DNA片段分别进行测定,每一浓度测定3次,结果响应电流的相对标准偏差少于1.53%,说明传感器批内及批间差异小,传感器重现性良好;
步骤18.将本发明上述传感器用于检测目标核酸序列,错配碱基以及血浆中干扰物质,结果错配碱基和血浆中干扰物质的电流响应相对于目标核酸序列显得微不足道,说明传感器的特异性好,可以很好区分目标序列且可排除血浆基质干扰。
以上所述仅是本发明的优选实施方式,应当指出的是,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提条件下,还可以做出若干改进,这些改进也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!