用于肺癌诊断的多分子标志物组合的制作方法
本发明属于疾病诊断技术领域,更具体地,本发明涉及用于肺癌诊断的多分子标志物组合。
背景技术:
肺癌已连续多年成为全球人群中癌症相关死亡的首要原因,根据调查结果统计,在2015年中,中国有73,300例被确诊为肺癌,610,200例人群死于肺癌。肺癌的5年生存率大概在17%左右,且近几年总生存率并没有明显提高。由于缺乏早期诊断肺癌的有效方法,超过一半的患者在诊断时已经是晚期,因此失去切除的机会。
临床上,对肺癌的检测仍依赖于CT、MR、PET等影像检测仪器,但实际上这些影像手段一般只能发现1-2cm以上的肿瘤,而肿瘤从病变到生长至1-2cm,一般要经过2-5年甚至更长的时间,因此,癌症早期漏诊率高达80-90%。目前,早期诊断肺癌的最简单的方法是通过验血寻找肿瘤标志物,特别是其中的蛋白标志。肺癌中常用的肿瘤标志物有神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、细胞角蛋白19片段(Cyfra21-1)以及前胃泌素释放肽(ProGRP)等。
(1)神经特异性烯醇化酶(NSE):烯醇化酶是一种糖酵解酶,普遍存在于哺乳动物的组织中,以系列同工酶二聚体的形式存在(αα、αβ、ββ、和γγ)。NSE为含γ亚基的同工酶,存在于神经内分泌细胞和神经源性肿瘤中(如小细胞肺癌、神经母细胞瘤、肠癌等)。小细胞肺癌(SCLC)是一种起源于神经内分泌细胞的肿瘤,因此NSE与SCLC关系密切,是小细胞肺癌的标记物。SCLC患者NSE阳性率约为60-80%,非小细胞肺癌患者阳性率<20%。因此,NSE有助于SCLC的诊断及其与NSCLC的鉴别诊断。NSE还是肺癌化疗效果观察和随访的有效指标,对化疗产生反应后此酶水平会下降,病情完全缓解后其可达正常水平。
(2)细胞角蛋白19片段(CK19,Cyfra21-1):Cyfra21-1是分子量约30kDa的上皮细胞角蛋白的可溶性成分之一,是一种非常好的鉴别肺良恶性疾病的标志物,尤其对肺鳞癌的检测效果更好。Cyfra21-1是相对较新的肿瘤标志物,临床上采用夹心酶联免疫吸附法,联合应用两种特异性单克隆抗体(ks19.1和bm19.21)检测血清中的细胞角蛋白19片段。Cyfra21-1存在于上皮起源的肿瘤细胞的胞浆中,当肿瘤细胞坏死后,可释放到血清中。免疫组织化学研究表明,肺癌中富含细胞角蛋白19片段,Cyfra21-1是NSCLC最灵敏的肿瘤标志物。因为Cyfra21-1只代表细胞角蛋白19一个片段,因此Cyfra21-1比组织多肽抗原(TPA)具有更高的特异性。研究表明,Cyfra21-1在肺鳞癌中的阳性率可高达80%,而且对肺癌的诊断有较高的特异性,它在肺良性疾病和健康人群血中的浓度很低,与性别、年龄以及吸烟习惯无关。Cyfra21-1的敏感性与肿瘤的组织学类型存在着一定的相关性,如肺鳞癌的敏感性为最高达76.5%、腺癌为47.8%、小细胞肺癌仅为42.1%。血清中Cyfra21-1的含量与肺鳞癌患者的病程呈正相关,根据肺癌的TNM分期,Ⅰ~Ⅳ期患者的敏感性分别为60.0%、88.8%、80%和100%。
(3)前胃泌素释放肽(ProGRP):ProGRP是一个相对稳定的激素胃泌素释放肽(GRP)的前体。人类的GRP主要存在于胃肠道、呼吸道以中枢神经系统中。一些研究认为,小细胞肺癌的肿瘤细胞释放GRP,并且GRP可能会刺激SCLC细胞生长。ProGRP作为SCLC的标志物,具有敏感性高(75.5%)、特异性强(97%)的特点。ProGRP水平和治疗反应也有较好的相关性,治疗后肿瘤完全消失的病人,ProGRP降至正常值范围,甚至测不出来长达一个月以上。国内外的研究表明,ProGRP对小细胞肺癌检测的敏感性、特异性和可靠性方面均优于NSE,敏感性和特异性高,阳性预测值和阴性预测值在90%以上,对局限期病变的阳性率也比NSE高,一定程度上提高了早期诊断可能性,而且对化疗后反应、疗效的评价、病程中病情监测和预后判定都提供了有价值的信息。
(4)癌胚抗原(CEA):CEA是一种存在于多种肿瘤细胞中的肿瘤抗原,肺癌细胞能直接产生CEA。CEA是最早发现的肺癌肿瘤标志物,也是目前肺癌诊断中最具代表性的肿瘤标志物,在腺癌与鳞癌中升高较明显。原发性肺癌患者血清CEA水平明显升高,对肺癌的诊断阳性率为40~60%,特别在肺腺癌中,阳性率及特异性较高。另外,CEA在肺癌早期的病人中阳性率较低,在肿瘤中晚期才有较显著的升高,因此CEA水平的动态变化能较好的反映患者对治疗的反应和预后。
虽然上述这些肿瘤标志物已经被应用于临床中肺癌的筛查工作,但是这些生物标记的敏感度大约在40-60%,特别是早期癌症的诊断率很低。肺部肿瘤异质性的存在使得肺癌的诊断筛查难度增加,并且当肿瘤发展到不同阶段,不同病理分期的时候,肿瘤标志物也会随之改变,这也增加了诊断的难度。单一指标缺乏准确性,因此需要多项指标共同检测,从而提高诊断的特异性以及灵敏度。
技术实现要素:
本发明的目的在于提供用于肺癌诊断的多分子标志物组合,以及在此基础上制备的用于诊断肺癌的芯片和试剂盒。
在本发明的第一方面,提供一种蛋白标志物组合在制备诊断肺癌的试剂中的用途;所述的蛋白标志物组合包括:肝细胞生长因子(HGF)、C反应蛋白(CRP)、催乳素(Prolactin)、Wnt诱导信号通路蛋白1(WISP1)、印记位点结合因子(BORIS)、CA125、细胞角蛋白19片段(Cyfra21-1)以及癌胚抗原(CEA)。
在一个优选例中,所述的肺癌是I~II期肺癌,或III~IV肺癌。
在另一优选例中,所述的诊断肺癌包括:区分小细胞肺癌患者(SCLC)和非小细胞肺癌(NSCLC)。
在另一优选例中,所述的试剂还用于肺癌的治疗疗效的评估,较佳地以血清作为样本。
在另一优选例中,所述的试剂是特异性识别或结合肝细胞生长因子(HGF)、C反应蛋白(CRP)、催乳素(Prolactin)、Wnt诱导信号通路蛋白1(WISP1)、印记位点结合因子(BORIS)、CA125、细胞角蛋白19片段(Cyfra21-1)、癌胚抗原(CEA)的抗体。
在本发明的另一方面,提供一种用于诊断肺癌的芯片,所述的芯片包括:特异性识别或结合肝细胞生长因子(HGF)的抗体、特异性识别或结合C反应蛋白(CRP)的抗体、特异性识别或结合催乳素(Prolactin)的抗体、特异性识别或结合WISP1的抗体、特异性识别或结合BORIS的抗体、特异性识别或结合CA125的抗体、特异性识别或结合细胞角蛋白19片段(Cyfra21-1)的抗体、特异性识别或结合癌胚抗原(CEA)的抗体。
在一个优选例中,所述的芯片是液相芯片,所述的特异性识别或结合肝细胞生长因子(HGF)的抗体、特异性识别或结合C反应蛋白(CRP)的抗体、特异性识别或结合催乳素(Prolactin)的抗体、特异性识别或结合WISP1的抗体、特异性识别或结合BORIS的抗体、特异性识别或结合CA125的抗体、特异性识别或结合细胞角蛋白19片段(Cyfra21-1)的抗体、特异性识别或结合癌胚抗原(CEA)的抗体被分别包被于具有特定识别信号(如颜色不同或编号不同)的微球上。
在本发明的另一方面,提供所述的芯片的用途,用于制备诊断肺癌的试剂盒。
在本发明的另一方面,提供一种用于诊断肺癌的试剂盒,所述试剂盒中包括下组的捕获抗体:特异性识别或结合肝细胞生长因子(HGF)的抗体、特异性识别或结合C反应蛋白(CRP)的抗体、特异性识别或结合催乳素(Prolactin)的抗体、特异性识别或结合WISP1的抗体、特异性识别或结合BORIS的抗体、特异性识别或结合CA125的抗体、特异性识别或结合细胞角蛋白19片段(Cyfra21-1)的抗体、特异性识别或结合癌胚抗原(CEA)的抗体。
在一个优选例中,所述的抗体是单克隆抗体或多克隆抗体。
在本发明的另一方面,提供一种用于诊断肺癌的试剂盒,所述试剂盒中包括:所述的芯片。
在一个优选例中,所述的试剂盒中还包括选自下组的至少一种试剂:
(1)质控液,
(2)携带可检测信号分子的检测抗体(如生物素标记检测抗体),
(3)显色剂或荧光标记物(如链亲和素-藻红蛋白),
(4)肝细胞生长因子(HGF)、C反应蛋白(CRP)、催乳素(Prolactin)、Wnt诱导信号通路蛋白1(WISP1)、印记位点结合因子(BORIS)、CA125、细胞角蛋白19片段(Cyfra21-1)以及癌胚抗原(CEA)的标准蛋白。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
图1、本发明针对大样本量患者及对照进行筛选肺癌标志物的测试、验证的流程示意图。
图2、CRP的输出标准曲线,以及HGF的输出标准曲线;
上图:CRP的检测曲线;
下图:HGF的检测曲线。
图3、8种分子标志物在肺癌患者和健康对照血清中表达情况的散点图。其中,应用的临床样本为:804个肺癌样本,575个健康对照。
图4、标志物的联合分析对于诊断肺癌的临床意义;
A为在试验组中,8个标志物联合检测的ROC曲线;其中WISP1和BORIS显著提高ROC曲线下面积;
B为在验证组中,8个标志物联合检测的ROC曲线;其中WISP1和BORIS显著提高ROC曲线下面积;
C为在试验组中,针对早期肺癌患者和健康对照,应用本发明的方法区分早期肺癌患者和健康对照;其中I-II表示早期肺癌;III-IV表示中晚期肺癌。
D为在验证组中,针对早期肺癌患者和健康对照,应用本发明的方法区分早期肺癌患者和健康对照;其中I-II表示早期肺癌;III-IV表示中晚期肺癌。
具体实施方式
本发明人致力于提高肺癌诊断准确率以及早期诊断的研究,经过深入的研究,揭示了一组肺癌联合标志物:肝细胞生长因子(HGF)、C反应蛋白(CRP)、催乳素(Prolactin)、Wnt诱导信号通路蛋白1(WISP1)、印记位点结合因子(BORIS)、CA125、细胞角蛋白19片段(Cyfra21-1)以及癌胚抗原(CEA)。在肺癌患者的血清中,这些蛋白质的表达显著高于健康对照。因此,可应用这些标志物来制造可高效诊断肺癌的诊断芯片或诊断试剂盒。这些标志物联合应用于临床诊断,可以显著提高诊断肺癌的准确度,并且能够检出肺癌早期患者。
本发明人收集了大量的临床病例,筛选肺癌标志物,揭示了一组可以高准确度地检出与肺癌的标志物:肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原。联合应用这些标志物,检出的准确性显著高于应用单一标志物的情形,也显著高于联合应用其它多个标志物的情形。并且WISP1、BORIS对于检测的准确性具有显著的提高。
WISP1(Genbank:NM_003882.3)是高半胱氨酸蛋白61/结缔组织生长因子/肾母细胞瘤过度表达基因家族成员之一。WISP1具有促进细胞增殖、介导细胞黏附、刺激细胞转移、促进有丝分裂及细胞外基质的形成等生物学功能。目前已发现WISP1在不同的肿瘤组织中发挥正向或负向调节作用,WISP1基因多态性与肺癌易感性及铂类药物化疗敏感性有关,但是其对肺癌的临床诊断意义目前还未见报道。
BORIS(Genbank:AF336042.1)是印记位点结合因子,最初在睾丸中发现的DNA结合蛋白。该蛋白与CCTCC结合因子(CTCF)同源,含有与CTCF相同的11锌指DNA识别结构域。BORIS与DNA的结合抑制CTCF识别相同的DNA区域,但它的N端与C端完全不同于CTCF。因此BORIS可能参与调控不同的细胞生物学事件。
BORIS定位于染色体20ql3区,研究发现该区域在多种肿瘤中发生扩增,导致BORIS表达异常活跃,包括乳腺癌、卵巢癌、胃癌、肝癌、子宫内膜癌、神经胶质瘤、结肠和食管癌以及肾胚细胞瘤有关。BORIS在肺癌中的表达以及临床意义目前未见报道。
基于本发明人的新发现,可以以肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原作为检测(确定、鉴定或诊断)肺癌的标志物(标记物)。通过分析这些蛋白的表达情况(包括基因水平上或蛋白水平上),从而得知受试者的是否罹患肺癌以及肺癌的严重程度,为疾病的诊断或预后提供依据,或可早期评估受试者罹患肺癌的可能性。
可采用各种技术来检测肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原的表达情况,这些技术均可包含在本发明中。所述的检测可以针对蛋白,也可针对相应的cDNA,或针对mRNA。可用已有的技术如(但不限于):Western印迹、SDS-PAGE、原位杂交、酶联免疫反应、聚合酶链反应(PCR)、Southern印迹、蛋白序列分析、质谱分析或DNA序列分析等。
较佳地,本发明以血清作为待测样本(样品)。
本发明还提供了用于在分析物中检测肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原的表达情况的试剂。所述的试剂例如是:特异性识别或结合这些蛋白的抗体。利用所述蛋白的特异性抗体来检测所述蛋白的表达情况以及表达量,从而可作出判断。较佳地,还设置正常的对照组,以确定所述蛋白在正常动物体中的表达情况。较佳地,所述的特异性抗体上携带可识别信号,从而可方便、直观地获得检测结果。
所述的抗体可以通过本领域内技术人员已知的各种技术进行制备。例如,纯化的肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原,或其具有抗原性的片段,可被施用于动物(如家兔,小鼠,大鼠等)以诱导多克隆抗体的产生,多种佐剂可用于增强免疫反应,包括但不限于弗氏佐剂等。与之相似的,表达肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原,或其具有抗原性的片段的细胞可用来免疫动物来生产抗体。所述的抗体也可以是单克隆抗体。此类单克隆抗体可以利用杂交瘤技术来制备(见Kohler等人,Nature 256;495,1975;Kohler等人,Eur.J.Immunol.6:511,1976;Kohler等人,Eur.J.Immunol.6:292,1976;Hammerling等人,In Monoclonal Antibodies and T Cell Hybridomas,Elsevier,N.Y.,1981)。
本发明还提供了一种用于诊断肺癌的芯片,所述的芯片包括:特异性识别或结合肝细胞生长因子的抗体、特异性识别或结合C反应蛋白的抗体、特异性识别或结合催乳素的抗体、特异性识别或结合WISP1的抗体、特异性识别或结合BORIS的抗体、特异性识别或结合CA125的抗体、特异性识别或结合细胞角蛋白19片段的抗体、特异性识别或结合癌胚抗原的抗体。
作为本发明的优选方式,所述的芯片是液相芯片,较佳地,采用双抗夹心法结合液相芯片技术。双抗夹心法常规的做法是将捕获抗体(又称为第一抗体或一抗)固定于载体,然后捕获抗体与蛋白抗原反应,洗涤后再与带标记的检测抗体(又称为第二抗体或二抗)反应,洗涤,最后进行化学发光或酶联显色反应检测信号。
本发明的优选方式中,将所述的捕获抗体固定于携带特定可检测信号(分子)的微球上,制备液相蛋白芯片,通过采用液相蛋白芯片进行检测的原理是:使单个微球通过检测通道,并使用两种激光同时对微球上的微球识别信号和可检测信号(分子)进行检测。一种激光激发的是微球上的微球识别信号,根据微球上的不同种识别信号,可以将微球分类,从而将各个不同的结合反应区分开来。另一种激光激发的是可检测信号(分子),目的是确定微球上结合的可检测信号的数量,从而确定微球上结合的目的分子的数量。因此,通过两种激光的同时检测,可以确定被结合的检测物的种类和数量。
所述的“微球识别信号”是指位于微球上的、用于区别不同的捕获抗体的识别信号。为了方便起见,对于固定有同一种捕获抗体的微球,微球识别信号优选是相同的。优选的,所述的微球识别信号是荧光信号,并且,对于固定有不同种捕获抗体的微球,荧光的色彩是不同的,对于固定有同种捕获抗体的微球,荧光的色彩优选是相同的。
将捕获抗体固定在微球上的详细操作程序可用常规方法,例如按照Luminex公司的产品说明书或网站:www.luminexcorp.com中所述的方法进行偶连,从而得到不同微球与相应捕获抗体形成的耦连物。
所述的不同的微球是具有不同微球识别信号的微球,由于带有不同的微球识别信号,使不同微球之间可被区分。在本发明的优选方式中,所述的微球识别信号为荧光信号,并且,微球上的荧光信号因固定于微球上的相应的捕获抗体的不同而不同。
本发明所述的微球可以采用聚苯乙烯、聚氯乙烯、聚乙烯等材料制成的。并且,所述的微球的平均直径可以为1-100μm;更优选的,所述的微球的平均直径可以为2-50μm。
可选用多种可检测信号(分子)来标记所述的检测抗体。比如,所述的可检测信号选自:FITC、CY3、CY5、藻蓝蛋白、Alexa Fluor Dyes、BODIPY Dyes、俄勒冈绿染料(Oregon Green Dyes)、得克萨斯红染料(Texas Red Dye),或若丹明(Rhodamine)。
对应于可检测信号(分子)的检测物质为能够与可检测信号(分子)相结合并能够报告所述结合的分子(报告分子)。当采用生物素来标记检测抗体时,可采用链亲和素-藻红蛋白作为报告分子。
在本发明的优选方式中,所述的可检测信号(分子)是生物素,该生物素作为显示标志,当与链霉菌亲和素偶联的藻红蛋白(链亲和素-藻红蛋白,又称为PE标记的链亲和素,SA-R-PE)结合后,通过激光激发产生荧光信号。生物素的标记方法是本领域技术人员熟知的。
为了消除假阳性和假阴性,宜在检测过程中设置阳性对照和阴性对照。此外,为了获得定量结果,可以在检测过程中设置含已知浓度的抗原蛋白(肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原)的标准品。对照或标准品的设置方法采用常规的方法。
本发明还提供了用于在分析物中检测肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原的表达情况,从而分析肺癌状况的试剂盒,该试剂盒包括:容器,以及分别位于容器中的特异性识别结合肝细胞生长因子、C反应蛋白、催乳素、WISP1、BORIS、CA125、细胞角蛋白19片段以及癌胚抗原的抗体。或者,所述的试剂盒包括:前面所述的芯片,特别是液相芯片。
所述的试剂盒中还可包括用于杂交或酶联检测等所需的其它各种试剂,包括但不限于:质控液、标准品、酶、对照液、显色液、洗液等。
此外,所述的试剂盒中还可包括使用说明书等,以指导人们按照正确的流程、条件、剂量来实施检测。
本发明通过大样本量分析,在肺癌患者血清中确定了一组新的分子蛋白,并通过多家医院采集的大样本分析和测试,证明该分子标志物组合敏感度高,重复性好且诊断准确率高,能够实现肺癌的早期诊断。基于此,开发了通过分析血清中多种分子标志物来检测肺癌的平台,可以有效的提高敏感性和特异性。
与现有技术相比,液相芯片试剂盒的敏感度高,通过多个标志物联合检测,大大提高了肺癌早期诊断的准确率,且检测快速,稳定性好,能够实现高通量检测,且成本低廉。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
一、实验方法
1、研究人群
本发明研究之初,选择人群的标准为:
1)病理学诊断为早期肺癌;
2)没有进行肺癌治疗;
3)采样的血清均在临床干预之前;
4)无其他并发症和相关自身免疫性疾病。
患者收集于2009年4月到2013年9月,来自杭州市第一人民医院,杭州市肿瘤医院和浙江省肿瘤医院,嘉兴第一人民医院,温州大学第一附属医院,绍兴人民医院等6家三甲医院。
健康对照组的血液样本均来自于献血人群,要求不曾患有相关肺部疾病。年龄和性别的选择都与患者病例相对应匹配。
研究样本的采集获得伦理审查委员会的批准。按照委员会的规定,所有患者均签署书面知情同意书。临床资料的收集包括病史、诊断分期、组织学分期、吸烟状态等临床信息。
2、血清采集
血清样本均在未经任何干预的情况下收集。首先用离心管收集5ml外周血,采血过程均按照标准化过程,血液均不加抗凝试剂。血清分离收集后分装并储藏至-80℃。
3、肿瘤生物标志物筛选和检测
主要试剂:
1)抗体微球:含有分别包被了CRP、Prolactin、HGF、WISP1、BORIS、CA125、Cyfra21-1、CEA捕获抗体的26#、37#、42#、45#、49#、52#、62#、79#微球;不同种包被微球的浓度均为1.2×104个/μl。
2)生物素标记检测抗体:分别用生物素标记的CRP、Prolactin、HGF、WISP1、BORIS、CA125、Cyfra21-1、CEA检测抗体的混合液;
3)链霉亲和素-PE;
4)质控液(CRP标准蛋白、Prolactin标准蛋白、HGF标准蛋白、WISP1蛋白、BORIS蛋白、CA125标准蛋白、CEA标准蛋白、Cyfra21-1标准蛋白);
其中,所述的捕获抗体、检测抗体能与其相应的肺癌血清标志物结合,所述的链霉亲和素-PE能与生物素高度结合,通过luminex检测,以红色激光激发微球上的红色分类荧光,依据微球的色彩不同确定反应类型,以绿色激光激发藻红蛋白,测定微球上结合的报告荧光分子的数量,用于间接确定微球上结合的肺癌血清标志物的含量。
主要步骤:
(一)、液相芯片的制备(每种蛋白包被相应的微球,制备方法相同)
1)取微球悬液(磁性微球,bio-rad),分别涡旋和超声约20s后,取200ul(约2.5×106个微球)于干净离心管(美国,Axygen)中,标记上微球型号和蛋白名称;
2)14000g,室温(约25℃),4min;小心吸去上清,为减少损失可残留少量上清;
3)加入100ul ddH2O,分别涡旋和超声约20s;
4)14000g,室温,4min;小心吸去上清,为减少损失可残留少量上清,加入160ul pH 6.2,0.1M的NaH2PO4,分别涡旋和超声约20s;
5)迅速加入20ul S-NHS,涡旋混匀;
6)迅速加入20ul EDC,分别涡旋和超声约20s;
7)室温,避光旋转孵育20min(若发现微球不呈悬浮状态,可每隔10min涡旋一次);
8)14000g,室温,4min;小心吸去上清,加入250μL 0.05M MES,pH 5.0,分别涡旋和超声约20s;
9)14000g,室温,4min;小心吸去上清,重复上述洗涤步骤一次;
10)小心吸去上清,用50ul pH 5.0,0.05M的MES重悬微球,分别涡旋和超声约20s;
11)加25ug捕获抗体于上述微球中,加入pH 5.0,0.05M的MES至终体积为500ul,分别涡旋和超声约20s;
12)室温,避光旋转孵育2h;
13)14000g,室温,4min;小心吸去上清,加入1mL 0.01%PBST,分别涡旋和超声约20s;
14)14000g,室温,4min;小心吸去上清,重复上述洗涤步骤一次;
15)加入1mL 1%PBSB,分别涡旋和超声约20s;
16)室温避光旋转孵育30min,封闭微球表面残余的活化羧基位点;
17)14000g,室温,4min;小心吸去上清,加入1mL 1%PBSB,分别涡旋和超声约20s;
18)小心吸去上清,加入1%PBSB至终体积为200ul,分别涡旋和超声约20s;
19)取2ul于38ul 1%PBSB中,涡旋20s,超声20s后,血球计数板计数,最终浓度(个/mL)=(4大格总数/4)×(1×104)×稀释倍数;
20)在离心管上标记微球浓度、偶连时间,然后放置4℃避光保存。
(二)、肺癌血清标记物的检测
使用前先取出液相芯片及相关试剂,放置平衡至室温。
-80℃取出肺癌患者和健康人的血清,分别放置在冰上融化后,涡旋混匀,取V型96孔血凝板(96孔板)将血清稀释20倍,枪头上下混匀,尽量不产生气泡。
准备CRP、Prolactin、HGF、WISP1、BORIS、CA125、CEA、Cyfra21-1标准蛋白。各取8个EP管分别标记上S1、S2、S3、S4、S5、S6、S7、S8,进行2倍系列稀释,每一个标准样本稀释后都要涡旋混匀并更换枪头,具体如表1。
表1
其中标准蛋白用1%PBSB作为稀释液,且为2倍稀释。
取制备好的液相芯片微球混合液,涡旋混匀20s,超声20s,按每孔2500个微球加入到1%PBSB中,涡旋混匀20s,超声20s,终体积为10ul/孔;
立即加入稀释20倍的血清和系列稀释的标准物(抗体的不同孔中加入血清或者不同稀释倍数的标准物),各30ul/孔;
用铝箔纸包好96孔板,室温,震荡孵育反应60min;
0.1%PBST洗三次,Run5:MAGX3;
1%PBSB稀释生物素标记检测抗体,50ul/孔;
用铝箔纸包好96孔板,室温,震荡孵育反应60min;
0.1%PBST洗三次,各种抗体的浓度均为0.1ug/ml,Run5:MAGX3;
1%PBSB稀释链霉亲和素-藻红蛋白(1:500),50ul/孔;
用铝箔纸包好96孔板,室温,震荡孵育反应60min;
0.1%PBST洗三次,Run5:MAGX3;
100ul/孔的1%PBSB重悬微球,室温,震荡3-5min;
于Luminex系列液相芯片分析仪上读取结果,仪器可自动绘制标准曲线,并计算出待测样本的测量值。
(三)结果分析
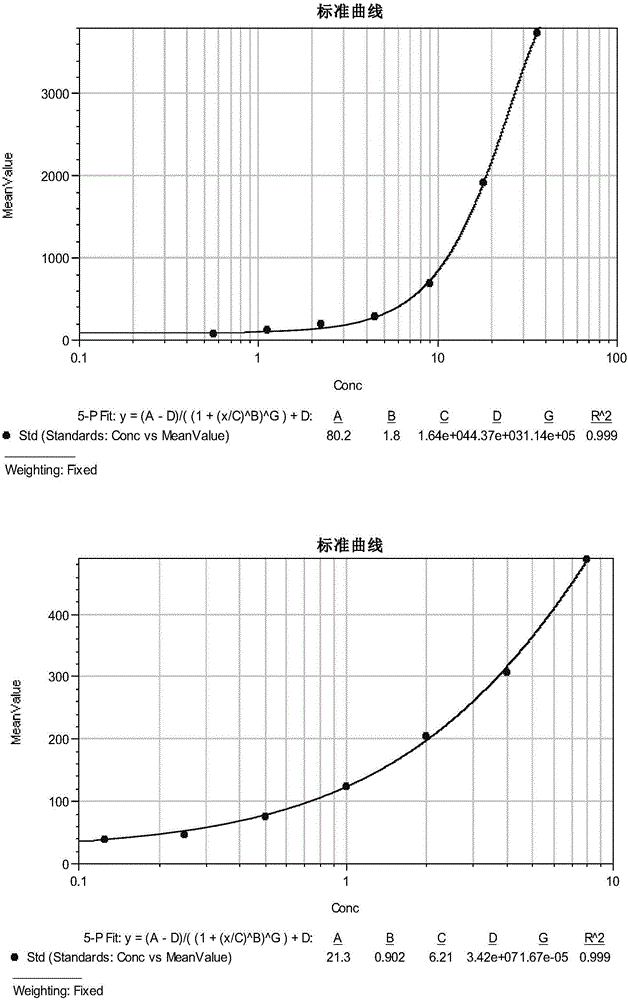
以CRP、HGF为例,制作标准曲线。
制作标准曲线时,CRP、HGF标准物的预测浓度、实测浓度和MFI值参见表2,CRP、HGF的检测曲线如图2所示;其中CRP的检测曲线为图2上图,HGF的检测曲线为图2下图。
表2、标准蛋白的标准曲线
CRP和HGF的输出标准曲线如图2。
针对其它候选标志物的标准曲线的制作和分析与上述类似。
4、统计分析
健康人群和肺癌患者中不同的分子标记物利用Mann-Whitney U进行分析。
分子标记物和临床病例的关系通过方差进行分析。
ROC曲线用来评价标志物的敏感性和特异性。
生物标记物的准确性利用逻辑回归进行评估。
二、实验结果
实施例1、标志物的筛选
本发明人共收集了804例患者,其中试验组543例,验证组261例。健康组共有575例,其中试验组301例,验证组274例。另外,还包括70例其他良性肺部疾病,以及80例肺部小结节病人。
统计结果显示,健康组和实验病例(试验组,验证组)组的患者在性别、吸烟状态、年龄等因素上无明显统计学差异。
受试者的临床病例特点总结于表3中。
表3
P值为χ2检验.
实施例2、肺癌相关分子标记物的筛选以及验证
本发明中,进行肺癌标志物的筛选流程如图1。
本实施例的目的是筛选出可以区分健康者和肺癌患者的分子标志物。将肺癌患者的血清样本与健康者的血清样本中表达的蛋白进行大规模的比较,以期筛选出肺癌相关分子标记物。
经过大样本量分析筛选,结果,本发明人共筛选出8个蛋白,其在肺癌患者中高表达,并且可以较好地将健康人群和肺癌患者区分出来,包括:C反应蛋白(CRP)、催乳素(Prolactin)、肝细胞生长因子(HGF)、CEA、WIPS1、Cyfra21-1、CA125、BORIS(P<0.01)。如图3。
因此,本发明人共发现了8个有效的分子标志物。
实施例3、诊断模型的建立以及ROC分析
本发明人进一步利用逻辑回归分析了8个标记物对于肺癌的筛选和诊断的临床价值。在试验组中,8个标志物(8-markers)的联合检测准确性达到了0.91(95%可信区间为0.89-0.93,其中敏感性为81.9%、特异性为83.7%)。在验证组中,联合检测准确性达到了0.93(95%可信区间为0.91-0.95,其中敏感性为80.8%、特异性为90.5%),如图4。
为了探索该模型对于早期肺癌诊断的能力,本发明人在804例肺癌患者选取了171例早期肺癌患者,发现该方法可以显著区分早期肺癌患者和健康对照(图4)。
同样的,该方法可以区分小细胞肺癌患者和非小细胞肺癌患者。具体的分析情况见表4。
表4
HC=健康对照LC=肺癌.SCLC=小细胞肺癌.NSCLC=非小细胞肺癌.
实施例4、WISP1以及BORIS作为标记物的作用
通过本次大样本量的筛选,本发明人发现了两个全新的肺癌标志物WISP1以及BORIS。
本发明人将8分子指标中各分子的权重进行分析表明,8分子指标(8-Marker)中每一个分子均有利于提高检测的准确度。其中,WISP1以及BORIS对该诊断模型的贡献非常显著。以6分子指标(6-marker:CRP、Prolactin、HGF、CA125、CEA、Cyfra21-1)与8分子指标(8-marker:CRP、Prolactin、HGF、WISP1、BORIS、CA125、CEA、Cyfra21-1)分别检测的检测准确度来评判,在试验组中,8分子指标的检测准确度0.91(95%可信区间为0.89-0.93);而若是去掉WISP1以及BORIS的6分子联合检测,其准确度只有0.83(95%可信区间为0.80-0.89)。该准确度的区别非常显著(p<0.01)。同样地,在验证组中,8分子指标的检测准确度也显著高于6分子标志物,如图4。
因此可见,8分子联合应用具有良好的诊断准确性,其中WISP1以及BORIS作为标记物对于检测的准确性非常关键。
实施例5、制备检测试剂盒及临床应用
1、制备临床用的检测试剂盒
如前所述,制备8种抗体微球,分别包被了CRP、Prolactin、HGF、WISP1、BORIS、CA125、Cyfra21-1、CEA捕获抗体的26#、37#、42#、45#、49#、52#、62#、79#微球。
将上述抗体微球分别置于不同的容器中,置于试剂盒中。同时,将生物素标记的CRP、Prolactin、HGF、WISP1、BORIS、CA125、Cyfra21-1、CEA检测抗体的混合液分别置于不同的容器中,置于试剂盒中。同时,将链霉亲和素-PE液置于试剂盒中。
从而,获得包含有应用于临床检测的主要试剂的试剂盒,可直接应用于临床检测。
2、临床应用
获得2位临床疑似患者的血清样本,应用所述的试剂盒,如前所述进行CRP、Prolactin、HGF、WISP1、BORIS、CA125、Cyfra21-1、CEA的检测。结果如下:
1位疑似患者测得结果:CRP表达20.39μg/ml、Prolactin表达2.56ng/ml、HGF表达0.76ng/ml、WISP1表达4.23ng/ml、BORIS表达2.49ngml、CA125表达4.83ng/ml、Cyfra21-1表达15.67ng/ml、CEA表达7.27ng/ml;利用这8个指标分析发现该患者是肺癌可能性大于90%。进一步临床CT以及病理学确证该患者为肺癌早期。
另1位疑似患者测得结果:CRP表达0.12μg/ml、Prolactin表达0.67ng/ml、HGF表达0.19ng/ml、WISP1表达3.51ng/ml、BORIS表达1.01ng/ml、CA125表达0.43ng/ml、Cyfra21-1表达1.48ng/ml、CEA表达2.21ng/ml;利用这8个指标分析发现该患者是肺癌可能性为9.8%。进一步病理学发现该患者为良性肺部小结节。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!