一种被动型Heymann肾炎大鼠模型的评价方法与流程
本发明涉及一种被动型heymann肾炎大鼠模型的评价方法。
背景技术:
被动型heymann肾炎(passiveheymannnephritis,phn),是被用来研究人类膜性肾病中最为经典的动物模型,其发病进程以及症状非常接近于人类的膜性肾病,而且这种模型的优点是发病比较迅速,整个病变过程也比较稳定,同时该模型易于重复,是用来检测药物治疗效果的理想动物模型。为了更好的进行实验研究,推动筛选治疗被动型heymann肾炎药物的进步,被动型heymann肾炎模型的复制评价成为技术关键。目前被动型heymann肾炎模型复制成功与否的判断主要根据病理组织学检查,肾组织形态的观察结果作为辅助。尿蛋白、尿素氮、肌酐等机制相关检测指标也被大量研究者监测。传统取血检测生化指标或取脏器观察病理切片评价方法需要较长时间,同时给模型动物带来创伤。因此,一种具有统一、量化、特异性强、快速、无创伤等特点的用于评价被动型heymann肾炎的大鼠模型的方法亟待构建。
代谢组学是继蛋白组学之后发展起来的一种全新的组学技术,利用高分离效率、高灵敏度及低检测限的先进分析仪器,以生物体内的小分子内源性代谢物的动态变化规律从整体来阐明机体生理病理变化趋势,在定性、定量分析研究疾病进展规律和药效关系等方面具有广泛的应用。
技术实现要素:
本发明是要解决现有被动型heymann肾炎大鼠模型缺少统一、量化、特异性强、快速和无创伤的评价方法的问题,提供了一种被动型heymann肾炎大鼠模型的评价方法。
本发明一种被动型heymann肾炎大鼠模型的评价方法,是通过以下步骤进行的:采用lc-ms仪器采集被动型heymann肾炎大鼠模型中大鼠尿液,通过markerview软件分析大鼠尿液中10个生物标记物的含量;
其中10个生物标记物为:tryptophan、l-glutamate、succinicacid、creatinite、phytosphingosine、taurine、kynuricacid、phenylpyruvate、citricacid和uridine;
若模型大鼠尿液中tryptophan的积分面积均数从正常大鼠的7.416降到5.268-7.812;
l-glutamate的积分面积均数从正常大鼠的2.930降到1.200~1.430;
succinicacid的积分面积均数从正常大鼠的1.383上升到3.742~3.924;
creatinite的积分面积均数从正常大鼠的2.993下降到1.832~2.102;
phytosphingosine的积分面积均数从正常大鼠的3.900上升到6.023~6.546;
taurine的积分面积均数从正常大鼠的4.931下降到2.101~2.635;
kynuricacid的积分面积均数从正常大鼠的1.113上升到1.204~1.763;
phenylpyruvate的积分面积均数从正常大鼠的1.810下降到0.928~1.310;
citricacid的积分面积均数从正常大鼠的5.238下降到3.00~3.445;
uridine的积分面积均数从正常大鼠的1.360下降到0.704~1.026;
其中7种标记物在模型大鼠尿液中的含量都下降到所述的数值范围内,3种标记物在模型大鼠尿液中的含量都上升到所述的数值范围内,则证明被动型heymann肾炎大鼠模型构建成功。
本发明所利用的代谢组学技术手段被视为生物体整体功能状态的“生化表型”,能够即时、灵敏、真实表征在各种外界因素刺激下生物体整体功能状态的应答与调节情况。本专利利用代谢组学技术方法找到大鼠被动型heymann肾炎模型生物标记物,本发明通过机体终端产物尿液中内源性生物标记物含量的变化,评价被动型heymann肾炎大鼠模型,从而建立全面统一评价机体变化,可量化,同时针对被动型heymann肾炎的特异性的模型评价方法。本发明利用代谢组学方法,对heymann肾炎造模前及结束后大鼠尿液的lc-ms谱图代谢轮廓进行非监督模型pca加以分析,查看造模前后大鼠尿液代谢轮廓的变化轨迹;然后通过有监督模式识别的偏最小二乘法(pls-da)判别分析,根据pls-da模型得到的变量权重值(vip),将vip值大于1的变量作为生物标志物的候选变量,为了验证多维统计中找到的候选变量是否在单位统计上具有显著差别,实验中采用t检验,其中p<0.05有显著性差异;结合载荷图来筛选候选变量,通过这些变量所代表的化合物的质谱信息,在metlin、hmdb、kegg、pubchem等数据库中进行搜索、匹配和推测,最终确定可能的生物标志物;所有数据采用spss20.0统计分析软件进行处理,各组数据以(mean±sd)表示,采用one-wayanova法来判别组间的差异性。本专利最终鉴定出大鼠被动型heymann肾炎模型的10个潜在生物标记物,分别是tryptophan、l-glutamate、succinicacid、creatinite、phytosphingosine、taurine、kynuricacid、phenylpyruvate、citricacid和uridine;同时阐明了10个生物标记物在不同组别的相对含量变化,在模型大鼠尿液中tryptophan的积分面积均数从正常大鼠的7.416降到5.324,l-glutamate的积分面积均数从正常大鼠的2.930降到1.310,succinicacid的积分面积均数从正常大鼠的1.383上升到3.844,creatinite的积分面积均数从正常大鼠的2.993下降到1.958,phytosphingosine的积分面积均数从正常大鼠的3.900上升到6.373,taurine的积分面积均数从正常大鼠的4.931下降到2.446,kynuricacid的积分面积均数从正常大鼠的1.113上升到1.553,phenylpyruvate的积分面积均数从正常大鼠的1.810下降到1.191,citricacid的积分面积均数从正常大鼠的5.238下降到3.336,uridine的积分面积均数从正常大鼠的1.360下降到0.885。
对10个生物标记物能成为被动型heymann肾炎模型大鼠尿液代谢组明显变化的关键代谢产物的有效性进行验证,发现造模前后尿液中10个生物标记物表达水平的变化一定程度上反映了被动型heymann肾炎模型大鼠尿液代谢轨迹变化趋势。本发明与传统取血检测生化指标或取脏器观察病理切片相比,具有高效、快速、无创伤、特异性强等优势。
附图说明
图1是模型构建期间大鼠模型尿液的pca动态趋势图
a代表正常对照组,b代表模型组;
图2是大鼠模型尿液pls-da分析平面得分图
a代表正常对照组,b代表模型组;
图3是大鼠尿液代谢所鉴定生物标记物不同组别的相对含量变化;
图4是正常对照组和模型组大鼠肾组织病理图;
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
本具体实施方式中的大鼠为sd大鼠,雄性,7周龄,清洁级,是在武汉大学实验动物中心购买得到。
【实施例1】大鼠心气虚证模型的建立
(1)抗近端小管刷状缘抗原(fx1a)的制备
将健康雄性sd大鼠用3%戊巴比妥(50mg/kg)腹腔麻醉后,在无菌条件下,沿腹正中打开腹腔,取出大鼠两侧的双肾,并分离出肾皮质,按1:30(v/w)比例加入50mmol/l甘露醇/2mmol/ltris-hcl(ph7.0),在冰浴中制成匀浆。加1mol/lcacl2至终浓度为10mmol/l,在4℃下3000g离心15min,取上清液,43000g再离心20min,取沉淀,用50mmol/l甘露醇/2mmol/ltris-hcl(ph7.0)重复洗涤1次。将沉淀用ph7.4的0.01mol/lpbs溶解即为fx1a,置于-20℃冰箱备用。
(2)兔抗大鼠fx1a抗血清的制备
将fx1a溶液与适量弗氏佐剂混合进行充分乳化后,注射到大白兔的颈部、背部、腹部以及四肢的足垫。免疫多次后,自大白兔耳缘静脉取血1ml,离心分离得血清后,用间接免疫荧光法或免疫双向扩散法测定抗血清的效价,达1:2000或1:32以上为合格。若抗体效价不合格可再次注射抗原,直至效价合格。效价合格后经腹主动脉取血,置于57℃水浴30min灭活补体。随后5000g离心10min,吸取上清即为兔抗鼠fx1a抗血清,分小管保存,置于-20℃冰箱中备用。(3)phn模型的建立
于spf级动物房中,将12只雄性sd大鼠适应性饲养一周后开始实验,期间自由进食饮水以及自然光照。随机分为正常对照组、模型组(各6只),其中,模型组的大鼠将fx1a抗血清按8ml/kg的剂量实施尾静脉注射,同时将等量生理盐水注射到正常对照组。十天后用代谢笼分别收集所有大鼠24h尿液以检测尿蛋白含量。
【实施例2】
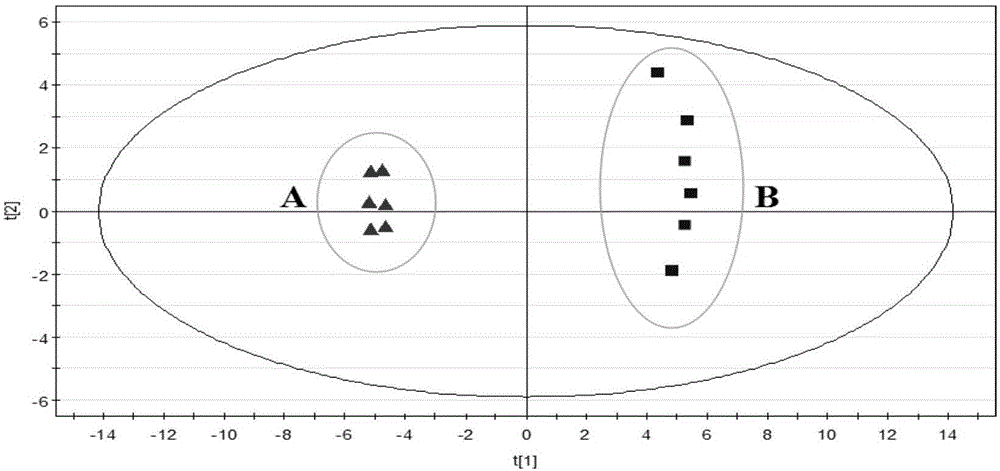
利用代谢组学方法,对实施例1中的heymann肾炎造模前及结束后大鼠尿液的lc-ms谱图代谢轮廓进行非监督模型pca加以分析,查看造模前后大鼠尿液代谢轮廓的变化轨迹。在simcia-p12.0软件的pca和pls-da的平面得分图中,每个点的坐标表示该样本在主成分1和主成分2中的相关性。横坐标代表主成分t[1],纵坐标代表主成分t[2]。simcia-p软件立体三维得分图是用来表示主成分间的相关性。如果两样本之间存在着比较明显的差异,那么这两坐标点在得分图上的位置会相对较远,反之亦然。取正常对照组与模型组大鼠的24h尿液样本进行pca分析,结果如图1,在pca得分图上显示正常对照组大鼠与heymann模型大鼠的样本点分散于不同的区域,呈明显的差异趋势,这说明采用注射fx1a抗血清的方法建立模型是可行的。正常对照组的样本点比较集中,主要分布在第二、三象限,具有一定的聚类性,说明其组内差异较小,内源性物质的代谢状态相对稳定,或是有一致的变化趋势;模型组的样本点主要集中在第一、四象限,样本点分布相对分散,而且该组的样本点都很明显地远离了正常对照组,这说明与正常对照组相比,大鼠在经过药物造模后,其尿液中的内源性物质代谢状态发生了一定的变化。由于pca是一种无督导的模式识别分析方法,对样本本身的个体差异或由外界因素干扰所造成的差异无法识别。为了减少或删除组内差异对分类造成的干扰,本实验数据还采用了有监督模式识别的偏最小二乘法判别分析(pls-da)。该方法与pca相比,主要是在分析的过程中引入了一个新的变量(y变量),此变量具有分类信息。结果见图2,经过pls-da方法分析后,与主成分分析得到的结果相比,该模型的拟合度更好,各组内的样本点也趋于集中,正常对照组与模型组之间分隔更远。
根据pls-da模型得到的变量权重值(vip),将vip值大于1的变量作为生物标志物的候选变量,为了验证多维统计中找到的候选变量是否在单位统计上具有显著差别,实验中采用t检验,其中p<0.05有显著性差异;结合载荷图来筛选候选变量,通过这些变量所代表的化合物的质谱信息,在metlin、hmdb、kegg、pubchem等数据库中进行搜索、匹配和推测,最终确定可能的生物标志物;所有数据采用spss20.0统计分析软件进行处理,各组数据以(mean±sd)表示,采用one-wayanova法来判别组间的差异性。本发明最终鉴定出大鼠被动型heymann肾炎模型的10个潜在生物标记物,分别是tryptophan、l-glutamate、succinicacid、creatinite、phytosphingosine、taurine、kynuricacid、phenylpyruvate、citricacid和uridine。
同时阐明了10个生物标记物在不同组别的相对含量变化,模型大鼠尿液中tryptophan的积分面积均数从正常大鼠的7.416降到5.324,
l-glutamate的积分面积均数从正常大鼠的2.930降到1.310,
succinicacid的积分面积均数从正常大鼠的1.383上升到3.844,
creatinite的积分面积均数从正常大鼠的2.993下降到1.958,
phytosphingosine的积分面积均数从正常大鼠的3.900上升到6.373,
taurine的积分面积均数从正常大鼠的4.931下降到2.446,
kynuricacid的积分面积均数从正常大鼠的1.113上升到1.553,
phenylpyruvate的积分面积均数从正常大鼠的1.810下降到1.191,
citricacid的积分面积均数从正常大鼠的5.238下降到3.336,
uridine的积分面积均数从正常大鼠的1.360下降到0.885。
【实施例3】
本实施例中的样本均来自于实施例1中的大鼠(正常对照组、模型组各6只)。在利用实施例2获得的评价方法进行验证构建成功的被动型heymann肾炎模型基础上继续进行以下试验和分析。
对照组和模型组的尿液代谢所鉴定生物标记物不同组别的相对含量变化见图3;图3的横坐标为生物标记物在对照组及模型组中信息,纵坐标为生物标记物相对含量,由图3可知,相比较对照组,被动型heymann肾炎模型大鼠尿液中succinic、phytosphingosin及kynuricacid含量升高,差异具有显著性;而其余7个生物标记物含量降低,差异具有显著性。
收集各组实验大鼠每周24小时产生的尿液并记录体积。将收集到的尿液置于添加了200μl1%叠氮化钠的ep管中,置于-70℃的冰箱中贮存,用于检测24小时尿蛋白的含量。于实验的最后一天麻醉处死各组所有大鼠,并采用心脏采血的方式取3ml左右,迅速在4℃,4000r·min-1下离心数分钟,分离得到血清,按试剂盒方法测定血浆中血清白蛋白(alb)、尿素氮(bun)、肌酐(cr)、总胆固醇(tch)和总甘油三酯(tg)含量。处死各组所有大鼠时,剖开腹腔,用肉眼观察大鼠的肾脏外形变化情况并记录,同时迅速在无菌条件下摘取大鼠的双肾,去掉包膜后分别用甲醛、戊二醛固定,进行肾组织病理及电镜检测。
1.生化指标检测
表1造模前后各组大鼠24h尿蛋白、alb、bun、cr、tch和tg含量变化(mean±sd,n=6)
注:与正常对照组相比*p<0.05**p<0.01
与空白组比较,被动型heymann肾炎大鼠24h尿蛋白、血浆中bun、cr、tch、tg含量均上升且差异具有显著性意义(p<0.01),alb含量则稍有下降,但同样具有显著性差异(p<0.01)。
2.肾组织病理学变化
肉眼观察,正常对照组(图4a)的大鼠肾脏大小以及形态均正常,颜色正常呈暗红色。模型组的大鼠肾脏明显肿大,不同于正常大小,颜色呈暗灰色。he染色后光镜观察,正常对照组的大鼠肾组织中肾小球结构以及大小均正常。肾小管大小、排列状况以及形态正常,未发现结晶物在肾小管管腔内沉积。与正常对照组相比,模型组(图4b)的大鼠肾组织中肾小球体积稍偏大,肾小球基底膜出现弥漫性增厚的现象。肾小管上皮细胞出现明显的空泡变性,发现有颗粒状变性,观察到管腔内有脱落坏死的上皮细胞,肾小管出现明显的萎缩现象。肾间质可观察到纤维结缔组织增生,足细胞出现肿胀。
由对照组结果可知,本试验的大鼠被动型heymann肾炎模型构建成功。本试验试验组与对照组相比,具有高效、快速、无创伤、特异性强的优点,试验组利用代谢组学技术方法找到大鼠被动型heymann肾炎模型生物标记物,通过机体终端产物尿液中内源性生物标记物含量的变化,评价被动型heymann肾炎模型,从而建立全面统一评价机体变化,可量化,同时针对被动型heymann肾炎的特异性的模型评价方法。
- 还没有人留言评论。精彩留言会获得点赞!