用于核酸药物线性DNA含量的检测方法与流程
本发明涉及生物医药领域,具体地,本发明涉及用于核酸药物线性dna含量的检测方法。
背景技术:
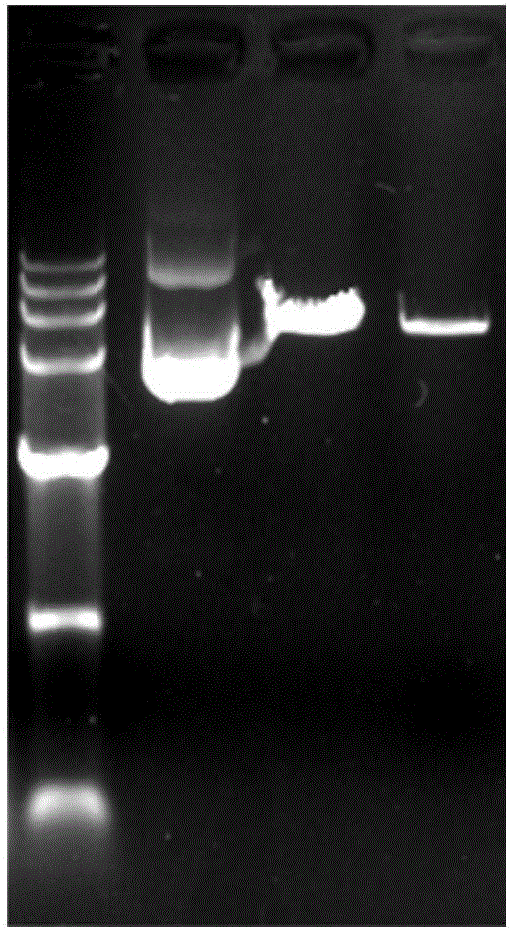
:细胞内双螺旋dna分子很长,通常是细胞长度的1000倍至几万倍,所以细胞内的dna必须要经过折叠和包装。dna双螺旋轴可进一步弯曲、缠绕成dna的三级结构--拓扑结构。最常见的三级结构是dna的超螺旋dna(supercoiledcirculardna,简称sc)、线性dna(lineardna,简称ldna)和开环dna(opencirculardna,简称oc)。在细菌细胞内,共价闭环质粒(cccdna)以超螺旋形式存在。在提取质粒过程中,除了超螺旋dna外,还会产生其它形式的质粒dna。如果质粒dna两条链中有一条链发生一处或多处断裂,分子就能旋转而消除链的张力,形成松弛型的环状分子,称开环dna;如果质粒dna的两条链在同一处断裂,则形成线状dna。技术实现要素:本发明是基于发明人对以下问题和事实的发现而做出的:发明人发现,以质粒为载体的核酸药物,其中,线性dna的含量是影响核酸药物活性的关键因素,线性dna的含量越高,核酸药物的活性越低,并且线性dna存在临床用药的风险,进而,如何快速准确的检测以质粒为载体的核酸药物中线性dna的含量,是本领域技术人员迫切要解决的问题。在本发明的第一方面,本发明提出了一种用于核酸药物线性dna含量的检测方法。根据本发明的实施例,所述方法包括:将待测核酸药物进行液相色谱分析,基于液相色谱分析的结果,确定所述待测核酸药物线性dna的含量,其中,所述液相色谱分析的条件是:流动相a为25mm硼酸,naoh或koh溶液调ph9.0,流动相b为25mm硼酸含1mnacl或kcl,naoh或koh溶液调ph9.0,上样量为5μl~10μl,流速为0.5~1.0ml/min,柱温25~40℃,检测波长260nm,采集时间10min,高斜率梯度洗脱,梯度斜率为5%~15%,梯度洗脱程序为:其中,所述线性dna的含量是通过如下方式确定的:确定线性dna含量在总dna含量中的比值,所述比值是通过液相色谱分析所得到线性dna对应的峰面积与总峰面积的比值确定的;将待测核酸药物的总dna含量与所述比值相乘,确定所述线性dna的含量,其中,所述总dna含量是通过对待测核酸药物进行紫外分光光度检测确定的。利用根据本发明实施例的用于核酸药物线性dna含量的检测方法,可快速(仅需10min)、准确、灵敏地(最低检测限可达30ng/μl)对核酸药物中线性质粒dna进行分离(主成分超螺旋dna与线性dna的分离度达1.5)和定量分析,可作为核酸药物(包括中间过程样品、原液、半成品、成品)的常规质控手段,可以为该药物的生产提供可靠的质控证据,为重组生物制品的研发和安全生产提供重要支持,进而保证临床用药的安全。在本发明的第二方面,本发明提出了一种用于核酸药物线性dna含量的检测方法。根据本发明的实施例,所述方法包括:将待测核酸药物进行液相色谱分析,基于液相色谱分析的结果,确定所述待测核酸药物线性dna的含量。利用根据本发明实施例的用于核酸药物线性dna含量的检测方法,可快速、准确、灵敏地对核酸药物中线性质粒dna进行分离和定量分析,可作为核酸药物(包括中间过程样品、原液、半成品、成品)的常规质控手段,可以为该药物的生产提供可靠的质控证据,为重组生物制品的研发和安全生产提供重要支持,进而保证临床用药的安全。根据本发明的实施例,上述用于核酸药物线性dna含量的检测方法还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述液相色谱分析的流动相a为25mm硼酸,流动相b为25mm硼酸含1mnacl/kcl。发明人通过大量的筛选实验发现,当流动相a采用25mm硼酸,流动相b采用含1mnacl或kcl的25mm硼酸时,核酸药物中线性dna和超螺旋dna分离度高,对核酸药物中线性dna的定量分析的准确度进一步提高。根据本发明的的实施例,所述流动相a和流动相b的ph为9.0。发明人发现,所述流动相ph为9.0,能够显著提高流动相的缓冲能力,适于线性dna与超螺旋dna的分离与定量。根据本发明的实施例,所述流动相a和流动相b的ph是采用naoh或koh进行调节的。根据本发明的实施例,流动相b采用含有nacl或kcl的硼酸溶液,进而优选采用对应的碱性溶液naoh或koh进行调节ph值,可避免引入其它离子,避免对离子交换色谱分离线性dna造成干扰,而影响洗脱效果和定量分析。根据本发明的实施例,所述液相色谱分析的上样量为5μl~10μl,流速为0.5~1.0ml/min,柱温为25~40℃,检测波长为260nm,采集时间为10min。发明人发现,本发明实施例的液相色谱分析采用上述上样量、流速、注温、检测波长和采集时间,能够使得核酸药物中线性dna和超螺旋dna的分离度大幅提高,对线性dna定量的准确度进一步提高。根据本发明的实施例,所述液相色谱分析采用高斜率梯度洗脱,所述梯度斜率为5%~15%。发明人经过大量的实验发现,梯度斜率低于5%,仅适用于开环dna与超螺旋dna的分离,而无法实现线性dna与超螺旋dna的分离,无法对线性dna进行定量;梯度斜率高于15%,无法实现线性dna与超螺旋dna的完全分离,影响线性dna的准确定量;采用梯度斜率为5%~15%洗脱程序,可实现线性dna与超螺旋dna的完全分离并准确定量。根据本发明的实施例,所述液相色谱分析采用的梯度洗脱的程序为:发明人经过实验发现,在上述梯度洗脱的条件下,核酸药物中线性dna和超螺旋dna的分离度高,可对线性dna进行准确定量。根据本发明的实施例,所述线性dna的含量是通过如下方式确定的:确定线性dna含量在总dna含量中的比值,所述比值是通过液相色谱分析所得到线性dna对应的峰面积与总峰面积的比值确定的;将待测核酸药物的总dna含量与所述比值相乘,确定所述线性dna的含量,其中,所述总dna含量是通过对待测核酸药物进行紫外分光光度检测确定的。利用根据本发明实施例的上述确定线性dna的含量的方式,可准确定量待测核酸药物中线性dna的含量。根据本发明的实施例,当线性dna的含量在30ng/微升~480ng/微升时,所述线性dna的含量是基于下列方程确定的:y=0.9692x-44.088,其中,x表示线性dna的含量,y表示线性dna对应的峰面积。发明人考察了质粒线性dna的不同进样量与峰面积的关系,意外地发现质粒线性dna的不同进样量与峰面积,在线性dna的含量在30ng/微升~480ng/微升时,存在明显的线性关系,进而当线性dna的含量在30ng/微升~480ng/微升时,可通过直接检测待测核酸药物中线性dna对应的峰面积,通过上述方程计算出线性dna的含量,检测方法更加快捷。附图说明图1是根据本发明实施例的质粒图谱;图2是根据本发明实施例的酶切后质粒的凝胶电泳图谱;图3是根据本发明实施例的未经酶切的质粒核酸药物的凝胶电泳图谱;图4是根据本发明实施例的在条件1的色谱条件下,酶切前样品b(即主成分超螺旋dna)的色谱图;图5是根据本发明实施例的在条件1的色谱条件下,酶切后样品a(线性dna)的色谱图;图6是根据本发明实施例的在条件1的色谱条件下,a和b混合进样的色谱图;图7是根据本发明实施例的在条件2的色谱条件下,a和b混合进样的色谱图;图8是根据本发明实施例的在条件3的色谱条件下,a和b混合进样的色谱图;图9是根据本发明实施例的在条件4的色谱条件下,酶切前样品b(即主成分超螺旋dna)的50%进样量的色谱图;图10是根据本发明实施例的在条件4的色谱条件下,酶切后样品a(线性dna)的50%进样量的色谱图;图11是根据本发明实施例的在条件4的色谱条件下,b与a以体积比为1:1进行混合进样的色谱图;图12是根据本发明实施例的在条件4的色谱条件下,酶切前样品b的90%进样量的色谱图;图13是根据本发明实施例的在条件4的色谱条件下,酶切后样品a的10%进样量的色谱图;图14是根据本发明实施例的在条件4的色谱条件下,b与a以体积比为9:1进行混合进样的色谱图;以及图15是根据本发明实施例的供试品(待测核酸药物)线性dna的检测色谱图。具体实施方式下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例1线性dna的制备在以下实施例中所用到的线性dna是通过如下方法制备的:1、采用sali对质粒(质粒图谱如图1所示)进行单酶切,酶切体系如表1所示:表1纯化水31.4ul10×hbuffer5ul质粒dna(600ug/ml)12.5ulsali(15u/ul)1.1ul总体积50ul2、将配置好的酶切体系轻轻涡旋振荡,短暂离心,置于37℃水浴2h。3、水浴完毕后,将酶切产物稀释不同浓度,加入10×上样缓冲液(终浓度1×)进行琼脂糖凝胶电泳检测,检测结果如图2所示,其中第一道样品为未经酶切的质粒核酸药物,第二、三泳道样品为经过酶切的不同浓度质粒核酸药物,琼脂糖凝胶电泳结果显示质粒dna已完全酶切线性化,同时表明质粒dna电泳速率为sc>l>oc。另外,发明人对未经酶切的质粒核酸药物进行单独的琼脂糖凝胶电泳,图谱如图3所示,图3显示未经酶切的质粒核酸药物含有多种构型,其中1指示二聚体,2指示开环dna,3指示线性dna,4指示超螺旋dna,5指示单链dna。其中,3指示的线性dna的含量是发明人需要严格质控的参数。实施例2在本实施例中,发明人详细介绍了液相色谱分析条件的筛选过程。条件1:1)流动相a和流动相b,流动相a为20mmtris,流动相b为含1mnacl的20mmtris,并用hcl溶液调节流动相到ph9.0,采用0.22um水系滤膜过滤流动相a和b。2)其它色谱条件如表2和表3所示。表2:表3:梯度洗脱程序:在条件1的色谱条件下,将酶切后获得的质粒线性dna样品a与酶切前样品b混合,进样,进而进行回收率试验,以此考察条件1下方法的专属性和准确度。色谱结果如图4、图5、图6所示,其中,图4显示了酶切前样品b(即主成分超螺旋dna)的色谱图,图5显示了酶切后样品a(线性dna)的色谱图,图6显示了a和b混合进样的色谱图。综合图4~图6可以看出,在条件1下,质粒主成分(超螺旋dna)与质粒线性dna无法分离,保留时间均为14分钟,峰重叠,无法对质粒线性dna进行定量分析。条件2:1)流动相a和流动相b,流动相a为25mm硼酸,流动相b为含1mnacl的25mm硼酸,并用naoh溶液调节ph9.0,采用0.22um水系滤膜过滤流动相。2)其它色谱条件如表4和表5所示表4:表5:梯度洗脱程序(梯度斜率低于5%):在条件2的色谱条件下,将酶切后获得的质粒线性dna样品a与酶切前样品b混合,进样,进而进行回收率试验,以此考察条件2下方法的专属性和准确度。色谱结果如图7所示,图7结果表明,在条件2的色谱条件下,图7显示线性dna(4.713min)与超螺旋dna(4.598min)未实现完全分离,因而无法对线性dna进行定量分析。条件3:1)流动相a和流动相b,流动相a为25mm硼酸,流动相b为含1mnacl的25mm硼酸,并用naoh溶液调节ph9.0,采用0.22um水系滤膜过滤流动相。2)其它色谱条件如表6和表7所示表6:条件内容名称/指标液相色谱仪agilent1260检测器/检测波长260nm色谱柱tskgeldna-npr(0.46id×7.5cm,tosoh)保护柱guardcolumn(0.46id×0.5cm,tosoh)流速1.0ml/min上样浓度150ng/μl进样量5μl采集时间15min柱温40℃表7:梯度洗脱程序(梯度斜率高于15%):在条件3的色谱条件下,将酶切后获得的质粒线性dna样品a与酶切前样品b混合,进样,进而进行回收率试验,以此考察条件3下方法的专属性和准确度。色谱结果如图8所示,图8结果表明,在条件3的色谱条件下,图8显示线性dna(4.443min)与超螺旋dna(4.281min)仍未实现完全分离,无法对线性dna进行准确定量。条件4:1)流动相a和流动相b,流动相a为25mm硼酸,流动相b为含1mnacl的25mm硼酸,并用naoh溶液调节ph9.0,采用0.22um水系滤膜过滤流动相。2)其它色谱条件如表8和表9所示表8:条件内容名称/指标液相色谱仪agilent1260检测器/检测波长260nm色谱柱tskgeldna-npr(0.46id×7.5cm,tosoh)保护柱guardcolumn(0.46id×0.5cm,tosoh)流速1.0ml/min上样浓度150ng/μl进样量10μl采集时间10min柱温40℃表9:梯度洗脱程序:在条件4的色谱条件下,将酶切后获得的质粒线性dna样品a与酶切前样品b进行不同体积混合(体积比b:a=1:1,b:a=9:1),进样,进而进行回收率试验,以此考察条件4下方法的专属性和准确度。色谱结果如图9~图14所示,其中,图9显示了酶切前样品b(即主成分超螺旋dna)的50%进样量的色谱图,图10显示了酶切后样品a(线性dna)的50%进样量的色谱图,图11显示了b与a以体积比为1:1进行混合进样的色谱图,图12显示了酶切前样品b的90%进样量的色谱图,图13显示了酶切后样品a的10%进样量的色谱图,图14显示了b与a以体积比为9:1进行混合进样的色谱图。在条件4下,当b与a以体积比为1:1进行混合进样时,其回收率和峰分离度通过表10可得:表10:在条件4下,当b与a以体积比为9:1进行混合进样时,其回收率和峰分离度通过表11可得:表11:综合图9~图14以及表7和表11可以看出,在条件4下,色谱峰保留时间能与混样前各成分色谱峰保留时间一一对应,主成分色谱峰和线性dna的色谱峰分离度高,测得的线性质粒dna的回收率符合可接受标准80%~120%,表明在条件4下的检测方法法具有较好专属性和准确度。另外,由图14可以看出,在条件4下,可检测样品中30ng/μl的线性dna(10%a浓度为30ng/ul),表明该方法的灵敏度高,可实现以质粒为载体的核酸药物中微量的线性dna杂质的定量分析。条件5:1)流动相a和流动相b,流动相a为25mm硼酸,流动相b为含1mnacl的25mm硼酸,并用naoh溶液调节ph9.0,采用0.22um水系滤膜过滤流动相。2)其它色谱条件如表12和表13所示表12:条件内容名称/指标液相色谱仪agilent1260检测器/检测波长260nm色谱柱tskgeldna-npr(0.46id×7.5cm,tosoh)保护柱guardcolumn(0.46id×0.5cm,tosoh)流速0.5ml/min上样浓度150ng/μl进样量5μl采集时间10min柱温25℃表13:梯度洗脱程序:在条件5的色谱条件下,发明人将酶切后获得的质粒线性dna样品a与酶切前样品b进行不同体积混合(体积比b:a=1:1,b:a=9:1),进样,进而进行回收率试验。结果表明在条件5下,色谱峰保留时间能与混样前各成分色谱峰保留时间一一对应,主成分色谱峰和线性dna的色谱峰分离度高,测得的线性质粒dna的回收率符合可接受标准80%~120%,表明在条件5下的检测方法法具有较好专属性和准确度。实施例3线性dna量与峰面积线性关系考察在本实施例中,发明人在实施例2筛选得到的液相色谱的条件下,考察了质粒线性dna的进样量与峰面积的线性关系,其中考察的进样量和对应测出的锋面积如表14所示,表14由表14可以看出,线性dna的含量在30ng/微升~480ng/微升的范围内,质粒线性dna的进样量与峰面积有明显的线性关系,其线性关系可通过方程y=0.9692x-44.088表示,其中,x表示线性dna的含量,y表示线性dna对应的峰面积。实施例4应用在本实施例中,发明人采用实施例2中筛选出的色谱条件对提供的核酸药物供试品进行了线性dna含量检测,采用的方法的色谱条件如表15和表16所示。表15表16梯度洗脱程序色谱结果如图15所示,图15结果表明,在上述色谱条件下,供试品中线性dna(3.095min)可与超螺旋dna(2.919min)实现良好分离,并可进行线性dna定量分析,线性dna的含量通过如下方式计算得出:(1)线性dna对应的峰面积为470.12mau*s,总峰面积为1513.17mau*s,所以线性dna含量在总dna含量中的比值为470.12/1513.17=0.31;(2)对核酸药物供试品进行紫外分光光度(od260nm)检测确定核酸药物供试品的总dna含量为150ng/ul;(3)将总dna含量150ng/ul与比值0.31相乘,获得本实施例的核酸药物供试品中线性dna的含量为46.5ng/ul。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1