一种rhPTH蛋白或rhPTH蛋白制剂的检测方法和纯度的分析方法与流程
本发明涉及医学检验和药物分析领域,具体而言,涉及一种rhpth蛋白或rhpth蛋白制剂的检测方法和纯度的分析方法。
背景技术:
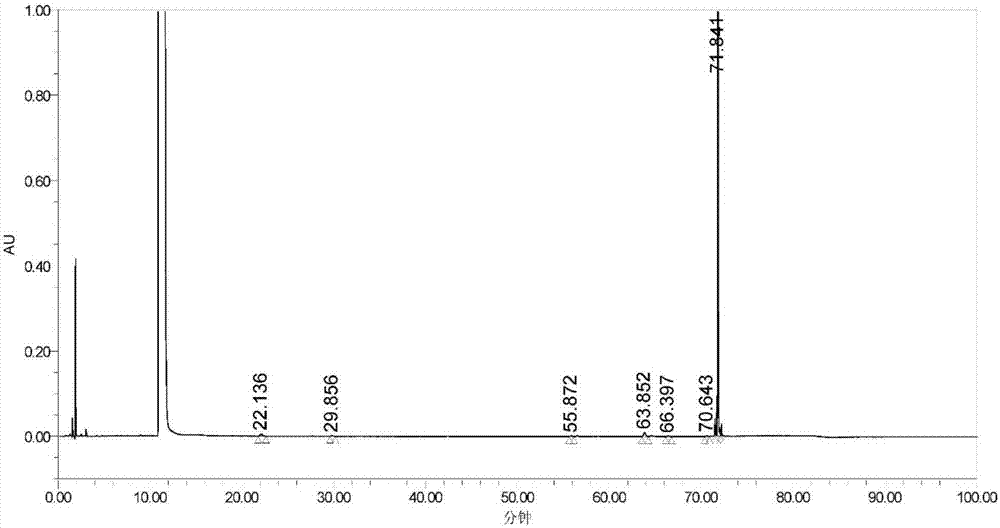
:药物的研制过程中,蛋白含量和纯度的检测方法是药物筛选以及质量控制的重要评价参数,该方法必须通过方法验证,满足专属性、精密度、准确度等方法验证方面的要求,这样才能保证检测结果的可靠性,才能用于指导药物的筛选以及产品质量控制。人甲状旁腺激素是维持机体血钙平衡的重要激素之一,其基本生理作用是通过增加成骨细胞数目,促进骨吸收及生长,rhpth是人内源性甲状旁腺激素的活性片段,每天注射一次可通过刺激成骨细胞活性,增加新骨在松质骨和皮质骨表面的聚集。由于rhpth产品处于开发阶段,目前针对rhpth含量和纯度的检测方法专属性、检测限、耐用性和精密度都还不够,需要进一步的提高。技术实现要素:本发明的第一目的在于提供一种rhpth蛋白或rhpth蛋白制剂的检测方法,通过该检测方法,能较好的提高检测的专属性、检测限和精密度,提供准确可靠的检测数据。本发明的第二目的在于提供一种rhpth蛋白或rhpth蛋白制剂纯度的分析方法,通过该分析方法,可以较好分析出不同样本的纯度和含量信息,为质量控制等提供较好的信息保障。为了实现本发明的上述目的,采用以下技术方案:一种rhpth蛋白或rhpth蛋白制剂的检测方法,包括以下步骤:将rhpth蛋白或rhpth蛋白制剂配置成待测溶液,将待测溶液注入高效液相色谱仪,在以下条件进行检测:色谱条件:色谱柱为反相色谱柱,流动相包括流动相a和流动相b,其中,流动相a主要由乙腈溶液和硫酸钠溶液按照8-15:85-92的体积比混合制得,流动相b主要由乙腈溶液和硫酸钠溶液按照45-55:45:55体积比混合制得;流动相a和流动相b的ph值为1.9-2.5;洗脱条件:洗脱时间及洗脱时间内流动相b的体积含量如下:0-5min,0~25%;5-15min,25%~35%;15-65min,35%~50%;65-70min,50%~100%;70-72min,100%;72-73min,100%~0;73-85min,0%;检测波长为210-220nm。一种rhpth蛋白或rhpth蛋白制剂纯度的分析方法,配置rhpth蛋白标准品的梯度浓度溶液以及rhpth蛋白或rhpth蛋白制剂待检品的溶液,按照上述的rhpth蛋白或rhpth蛋白制剂的检测方法进行色谱检测,根据色谱检测的结果计算得到rhpth蛋白或rhpth蛋白制剂待检品的纯度结果。与现有技术相比,本发明的有益效果为:本发明提供的rhpth蛋白或rhpth蛋白制剂的检测方法,通过优化流动相的配比、样品的浓度、检测时间、检测波长和柱温等条件,进一步提高检测的专属性、检测限和耐用性;采用该检测方法进行纯度分析也会具有较为精确的检测结果好而可靠的检测数据,具有较大的实际应用价值。附图说明为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。图1为本发明实验例1提供的现行检测方法的色谱图;图2为本发明实验例1提供的原研药的色谱图;图3为本发明实验例1提供的洗脱条件调整的色谱图。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。下面对本发明实施例的一种rhpth蛋白或rhpth蛋白制剂的检测方法和纯度的分析方法进行具体说明。一种rhpth蛋白或rhpth蛋白制剂的检测方法,包括以下步骤:将rhpth蛋白或rhpth蛋白制剂配置成待测溶液,将待测溶液注入高效液相色谱仪,在以下条件进行检测:色谱条件:色谱柱为反相色谱柱,流动相包括流动相a和流动相b,其中,流动相a主要由乙腈溶液和硫酸钠溶液按照8-15:85-92的体积比混合制得,流动相b主要由乙腈溶液和硫酸钠溶液按照45-55:45:55体积比混合制得;流动相a和流动相b的ph值为1.9-2.5;洗脱条件:洗脱时间及洗脱时间内流动相b的体积含量如下:0-5min,0~25%;5-15min,25%~35%;15-65min,35%~50%;65-70min,50%~100%;70-72min,100%;72-73min,100%~0;73-85min,0%;检测波长为210-220nm。进一步地,本发明的较佳实施例中,流动相a和流动相b的流速为0.8ml/min-1.3ml/min。进一步地,本发明的较佳实施例中,反相色谱柱为c18柱或c8柱。进一步地,本发明的较佳实施例中,待测溶液的加样量为45-60μl。进一步地,本发明的较佳实施例中,色谱柱的柱温为38℃-44℃。进一步地,本发明的较佳实施例中,待测溶液的浓度为0.2mg/ml-0.3mg/ml。进一步地,本发明的较佳实施例中,测溶液有测试母液制得,测试母液由rhpth蛋白或rhpth蛋白制制得。进一步地,本发明的较佳实施例中,测试母液的2mg/ml-3mg/ml。一种rhpth蛋白或rhpth蛋白制剂纯度的分析方法,配置rhpth蛋白标准品的梯度浓度溶液以及rhpth蛋白或rhpth蛋白制剂待检品的溶液,按照上述的rhpth蛋白或rhpth蛋白制剂的检测方法进行色谱检测,根据色谱检测的结果计算得到rhpth蛋白或rhpth蛋白制剂待检品的纯度结果。进一步地,本发明的较佳实施例中,还包括rhpth蛋白标准品的标准曲线的获得。以下结合实施例对本发明的特征和性能作进一步的详细描述。实施例1本实施例提供一种rhpth蛋白或rhpth蛋白制剂的检测方法,具体检测步骤如下:1.1将待检rhpth蛋白或rhpth蛋白制剂配置成测试母液,测试母液的浓度为2mg/ml;1.2将测试母液稀释成rhpth蛋白或rhpth蛋白制剂的待测溶液;待测溶液的浓度为0.2mg/ml;1.3流动相包括流动相a和流动相b,流动相a主要由乙腈溶液和硫酸钠溶液按照8:92的体积比混合制得,流动相a的ph值为1.9,流动相b主要由乙腈溶液和硫酸钠溶液按照45:55体积比混合制得,流动相b的ph值为2.5;1.4选择c18柱作为反相色谱柱,将45μl待测溶液加入到色谱柱中在210nm的检测波长、38℃的柱温下进行检测;1.5流动相的流速为0.8ml/min。洗脱条件为:洗脱时间及洗脱时间内流动相b的体积含量如下:0-5min,0~25%;5-15min,25%~35%;15-65min,35%~50%;65-70min,50%~100%;70-72min,100%;72-73min,100%~0;73-85min,0%。实施例2本实施例提供一种rhpth蛋白或rhpth蛋白制剂的检测方法,具体检测步骤如下:1.1将待检rhpth蛋白或rhpth蛋白制剂配置成测试母液,测试母液的浓度为3mg/ml;1.2将测试母液稀释成rhpth蛋白或rhpth蛋白制剂的待测溶液;待测溶液的浓度为0.3mg/ml;1.3流动相包括流动相a和流动相b,流动相a主要由乙腈溶液和硫酸钠溶液按照15:85的体积比混合制得,流动相a的ph值为2.5,流动相b主要由乙腈溶液和硫酸钠溶液按照55:45体积比混合制得,流动相b的ph值为1.9;1.4选择c8柱作为反相色谱柱,将60μl待测溶液加入到色谱柱中在220nm的检测波长、44℃柱温下进行检测;1.5流动相的流速为1.3ml/min。洗脱条件为:洗脱时间及洗脱时间内流动相b的体积含量如下:0-5min,0~25%;5-15min,25%~35%;15-65min,35%~50%;65-70min,50%~100%;70-72min,100%;72-73min,100%~0;73-85min,0%。实施例3本实施例提供一种rhpth蛋白或rhpth蛋白制剂的检测方法,具体检测步骤如下:1.1将待检rhpth蛋白或rhpth蛋白制剂配置成测试母液,测试母液的浓度为2.5mg/ml;1.2将测试母液稀释成rhpth蛋白或rhpth蛋白制剂的待测溶液;待测溶液的浓度为0.25mg/ml;1.3流动相包括流动相a和流动相b,流动相a主要由乙腈溶液和硫酸钠溶液按照10:90的体积比混合制得,流动相a的ph值为2.3,流动相b主要由乙腈溶液和硫酸钠溶液按照50:50体积比混合制得,流动相b的ph值为2.3;1.4选择c18柱作为反相色谱柱,将50μl待测溶液加入到色谱柱中在210nm的检测波长、40℃柱温下进行检测;1.5流动相的流速为1.0ml/min。洗脱条件为:洗脱时间及洗脱时间内流动相b的体积含量如下:0-5min,0~25%;5-15min,25%~35%;15-65min,35%~50%;65-70min,50%~100%;70-72min,100%;72-73min,100%~0;73-85min,0%。。实施例4本实施例提供一种rhpth蛋白或rhpth蛋白制剂纯度的分析方法,具体步骤如下:1.1配置rhpth蛋白标准品的梯度浓度溶液以及rhpth蛋白或rhpth蛋白制剂待检品的溶液;1.2按照实施例3提供的检测方法进行色谱检测;1.3根据色谱检测的结果计算得到rhpth蛋白标准品的标准曲线;1.4根据rhpth蛋白标准品的标准曲线技术计算得到rhpth蛋白或rhpth蛋白制剂待检品的纯度。实验例1本实验例对rhpth检测方法的优化实验。(1)现行rhpth蛋白纯度和有关物质检测方法waterssymmetry300c18(3.9mmid×150mm,5μm,),part.no.wat106154流动相a:95%水+5%乙腈+0.1%三氟乙酸,流动相b:5%水+95%乙腈+0.1%三氟乙酸分析条件为:流动相a和流动相b梯度洗脱;检测仪器:hplc,pda检测器;柱温30℃,检测波长220nm,记录时间35min,进样量10μg(40μl),洗脱条件如表1所示。表1现行色谱洗脱条件steptime(min)flow(ml/min)%solutiona%solutionb101.01000251.080203201.070304251.001005301.010006351.01000相应的色谱图如图1所示。(2)rhpth原研药质量标准中纯度和有关物质检测方法分析色谱柱:agilentzorbax300sb-c18(4.6×150mm、5μm、),part.no.863973-902;流动相a:0.2mna2so4(ph2.3):乙腈=90:10;流动相b:0.2mna2so4(ph2.3):乙腈=50:50;分析条件为:流动相a和流动相b梯度洗脱;检测仪器:hplc,pda检测器;柱温40℃,检测波长214nm,记录时间100min,进样量12.5μg(50μl),洗脱条件如表2所示。表2rhpth原研色谱条件steptime(min)flow(ml/min)%solutiona%solutionb101.01000221.01000381.076244681.060405751.001006801.001007821.0100081001.01000色谱检测的色谱图如图2所示。(3)在原研药检测方法的基础上进行洗脱梯度优化:分析色谱柱:agilentzorbax300sb-c18(4.6×150mm、5μm、),part.no.863973-902;流动相a:0.2mna2so4(ph2.3):乙腈=90:10;流动相b:0.2mna2so4(ph2.3):乙腈=50:50;分析条件为:流动相a和流动相b梯度洗脱;检测仪器:hplc,pda检测器;柱温40℃,检测波长214nm,记录时间100min,进样量12.5μg(50μl);条件分别如表3-7所示。表3调整洗脱梯度1steptime(min)flow(ml/min)%solutiona%solutionb101.01000221.01000381.076304681.060605751.001006801.001007821.0100081001.01000表4调整洗脱梯度2steptime(min)flow(ml/min)%solutiona%solutionb101.01000251.075253401.050504451.001005471.001006481.010007601.01000表5调整洗脱梯度表6调整洗脱梯度steptime(min)flow(ml/min)%solutiona%solutionb101.01000251.075253201.065354501.050505551.001006571.001007581.010008701.01000表7调整洗脱梯度steptime(min)flow(ml/min)%solutiona%solutionb101.01000251.075253151.065354651.050505701.001006721.001007731.010008851.01000洗脱梯度调整的色谱图如图3所示。从保留时间、峰面积、纯度、主峰与杂质的分离度(r>1.5),拖尾因子(0.8-1.5)和理论塔板数(不低于10000)等维度比较不同的色谱分析检测结果。结果如表8所示。表8不同方法的色谱结果比较从表8中可以看出,相比本品现行反相c18的方法,原研药rhpth有关物质的反相c18方法的流动相加了200mmna2so4后,有效的改善了峰型,拖尾因子接近1.0,两个色谱柱尺寸接近,agilent色谱柱粒径3.5um,分离度上有改善。因此,通过优化,得到较优的色谱条件:采用agilent色谱柱,经过5次洗脱梯度的调整,优化后的方法总运行时间为85min。纯度和现行反相c18的结果相近,主峰前后的分离度都在1.5以上,理论塔板数大于10000。实验例2本实验例对rhpth蛋白及rhpth蛋白相关制剂进行专属性、精密度、检测限和耐用性检测分析。色谱条件、分析方法参考实施例3的方法。样品如表9所示。表9rhpth蛋白及rhpth蛋白相关制剂名称批号规格贮存条件rhpth工作对照品201412060.49mg/ml-20℃、密封rhpth注射液01-20170322-010.25mg/ml冷藏、密封rhpth蛋白原液p201612011.43mg/ml-20℃、密封溶液制备处方缓冲液:8mmol/l醋酸盐缓冲液(ph4.0),45.4mg/ml甘露醇,3mg/ml间甲酚混合溶液,4℃保存备用;250μg/ml工作对照品溶液:取200μlrhpth作对照品,加192μl水混匀,精确稀释至250μg/ml。原液供试品:取100μl工艺室配制的rhpth蛋白原液,加水472μl精确稀释至250μg/ml,作为原液供试品。系统适用性样品:取lml工作对照品,加入1mhcl调成ph3.0,90℃水浴2小时,用水稀释到0.25mg/ml做为系统适应性溶液进行系统适应性确认。专属性实验结果如表10所示。表10专属性实验结果从表10可以看出,该反相分析方法对检测rhpth的专属性较好,主峰拖尾因子平均值为1.30,rhpth注射液中的辅料对主药的纯度测定无干扰。用pda检测器对系统适用性溶液进行3d扫描,供试品主峰纯度1角度均小于纯度1阈值,表明主峰纯度较高,为单一成分。检测限的检测结果如表11所示。表11检测限实验结果从表11可以看出,对rhpth主峰进行梯度稀释,当工作对照品进样浓度为4μg/ml时的三针信噪比平均值为8.6,大于3:1,当工作对照品进样浓度为2μg/ml时检测不到色谱峰,可以确定4μg/ml供试品的浓度为该方法的检测限。选择rhpth蛋白原液,进行6次重复的实验以进行重复性检验和中间精密度的检验,重复性检验结果如表12所示,中间精密度的检验如表13所示。表12重复性实验结果从表12可以看出,进行连续6次的重复实验,主峰纯度的相对标准偏差rsd=0.009≤2%,故重复性满足验证要求。表13中间精密度实验结果从表13可看出,通过6次连续的重复实验,主峰纯度的相对标准偏差rsd=0.096≤2%,故中间精密度满足验证要求。对系统耐用性进行了检验,通过改变流动相、ph值、柱温和柱温等条件,以检验系统的耐用性,检验结果如表14所示。表14系统耐用性实验结果从表14可以看出,当检测条件改变时,主峰纯度检测结果不受流速,柱温,流动相ph值和盐离子浓度的影响,rsd均≤2%,分离度r均>1.5,拖尾因子均位于0.8~1.5之间,系统耐用性较好。实验例3本实验例主峰纯度检测结果不受流速,柱温,流动相ph值和盐离子浓度的影响,rsd均≤2%,分离度r均>1.5,拖尾因子均位于0.8~1.5之间,系统耐用性较好。综上所述,本发明实施例提供的rhpth蛋白或蛋白制剂的检测方法和纯度分析,通过高效液相的色谱分析,可以提供较好的实验结果,且检测和分析方法具有较好的专属性,检测限较低,可以提供灵敏的检测,方法的重复性较好,中间精密度也较好,整个检测方法的系统耐用性也较高;说明本发明提供的rhpth蛋白或蛋白制剂的检测方法和纯度的分析方法,具有较高的实用性和较高的推广应用价值。以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1