1-十六酰-SN-丙三醇-磷酸胆碱和十二烷二酸为特发性男性不育诊断标志物及其应用的制作方法
本发明属于分析化学及临床医学领域,涉及尿液中与特发性男性不育相关的1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸作为生物标志物及其基于uplc-qexactivems的检测方法和应用。
背景技术:
目前,全球约有10-15%的育龄夫妇患有生育障碍。我国由于人口基数大,新婚夫妇中不孕不育的患者人数远超过百万,其中男性因素导致的不育高于50%。男性不育中目前仍有约40%-75%找不到原因,称为特发性男性不育症。特发性男性不育造成了极为严重的疾病负担。
事实上,特发性男性不育诊断存在很大难度。男性不育的who的诊断标准是夫妻婚后同居1年以上,未采取避孕措施,由于男方原因造成女方不孕者。然而,由于现实原因很多夫妻并不能保证严格的同居1年,使得最后的男性不育判断变得非常困难;同居长达1年的观察时间,大大耽误了对男性不育进行早期治疗和干预的时间;为了排除女方原因,女方还需要进行详细的检查,带来了沉重的经济和医疗负担。现有的男性不育相关检查依赖的是传统的精液常规检查,它只关注精子数量、运动度、精液量、ph和液化时间等常规参数。因为受到禁欲时间等因素的影响,常规精液参数常规分析结果表现为较大的波动性。因而,临床诊断往往需要参考多次精液常规分析,给医生和患者带来了负担。更为重要的是,传统的精液参数检查不能全面地反应精液的全部状况。因此,男性不育经常表现为常规精液参数无明显异常,也使得传统的精液参数检查并不能有效诊断男性不育。因而,临床上亟需用于特发性男性不育的新的诊断方法。
代谢组学是继基因组学、蛋白组学、转录组学之后一门新兴的组学技术,它是通过高通量考察生物体系在遗传改变和/或环境改变后代谢产物的变化研究生物体系的一门科学。代谢组学研究具有“无偏”、“全局”、“无假设”、“由数据驱动假设”的特点,因而研究的结论往往具有较高的可靠性和创新性。代谢组学可以系统性回顾、分析和探索细胞、组织和器官产生的小分子生物标记物及其变化情况,更加直观地了解功能表型改变的物质基础,其对象涉及脂代谢、糖代谢、氨基酸代谢、核酸代谢、辅酶代谢等生物体的代谢网络,是比基因组学、蛋白组学、转录组学更接近“表型”的组学。代谢组学由于其分析的样本可以为尿液这些无创的样本,可大大减少病人采样的创伤。代谢组学在复杂疾病的诊断中表现出极高的应用潜力和价值,具有灵敏度高且稳定的特点。代谢组学通过对机体的整体代谢组分进行分析研究,从中找出特异性生物标志物,可对临床疾病进行及时、准确、高灵敏度和高特异性的诊断。目前代谢组学在疾病的诊断方面主要应用于冠心病、肝脏疾病、糖尿病、高血压、肥胖和肿瘤。值得注意的是,尿液是临床上容易获得的生物样本,具有无创、体积大的优点。特别适合疾病的诊断和筛查。然而,采用代谢组学分析尿液代谢小分子在特发性男性不育的诊断监测中的应用还未得到相应的关注。
目前常见的代谢组学检测平台主要包括核磁共振(nmr)、气相色谱串联质谱(gc-ms)、液相色谱串联质谱(lc-ms)和毛细管电泳串联质谱(ce-ms)。核磁共振虽然是化学物定性的金标准,但存在灵敏度低的缺点,难以获得较为完整的代谢谱。串联质谱具有灵敏度高和定性准确的优势。但是,气相色谱串联质谱只限于检测易挥发的物质,检测范围不能覆盖代谢谱的要求。为了弥补该缺陷,气相色谱串联质谱往往采用衍生化的方法检测化学物,这使得前处理方法变得复杂,引入更多的误差。同时,气相色谱串联质谱检测由于分离技术的限制,一般检测时间较长,延长了实验周期,增加了仪器占用率,限制了其在大样本人群检测中的应用。毛细管电泳串联质谱,对极性化合物的分离检测具有优势,但仪器稳定性的问题较难解决。而液相色谱串联质谱具有样本处理简单,灵敏度高,临床实用性强的特点,可以很好地解决上述问题。uplc-qexactivems是新一代高分辨质谱与超高效液相的组合,具有相比传统lc-ms更强的灵敏度、特异度和稳定性。故而采用uplc-qexactivems进行尿液代谢小分子的代谢组学分析,若能发现稳定的与特发性男性不育发病相关的特异尿液代谢小分子作为生物标志物,并研发相应的代谢小分子标志的uplc-qexactivems检测方法,不仅在该领域处于国际领先地位,还可创造令人瞩目的经济效益,对提高我国男性生殖健康水平也将是一次强有力的推动。
技术实现要素:
本发明的目的是提供与特发性男性不育相关的尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸标志物。
本发明另一个目的是提供上述尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸标志物的检测方法。
本发明再有一个目的是提供检测上述尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸标志物的试剂盒。
本发明的目的是通过下列技术措施实现的:
与特发性男性不育相关的尿液标志物,该标志物为尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸。
所述的尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸标志物在制备特发性男性不育诊断或监测试剂盒中的应用。
一种诊断或监测特发性男性不育的试剂盒,该试剂盒含有检测尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的试剂。
所述的试剂盒,该试剂盒含有采用uplc-qexactivems方法检测尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸试剂。
所述的试剂盒,该试剂盒含有下列试剂:
1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸标准品;
内标a:肌酐、缬氨酸、烟酸、胸腺嘧啶、戊二酸、l-苯基丙胺酸、n-乙酰对氨基酚、马尿酸中一种或多种物质的同位素内标(氘标,水溶液);
内标b:十五烷酸的同位素内标(氘标,甲醇溶液);
内标c:二十四烷酸的同位素内标(氘标,甲醇溶液)。
进一步,该试剂盒还含有:
hypersilgoldc18色谱柱;
试剂a:沉淀蛋白用,含100%甲醇;
试剂b:流动相用,含0.1%的甲酸的水;
试剂c:流动相用,含0.1%的甲酸的乙腈;
试剂d:复溶用,超纯水。
一种检测如前所述的与特发性男性不育相关的尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸标志物的方法,该方法采用uplc-qexactivems方法,检测尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸含量。
上述检测方法中:
一、液相条件:
液相色谱柱为hypersilgoldc18色谱柱,柱温为40℃;
流动相a为含0.1%甲酸的水,流动相b为含0.1%甲酸的乙腈,流速为400μl/min;
仪器梯度为:0-3min1%b,3-10min1%到99%b,10-13min99%b,13-13.1min99%到1%b,13.1-17min1%b;(各梯度中流动相a的量与对应的流动相b的量共100%,下同)
进样方式:体积5μl;
二、质谱条件
采用加热电喷雾电离方式(hesi)进行分析,正离子模式喷雾电压:3.5kv;负离子模式喷雾电压:2.5kv;两种模式下毛细管温度:250℃,加热器温度:425℃,鞘气气流:50au,辅助气气流:13au,反吹气气流:0au;透镜电压:60v;采用全扫模式,扫描范围:70到1050m/z;分辨率:70000。
本发明详细描述如下:
本发明人以标准操作程序(sop)采集符合标准的尿液样本,系统收集完整的人群基础信息和临床资料,并采用了基于uplc-qexactivems的代谢组学方法进行分析。
具体来说研究的实验方法主要包括以下几个部分:
一、研究对象选择和分组依据
第一阶段筛选阶段
随机纳入明确诊断的特发性男性不育607人和健康对照430人,共1037人。
a组:健康对照组(430人):
1.年龄在19至39岁之间;
2.体质指数在17至31之间;
3.生殖能力健康的男性,而且6-8个月后有了健康的后代;
4.无全身重大疾病。
b组:特发性男性不育疾病组(607人):
1.年龄与对照组匹配;
2.体质指数与对照组匹配;
3.尝试怀孕12个月没有成功,而配偶没有不孕疾病的男性;
4.无明确男性不育病因;
5.吸烟饮酒史与对照组匹配;
6.民族与对照组匹配;
7.无全身重大疾病。
第二阶段验证阶段
纳入明确诊断的特发性男性不育15人和健康对照15人,共30人。
a组:健康对照组(15人):
1.年龄在24到36岁之间;
2.体质指数在19至24之间;
3.生殖能力健康的男性,而且6-8个月后有了健康的后代;
4.无全身重大疾病。
b组:特发性男性不育疾病组(15人):
1.年龄与对照组匹配;
2.体质指数与对照组匹配;
3.尝试怀孕12个月没有成功,而配偶没有不孕疾病的男性;
4.无明确男性不育病因;
5.吸烟饮酒史与对照组匹配;
6.民族与对照组匹配;
7.无全身重大疾病。
二、uplc-qexactivems代谢组学分析和特发性男性不育诊断用尿液生物标志物1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的筛选和验证
1.样本前处理
1.1.取300μl尿液、加入10μl内标a,加入10μl内标b,加入10μl内标c,加入甲醇900μl(试剂a),涡旋30s。
1.2.离心机中4℃16000g离心15min,将上清液转移至1.5ml进口ep管,并将上清液在室温条件下于离心浓缩干燥仪中浓缩至干。
1.3.用5μl超纯水(试剂d)复溶,待分析。
2.仪器检测
2.1.分析仪器:uplcultimate3000system(dionex)高效液相色谱仪;q-exactive高分辨质谱仪。
2.2.液相条件:
2.2.1.液相色谱柱为hypersilgoldc18色谱柱(100mm×2.1mm,粒径1.9μm,thermoscientific,germany),柱温为40℃。
2.2.2采用的流动相为(a)含0.1%甲酸的水(试剂b)和(b)含0.1%甲酸的乙腈(试剂c),流速为400μl/min。
2.2.3仪器梯度为:0-3min1%b,3-10min1%到99%b,10-13min99%b,13-13.1min99%到1%b,13.1-17min1%b。
2.2.4进样方式:体积5μl。
2.3.质谱条件
2.3.1加热电喷雾电离方式(hesi)进行分析。
2.3.2采用加热电喷雾电离方式(hesi),正离子模式喷雾电压:3.5kv;负离子模式喷雾电压:2.5kv;两种模式下毛细管温度:250℃,加热器温度:425℃,鞘气气流:50au,辅助气气流:13au,反吹气气流:0au;透镜电压:60v。采用全扫模式,扫描范围:70到1050m/z;分辨率:70000。
3.物质定性
生物标志物定性采用与标准品1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸比对色谱信息(保留时间)和质谱信息(精确分子量),并实时比对样本中同位素内标标准品系列的色谱信息以校正保留时间。
4.数据分析:
生物标志物筛选采用多元logistic回归确认关键代谢物。
5.健康对照组、特发性男性不育组尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的的差异和诊断意义。
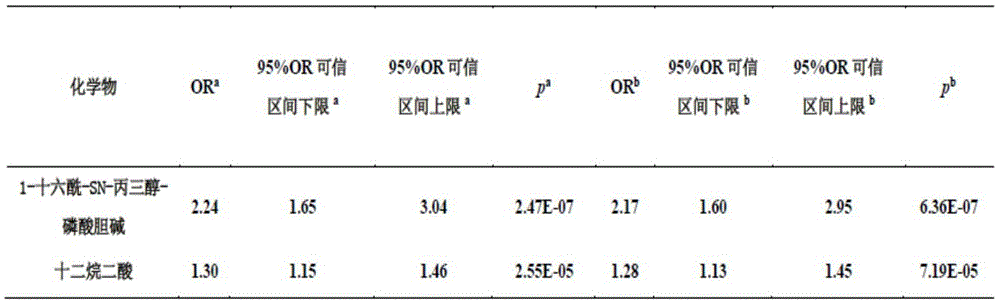
经过校正年龄、体质指数、吸烟和饮酒史的信息,多元logistic回归分析发现尿液样本中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的含量与特发性男性不育密切相关。采用随机人群应用上述代谢小分子组合诊断特发性男性不育,灵敏度为86.67%,特异度为93.33%,roc曲线下面积为0.9289,具有较高的辅助诊断价值。
三、诊断试剂盒制备方法
根据上述一系列实验结果,本发明人还制备了一种能诊断或监测特发性男性不育的试剂盒,所述试剂盒含有用于检测与特发性男性不育相关的尿液生物标志物1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的试剂,包含测定受试者尿液中稳定存在且可检测的1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的标准品以及辅助分析的内标标准品系列。诊断试剂盒还可以包括一套尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸提取及色谱分离用试剂及器材。
本发明的有益效果:
本发明人通过采用uplc-qexactivems比较正常对照和特发性男性不育尿液中的代谢小分子,发现了尿液中存在可用于评估是否患有特发性男性不育,具有诊断价值的尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸组合,以及该尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸检测的uplc-qexactivems的应用,研制出可便于临床应用的特发性男性不育诊断、监测试剂盒。
本发明采用尿液代谢小分子作为特发性男性不育评价的标志物的优越性在于:
(1)尿液代谢小分子是一种新型生物标志物,其与疾病结局关联强,不仅稳定、微创、易于检测,且定量精确,将大大提高特发性男性不育诊断的敏感性和特异性,该类小分子生物标志物的成功开发将为特发性男性不育的防治开创全新局面,为其他疾病生物标志物的研制提供借鉴。
(2)本发明提供的尿液代谢小分子标志物可用作特发性男性不育的诊断标志物,可在早期辅助诊断特发性男性不育,从而为临床医生进一步深入检查提供依据,为快速准确掌握患者的疾病状态和病情严重程度、及时采取更具个性化的防治方案提供支持,延缓和阻止疾病进展。
(3)本发明采用特发性男性不育和健康对照随机人群的尿液样本进行验证,证明了尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸水平在诊断特发性男性不育中具有较高灵敏度和特异度,可作为标志物使用。
(4)本发明采用严密、多阶段的验证和评价体系,初期通过预实验筛选多种尿液代谢小分子,应用uplc-qexactivems进行独立人群验证,保证了该尿液代谢生物标志物和诊断方法的可靠性。
(5)uplc-qexactivems技术样本处理简单,仪器分析迅速准确,具有较高的临床诊断实用价值。
附图说明
图1筛选阶段,经过校正年龄、体质指数、吸烟和饮酒史的信息,多元logistic回归分析发现尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸与特发性男性不育密切相关。a未调整混杂因素的单因素logistic回归结果。b调整年龄、体质指数、吸烟和饮酒史后的多元logistic回归结果。
图2代谢检测水平波动性(均数±标准差)。
图3验证阶段,采用尿液1-十六酰-sn-丙三醇-磷酸胆碱含量信息制作的正常对照组和特发性男性不育组之间的roc曲线。
图4验证阶段,采用尿液十二烷二酸含量信息制作的正常对照组和特发性男性不育组之间的roc曲线。
图5验证阶段,采用尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸含量信息制作的正常对照组和特发性男性不育组之间的roc曲线。
具体实施方式
以下通过实施例对本发明作进一步的阐述。
实施例1:研究对象选择和分组依据
本部分研究对象来自南京医科大学附属医院的首诊特发性男性不育病例及健康生育对照。研究内容和知情同意书均得到南京医科大学伦理委员会的批准,符合相关法规的要求。病例和对照在了解内容后签署了知情同意书。所有研究对象均进行了完整的体格检查,并完成了一份包括个人基础资料、生活习惯、职业和环境暴露、遗传危险因素、性功能与生殖功能、疾病史和体力活动的调查问卷。第一阶段纳入了符合要求的607例特发性男性不育病例和430例健康对照;第二阶段符合要求的15例特发性男性不育病例和15例健康对照作为特发性男性不育尿液生物标志物的筛选实验对象。具体的样品归类标准如下:
第一阶段筛选阶段
随机纳入明确诊断的特发性男性不育607人和健康对照430人,共1037人。
a组:健康对照组(430人):
1.年龄在19至39岁之间;
2.体质指数在17至31之间;
3.生殖能力健康的男性,而且6-8个月后有了健康的后代;
4.无全身重大疾病。
b组:特发性男性不育疾病组(607人):
1.年龄与对照组匹配;
2.体质指数与对照组匹配;
3.尝试怀孕12个月没有成功,而配偶没有不孕疾病的男性;
4.无明确男性不育病因;
5.吸烟饮酒史与对照组匹配;
6.民族与对照组匹配;
7.无全身重大疾病。
第二阶段验证阶段
纳入明确诊断的特发性男性不育15人和健康对照15人,共30人。
a组:健康对照组(15人):
1.年龄在24到36岁之间;
2.体质指数在19至24之间;
3.生殖能力健康的男性,而且6-8个月后有了健康的后代;
4.无全身重大疾病。
b组:特发性男性不育疾病组(15人):
1.年龄与对照组匹配;
2.体质指数与对照组匹配;
3.尝试怀孕12个月没有成功,而配偶没有不孕疾病的男性;
4.无明确男性不育病因;
5.吸烟饮酒史与对照组匹配;
6.民族与对照组匹配;
7.无全身重大疾病。
实施例2:uplc-ms代谢组学特发性男性不育生物标志物筛选
1.样本前处理
1.1.取300μl尿液、加入10μl内标a,加入10μl内标b,加入10μl内标c,加入甲醇(试剂a)40μl,涡旋30s。
1.2.离心机中4℃16000g离心15min,将上清液转移至1.5ml进口ep管,并将上清液在室温条件下于离心浓缩干燥仪中浓缩至干。
1.3.用5μl超纯水(试剂d)复溶,待分析。
2.仪器检测
2.1.分析仪器:uplcultimate3000system(dionex)高效液相色谱仪;q-exactive高分辨质谱仪。
2.2.液相条件:
2.2.1液相色谱柱为hypersilgoldc18色谱柱(100mm×2.1mm,粒径1.9μm,thermoscientific,germany),柱温为40℃。
2.2.2采用的流动相为(a)含0.1%甲酸的水(试剂b)和(b)含0.1%甲酸的乙腈(试剂c),流速为400μl/min。
2.2.3仪器梯度为:0-3min1%b,3-10min1%到99%b,10-13min99%b,13-13.1min99%到1%b,13.1-17min1%b。
2.2.4进样方式:体积5μl。
2.3.质谱条件
2.3.1加热电喷雾电离方式(hesi)进行分析。
2.3.2采用加热电喷雾电离方式(hesi),正离子模式喷雾电压:3.5kv;负离子模式喷雾电压:2.5kv;两种模式下毛细管温度:250℃,加热器温度:425℃,鞘气气流:50au,辅助气气流:13au,反吹气气流:0au;透镜电压:60v。采用全扫模式,扫描范围:70到1050m/z;分辨率:70000。
3.物质定性
生物标志物定性采用与标准品1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸比对色谱信息(保留时间)和质谱信息(精确分子量),并实时比对样本中同位素内标标准品系列的色谱信息以校正保留时间。
4.数据分析:
生物标志物筛选采用多元logistic回归确认关键代谢物。
5.健康对照组、特发性男性不育组尿液样本中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸差异和诊断意义。
经过校正年龄、体质指数、吸烟和饮酒史的信息,多元logistic回归分析发现尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸与特发性男性不育密切相关(图1)。
实施例3尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的稳定性分析
采用实施例2的方法对尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸水平的稳定性进行评价(间隔时间为2周)。结果显示,尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸测定水平稳定(图2),具备作为诊断/监测标志物的特性。
实施例4尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸组合对特发性男性不育的诊断
根据上述uplc-qexactivems代谢组学方法,本发明人通过对随机人群15病例和15对照的尿液样品检测1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸,以此绘制roc曲线并评估诊断的灵敏性和特异性,进而评估检测尿液中这2个物质水平对特发性男性不育的诊断能力。
1-十六酰-sn-丙三醇-磷酸胆碱的灵敏度为73.33%,特异度为93.33%,roc曲线下面积为0.8756(图3);十二烷二酸灵敏度为73.33%,特异度为93.33%,roc曲线下面积为0.8356(图4)。
组合1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的灵敏度为86.67%,特异度为93.33%,roc曲线下面积为0.9289(图5)。
故而组合1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸具有较好地诊断特发性男性不育的能力。
实施例5用于特发性男性不育尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸检测和诊断试剂盒的制作
首先通过uplc-qexactivems的方法确定正常对照和特发性男性不育尿液中具有较高丰度的代谢小分子。然后,在其中通过基于uplc-qexactivems的代谢组学技术筛选与特发性男性不育相关的生物标志物,作为是否为特发性男性不育的诊断指标。优选将筛选出的对应尿液生物标志物的数量控制在2个,这是在预实验的基础上做出的最优化的精简。采用尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸这2个生物标志物,既可以保障较好的灵敏度与特异度,又能节省成本,减轻患者的负担,还能减少检测时间,具有快速、准确、经济的优点,便于临床推广使用,当然采用其中1个标志物也可以,采用2个标志物效果更好。此试剂盒包括一批尿液1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸检测用试剂和耗材,其中生物标志物的定性和定量采用1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸标准品,辅助分析采用内标a:肌酐、缬氨酸、烟酸、胸腺嘧啶、戊二酸、l-苯基丙胺酸、n-乙酰对氨基酚、马尿酸八种物质的氘标同位素内标。内标b:十五烷酸的氘标同位素内标。内标c:二十四烷酸的氘标同位素内标。其它还有用于uplc色谱分离的配套反向色谱柱(hypersilgoldc18色谱柱,100mm×2.1mm,粒径1.9μm)、用于沉淀尿液蛋白的试剂(100%甲醇),用于流动相的试剂(含0.1%的甲酸的水和含0.1%的甲酸的乙腈),用于提取1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸的试剂(100%超纯水)。此试剂盒的价值在于只需要300μl尿液,即可检测尿液中1-十六酰-sn-丙三醇-磷酸胆碱和十二烷二酸标志物的含量,再通过含量诊断特发性男性不育,并易于进行动态监测和观察治疗效果。
具体试剂盒组成如下:
1-十六酰-sn-丙三醇-磷酸胆碱标准品
十二烷二酸标准品
内标a(肌酐、缬氨酸、烟酸、胸腺嘧啶、戊二酸、l-苯基丙胺酸、n-乙酰对氨基酚、马尿酸八种物质的氘标同位素内标水溶液)
内标b(十五烷酸的氘标同位素内标甲醇溶液)
内标c(二十四烷酸的氘标同位素内标甲醇溶液)
进一步,还可以含有:
色谱柱(thermo100mm×2.1mm,粒径1.9μm,hypersilgoldc18色谱柱)
试剂a(100%甲醇)
试剂b(含0.1%的甲酸的水)
试剂c(含0.1%的甲酸的乙腈)
试剂d(100%超纯水)。
主要参考文献
asiago,v.m.,l.z.alvarado,n.shanaiah,g.a.gowda,k.owusu-sarfo,r.a.ballas,andd.raftery.2010.earlydetectionofrecurrentbreastcancerusingmetaboliteprofiling.cancerres70:8309-8318.
brindle,j.t.,h.antti,e.holmes,g.tranter,j.k.nicholson,h.w.bethell,s.clarke,p.m.schofield,e.mckilligin,d.e.mosedale,andd.j.grainger.2002.rapidandnoninvasivediagnosisofthepresenceandseverityofcoronaryheartdiseaseusing1h-nmr-basedmetabonomics.natmed8:1439-1444.
dunn,w.b.,d.i.broadhurst,h.j.atherton,r.goodacre,andj.l.griffin.2011.systemslevelstudiesofmammalianmetabolomes:therolesofmassspectrometryandnuclearmagneticresonancespectroscopy.chemicalsocietyreviews40:387-426.
glinski,m.,andw.weckwerth.2006.theroleofmassspectrometryinplantsystemsbiology.massspectrometryreviews25:173-214.
godin,j.p.,l.b.fay,andg.hopfgartner.2007.liquidchromatographycombinedwithmassspectrometryfor13cisotopicanalysisinlifescienceresearch.massspectrometryreviews26:751-774.
jessica,d.tracey,g.,r.mark,w.christos,g.,s,andmatthew,b.,c.,2016.theuseofmetabolomicstomonitorsimultaneouschangesinmetabolicvariablesfollowingsupramaximallowvolumehighintensityexercise.metabolomics12:7.
locasale,j.w.,a.r.grassian,t.melman,c.a.lyssiotis,k.r.mattaini,a.j.bass,g.heffron,c.m.metallo,t.muranen,h.sharfi,a.t.sasaki,d.anastasiou,e.mullarky,n.i.vokes,m.sasaki,r.beroukhim,g.stephanopoulos,a.h.ligon,m.meyerson,a.l.richardson,l.chin,g.wagner,j.m.asara,j.s.brugge,l.c.cantley,andm.g.vanderheiden.2011.phosphoglyceratedehydrogenasedivertsglycolyticfluxandcontributestooncogenesis.natgenet43:869-874.
munger,j.,b.d.bennett,a.parikh,x.j.feng,j.mcardle,h.a.rabitz,t.shenk,andj.d.rabinowitz.2008.systems-levelmetabolicfluxprofilingidentifiesfattyacidsynthesisasatargetforantiviraltherapy.natbiotechnol26:1179-1186.
nicholson,j.k.,j.connelly,j.c.lindon,ande.holmes.2002.metabonomics:aplatformforstudyingdrugtoxicityandgenefunction.natrevdrugdiscov1:153-161.
soga,t.,m.sugimoto,m.honma,m.mori,k.igarashi,k.kashikura,s.ikeda,a.hirayama,t.yamamoto,h.yoshida,m.otsuka,s.tsuji,y.yatomi,t.sakuragawa,h.watanabe,k.nihei,t.saito,s.kawata,h.suzuki,m.tomita,andm.suematsu.2011.serummetabolomicsrevealsgamma-glutamyldipeptidesasbiomarkersfordiscriminationamongdifferentformsofliverdisease.journalofhepatology55:896-905.
sreekumar,a.,l.m.poisson,t.m.rajendiran,a.p.khan,q.cao,j.yu,b.laxman,r.mehra,r.j.lonigro,y.li,m.k.nyati,a.ahsan,s.kalyana-sundaram,b.han,x.cao,j.byun,g.s.omenn,d.ghosh,s.pennathur,d.c.alexander,a.berger,j.r.shuster,j.t.wei,s.varambally,c.beecher,anda.m.chinnaiyan.2009.metabolomicprofilesdelineatepotentialroleforsarcosineinprostatecancerprogression.nature457:910-914.
suhre,k.,s.y.shin,a.k.petersen,r.p.mohney,d.meredith,b.wagele,e.altmaier,p.deloukas,j.erdmann,e.grundberg,c.j.hammond,m.h.deangelis,g.kastenmuller,a.kottgen,f.kronenberg,m.mangino,c.meisinger,t.meitinger,h.w.mewes,m.v.milburn,c.prehn,j.raffler,j.s.ried,w.romisch-margl,n.j.samani,k.s.small,h.e.wichmann,g.zhai,t.illig,t.d.spector,j.adamski,n.soranzo,andc.gieger.2011.humanmetabolicindividualityinbiomedicalandpharmaceuticalresearch.nature477:54-60.
wang,j.,p.alexander,l.wu,r.hammer,o.cleaver,ands.l.mcknight.2009.dependenceofmouseembryonicstemcellsonthreoninecatabolism.science325:435-439.
wang,t.j.,m.g.larson,r.s.vasan,s.cheng,e.p.rhee,e.mccabe,g.d.lewis,c.s.fox,p.f.jacques,c.fernandez,c.j.o'donnell,s.a.carr,v.k.mootha,j.c.florez,a.souza,o.melander,c.b.clish,andr.e.gerszten.2011a.metaboliteprofilesandtheriskofdevelopingdiabetes.natmed17:448-453.
wang,z.,e.klipfell,b.j.bennett,r.koeth,b.s.levison,b.dugar,a.e.feldstein,e.b.britt,x.fu,y.m.chung,y.wu,p.schauer,j.d.smith,h.allayee,w.h.tang,j.a.didonato,a.j.lusis,ands.l.hazen.2011b.gutflorametabolismofphosphatidylcholinepromotescardiovasculardisease.nature472:57-63.
zengj,huangx,zhoul,tany,huc,wangx,niuj,wangh,linx,yinp.metabolomicsidentifiesbiomarkerpatternforearlydiagnosisofhepatocellularcarcinoma:fromdiethylnitrosaminetreatedratstopatients.2015.scirep5:16101.
zhang,y.,y.dai,j.wen,w.zhang,a.grenz,h.sun,l.tao,g.lu,d.c.alexander,m.v.milburn,l.carter-dawson,d.e.lewis,h.k.eltzschig,r.e.kellems,m.r.blackburn,h.s.juneja,andy.xia.2011.detrimentaleffectsofadenosinesignalinginsicklecelldisease.natmed17:79-86.
- 还没有人留言评论。精彩留言会获得点赞!