一种检测乙型肝炎病毒表面抗原试剂盒及其制备方法与流程
本发明涉及一种检测乙型肝炎病毒表面抗原试剂盒及其制备方法,具体涉及一种基于磁性微球与时间分辨免疫分析法相结合检测乙型肝炎病毒表面抗原试剂盒的制备方法。
背景技术:
乙型肝炎(简称乙肝)是由乙型肝炎病毒(hbv)引起的能导致肝性炎症及肝功能损害的一种传染性疾病。乙型肝炎病毒表面抗原(hbsag)是hbv感染后最早出现的免疫学指标,往往早于临床症状数天或数周出现。在人血清或血浆中检出hbsag提示hbv感染。在诊断领域,hbsag检测被用于确定hbv感染者以及用于防止hbv通过血液和血液制品传播。hbsag还用于监测急、慢性hbv感染的病程以及必要时用于确定抗病毒疗效。
乙型肝炎病毒表面抗原(hbsag)由dane颗粒的外壳和直径22nm的球型颗粒和管型颗粒所组成,有共同的抗原决定簇“a”和几种亚型抗原决定簇“d/y”、“w/r”,按不同组合可构成多种亚型,我国以adr型为多见。hbsag有免疫原性,能刺激机体产生hbv表面抗体,起抵抗hbv的作用。
目前乙肝病毒血清学检查项目一般包括hbsag、anti-hbs、hbeag、anti-hbe、anti-hbc,即俗称的“乙肝两对半”。现主流hbsag的检测方法有酶联免疫(elisa)、胶体金法、化学发光(clia)、电化学发光(ecl)、时间分辨荧光免疫分析(trfia)等。elisa作为半定量检测方法是现应用最广的检测方法,但其灵敏度、线性宽度范围均未达到较高水平,难以适应市场发展的需求。胶体金法与elisa均有相同的缺点。而clia及ecl虽灵敏度高但均存在检测设备造价高昂,而相应的标记物研发门槛高,短时期内国内均会受制于人,同样也限制了在国内的推广。而时间分辨荧光免疫分析(trfia)灵敏度能达到clia一致的水平,不仅检测设备造价较低,并且标记技术在国内已相当成熟、检测成本低兼。而传统的时间分辨检测,仍以空白酶标板的物理吸附为主,检测过程耗时长。缩短反应时间,降低检测成本,提高检测灵敏度及线性范围,将具有不错的市场前景。
技术实现要素:
基于此,本发明的目的在于克服现有技术上及相关技术检测费用高昂的缺点,提供一种检测乙型肝炎病毒表面抗原试剂盒,及所述试剂盒的制备方法。
为实现上述目的,本发明采取如下技术方案:
一种检测乙型肝炎病毒表面抗原试剂盒,由如下组分组成:包被有hbsag抗体的磁性微球、hbsag校准品、与镧系元素结合的hbsag抗体标记物、分析缓冲液、浓缩洗液(清洗液)和增强液、rfid卡。
优选地,所述的包被有hbsag抗体的磁性微球中的磁性微球是将微米级的fe2o3或fe3o4磁性粒子和有机高分子材料进行复合,形成具有超顺磁性的、能够与免疫性抗原或抗体相结合的微米级的微球,即通称为“磁珠”。磁性微球应能满足直径为0.1~5μm,磁性微球通过表面修饰可带有多种活性功能基团,包括但不限于羟基(-oh)、氨基(-nh2)、羧基(-cooh)。
优选地,所述的包被有hbsag抗体的磁性微球中的hbsag抗体即可以是单克隆抗体,也可以是多克隆抗体。
优选地,所述的包被有hbsag抗体的磁性微球是采用以下步骤制备而成的:
将hbsag抗体经2~8℃超速冷冻离心机将缓冲体系置换处理后,与清洗、活化后的磁性微球混合并恒温孵育,孵育后清洗磁珠丢弃上清液,然后用磁珠封闭液进行封闭,清洗磁珠再次丢弃上清液,将包被有hbsag抗体的磁性微球在磁珠保存液中2~8℃冰箱中直立保存。
所述磁性微球的活化中edc及sulfo-nhs每毫克磁性微球优选地加样质量为10μg~1000μg。活化方式包括但不限于edc、sulfo-nhs其中的一种和两种。
优选地,所述的与镧系元素结合的hbsag抗体标记物中的抗体既可以是单抗亦可是多抗。其中的镧系元素与hbsag抗体结合是通过中间螯合剂完成,镧系元素包括但不限于铕(eu)、钐(sm),螯合剂包括但不限于异硫氰酸苯基-edta、异硫氰酸苯甲基-dtta、p-异硫氰基苄基-dtta、二乙烯三胺五醋酸氨基苯基-edta。
本发明还提供一种采用上述试剂盒检测hbsag的方法,所述方法包括如下步骤:
(1)用分析缓冲液将标记物稀释至工作液;
(2)用纯化水将浓缩洗液稀释至工作液;
(3)将稀释好的工作浓度的磁性微球加于反应杯内;
(4)将待检样本或校准品加于上述反应杯内;
(5)将(1)中稀释好的标记物工作液加入反应杯内;
(6)反应杯在室温下孵育;
(7)用(2)中的清洗工作液加磁后洗涤反应杯内的磁性微球;
(8)洗涤后,去磁,加入增强液孵育;
(9)孵育结束后,进行对应波长的荧光采集检测并分析。
优选地,本发明为了更进一步减少人工操作步骤,配合公司自研自产的smarttrf全系列免疫荧光检测设备,将本发明检测方法的相应参数、操作步骤均悉数拷贝至rfid卡中。实际操作过程中,只需要将rfid卡与上述免疫荧光检测设备适配即可全自动完成上述实验的操作步骤。rfid(radiofrequencyidentification)技术,又称无线射频识别,是一种通信技术,可通过无线电讯号识别特定目标并读写相关数据,而无需识别系统与特定目标之间建立机械或光学接触。
本发明还提供一种检测hbsag试剂盒的制备方法,所述方法包括如下步骤:
(1)制备包被有hbsag抗体的磁性微球;
(2)制备与镧系元素结合的hbsag抗体标记物;
(3)制备校准品;
(4)制备分析缓冲液、浓缩洗液和增强液;
(5)将各组份分别分装至相应的存储容器中;
(6)rfid卡复制拷贝;
(7)喷码、贴标签;
(8)组装成成品试剂盒。
与现有技术相比,本发明有益效果在于:
本方法基于磁性微球与时间分辨免疫分析法相结合,即克服酶标板物理性吸附反应时间较长,检测结果较慢的弊端,大大缩短反应时间,同时也具备时间分辨检测技术准确性高、灵敏度高、特异性强、线性范围宽、检测稳定且方便的优点。磁性微球包被相应的抗原或抗体,因磁性微球立体的特性,大大增加免疫反应的接触表面积,从而大大缩短检测时间,并且本发明对于传统的两步法检测作了进一步优化,检测hbsag只需一步法检测,30分钟内即可检出结果。另外,由于磁性微球的流体特性,不再受限于传统酶标板的框架限制,在任意的反应杯及小试管内即可完成检测,同时能减小检测仪器设备的体积大小及设备成本以满足二、三线城市的全自动化检测需求,亦能如酶标板、化学反光检测一样进行大通量检测,满足一线城市的全自动化检测需求。
附图说明
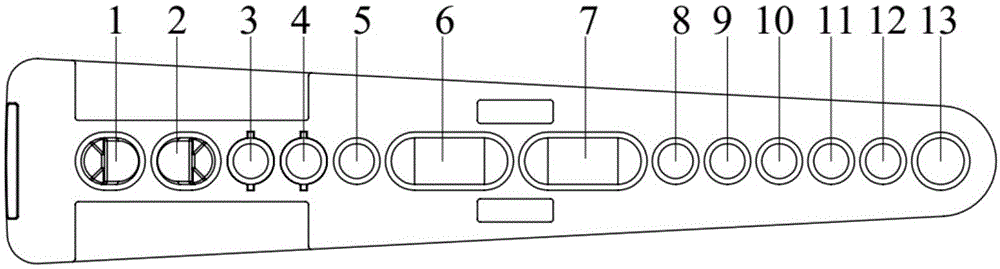
图1为采用本发明所述检测试剂盒用来储存包被有hbsag抗体的磁性微球、与镧系元素结合的hbsag抗体标记物、分析缓冲液、清洗液和增强液的试剂条的俯视示意图。
图2为采用本发明所述检测试剂盒用来储存包被有hbsag抗体的磁性微球、与镧系元素结合的hbsag抗体标记物、分析缓冲液、清洗液和增强液的试剂条的立体结构示意图。
具体实施方式
以下结合实施例和附图对本发明作进一步的说明,更好地说明本发明的技术特点、技术方案。以下实施例并不对本发明造成任何限制。以下实施例中磁性微球来源于ge公司;铕标记购于芬兰wallac公司;乙型肝炎病毒表面抗原国家参考品由中国食品药品检定研究院提供;对照试剂盒为雅培乙型肝炎病毒表面抗原定量测定试剂盒(化学发光微粒子免疫检测法)。
实施例1
一种检测乙型肝炎病毒表面抗原试剂盒,所述试剂盒包括:包被有hbsag抗体的磁性微球、hbsag校准品、铕标记的hbsag抗体标记物、分析缓冲液、浓缩洗液和增强液、rfid卡。
本发明还提供上述检测乙型肝炎病毒表面抗原试剂盒的制备方法,所述方法包括如下步骤:
(1)制备包被有hbsag抗体的磁性微球:将hbsag抗体经2~8℃超速冷冻离心机将缓冲体系置换处理后,与清洗、活化后的直径1μm羧基磁性微球混合并恒温孵育1~3小时,孵育后使用磁珠清洗液清洗磁珠并丢弃上清液,然后用磁珠封闭液进行封闭,清洗磁珠再次丢弃上清液,将包被好的hbsag抗体磁性微球在磁珠保存液中以2~8℃冰箱直立保存。再将包被好hbsag抗体磁性微球用磁珠保存液稀释至工作液浓度,分装成10ml/瓶。优选地,磁性微球与hbsag抗体包被的质量之比为10:1、20:1、30:1、40:1中的一种;优选地,所述置换缓冲液及磁珠清洗液是0.05~0.5mph5.8~ph7.0的mes缓冲液;优选地,磁性微球的活化中edc及sulfo-nhs每毫克磁性微球优选地加样质量为10μg~1000μg;优选地,磁性微球的封闭液及保存液为含0.1%~8%bsa的0.1~0.5mph7.0~8.5的tris-hcl缓冲液;
(2)制备铕标记的hbsag抗体标记物:将hbsag抗体置于截留分子量为10000超滤离心管中,10000rpm离心7~10min,弃去滤液。再加入0.05mph9.6碳酸盐缓冲液10000rpm离心7~10min反复2~3次,将离心管滤膜反转3000rpm离心6min,收集最后浓缩的200μl溶液。并将其与事先用碳酸盐缓冲液溶好的dtta-eu3+混合,hbsag抗体与铕质量比为1:1,2~8℃振荡混匀48±2小时。标记溶液经0.05mph7.8tris-hcl缓冲液平衡的sephadextmg-75凝胶柱(⌀1.0*50cm)层析纯化,在a280监测收集第一峰。将收集到的铕标记的hbsag抗体标记物用0.2%bsa,0.05mph7.8tris-hcl缓冲液稀释至最佳浓度的1/20倍,分装至1.0ml/瓶。
(3)制备hbsag校准品:使用标准物质gbw(e)0900724iu/ml、gbw(e)0900701iu/ml为对照,使用2%bsa、0.5%tween-20,0.02%proclin300,ph7.50.02mtris-hcl缓冲液将hbsag抗原稀释至低浓度值点1iu/ml、高浓度值点300iu/ml。
(4)制备分析缓冲液:含有tween-20、proclin300、edta、bsa、tris-hcl缓冲液,分装至30~40ml/瓶。
(5)制备浓缩洗液:含有tween-20、proclin300、tris-hcl缓冲液,分装至30~40ml/瓶。
(6)制备增强液:含有乙酸钠、β-nta、topo、冰乙酸、无水乙醇、tritonx-100,分装至30~40ml/瓶。
(7)制备rfid卡:将空白rfid卡按本发明本实施例中检测方法进行相关参数设置;
(8)喷码、贴标签,组装试剂盒。
本发明还提供上述检测乙型肝炎病毒表面抗原试剂盒的检测方法,所述方法具体操作如下:
(1)试剂准备
(2)实验操作
本实施例中,实际的实验操作步骤及相关参数,已事先拷贝至配套的rfid卡内,实验操作过程只需要按试剂准备过程准备好后,将rfid卡与全自动设备适配即可完成从信息读取、加样到检测的全过程。
实施例2
一种检测乙型肝炎病毒表面抗原试剂盒,与实施例1中所述检测试剂盒基本相同,不同在于:
(1)所述检测乙型肝炎病毒表面抗原试剂盒组份仅包括:试剂条、hbsag校准品、rfid卡。
(2)本实施例中,所述检测试剂盒中试剂条是由包被有hbsag抗体的磁性微球、铕标记的hbsag抗体标记物、分析缓冲液、清洗液和增强液、分装至试剂条对应的孔内封膜后而成。其中清洗液为实施例1中浓缩洗液加纯化水稀释25倍而成;其余各组分与实施例1中相同。
本实施例中,正如图1、图2所示,所述检测试剂盒中试剂条各孔位功能描述如下:
试剂条从左到右依次排列,名称依次为第1~13个孔。第1、2孔均为测试孔,第3、4孔为荧光标记孔,第5孔为分析缓冲液孔、第6、7孔为清洗液孔,第8、9为样本稀释液孔,第12为增强液孔,第10、11、13为预备孔。第1与2孔均为存放磁性微球进行免疫反应的反应孔,最大可存放液体体积为800μl;第3、4孔可以从整个试剂条上拆卸成为独立的组分,便于对荧光标记物进行分装储存。第3、4、5孔可以存放最大液体体积为400μl;第6、7孔可以存放最大液体体积为3000μl;第8~12孔可以存放最大液体体积为400μl;第13孔可以存放最大液体体积为600μl。
本实施例中,所述检测试剂盒中的试剂条是按如下方式进行封膜后制成:
将300μl包被有hbsag抗体磁性微球、50μl铕标记hbsag抗体标记物、200μl分析缓冲液、3000μl清洗液、200μl增强液分别分装至试剂条的第1、3、5、6、12孔内,封膜后即制成所述试剂条。
本发明还提供上述检测乙型肝炎病毒表面抗原试剂盒的制备方法,按上述方式制得试剂条后,与hbsag校准品、rfid卡即可组成试剂盒。除了各组份分装方式及储存容器不一样外,其余与实施例1中相同。
本发明还提供上述检测乙型肝炎病毒表面抗原试剂盒的检测方法,只需要将上述试剂条轻晃混匀后插入smarttrf系列设备的试剂条卡槽内,设备读取rfid卡相关信息即可全自动完成检测过程。rfid卡的相关信息参数及检测步骤与实施例1中相同。
实施例3
本发明所述检测乙型肝炎病毒表面抗原试剂盒的性能评价:
按实施例中制备的试剂盒及检测方法,检测采购自中国食品药品检定研究院的乙型肝炎病毒表面抗原国家参考品,以及收集来源于医院雅培architecti2000检测hbsag的临床样本300例。
实施例1、实施例2检测乙型肝炎病毒表面抗原国家参考品,结果如下:
(1)阴性符合率:20份阴性国家参考品n1~n20,实施例1、实施例2检测符合率(-/-)均为20/20;
(2)阳性符合率:3份阴性国家参考品p1~p3,实施例1、实施例2检测符合率(+/+)均为3/3;
(3)精密性:精密性参考品重复检测10次,实施例1、实施例2检测精密性c.v≤15%;
(4)最低检出量:检测灵敏度参考品,实施例1、实施例2检测均符合adr亚型≤0.1iu/ml,adw亚型≤0.1iu/ml,ay亚型≤0.2iu/ml。
实施例1、实施例2检测雅培hbsag300例临床样本,结果如下:
表1实施例1临床样本对比
本发明实施例1中所述检测试剂盒检测乙型肝炎表面抗原与对照试剂阴性符合率100%、阳性符合率100%。
所述的浓缩洗液(清洗液)在实施例1中指代的是待稀释至工作液的高浓度清洗液;清洗液在实施例2中指代的是不需要任何处理的工作液。
可以理解的,在实施例1中检测hbsag试剂盒的检测方法及制备方法是为了满
足大通量检测目的而发明的,仪器设备体积巨大且造价相对高昂,为了进一步满足二、三线城市的检测需求,相应的,我们在实施例1的基础上更进一步作了一些检测方法及试剂盒制备方法上的修改,如实施例2中的一样。
可以理解的,本发明在实施例2中与实施例1中的检测方法及制备方法的区别在于,实施例2是将实施例1中的包被有hbsag抗体的磁性微球、与镧系元素结合的hbsag抗体标记物、分析缓冲液、清洗液和增强液同时分装进特制的试剂条(如图1、图2所示),因此实施例2中试剂盒的组份仅有试剂条、rfid卡、hbsag校准品。其中rfid卡、hbsag校准品与实施例1中保持一致。
可以理解的,本发明在实施例2中的检测方法是将试剂条插入检测设备后,同时用相应的rfid卡与设备适配即可,设备全自动操作步骤与实施例1保持一致;
可以理解的,本发明在实施例2中的检测试剂盒的制备方法与实施例1中的不同在于,步骤(4)中浓缩洗液变为清洗液,步骤(5)变为“将各组份分别分装至试剂条的相应孔内,分装完后随即封膜喷码”即可。
- 还没有人留言评论。精彩留言会获得点赞!