一种分离外泌体的方法与流程
本发明涉及生物技术领域,具体地说涉及一种分离外泌体的方法。
背景技术:
外泌体是指由细胞分泌的,粒径在30-150nm之间小膜泡,其可携带多种蛋白质、mrna、mirna,参与细胞通讯、细胞迁移、血管新生和肿瘤细胞生长等过程。几乎所有细胞都会分泌外泌体,血液、唾液、尿液、脑脊液和乳汁等体液中都能够提取到外泌体(pnas105(2008)10513-10518)。通过对体液中外泌体的提取,检测外泌体中携带的生物分子,可以方便快捷地监测疾病的发生发展过程。而通过文献调研我们可知,上述外泌体的下游应用都取决于提取得到的外泌体品质,即外泌体的纯度和得率,即获得更高纯度和更高得率的外泌体样本是成功实现外泌体下游应用的关键因素。
现有的外泌体分离方法种类很多,经典的外泌体分离方法是超速离心法,超速离心法是基于外泌体与其他生物组份密度的微小差异进行分离,该方法分离得到的外泌体纯度较高,但是损失较大,得率较低,同时还要借助昂贵的大型仪器,分离纯化外泌体的效率较低。另一类是通过在微球表面固定与外泌体表面的特定蛋白结合的抗体,通过免疫亲和作用提取样本中的外泌体,该方法虽然操作相对简单,但由于所用抗体种类有限,因此只能提取部分外泌体,即外泌体种类的完整性不足,且回收率亦不能令人满意,此外由于采用抗体与外泌体表面抗原结合的方式进行外泌体的分离纯化,干预了外泌体表面的免疫特性,有可能影响其下游的应用。此外还有基于亲水性聚合物沉淀的方法提取外泌体(如文献scientificreports2016,6,23978,专利cn107523536a),但分离到的外泌体中夹杂有大量的非外泌体来源蛋白,外泌体纯度极低。
因此,目前还未有一种方法可简单有效地同时实现高得率和高纯度的外泌体分离,急需开发一种简单高效的外泌体分离方法。
技术内容
本发明公开了一种分离外泌体的方法,该方法包括如下步骤:
首先将微球与结合试剂、待分离的外泌体样本混合、孵育,形成微球-外泌体复合物;去除未被微球吸附的上清,然后将微球-外泌体复合物分散到洗脱液中,将外泌体从微球表面洗脱;去除微球,即为纯化得到的外泌体。
具体的说,本发明的一种分离外泌体的方法,包括如下步骤:
(1)构建反应体系:将微球、结合试剂和预处理后的样品混匀;
(2)孵育:将混匀后的反应体系在0-30℃下静置或混匀孵育10min~4h;然后去除上清液,得到微球-外泌体复合物;
(3)洗脱:加入洗脱液,并将微球-外泌体复合物均匀分散于洗脱液中,洗脱微球上吸附的外泌体;然后去除微球,所得的上清液即为包含外泌体的溶液。
其中步骤(1)中,微球粒径在100nm-30μm,表面带有亲水性功能基团,所述的亲水性功能基团为羧基、氨基、羟基或两性离子;微球可通过自行合成或购买商品化试剂盒得到;微球可含有磁性,也可不含磁性;含有磁性的微球可用磁吸附方式分离,不含磁性的微球可用100-3000g离心进行分离;
结合试剂由亲水性聚合物、盐和ph缓冲液组成;
其中亲水性聚合物为聚乙二醇(peg)、聚丙烯酰胺、葡聚糖、聚乙烯亚胺或聚乙烯吡咯烷酮、两性甜菜碱类化/聚合物的中的一种或多种;
优选的亲水性聚合物为peg,分子量在2000~12000;进一步优选的,peg的分子量为8000;
其中盐为钾盐或钠盐,优选的为钠盐,更具体的说是nacl;
其中ph缓冲液为:pbs、tris-hcl、柠檬酸盐缓冲液等,优选的为pbs;
样本为细胞培液以及血浆、血清、脑脊液、淋巴液、乳汁、尿液或唾液等各种任意含有外泌体的液体样本;
其中预处理后的样本,是指将样本经过低速差速离心,然后过滤的预处理;
具体的说,对样本的预处理为:对样本进行低速差速离心,包含300g离心5min、2000g离心10min和10000g离心30min步骤;离心之后,用0.22μm滤膜的过滤以去除较大的杂质;
其中步骤(2)中,
微球的工作浓度为0.01mg/ml-3mg/ml;
亲水性聚合物的工作浓度在30mg/ml-200mg/ml;
盐的工作浓度范围在0.01-2m;
其中步骤(3)中,
洗脱液为pbs、tris-hcl、柠檬酸盐缓冲液或去离子水;
更具体的说,本发明的一种分离外泌体的方法,包括如下步骤:
(1)构建反应体系:将微球、结合试剂和预处理后的样品混匀;
(2)孵育:将混匀后的反应体系在0-30℃下静置或混匀孵育10min~4h;然后去除上清液,得到微球-外泌体复合物;
(3)洗脱:加入洗脱液,并将微球-外泌体复合物均匀分散于洗脱液中,洗脱微球上吸附的外泌体;然后去除微球,所得的上清液即为包含外泌体的溶液;
(4)二次分离纯化:步骤(3)得到的外泌体溶液作为第二次分离纯化的样本,重复步骤(1)-(3),得到所需的包含外泌体的溶液。
通过二次分离纯化,可以提高所得外泌体溶液中的外泌体纯度。
其中上述步骤(1)对样本预处理的目的是去除其中的细胞碎片和其他较大的杂质,利于纯化外泌体;
其中样本可以是新鲜的或者在-20℃及以下温度冻存的;冻存的样品在使用前,需在室温下复溶;
对于蛋白和外泌体浓度较低、体积较大的细胞培液,为提高处理效率、减少试剂用量,可在预处理后用100kd超滤管进行浓缩处理,可进行10-50倍浓缩。
本发明解决的技术问题是:利用亲水性聚合物竞争溶液中的水分子,大量的亲水性聚合物存在条件下,使得外泌体脱水而析出,在析出过程中由于溶液中存在大量的微球,外泌体会优先吸附于微球表面,之后通过洗脱液将外泌体从微球表面脱附下来,从而实现样品中外泌体的快速稳定提取。该技术解决了现有的外泌体分离方法无法同时实现分离得率高和外泌体纯度高两个要素的难点,具有简单易操作、分离时间短、分离得到的外泌体纯度高、得率高、表面性状保存完整等优点,后续可与自动化分离装备联用,实现外泌体的全自动分离与纯化。
本发明提供的一种分离外泌体的方法,通过亲水性聚合物和微球,能够吸附大量的外泌体,且吸附在微球表面的外泌体可以被快速简单地洗脱下来。本发明的方法分离得到的外泌体产率高,且获得的外泌体中的rna含量与蛋白种类也高于经典的超速离心方法。
本发明的方法适用于多种细胞培液以及血浆、脑脊液、尿液、乳液、淋巴液或唾液等任意含有外泌体的液体样本,且有利于小体积样品的外泌体分离。通过联用亲水性聚合物和微球,可以在方便快捷地分离得到较高纯度外泌体的同时,有效去除样品中游离蛋白等杂质对外泌体下游应用的干扰。此外,通过重复提取步骤,可得到纯度与超离方法接近的外泌体,且得率是超离方法的4倍以上。该方法提取得到的外泌体,可以有效用于下游分析与研究,包括westernblot鉴定、rna分析和蛋白质谱表征,相关的蛋白、核酸标志物测定,细胞间相互作用的机理探究等。
附图说明:
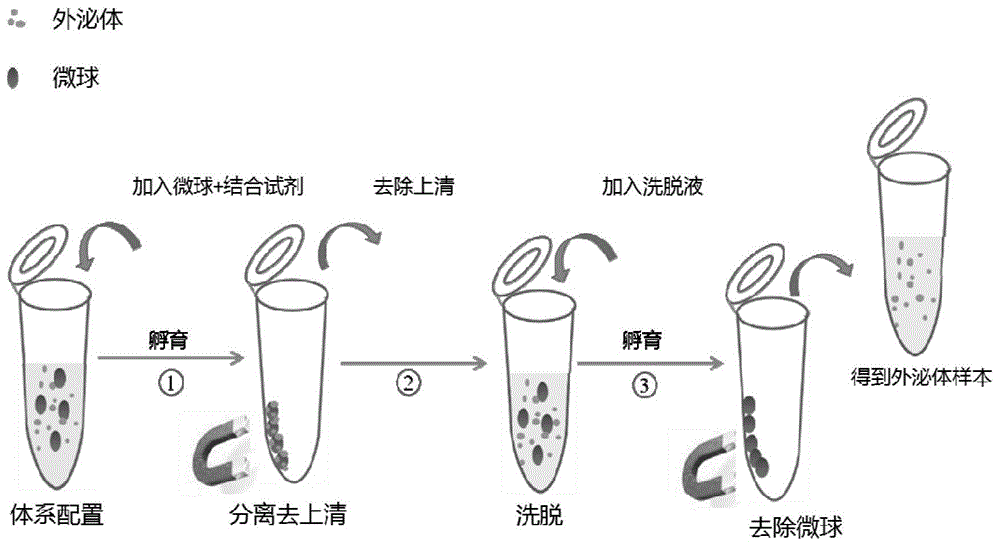
图1:基于微球和peg试剂提取外泌体方法的示意图。
图2:实施例1提取细胞培液外泌体的回收率和纯度结果。
图3:tem表征实施例1中提取a549细胞培液外泌体。
图4:tem表征实施例1中提取293t细胞培液外泌体。
图5:实施例1中外泌体westernblot的结果。
图6:实施例2提取血浆外泌体的回收率和纯度结果。
图7:tem表征实施例2中提取到的外泌体。
图8:tem表征密度梯度离心法提取到的外泌体。
图9:实施例2中westernblot显示的蛋白结果。
图10:不同孵育时间下的血浆外泌体颗粒回收率结果
图11:不同孵育时间下的细胞培液外泌体颗粒回收率结果
具体实施例
下述实施例中所用材料和试剂等,如无特殊说明,均是购买自商业化试剂。相应的试剂并非仅限制于下述的公司与型号,亦可采用其他公司的相应型号产品或自行合成。
下述实施例中亲水性聚合物溶液浓度为质量浓度,计算方式为溶解质量(g)/溶液体积(ml)。
试剂来源:
peg购买自sigma-aldrich;
微球购买自上海奥润微纳新材料科技有限公司,型号为sp100;
1×pbs购买自hyclone;
0.22μm滤膜、100kd过滤管购买自millipore;
nacl购买自中国国药集团化学试剂有限公司。
293t细胞为人肾上皮细胞系,购买自中科院细胞库,来源于atcc;
a549细胞为腺癌人类肺泡基底上皮细胞,购买自中科院细胞库,来源于atcc;
mcf细胞为人乳腺癌细胞,购买自中科院细胞库,来源于atcc,
以上几种细胞均为购买的细胞株,在实验室培养。
蛋白印迹法鉴定的外泌体蛋白标志物tsg101、hsp70、alix、cd9和cd63,所需的相关抗体均购买自abcam公司。
实施例1:
本实施例提供了一种微球结合亲水性聚合物分离细胞培液中外泌体的方法
一、样品
本实施例中使用的样品为培养至细胞贴壁传代时收集的细胞培液,细胞为293t细胞和a549细胞。
二、样品预处理
对细胞培液进行低速差速离心,包含300g离心5min、2000g离心10min和10000g离心30min步骤;离心之后,用0.22μm滤膜的过滤以去除较大的杂质。
上述预处理方法适用于下述所有的细胞培液样本实施例。
针对本发明中提出的亲水性聚合物和微球共同作用提取外泌体的方法,可进一步对过滤后的细胞培液进行超滤浓缩:在100kd过滤管中,4000g离心10min,浓缩细胞培养上清液15倍。
三、试剂准备
选择亲水性聚合物为peg(分子量8000),预先加去离子水溶解peg,配置成质量浓度为500mg/ml的水溶液,作为母液。
称取2.34g无水nacl固体,溶解于20ml的去离子水中。充分溶解后,通过0.22μm的滤膜过滤,去除大的杂质,得到2m的nacl母液。
四、外泌体分离
微球结合peg分离细胞培液外泌体方法,实验流程示意图如图1。
具体实验步骤如下:
1、取2ml的ep管,依次添加100μl的2m的nacl母液、100μl磁性微球(表面为羧基基团、直径1μm)母液、160μl的peg母液,最后用pbs补足至600μl,震荡混匀。向管内加入400μl的预处理的样品溶液,颠倒混匀,最终peg8000的浓度为80mg/ml(对应专利附图中的8%,以下皆同),nacl的浓度为0.2m,微球的工作浓度为1mg/ml。
2、将混匀液置于4℃冰箱中,旋转反应器上混匀孵育1h。
3、取出样品ep管,置于磁分离架上,经过快速磁吸附,得到微球-样品复合物,待微球完全吸附后,舍弃上清液。
4、去除磁分离板,向微球-样品复合物中加入pbs作为洗脱液,轻微震荡混匀,置于4℃冰箱中,旋转反应器上混匀10min,洗脱样品。
5、取出样品,再次置于磁分离架上,经过快速磁吸附,待微球完全吸附后,吸取上清液保存。保存的上清液中即为分离得到的外泌体。
6、针对需要得到与超离方法纯度接近的外泌体样本的情况,可以通过重复上述分离步骤(即进行两次分离纯化,下文简称为两步法),进一步纯化外泌体样品。
五、外泌体质量表征
提取得到的外泌体溶液质量,主要通过bca法、nta法、tem和westernblot进行表征。
bca法(nanodrop也可,在蛋白浓度低于1mg/ml时需采用bca法进行测定)测定其中的游离杂蛋白浓度,nta法测定外泌体颗粒浓度和粒径,通过原始样本和提取得到的外泌体溶液的bca和nta检测结果,可计算得到外泌体的回收率。bca法得到的是蛋白回收率,nta法得到颗粒回收率,蛋白回收率越低、颗粒回收率越高说明提取得到的外泌体质量越高。此外,外泌体的相对纯度定义是颗粒浓度/蛋白浓度,单位是个/mg,该值越大同样表明提取得到的外泌体质量越高。tem可定性观察提取得到的外泌体形貌,westernblot用于表征外泌体上的特征蛋白,tem和westernblot可定性地表示是否有提取得到外泌体。
1、bca方法测定蛋白含量:bca蛋白测定方法使用的是商品化购买的试剂盒(购自thermoscientific,货号为23225),具体操作流程详见试剂盒说明书。
2.nta方法测定颗粒数:nta测定采用zetaview检测仪器,测定流程参照analyticachimicaacta,2017,982:84-95。bca与nta的测定结果如图2所示,单次本方法提取的外泌体纯度和得率均与商品化试剂盒相当;而在第二次80mg/mlpeg浓度提取后,相比于第一次80mg/ml的peg工作浓度提取得到的外泌体产物,外泌体样品的相对纯度提高10倍,并且颗粒回收率在50%以上,得率是经典的超速离心法的3-4倍,但纯度比商品化试剂盒提高了10倍。由此可见,通过本方法可简便、快速有效地提取到外泌体,且纯度和得率与商品化试剂盒相当。而优化的本方法(二步法)可进一步得到纯度要求更高的外泌体样本,可高得率地得到纯度与常规采用超速离心分离方法相当的外泌体。
3、透射电镜tem:透射电镜用于观察所提取的外泌体的结构形态,定性判定是否有提取到外泌体,具体实验流程详见thejournalofimmunology,2001,166(12):7309-7318。图3、图4为a549细胞、293t细胞培液提取的外泌体样品拍摄的tem结果,可看出本方法确实分离得到了高纯度的外泌体。
4.westernblot:通过蛋白质印迹法表征外泌体的特征蛋白,如cd63、hsp70、tsg101、cd9、alix等,鉴定外泌体特征的蛋白,其主要操作步骤详见analyticachimicaacta,2017,982:84-95。westernblot结果如图5所示,两步法提取得到的外泌体可跑出外泌体特有的hsp70、tsg101、alix蛋白印迹,证明本方法可提到高纯度的外泌体样本。
对比实施例:经典超速离心方法提取外泌体
1、将预处理后的细胞培液,加入离心管中。装满6个36.8ml离心管,配平后放置在sw32-ti转子上。设置机器运行温度为4℃,预冷一段时间后,设置转速为100000g。
2、第一次在100000g转速下离心70min,待机器自行运行停下后,小心取出转子和其中的离心管。
3、小心吸取上清液,加入1ml的pbs重分散外泌体沉淀。
4、将六个管子的样品转移到同一个管子中,在4℃下,100000g转速离心70min,待机器自行运行停下后,小心取出转子和其中的离心管,避免震荡。
6、用移液枪小心吸取上清,避免吸取底部白色沉淀。将外泌体重新用200μl的pbs分散,即得外泌体溶液。
对比实施例:exoquick试剂盒方法提取外泌体
对比试剂盒购买自sbi公司的商品化exoquick试剂盒,具体操作步骤详见试剂盒说明书。
实施例2:
本实施例提供了一种微球结合亲水性聚合物的方法分离血浆外泌体的方法
一、生物液体样品
采用的血浆样本为正常人的血浆样本,由志愿者(上海人群)提供。
二、样品预处理
对血浆进行低速差速离心,包含300g离心5min、2000g离心10min、10000g离心30min。离心之后,采用0.22μm过滤以去除较大的杂质。
本预处理方法适用于下述所有的血浆样本实施例。
三、试剂准备
与实施例1相同。
四、外泌体分离
微球结合peg分离血浆外泌体实验步骤如下:
1、取2ml的ep管,依次添加100μl的2mnacl母液、100μl磁性微球(表面为羧基基团、直径1μm)母液、100μl的peg8000母液,最后用pbs补足至600μl,震荡混匀。向管内加入400μl的样品,颠倒混匀,最终peg浓度为50mg/ml,nacl浓度为0.2m,微球的工作浓度1mg/ml。将混匀液置于4℃冰箱中,旋转反应器上混匀孵育1h。
2、取出样品,置于磁分离架上,经过快速磁吸附,待微球完全吸附后,舍弃上清液。
3、去除磁分离板,向微球中加入pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀5min,洗脱样品。
4、取出样品,置于磁分离架上,经过快速磁吸附,待微球完全吸附后,吸取上清保存。保存的上清中即为分离得到的外泌体。
5、针对需要得到与超离方法纯度接近的外泌体样本的情况,可以通过二步法重复上述分离步骤,进一步纯化外泌体样品。
五、外泌体质量表征
各个表征方法和相应具体步骤如实施例1。
不同提取方法得到的外泌体纯度和得率如图6所示,可见一步的本方法所得外泌体得率高于试剂盒方法,纯度略低于试剂盒方法;而经过两步法提取外泌体,可在保留60%以上颗粒回收率的同时,显著提高外泌体的纯度,效果比经典的密度梯度离心法更好(得率提高了3-4倍,纯度提高了5倍),且与试剂盒方法相比在得率接近的同时纯度提高了2倍。证明本方法无论一步法或是两步法均可得到高纯度高得率的外泌体样本,而二步法所得的外泌体质量明显优于经典的密度梯度离心方法和试剂盒方法。
图7、图8分别为从血浆中经过两次微球结合50mg/mlpeg条件、密度梯度离心方法提取得到的外泌体样本的tem表征图,由图可见,两者均具有典型的茶托结构的外泌体,证明本方法确实提取得到了理想的外泌体。
图9为通过westernblot表征的外泌体特征蛋白条带,由左至右分别为原始血浆样本、密度梯度离心方法得到的外泌体、通过两次微球结合50mg/mlpeg浓度提取的血浆外泌体,对比于经典的密度梯度离心法分离的外泌体,均能够清楚表征出cd9和cd63条带,证明本方法确实提取得到了理想的外泌体样本。
对比实施例:经典的蔗糖密度梯度离心方法分离血浆中的外泌体
1、预处理后的血浆样本采用密度梯度法进行离心(蔗糖浓度梯度为5%、10%、20%、40%),各组分蔗糖溶液1ml,剩余空间加过滤后样本1ml,加热封口;
2、准备好的样品于超速离心机4℃,150,000g离心过夜;
3、弃上清,加入pbs分散沉淀,4℃,150,000g离心2h,弃去上清;
4、所得的沉淀溶于200μlpbs,即为分离所得的外泌体样本。
对比实施例:常用试剂盒方法
对比试剂盒为购自systembiosciences的equltra20a-1试剂盒,简称equl-20a,具体操作流程如说明书所示。
实施例3:
本实施例提出微球和亲水性聚合物分离血浆外泌体的亲水性聚合物优化
一、样品准备
血浆样品同实施例2。
二、样品预处理
血浆样品预处理同实施例2。
三、试剂准备
亲水性聚合物peg母液、nacl母液制备方法同实施例1,选择亲水性聚合物peg分子量mw为2000、4000、6000、8000、10000、12000。
四、外泌体分离
1、取若干2ml的ep管,依次添加100μl的2mnacl母液、100μl磁性微球(表面为羧基基团、直径1μm)母液、100μl的peg母液,最后用pbs补足至600μl,震荡混匀。向管内加入400μl的样品,颠倒混匀,最终peg浓度为50mg/ml,nacl浓度为0.2m,微球的工作浓度1mg/ml。置于4℃冰箱中,旋转反应器上混匀孵育120min。
2、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,舍弃上清液。
3、去除磁分离板,向微球中加入pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀5min,洗脱样品。
4、取出样品,置于磁分离架上,经过快速磁吸附,待微球完全吸附后,吸取上清保存。保存的上清中即为分离得到的外泌体。
五、外泌体表征
外泌体的表征手段同实施例1。
通过nta检测外泌体颗粒浓度以及bca检测外泌体蛋白浓度的实验结果显示,不同分子量的peg分子与微球共同作用都能够有效提取体液样品中的外泌体。同时对于血浆样品,在相同的质量浓度的peg浓度下,peg分子量为8000提取的外泌体回收率和纯度高于其他分子量的peg。
实施例4:
本实施例提出微球和亲水性聚合物分离细胞培液外泌体的亲水性聚合物优化
一、样品准备
细胞培液样品来源同实施例1,此处采用的为a549细胞。
二、样品预处理
细胞培液样品预处理同实施例1。
三、试剂准备
亲水性聚合物peg母液、nacl母液制备方法同实施例1,选择亲水性聚合物peg分子量mw为2000、4000、6000、8000、10000、12000。
四、外泌体分离
1、取若干2ml的ep管,依次添加100μl的2mnacl母液、100μl磁性微球(表面为羧基基团、直径1μm)母液、160μl的peg母液,最后用pbs补足至600μl,震荡混匀。向管内加入400μl的样品,颠倒混匀,最终peg浓度为80mg/ml,nacl浓度为0.2m,微球工作浓度为1mg/ml。置于4℃冰箱中,旋转反应器上混匀孵育120min。
2、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,吸取上清,舍弃上清液。
3、去除磁分离板,向微球中加入pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀5min,洗脱样品。
4、分离:取出样品,置于磁分离架上,经过快速磁吸附,待微球完全吸附后,吸取上清保存。保存的上清中即为分离得到的外泌体。
五、外泌体表征
外泌体的表征手段同实施例1。
通过nta检测外泌体颗粒浓度以及bca检测外泌体蛋白浓度的实验结果显示,对于细胞培液样品,不同分子量的peg分子与微球共同作用都能够有效提取样品中的外泌体。同时对于细胞培液样品,在相同的质量浓度的peg浓度下,peg分子量为8000提取的外泌体回收率和纯度高于其他分子量的peg。
实施例5:
本实施例提出微球和亲水性聚合物分离血浆外泌体的亲水性聚合物工作浓度优化
一、样品准备
血浆样品同实施例2。
二、样品预处理
血浆样品预处理同实施例2。
三、试剂准备
亲水性聚合物peg母液(peg8000)、nacl母液制备方法同实施例1。
四、外泌体分离
1、取若干2ml的ep管,依次添加100μl的2mnacl母液、100μl磁性微球(表面为羧基基团、直径1μm,工作浓度1mg/ml)母液、60-400μl的peg母液,最后用pbs补足至600μl,震荡混匀。向管内加入400μl的样品,颠倒混匀,最终peg浓度为30mg/ml、50mg/ml、80mg/ml、100mg/ml、150mg/ml,nacl浓度为0.2m。置于4℃冰箱中,旋转反应器上混匀孵育60min。
2、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,舍弃上清液。
3、去除磁分离板,向微球中加入pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀30min,洗脱样品。
4、取出样品,置于磁分离架上,经过快速磁吸附,待微球完全吸附后,吸取上清保存。保存的上清中即为分离得到的外泌体。
五、外泌体表征
外泌体的表征手段同实施例1。
通过nta检测外泌体颗粒浓度以及bca检测外泌体蛋白浓度的实验结果显示,对于血浆样品,不同peg工作浓度与微球共同作用都能够有效提取样品中的外泌体。对于血浆样品,随着peg浓度从30mg/ml增加至50mg/ml,分离得到的外泌体样品的回收率从50%增加至85%,而从50mg/ml增加至80mg/ml,100mg/ml,150mg/ml,颗粒回收率无明显增加,且杂蛋白的回收率提高了2-5倍,因此综合考虑外泌体的回收率和纯度指标,在50mg/mlpeg条件下产物外泌体的纯度最高,且回收率也较高,最佳的peg浓度为50mg/ml。
实施例6:
本实施例提出微球和亲水性聚合物分离培液外泌体的亲水性聚合物工作浓度优化
一、样品准备
细胞培液样品来源同实施例1。
二、样品预处理
细胞培液样品预处理同实施例1,此处采用的为a549细胞。
三、试剂准备
亲水性聚合物peg母液、nacl母液制备方法同实施例1。
四、外泌体分离
1、取若干2ml的ep管,依次添加100μl的2mnacl母液、100μl磁性微球(表面为羧基基团、直径1μm,工作浓度1mg/ml)母液、60-400μl的peg母液,最后用pbs补足至600μl,震荡混匀。向管内加入400μl的样品,颠倒混匀,最终peg浓度为30mg/ml、50mg/ml、80mg/ml、100mg/ml、150mg/ml,nacl浓度为0.2m。置于4℃冰箱中,旋转反应器上混匀孵育60min。
2、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,舍弃上清液。
3、去除磁分离板,向微球中加入pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀30min,洗脱样品。
4、取出样品,置于磁分离架上,经过快速磁吸附,待微球完全吸附后,吸取上清保存。保存的上清中即为分离得到的外泌体。
五、外泌体表征
外泌体的表征手段同实施例1。
通过nta检测外泌体颗粒浓度以及bca检测外泌体蛋白浓度的实验结果显示,对于培液样品,不同peg工作浓度与微球共同作用都能够有效提取样品中的外泌体。对于细胞培液样品,随着peg浓度从50mg/ml增加到80mg/ml,颗粒回收率从60%增加到80%,在80mg/ml的peg浓度下提取得到的外泌体样品相对纯度最高的,并且颗粒的回收率也达到相对较高的80%。peg浓度增加至100mg/ml,150mg/ml,外泌体颗粒的回收率增加至85%,样品的相对纯度是80mg/ml条件下的1/4。
实施例7:
本实施例提出微球和亲水性聚合物分离细胞培液外泌体的盐离子工作浓度优化
一、样品准备
细胞培液样品来源同实施例1。
二、样品预处理
细胞培液样品预处理同实施例1,此处采用的为a549细胞。
三、试剂准备
亲水性聚合物peg8000母液、nacl母液制备方法同实施例1。
四、外泌体分离
1、取若干2ml的ep管,依次添加不同量的2mnacl母液、100μl磁性微球(氧化硅、直径1μm,工作浓度1mg/ml)母液、160μl的peg母液,最后用pbs补足至600μl,震荡混匀。向管内加入400μl的样品,颠倒混匀,最终nacl浓度为0m、0.1m、0.2m、0.3m、0.4m。置于4℃冰箱中,旋转反应器上混匀孵育60min。
2、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,舍弃上清液。
3、去除磁分离板,向微球中加入pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀30min,洗脱样品。
4、取出样品,置于磁分离架上,经过快速磁吸附,待微球完全吸附后,吸取上清保存。保存的上清中即为分离得到的外泌体。
五、外泌体表征
外泌体的表征手段同实施例1。
发现随着nacl的浓度从0逐渐升高至0.2m,外泌体的回收率和纯度得到提升,而nacl浓度超过0.2m上升至0.4m,外泌体的回收率和纯度几乎不受影响。因此综合考虑分离效果,最终选择体系中nacl的工作浓度为0.2m。
实施例8:
本实施例提供了微球结合亲水性聚合物peg提取血浆外泌体的方法,尝试了不同的微球种类
一、样品准备
血浆样品来源和预处理同实施例2。
二、试剂准备
peg8000母液、nacl母液制备方法同实施例1。
微球试剂选择,包括直径为1μm的表面羧基修饰的氧化硅微球(无磁性)、1μm的未修饰的氧化硅磁球、直径为5.6μm的羧基修饰的氧化硅微球(无磁性)和5μm的氨基修饰的氧化硅磁球,均购买自上海奥润微纳新材料科技有限公司商品化的试剂盒。
三、外泌体分离
1、孵育:依次添加160μlpeg8000母液、100μlnacl母液、微球溶液、240μl的pbs溶液、400μl的样品于2mlep管内。最终peg浓度为80mg/ml,nacl浓度为0.2m,微球的工作浓度为0.1mg/ml。轻微涡旋混匀后,置于4℃冰箱中,旋转反应器上混匀孵育2h。
2、分离:取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,吸取上清,舍弃上清液(无磁性的微球采用1000g离心5min分离)。
3、洗脱:去除磁分离板,向微球中加入400μl的pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀5min,洗脱样品。
4、分离:取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后(无磁性的微球采用1000g离心5min分离),吸取上清,留存。即可得到外泌体样品。
四、外泌体表征
外泌体表征同实施例1。
通过nta检测外泌体颗粒浓度以及bca检测外泌体蛋白浓度的实验结果显示,发现对于血浆样品,在2小时相同的孵育时间下,直径为1μm的表面羧基修饰的氧化硅微球(无磁性)、1μm的未修饰的氧化硅磁球、直径为5.6μm的羧基修饰的氧化硅微球(无磁性)和5μm的氨基修饰的氧化硅磁球分离所得的外泌体回收率分别为80%、78%、73%和71%,证明本方法可选用多种微球种类来进行外泌体的有效分离。
实施例9:
本实施例提供了微球结合亲水性聚合物peg提取细胞培液外泌体的方法,对微球(表面为羧基修饰、直径1μm)的工作浓度进行优化
一、样品准备
细胞培液样品来源和预处理同实施例1,此处采用a549细胞。
二、试剂准备
peg8000母液、nacl母液制备方法同实施例1。
微球试剂选择,直径为1μm的表面羧基修饰的氧化硅磁球。
三、外泌体分离
1、依次添加160μl的peg母液、100μl的nacl母液、不同体积的磁性微球溶液和pbs溶液、400μl的样品于2mlep管内。最终peg浓度为80mg/ml,nacl浓度为0.2m,通过调节磁性微球溶液和pbs溶液的体积,使磁性微球的工作浓度为0.1mg/ml、0.2mg/ml、0.5mg/ml和1mg/ml。轻微涡旋混匀后,置于4℃冰箱中,旋转反应器上混匀孵育2h。
2、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,吸取上清,舍弃上清液。
3、去除磁分离板,向微球中加入400μl的pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀5min,洗脱样品。
4、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,吸取上清,留存。即可得到外泌体样品。
四、外泌体表征
外泌体表征同实施例1。
通过nta检测外泌体颗粒浓度以及bca检测外泌体蛋白浓度的实验结果显示,发现对于培液样品,在相同的孵育时间条件下,磁性颗粒的工作浓度越高(一般在0.5mg用量以上),吸附外泌体的速度越快,微球吸附得到外泌体的总量越多。
实施例10:
本实施例提供了微球结合亲水性聚合物peg提取血浆外泌体方法在提取时间上的优化
一、样品准备与预处理
样品准备与预处理同实施例2。
二、试剂准备
peg8000母液、nacl母液制备方法同实施例1。
三、外泌体分离
1、依次添加160μlpeg母液、100μl2mnacl溶液、100μl的磁性微球(表面为羧基修饰、直径1μm,工作浓度1mg/ml)溶液、240μl的pbs溶液、400μl的血浆样品于2mlep管内。最终peg浓度为80mg/ml,nacl浓度为0.2m,微球加入量为1mg,轻微涡旋混匀后,置于4℃冰箱中的旋转反应器上,混匀孵育15min、30min、60min、120min。
2、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,吸取上清,舍弃上清液。
3、去除磁分离板,向微球中加入400μl的pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀20min,洗脱样品。
4、取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,吸取上清,留存。
四、外泌体表征
外泌体表征同实施例1。
图10为不同孵育时间下通过nta测得的颗粒回收率,由图可见孵育时间从15min增加至60min,得到的颗粒回收率从30%增加至85%,而孵育时间从60min增加至120min,颗粒回收率为85%和85%,无明显增加,证明在本体系下60min已经达到了微球和peg共同作用分离血浆外泌体的平衡时间。
实施例11:
本实施例提供了微球结合亲水性聚合物peg提取细胞培液外泌体方法在提取时间上的优化
一、样品准备
细胞培液样品来源及预处理同实施例1,此处采用的为a549细胞。
二、试剂准备
peg8000母液、nacl母液制备方法同实施例1。
三、外泌体分离
1、孵育:依次添加100μlpeg母液、100μl2mnacl溶液、100μl的磁性微球(表面为羧基修饰、直径1μm)溶液、240μl的pbs溶液、400μl的样品于2mlep管内。最终peg浓度为50mg/ml,nacl浓度为0.2m,微球工作浓度为1mg/ml,轻微涡旋混匀后,置于4℃冰箱中的旋转反应器上,混匀孵育15min、30min、60min、120min。
2、分离:取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,吸取上清,舍弃上清液。
3、洗脱:去除磁分离板,向微球中加入400μl的pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀5min,洗脱样品。
4、分离:取出样品,置于磁分离架上,经过快速磁吸附,待微球吸附后,吸取上清,留存。即可得到外泌体样品。
四、外泌体表征
外泌体表征同实施例1。
图11为不同孵育时间通过nta测得的颗粒回收率,由图可见孵育时间从15min增加至60min,得到的颗粒回收率从25%逐渐增加80%,而孵育时间从60min增加至120min,颗粒回收率分别为80%和82%,无明显增加,在60min已基本达到了微球和peg共同作用分离培液外泌体的平衡时间。
实施例12:
本实施例提出微球和亲水性聚合物分离培液外泌体时,亲水性聚合物的不同选择
一、样品准备和预处理
细胞培液样品来源及预处理同实施例1,此处采用的为a549细胞。
二、外泌体分离
1、取若干2ml的ep管,依次添加100μl微球(表面为羧基修饰、直径1μm,工作浓度0.5mg/ml)母液、各类亲水性聚合物溶液(聚丙烯酰胺、葡聚糖、聚乙烯亚胺、聚乙烯吡咯烷酮和三甲基甘氨酸),最后用pbs补足至600μl,震荡混匀。向管内加入400μl的样品,颠倒混匀,最终聚合物母液浓度分别为30mg/ml、50mg/ml、80mg/ml、100mg/ml、150mg/ml、200mg/ml。置于4℃冰箱中,旋转反应器上混匀孵育60min。
2、取出样品,放置于离心机上2000g离心5min,舍弃上清液。
3、去除磁分离板,向微球中加入pbs,震荡混匀,置于4℃冰箱中,旋转反应器上混匀30min,洗脱样品。
4、取出样品,放置于离心机上2000g离心5min,吸取上清保存。保存的上清中即为分离得到的外泌体。
三、外泌体表征
外泌体的表征手段同实施例1。
通过nta检测外泌体颗粒浓度以及bca检测外泌体蛋白浓度的实验结果显示,五种聚合物均可提取到外泌体颗粒,外泌体的回收率在30%-60%之间。
实施例13:
本实施例提供了微球结合亲水性聚合物peg提取方法结合自动化样品移液平台的范例
一、样品准备
细胞培液样品来源及预处理同实施例1,此处采用的为a549细胞。
二、试剂准备
peg8000母液、nacl母液制备方法同实施例1。
三、外泌体分离
1、利用自动样本制备工作站(tecan公司freedomevo)在样本孵育模块中依次加入100μl的peg母液、100μl2m的nacl溶液、100μl的磁性微球(表面为羧基修饰、直径1μm,工作浓度1mg/ml)溶液、240μl的pbs溶液、400μl的样品。吹打混匀后原位孵育60min,间隔5min用移液臂吹打一次。
2、利用移板装置将样本孵育模块移至磁分离器,经过快速磁吸附,待微球吸附后,用移液臂吸取上清,舍弃上清液。
3、去除磁分离板,用移液臂加入400μl的pbs,吹打混匀,转移至4℃孵育位孵育5min,洗脱外泌体。
4、转移至磁分离位,经过快速磁吸附,待微球吸附后,移液臂吸取上清,留存。即可得到外泌体样品。
四、外泌体表征
外泌体表征同实施例1。
通过nta检测外泌体颗粒浓度以及bca检测外泌体蛋白浓度的实验结果显示,该方法可成功提取到外泌体,外泌体得率在40-80%之间,证实本方法可与自动化样品移液工作站结合,实现自动化的外泌体提取。
上述实施例仅为说明本发明的使用方式和后续应用可能性所作的举例,并非是对本发明的具体实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出试剂修改、浓度改变、样本改变、应用方式变化等其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!