一种人外泌体蛋白、试剂盒及其应用的制作方法
本发明属于医学生物
技术领域:
,尤其涉及一种外泌体dicer蛋白及其应用,具体地为一种可用于肺癌早期检测及术后监测的以外泌体dicer蛋白为肿瘤标志物的elisa(酶联免疫吸附测定法)试剂盒的制备及应用。
背景技术:
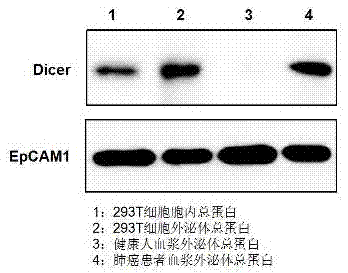
:近年来,肺癌成为威胁人类健康的主要恶性肿瘤之一,其死亡率居恶性肿瘤首位,且发病率逐年增高。肺癌的5年存活率仅为13%,80%的患者在诊断后1年内死亡。肺癌的早期诊断率仅15%,但这些患者的5年存活率可达60%~90%。以上可见,诊断肺癌、控制肺癌是摆在医务工作者面前紧迫而艰巨的任务。临床上传统的肺癌诊断方法有胸部x线片、支气管镜检查、痰液细胞涂片等,因其症状、体征均无特异性,与其它肺部疾病,如肺炎,肺结核等病难以鉴别。因其特异度和灵敏度有限,大多数患者发现时已是晚期。肿瘤标志物相比于其他传统诊断方法具有更高的特异度和灵敏度,也越来越得到广泛应用。随着肿瘤病理学、分子生物学研究的进展,血浆肿瘤标志物的研究与筛选成为肺癌早期诊断的研究热点。理想的肿瘤标志物应该是敏感性高,特异性强,表达量或血浆中水平与肿瘤组织扩散或肿块大小成正相关。目前临床常用的肺癌肿瘤标志物包括:cea(癌胚抗原)、cyfra21-1(细胞角蛋白19的可溶性片段)、scc(鳞状细胞癌抗原)、nse(神经元特异性烯醇化酶)和progrp(胃泌素释放肽前体)。癌胚抗原cea是一种具有人类胚胎抗原决定簇的酸性糖蛋白,它是一种肿瘤相关抗原,存在于多种肿瘤组织中,其在肺腺癌中有较高的诊断价值,特异性在90%以上时,敏感性可达50%-70%,也是临床上应用最为广泛的一种。由于肺癌发病机理较复杂,致病的分子生物学基础因个体差异也表现出多样性,这也使得单一的分子标记物并不能有效指示肺癌发病的早期差异或者预后的个体特征。因此发现并开发能兼顾敏感性和特异性的血浆肿瘤标志物,应用于肺癌的临床检测,以期达到肺癌早期诊断、术后监测及预后评估的目在肺癌的临床应用中显得十分必要。外泌体(exosome)在30年前被人们所发现。外泌体是直径约为30-150nm,密度在1.13-1.21g/ml的小囊泡。外泌体天然存在于体液中,包括血液、唾液、尿液和母乳,是活细胞分泌的来源于晚期核内体(也称为多囊泡体)的膜性囊泡。外泌体中携带有母细胞的多种蛋白质、脂类、dna和rna等重要信息。而不同组织细胞来源外泌体由于携带的蛋白质不同,则能够发挥不同的生物学功能。外泌体通过与受体细胞相融在细胞间通信过程中起关键作用。因此这些外泌体内的蛋白及rna等被证实对于多种生理学事件均发挥了巨大的调控作用,被认为是潜在的生物标志物或治疗试剂。酶联接免疫吸附剂测定(enzyme-linkedimmunosorbentassay,简称elisa)是继免疫荧光和放射免疫技术之后发展起来的一种免疫酶技术。它是将已知的抗原或抗体吸附在固相载体表面,使酶标记的抗原抗体反应在固相表面进行的技术。该技术可用于检测大分子抗原和特异性抗体等,具有快速、灵敏、简便、载体易于标准化等优点。同时,由于elisa的技术条件要求低、携带方便、常以试剂盒的形式出现且易商品化、操作简便和经济实惠,已成为一种应用最为广泛和发展最为成熟的生物检测与分析技术。基于elisa的双抗体夹心法是检测抗原的最常用的方法。dicer酶是一种核糖核酸内切酶,属于rnaseiii家族中特异识别双链rna的一员。dicer蛋白有着较多的结构域,包含一个rna解旋酶基序如位于氨基端的dexh盒子,和一个位于羧基端的rnase基序。它最先在果蝇中发现,并且在不同的生物体上表现出很高的保守性。编码人类dicer蛋白的基因定位于染色体14q32.13。dicer蛋白在大脑、心脏、肝脏、肺、胰腺、肾脏及胎盘等器官中均广泛表达,并且在rna干扰通路中发挥作用。它能以一种atp依赖的方式逐步切割包括mirna前体等各种方式引入的双链rna,切割将rna降解为19-21bp的双链rnas(dsrnas),每个片段的3’端都有2个碱基突出。单链mirna前体经过dicer加工后可成熟为长度为20-24个核苷酸的mirna。dicer蛋白位于哺乳动物的细胞质中,通常它与钙网蛋白共定位于内质网。dicer蛋白的分子大小为218kda。随着研究对于外泌体及其所分泌蛋白和rna等的深入,外泌体在肿瘤的发生、发展、恶性转化等过程中的机制也越来越清楚。研究表明肿瘤细胞的外泌体与正常细胞的外泌体之间存在差异,肿瘤的外泌体会促进肿瘤的生长和转移,同时肿瘤分泌的外泌体可以改变周围的细胞,使其成为肿瘤细胞并促进肿瘤的生长。发明人前期的研究显示肿瘤患者外泌体中的成熟mirna水平较正常人明显上升,同时同一患者外泌体中的mirna前体则随着时间而不断下降,这提示了外泌体中存在的mirna成熟所需要的关键蛋白。随后的一些列实验证实癌细胞的转化依赖于dicer蛋白,肿瘤外泌体含有dicer等相应蛋白质,能够加工mirna前体使其成熟为相应的mirna,从而改变肿瘤细胞周围的细胞将其转化为肿瘤细胞。这样一来,dicer蛋白就可作为一个标记物指示肿瘤细胞的存在,或作为治疗癌症的靶标。因此,建立外泌体dicer的elisa检测方法,建议以外泌体dicer为标志物的肿瘤检测体系对于基础研究和肿瘤的临床医学检测等都有重要的应用价值。技术实现要素:本发明提供了一种外泌体dicer蛋白,不仅首次证实了外泌体中dicer蛋白的存在,并发现该分泌型dicer蛋白在正常人和肿瘤患者血浆中的表达有显著差异,尤其在肺癌晚期患者血浆中明显升高,并与肺癌患者肿瘤负荷呈显著正相关,因此能作为一种理想的血浆学标记物用于肺癌患者的术前诊断、术后治疗效果评估及随访监测,更进一步提供了一种以外泌体dicer蛋白为新型肿瘤标志物的试剂盒,为便捷快速无创式的肺癌体外诊断提供了有效的工具。本发明解决上述技术问题的技术方案如下:一种外泌体dicer蛋白,所述外泌体dicer蛋白与胞内的dier蛋白序列特征一致(genebank索取号为aai50288.1),包含于外泌体中,且能在血浆外泌体中被稳定检测到。本发明通过elisa技术、western-blot检测及qrt-pcr等多方面证明人血浆中外泌体dicer蛋白的存在,并确定其大小为218kd,与胞内的dicer蛋白大小一致;此外,在肺癌患者血浆中发明人发现该外泌体dicer蛋白浓度升高,而且具有非常高的敏感性和特异性,外泌体dicer蛋白在很多方面表现出与肿瘤发生相关的活性,包括促进细胞增殖和迁移,抗肿瘤细胞凋亡和药物作用等。至此,发明人首次证实了该外泌体dicer蛋白在癌症患者血浆中特异性差异性表达。在上述技术方案的基础上,更进一步地,上述的外泌体dicer蛋白作为肿瘤标志物的应用。上述的外泌体dicer蛋白作为肿瘤标志物在肺癌术前检测及术后监测中的应用。基于上述技术方案,本发明提供一种以外泌体dicer蛋白为肿瘤标志物的检测试剂盒,包括:包被到酶标板上的山羊抗人dicer多克隆抗体、检测抗体为小鼠抗人dicer单克隆抗体、链霉亲和素-辣根过氧化物酶标记的驴抗小鼠igg多克隆抗体和标准品,所述标准品为dicer人重组蛋白,所述dicer人重组蛋白包含ncbigenebank索取号为aai50288.1所示的氨基酸序列,优选地,所述dicer人重组蛋白就是由ncbigenebank索取号为aai50288.1所示的氨基酸组成。利用上述试剂盒能通过检测人血浆中外泌体dicer蛋白的浓度从而协助诊断及随访肺癌患者,为体外诊断肺癌提供了另一种高效无创的工具。本发明所述的外泌体dicer蛋白等同于分泌型dicer蛋白,是指包含于血浆外泌体之中,能够被包括下述试剂盒等方法稳定检测或定量的dicer蛋白。具体而言,本发明所述的上述试剂盒是用于检测血浆中外泌体dicer蛋白的elisa试剂盒,其包被一种山羊抗人dicer多克隆抗体,通过包被的dicer抗体捕获血浆中的外泌体dicer蛋白,用小鼠抗人dicer单克隆抗体检测外泌体dicer蛋白的含量。本发明所述的试剂盒的检测原理采用双抗体夹心法elisa。本发明所述的试剂盒的检测对象为外泌体中表达dicer蛋白的肿瘤,所述外泌体中表达dicer的肿瘤包括肺癌、乳腺癌、宫颈癌、卵巢癌、结直肠癌和膀胱癌等,所述肿瘤优选为肺癌。本发明所述的试剂盒用于肺癌的早期诊断、监测治疗效果和预后随访。在本发明所述的试剂盒中,所述包被抗体的工作浓度为4ug/ml所述检测抗体的工作浓度为0.4ug/ml,所述酶联抗体的工作浓度为1ug/ml。本发明所述的试剂盒具有良好的特异性、敏感性和稳定性。本发明所述试剂盒的具体的优点在于:(1)引入一种新的肺癌分子标志物外泌体dicer蛋白,通过检测该标志物,可以协助肺癌患者的临床诊断,进一步判断患者预后情况,指导治疗;同时,作为肺癌的一个独立预后因子,该标志物也可能成为治疗新靶点。(2)该标志物的检测只需抽血便可进行,为无侵入式液体活检,且可以随时检测,有利于监测病情。(3)elisa检测技术在临床应用已经比较成熟,且简单方便,成本低廉,适合临床检测。进一步,所述包被到酶标板上的山羊抗人dicer多克隆抗体,母液浓度为0.2mg/ml,稀释50倍后的工作液的浓度为4ug/ml;1)检测抗体为小鼠抗人dicer单克隆抗体,母液的浓度为0.2mg/ml,利用生物素标记后(生物素标记试剂盒购自日本同仁,型号为lk03,具体标记方法及实施步骤参照该产品说明书),使用时,稀释500倍得到的工作液浓度为0.4ug/ml;2)链霉亲和素-辣根过氧化物酶标记的驴抗小鼠igg多克隆抗体(即streptavidin-hrpigg),母液的浓度为0.5mg/ml;3)标准品为dicer人重组蛋白,所述dicer人重组蛋白包含ncbigenebank索取号为aai50288.1所示的氨基酸序列,优选地,所述dicer人重组蛋白就是由ncbigenebank索取号为aai50288.1所示的氨基酸组成。其由南京金斯瑞生物科技有限公司合成,其合成方法为在昆虫细胞sf9中真核表达并经过亲和纯化,母液的浓度为100ng/ul。采用上述进一步方案的有益效果是:在本发明所述的试剂盒中,所述包被抗体的工作浓度为4ug/ml,所述检测抗体的工作浓度为0.4ug/ml,所述酶联抗体的工作浓度为1ug/ml,进一步保证了本发明所述的试剂盒具有良好的特异性、敏感性、稳定性以及使用时的便利性。进一步,还包括包被缓冲液、洗涤液、封闭液、加样缓冲液、显色液、反应终止液。进一步,所述包被缓冲液为磷酸盐缓冲液(pbs),其成分为140mmnacl、2.7mmkcl、10mmna2hpo4、1.8mmkh2po4,ph值为7.4;所述洗涤液为添加了体积分数为0.05%的tween-20的包被缓冲液;所述封闭液为含有体积分数为1%的牛血浆白蛋白的包被缓冲液;所述加样缓冲液的成分为50mmtris-hcl、0.5mkcl、体积分数为1%的牛血浆白蛋白、体积分数0.05%的tween-20,ph值为8.4;所述反应终止液的成分为2mh2so4。本发明所用术语″工作浓度″是指在进行检测时所使用的试剂例如抗体的浓度。本发明所述的以分泌型dicer蛋白为肿瘤标志物的试剂盒在使用时,包括以下步骤:1.按照血液血浆操作规范,收集分离血浆样本,包括正常人和患者的血浆样本(包括肺部良性病变和肺癌患者的血浆样本);2.分离血浆中的外泌体,提取外泌体中的总蛋白;3.双抗夹心法elisa实验,由96孔酶标板多克隆抗体包被;单克隆抗体检测外泌体dicer蛋白;计算血浆中外泌体dicer蛋白的含量等先后步骤完成。优选地,步骤1的具体操作为:1)在真空采血管中收集2ml正常人或者肺癌患者的外周全血,4°c存放或者-80°c冻存;2)冻存的全血在冰上完全冻融,在4°c条件下,2000rpm离心20分钟;3)小心将上层透亮澄清的液体转移到另一个干净的离心管中,继续到下步操作或者-80°c冻存;4)以上操作过程中需注意洁净环境,同时需要佩戴手套及口罩等,注意操作人员的安全操作。优选地,步骤2的具体操作为:1)血浆外泌体的分离与纯化2)完全冻融状态的血浆在4°c下2000*g离心20分钟,除去细胞和细胞碎片;3)取上清移至新的离心管,4°c条件下16500*g离心30分钟,进一步除去细胞碎片;4)取上层液体转移到离心管,加入0.5倍体积的磷酸盐缓冲液(pbs),涡旋混匀;5)在溶液中加入0.05倍血浆起始体积的蛋白酶k,优选地,500ul起始体积的血浆需要加入25ul蛋白酶k;6)混匀样本,在37°c条件下孵育10分钟;7)将样本经过0.22um一次性过滤器,去除大的囊泡,收集清液;8)将收集的清液在110000*g下离心70分钟,弃上清,再加入5mlpbs溶液清洗沉淀,110000*g再次离心70分钟,弃除上清;9)用100ul外泌体重悬溶液(pbs)重悬全部沉淀,-20℃保存。10)外泌体总蛋白的提取11)在冰上将外泌体溶液及外泌体蛋白裂解液融化;12)在25ul重悬后的外泌体溶液中加入等体积的外泌体蛋白裂解液,通过移液器上下吹吸混匀样本;13)在冰上孵育30分钟,每隔10分钟颠倒离心管不断混匀样本;14)在4°c条件下,14,000*g离心10分钟,转移上清液到干净的离心管中,并置于冰上;15)测量蛋白浓度,优选地,将蛋白样本稀释200倍后通过bca法测定波长562nm的吸光度值,通过标准蛋白溶液所绘制的标准曲线而换算其浓度;16)蛋白样本存放于-80°c,或直接用于下游分析。优选地,步骤3的具体操作为:1)在酶标板中加入包被缓冲液(pbs)稀释50倍的山羊抗人dicer多克隆抗体,每孔100ul,4℃包被24小时;弃去孔中液体,在干净的吸水纸上拍干,并用洗涤液洗涤三次,每次5分钟;2)每孔加入200ul封闭液,37℃封闭2小时;弃去孔中液体,在干净的吸水纸上拍干,并用洗涤液洗涤三次,每次5分钟;3)将标准品(浓度分别为0ng/ml、0.78125ng/ml、1.5625ng/ml、3.125ng/ml、6.25ng/ml、12.5ng/ml、25ng/ml、50ng/ml)分别加入步骤4)处理的孔中,每孔加入100ul,用于制作标准曲线;4)将待测蛋白样品分别加入步骤3)处理的孔中,每孔加入100ul;加盖封口膜,置于37℃孵育2小时,用于检测待测样品;5)将步骤3)和步骤4)孔中的液体弃去,在干净的吸水纸上拍干,并用洗涤液洗涤三次,每次5分钟;6)向步骤5)的孔中,每孔分别加入利用加样缓冲液稀释500倍的生物素标记的小鼠抗人dicer单克隆抗体(浓度为0.4ug/ml),每孔加入100ul,37℃反应2h,加盖封口膜;弃去孔中液体,在干净的吸水纸上拍干,并用洗涤液洗涤三次,每次5分钟;7)每孔分别加入100ul的streptavidin-hrpigg(浓度为0.5mg/ml),加盖封口膜,37℃避光反应20min;8)每孔加入100ul显色液tmb,室温反应10-30min;9)每孔加入50ul2mh2so4终止反应;10)在酶标仪中测定od450和od570值;11)根据标准品测定的od450-570值(即利用od450测的数值减去od570测得的数值),利用统计学绘图软件根据测定的值绘制标准曲线,横坐标为待测样品中外泌体dicer蛋白的浓度,纵坐标为od450-570值;12)通过标准曲线和未知浓度样品的od450-570值计算待检样品中外泌体dicer蛋白的浓度。附图说明图1为肺癌患者血浆外泌体内mirna前体及其成熟mirna在室温孵育不同时间时的相对表达情况。图1a显示外泌体内mirna前体在孵育24小时和72小时后的相对表达变化情况;图1b显示外泌体内成熟mirna在孵育24小时和72小时后的相对表达变化情况。图2westemblotting方法检测肺癌患者和健康个体血浆外泌体中dicer蛋白表达情况。图3为血浆外泌体dicer蛋白的检测标准曲线。图4elisa试剂盒检测外泌体dicer蛋白的灵敏度和特异度。图5为根据公式计算出肿瘤患者、肺部良性疾病患者和健康个体的血浆外泌体dicer蛋白浓度比较。具体实施方式以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。实施例1血浆样本的收集,血浆中外泌体的分离及其内含总蛋白的提取发明人于2015年5月至11月期间先后在温州医科大学附属医院收集了三批肺癌患者(258例,病理特征见表1),肺部良性疾病(41例)和健康个体(110例)的外周血样本(不同批次样本的收集、预处理、分装、保存条件等均保持一致),通过离心的方法分别分离了相应个体的血浆样本。从血浆中分离外泌体的具体操作为1)完全冻融状态的血浆在4°c下2000*g离心20分钟,除去细胞和细胞碎片;2)取上清移至新的离心管,4°c条件下16500*g离心30分钟,进一步除去细胞碎片;3)取上层液体转移到离心管,加入0.5倍体积的磷酸盐缓冲液(pbs),涡旋混匀;4)在溶液中加入0.05倍血浆起始体积的蛋白酶k溶液,如500ul起始体积的血浆加入25ul蛋白酶k;5)混匀样本,在37°c条件下孵育10分钟;6)将样本经过0.22um一次性过滤器,去除大的囊泡,收集清液;7)将收集的清液在110000*g下离心70分钟,弃上清,再加入5mlpbs溶液清洗沉淀,110000*g再次离心70分钟,弃除上清;8)用100ul外泌体重悬溶液(pbs)重悬全部沉淀,-20℃保存。从血浆外泌体中提取总蛋白的操作:1)在冰上将外泌体溶液及外泌体蛋白裂解液融化;2)在100ul重悬后的外泌体溶液中加入等体积的外泌体裂解液,通过移液器上下吹吸混匀样本;3)在冰上孵育30分钟,每隔10分钟颠倒离心管不断混匀样本;4)在4°c条件下,14,000*g离心10分钟,转移上清液到干净的离心管中,并置于冰上;5)测量蛋白浓度,优选地,将蛋白样本稀释200倍后通过bca法测定波长562nm的吸光度值,通过标准蛋白溶液所绘制的标准曲线而换算其浓度;6)蛋白样本存放于-80°c,或直接用于下游分析。表1肺癌患者的病理分类实施例2:肺癌血浆外泌体室温孵育实验,检测mirna及其前体的表达量参照实施例1的具体实施方法分离血浆中的外泌体,通过将3-5管肺癌或健康人的外泌体样本混合再分装的方法来获取等量等质的外泌体样本。随后,分别取健康个体和肺癌患者相应的外泌体样本在室温条件下不添加其他任何化合物的情况下分别放置24h和72h,随后通过trizol法提取其中的总rna。在25ul外泌体重悬液中加入1mltrizol溶液(invitrogen),用力涡旋振荡后室温静置5分钟,随后加入200ul氯仿溶液,上下振荡离心管至均一状态,室温静置3分钟后在4℃条件下12000rpm高速离心15min。吸取上层水相到新的离心管中,加入等体积的预冷异丙醇,充分颠倒混匀后,再在-20℃条件下静置2个小时以上。4℃条件下,12000rpm高速离心15min后小心弃掉上清液,加入1ml预冷的75%乙醇洗涤沉淀,再在4℃下7500rpm离心5min,弃去液体,室温下放置5min以充分晾干沉淀,最后5ul加入不含rnase的无菌水溶解沉淀。使用nanodrop2000紫外分光光度计测量rna纯度及浓度,样品可冻存于-80℃。所提取的总rna通过multiscribe反转录酶(appliedbiosystems)和oligo-d(t)而逆转录为cdna。具体的,150ng的总rna通过使用如表2所示的引物及superscriptiiiplatinum一步法rt-qpcr试剂盒(invitrogen)来反转录mirna前体的cdna;而10ng的rna与含有特定的mirna引物taqmanmicrorna反转录试剂盒(appliedbiosystems)试剂混合,然后按照厂商的操作指示来完成反转录。以上反映按照16°c孵育30分钟,42°c孵育30分钟,85°c孵育5分钟的先后顺序进行。实时荧光定量pcr在abisteponeplus定量pcr仪(appliedbiosystems)上进行,使用sybrgreenmastermix(appliedbiosystems)和β-actin作为参照来进行mirna前体的定量;使用商业化的assay-on-demand(appliedbiosystems)用于每个mirna的研究。mirna的表达通过rnu6b的表达来进行归一化。每一组都进行三次重复。通过融解曲线分析和电泳确定目的条带,δδct法进行相对定量。不同来源的外泌体内mirna及其前体在相应条件下的相对表达量如图1所示。图1a显示的是外泌体在室温放置24小时和放置72小时的情况下,其中mirna前体的相对表达量变化情况。可见相较于健康个体的相对稳定的表达,肺癌患者血浆外泌体中的mirna前体在室温孵育了72小时之后有了较明显的下降。图1b显示的则是外泌体中mirna在不同时间点的相对表达情况,与其前体的变化趋势相反,相应的成熟mirna的表达在放置了72小时之后了有了大幅的提升。这中相反的变化趋势也提示了潜在的由前体向成熟mirna转化的过程。表2靶标引物序列hsa-actinf:5’catgtacgttgctatccaggc3’hsa-actinr:5’ctccttaatgtcacgcacgat3’pre-mir-10a,bf:5’taccctgtagatccgaatttgtg3’pre-mir-10a,br:5’attcccctagatacgaatttgtga3’pre-mir-21f:5’gcttatcagactgatgttgactg3’pre-mir-21r:5’cagcccatcgactggtg3’实施例3:验证血浆外泌体dicer蛋白的存在步骤1按照实例1中的方法分离肺癌患者及正常健康个体血浆中的外泌体及其中的总蛋白,并用bca法测定562nm波长下的吸光光度值,根据标准曲线计算浓度,蛋白定量为30ug后置于-80℃备用,得到血浆来源的外泌体总蛋白。步骤2用容积为75cm的培养瓶培养atcc来源293t细胞,待细胞达到70%融合度时换成10ml无血浆1640培养基(购自gibico公司)培养24小时。收取5瓶上清约50ml,利用低温冻干机冻干成粉末状后,加入5ml细胞裂解液(购自康为世纪,货号为cw0889)。溶解后,用bca法测定562nm波长下的吸光光度值,根据标准曲线计算浓度,蛋白定量为30ug后置于-80℃备用,得到培养细胞来源的外泌体总蛋白。步骤3按照步骤2的提示培养细胞,取一瓶离心收集的细胞,加入1ml细胞裂解液,充分裂解后,4°c条件下高速离心10分钟,收集上清,用bca法测定并计算蛋白浓度,蛋白定量为30ug后置于-80℃备用,得到细胞来源的胞内总蛋白作为阳性对照。步骤4分别将步骤1得到的30ug肺癌患者及健康个体血浆外泌体总蛋白样品,步骤2得到的30ug上清中的外泌体总蛋白以及步骤3得到的30ug胞内总蛋白分别置于2×sds样品上样缓冲液中,100℃同时变性5分钟,顺序加样到10%的sds-page凝胶中,通过10%的sds-page分离,采用湿氏电转仪(bio-rad)恒流350ma冰浴转膜1h20min转到0.2mm的pvdf膜,质量体积比5%脱脂牛奶37℃封闭1小时,加一抗多克隆抗体anti-dicer(将原液按照体积比稀释400倍,原液为购自santacruzbiotechnology,inc.的多克隆抗体,货号为sc-34601)孵育过夜;加二抗(原液为donkeyantigoatigg-hrp,工作液的浓度是将原液按照体积比稀释1000倍,购自proteintech,usa),室温下孵育1小时,化学发光(supersignalwestpicochemiluscentsubstrate,34080,pierce),根据试剂盒的说明书进行显影、定影,利用上述westernblotting方法分别检测人血浆中外泌体总蛋白(即步骤1得到的蛋白)和培养人293t细胞的外泌体中dicer蛋白(即步骤2得到的蛋白)及胞内dicer蛋白(即步骤3得到的蛋白)的结果见图2。实施例4构建以外泌体dicer蛋白为肿瘤标志物的检测试剂盒以外泌体dicer蛋白为肿瘤标志物的试剂盒为elisa检测试剂盒,包括:血浆总外泌体重悬液、蛋白酶溶液、外泌体裂解液、包被到酶标板上的山羊抗人dicer多克隆抗体、检测抗体为小鼠抗人dicer单克隆抗体、链霉亲和素-辣根过氧化物酶标记的驴抗小鼠igg多克隆抗体、标准品、包被缓冲液、洗涤液、封闭液、加样缓冲液、显色液、反应终止液。1)血浆总外泌体重悬液为磷酸盐缓冲液,其成分为140mmnacl、2.7mmkcl、10mmna2hpo4、1.8mmkh2po4,ph值为7.4;2)蛋白酶溶液为蛋白酶k,其浓度为20mg/ml;3)外泌体裂解液,其成分为50mmtris-hcl(ph7.5)、150mmnacl、质量分数1%的np-40、5mmedta、1mm矾酸钠、1mmpmsf、10µg/ml抑肽酶、10µg/ml亮肽素,矾酸钠、pmsf、抑肽酶、亮肽素等在临用前加入。4)标准品为dicer人重组蛋白,其氨基酸序列为ncbigenebank索取号为aai50288.1所示的序列,由南京金斯瑞生物科技有限公司合成,其合成方法为在昆虫细胞sf9中真核表达并经过亲和纯化,母液的浓度为100ng/ul。5)包被到酶标板上的山羊抗人dicer多克隆抗体,购自santacruzbiotechnology,inc.,目录号为sc-34601,母液浓度为0.2mg/ml,利用pbs稀释50倍后的工作液的浓度为4ug/ml。6)检测抗体为小鼠抗人dicer单克隆抗体,购自santacruzbiotechnology,inc.,目录号为sc-136981,母液的浓度为0.2mg/ml,利用生物素标记后,使用时,将生物素标记的小鼠抗人dicer单克隆抗体稀释500倍得到的工作液浓度为0.4ug/ml。7)链霉亲和素-辣根过氧化物酶标记的驴抗小鼠igg多克隆抗体(即streptavidin-hrpigg),购自r&dsystems,catalog#dy998,母液的浓度为0.5mg/ml。8)包被缓冲液为磷酸盐缓冲液(即pbs),其成分为140mmnacl、2.7mmkcl、10mmna2hpo4、1.8mmkh2po4,ph值为7.4。9)洗涤液为添加了体积分数为0.05%的tween-20的包被缓冲液。10)封闭液为含有体积分数为1%的牛血浆白蛋白的包被缓冲液。11)加样缓冲液的成分为50mmtris-hcl、0.5mkcl、体积分数为1%的牛血浆白蛋白、体积分数为0.05%的tween-20,ph值为8.4。12)显色液tmb,购自r&dsystems,catalog#dy999。13)所述反应终止液的成分为2mh2so4。实施例5:外泌体dicer蛋白检测试剂盒的使用方法1)收集血浆样本并按照常规血浆分离方法处理,得到血液上清;2)参照实施例1中的外泌体分离及总蛋白提取步骤,得到血浆外泌体的总蛋白;3)在96孔酶标板中,每孔加入100ul浓度为4ug/ml山羊抗人dicer多克隆抗体,4℃孵育24h;弃去孔中液体,在干净的吸水纸上拍干,用洗涤液洗三次,每次洗涤5分钟,滤纸吸干;4)每孔加入200ul封闭液封闭2h(37℃条件下封闭),弃去孔中液体,在干净的吸水纸上拍干,用洗涤液洗三次,每次洗涤5分钟,滤纸吸干;5)每孔加入标准品或待检测的蛋白溶液100ul,留出阴性对照孔加pbs做空白对照,37℃孵育2h后,弃去孔中液体,在干净的吸水纸上拍干,用洗涤液洗三次,每次洗涤5分钟,滤纸吸干;6)每孔加入100ul小鼠抗人dicer单克隆抗体(已生物素化,浓度为0.4ug/ml),37℃孵育2h,孵育时加盖封口膜,孵育完成后弃去孔中液体,在干净的吸水纸上拍干,用洗涤液洗三次,每次洗涤5分钟,滤纸吸干;7)每孔加入100ulstreptavidin-hrpigg(浓度为0.5mg/ml),加盖封口膜,37℃条件下避光反应20分钟;8)每孔加入100ultmb显色,室温反应20分钟;9)每孔加入50ul2mh2so4终止反应;10)在酶标仪中测定od450和od570值(450nm,570nm,bio-radmodel)。实施例6标准曲线的制备将实施例5的步骤4)分别添加不同浓度的标准品,标准品的浓度分别为0ng/ml、0.78125ng/ml、1.5625ng/ml、3.125ng/ml、6.25ng/ml、12.5ng/ml、25ng/ml、50ng/ml。其余步骤均同实施例5。根据标准品测定的od450-570值(即利用od450测的数值减去od570测得的数值),利用统计学绘图软件根据测定的值绘制标准曲线,横坐标为待测样品中外泌体dicer蛋白的浓度,纵坐标为od450-570值;测得标准曲线的方程为:y=0.0254x+0.0328,其中,y为样品孔的吸光度(od450-570值),x为血浆中分泌型dicer蛋白绝对含量(ng/ml)。标准曲线如图3所示,r-square(即标准曲线的回归系数)为0.999,表示该试剂盒在技术上合格。根据特异性识别血浆中外泌体dicer蛋白含量,判断患者是否患有恶性肺癌肿瘤。实施例7:对比实施例为了验证本技术方案所具备的有益效果,同时设置了其他的条件进行对比试验。采用dicer人重组蛋白为标准品,其氨基酸序列为ncbigenebank索取号为aai50288.1所示的氨基酸序列,由南京金斯瑞生物科技有限公司合成,利用实施例6所示的方法制作标准曲线。选取敏感特异配对包被抗体和检测抗体利用方阵滴定法来验证本发明所述的技术的检测条件的有益效果。其中包被抗体为山羊抗人dicer多克隆抗体,检测抗体为生物素标记后小鼠抗人dicer单克隆抗体。如表3所示,设置不同的包被抗体浓度和检测抗体浓度。表3添加的标准品的浓度示意图编号123456789101112a3.1253.1253.1253.1253.1253.1253.1253.1253.1253.1253.1253.125b6.256.256.256.256.256.256.256.256.256.256.256.25c12.512.512.512.512.512.512.512.512.512.512.512.5d252525252525252525252525e3.1253.1253.1253.1253.1253.1253.1253.1253.1253.1253.1253.125f6.256.256.256.256.256.256.256.256.256.256.256.25g12.512.512.512.512.512.512.512.512.512.512.512.5h252525252525252525252525包被抗体浓度的设置:将包被抗体用包被缓冲液稀释为8ug/ml、4ug/ml、2ug/ml等浓度按列包被96孔板(96孔酶标板,康宁公司,美国),每个浓度包被两列,共设两组,第一组的所在的列的编号为1-6,第二组所在的列的编号为7-12。标准品浓度的设置:向编号a1至a12的孔中、编号e1至e12的孔中均加入弱阳性抗原(dicer人重组蛋白浓度为3.125ng/ml);向编号b1至b12的孔中、编号f1至f12的孔中均加入弱阳性抗原(dicer人重组蛋白浓度为6.25ng/ml);向编号c1至c12的孔中、编号g1至g12的孔中均加入强阳性抗原(dicer人重组蛋白浓度为12.5ng/ml);向编号d1至d12的孔中、编号h1至h12的孔中均加入强阳性抗原(dicer人重组蛋白浓度为25ng/ml)。检测抗体浓度的设置:将检测抗体用加样缓冲液稀释为400ng/ml、200ng/ml、100ng/ml、50ng/ml四个浓度,分别加入上述孔中。其中,编号a1至a6、b1至b6、c1至c6、d1至d6的孔中加入浓度为400ng/ml检测抗体;编号a7至a12、b7至b12、c7至c12、d7至d12的孔中加入浓度为200ng/ml检测抗体;编号e1至e6、f1至f6、g1至g6、h1至h6的孔中加入浓度为100ng/ml检测抗体;编号e7至e12、f7至f12、g7至g12、h7至h12的孔中加入浓度为400ng/ml检测抗体。加底物(tmb)显色,加酸(硫酸,浓度为2m,体积为50ul)终止反应。分别读取吸光度od450-570值(450nm,570nm,bio-radmodel)。其余详细的具体步骤(如添加各种试剂的体积、洗涤等等过程)均参照实施例5。根据实验的检测结果,本技术方案设置的包被抗体的工作浓度以及检测抗体的工作浓度,强阳性抗原液od值在1.0-3.0左右,阴性参考od值<0.2,远远好于其他检测条件,符合构建试剂盒所需达到的标准。本技术方案选取的包被抗体的工作浓度为4ug/ml为最佳工作浓度,本技术方案选取的检测抗体的工作浓度为0.4ug/ml为最佳工作浓度远远好于设置的其他浓度的检测效果。实施例8利用血浆外泌体dicer蛋白检测试剂盒检测样品收集血浆,按常规血浆分离方法,抽取2ml静脉外周血,4°c条件下2000rpm离心20分钟,吸出上层血浆到干净的离心管中,-80℃冻存,使用前冰上融化。然后按照实施例5所述的检测方法,对肺癌患者血浆样本(n=258)进行检测,并以标准品、正常个体血浆样品(n=110)及肺部良性病变(n=41)作为对照。对该检测结果进行利用软件spss16.0进行如下的统计学分析。cutoff值的确定:根据统计结果中各可能切点的灵敏度和特异度,计算youden指数,并选择其最大的切点为临界点,确定血浆中含量≥3.304ng/ml为roc曲线上的最佳临界点,即cutoff值(如图4所示)。血浆外泌体dicer蛋白含量诊断恶性肺癌的灵敏度为84.4%,特异度为86.5%。根据实施例6获得的公式y=0.0254x+0.0328计算出的浓度比较如图5所示。浓度均值(正常个体)=1.89ng/ml,浓度均值(良性病变)=2.65ng/ml,浓度均值(肺癌患者)=6.12ng/ml,利用单因素方差分析(one-wayanova)检验,外泌体dicer蛋白在肺癌中表达高于肺部良性病变和正常个体,具有统计学差异(图5)。外泌体dicer蛋白在肺癌患者及正常人群血浆中的表达差异,另外,也可以据此表明外泌体dicer蛋白肺癌患者未转移组及转移组之间的表达差异及治疗后肺癌患者中的表达情况。肺癌患者分为未转移组、转移组和复发组,未转移组均值=5.01ng/ml,转移组均值=6.23ng/ml,复发组均值=6.74ng/ml,统计分析发现肺癌中dicer浓度转移组高于未转移组,且复发患者外泌体dicer表达明显高于转移组和未转移组(未附图说明)。另外,随着治疗的进行,患者血浆外泌体中dicer浓度逐渐降低,具有统计学差异,提示外泌体dicer浓度可能成为肺癌治疗效果评估的指标,未治疗组、化疗后术前、术后、术后化疗后浓度均值分别为8.39ng/ml、5.94ng/ml、4.38ng/ml、2.98ng/ml。工业实用性本发明提供的试剂盒是一种可用于临床检测的实用性试剂盒,通过检测患者血浆外泌体中dicer的水平来协助肺癌的早期诊断、预测预后、评估疗效及随访监测以期早期发现肿瘤复发和转移。外泌体dicer蛋白的发现,为肺癌诊断提供了血浆学标记物以外的另一种分子标记物。本发明所述的外泌体dicer的灵敏度和特异性均较高。因此,利用本发明的试剂盒,可以结合影像学检查来开展无创性肺癌术前早期诊断及术后监测。且由于该生物标志物是一个独立预后因子,因此可以预测预后、监测病情、指导治疗。鉴于以上结果及外泌体dicer蛋白的证实,本发明人进一步尝试开发了人血浆外泌体蛋白的检测试剂盒-双抗夹心elisa试剂盒。实验结果证实试剂盒构建成功。该试剂盒对肺癌患者的可信检出率为80.04%,通过该试剂盒,本发明人发现正常个体与肺癌患者血浆dicer含量有显著差异。本发明中的一些术语与缩写:mab:单克隆抗体,monoclonalantibody;pab:多克隆抗体,polyclonalantibody;bsa:牛血浆白蛋白;tween-20;igg:免疫球蛋白g;tmb:四甲基联苯胺;od:吸光度;np-40:乙基苯基聚乙二醇;pmsf:苯甲基磺酰氟。需要特别指出的是,具体实例和附图仅是为了说明,显然本领域的普通技术人员可以根据本文说明,在本发明的范围内对本发明做出各种各样的修正和改变,这些修正和改变也纳入本发明的范围内。以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1