一种改良的微载体活细胞荧光染色方法与流程
本发明涉及生物技术领域,尤其涉及一种微载体培养的活细胞荧光染色方法。
背景技术:
微载体一般是由天然葡聚糖或者各种合成的聚合物组成,能适用于贴壁细胞的生长,其基本类型主要包括液体微载体、大孔明胶微载体、聚苯乙烯微载体、phema微载体、甲壳质微载体、聚氨酯泡沫微载体、藻酸盐凝胶微载体以及磁性微载体等。常用商品化微载体主要有cytodex1、2、3,cytopore和cytoline等。微载体细胞培养技术的基本原理是,将对细胞无害的微载体加入到培养容器的培养液中,作为载体,使细胞在微载体表面附着生长,同时通过持续搅动使微载体始终保持悬浮状态。应用微载体技术可以实现干细胞的规模化获取,为干细胞治疗应用于临床提供现实基础。
为了更好地观察微载体培养的细胞的活性,我们需要借助荧光染色技术。细胞荧光染色是观察细胞活性的一项重要技术手段,常用的细胞荧光染色方法有很多,如吖啶橙(ao)染色法、溴化乙锭(eb)染色法、荧光素双醋酸酯(fda)染色法、异硫氰酸荧光素(fitc)、碘化丙啶(pi)、hoechst系列染料、sytox系列染料及钙黄绿素(calcein)染色等。钙黄绿素-乙酸甲基酯(caclein-am)本身并不是荧光分子,但具有细胞膜透性,通过活细胞内的酯酶作用,calcein-am能够脱去am基,产生的calcein能发出强绿色荧光,其激发波长为490nm,发射波长为515nm。因此,calcein-am仅对活细胞染色。
上述染色方法利用了活死细胞的细胞膜通透性差异以及染料与核酸物质结合能力的差异或者活死细胞代谢差异对活死细胞分别进行染色,然而这些染色方法存在着三个共同的缺点,即一是细胞通透性较低,染色剂与细胞内的物质难以完全结合发出强烈荧光,因而造成细胞活率较低;二是染色剂渗透压与细胞生长环境ph的差异容易导致细胞从微载体表面脱落;三是染色剂与细胞结合后发出的荧光容易淬灭,造成活细胞计数时不准确。
技术实现要素:
为了克服上述缺点,本发明公布了一种既能够增强细胞膜通透性,又能够延缓荧光淬灭的微载体活细胞荧光染色方法,从而让细胞活率检测更精确,使干细胞治疗更好地应用于临床。
本发明采用以下技术方案:
(1)利用微载体技术培养贴壁细胞;
(2)无菌dpbs清洗1-2次,加入细胞膜通透剂tritonx-100,室温孵育10min;
(3)去掉孵育液,无血清培养基清洗1-2次;
(4)用无血清培养基配制calcein-am染色液,加入微载体中染色30min;
(5)染色完成后,弃掉染液,加入抗荧光衰减剂dabco;
(6)dpbs清洗1次,荧光显微镜下观察,拍照。
本发明针对常规荧光染色过程中,细胞通透性较低,染料与细胞内物质结合较差,造成荧光强度较弱或荧光较易淬灭的现象以及染料与细胞结合过程中,细胞容易脱落的问题进行创新,即在染色前,使用细胞膜通透剂增加细胞膜的通透性;染色时,选择无血清培养基作为缓冲剂配制染色液,以防止细胞脱落;染色后加入毒性较小的抗荧光衰减剂dabco,从而大大提高常规荧光染色的准确性。
附图说明
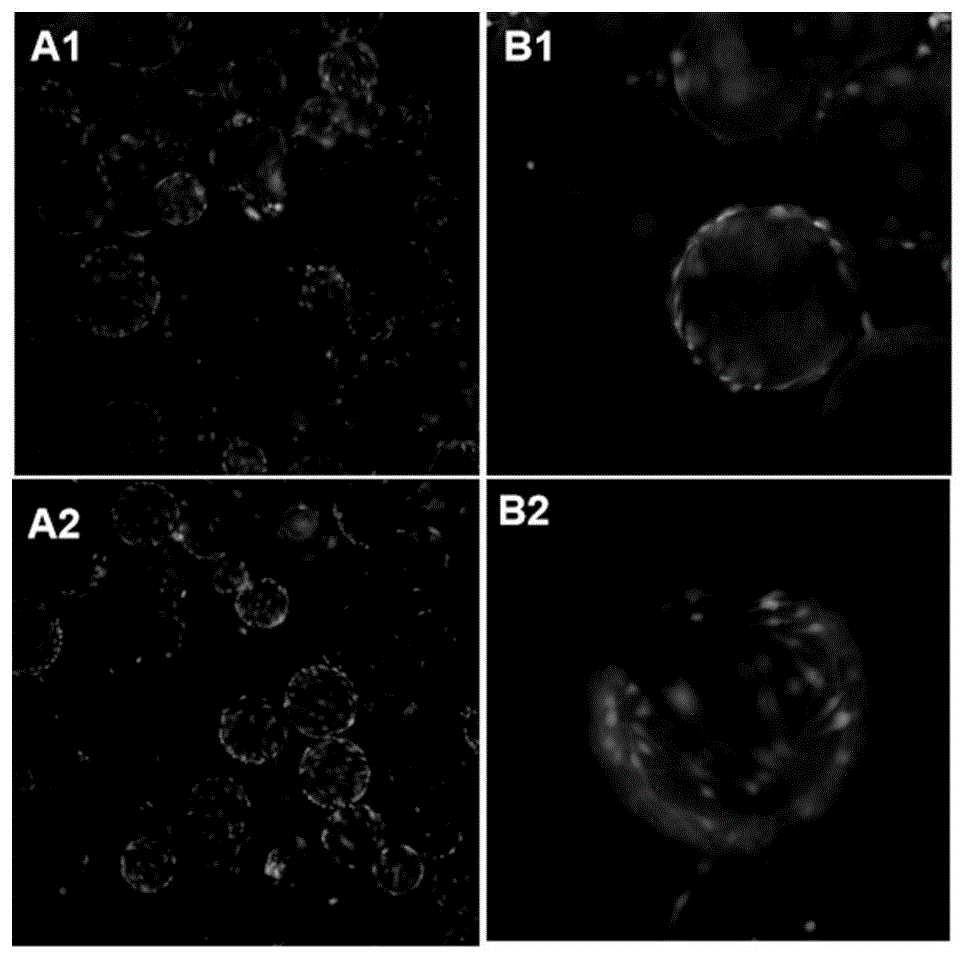
附图1球形微载体上adscs经calcein-am荧光染色后图片a:40xb:100x
附图2片状微载体上hu-mscs经calcein-am荧光染色后图片a:40xb:100x
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步具体的说明。
在本发明中,若非特指,所有设备和原料均可从市场购得或是本行业常用的,下述实施例中的方法,如无特别说明,均为本领域常规方法。
实施实例1
采用cephodex球形微载体(滨州贝尔凯瑞生物技术有限公司,山东)培养人脂肪间充质干细胞(adscs),按照说明书要求对浓度为3g/l微载体进行膨胀、灭菌、无菌检验等预处理,具体方法如下:
取0.3g微载体加入30-50ml无菌pbs浸泡48h充分膨胀,高压蒸汽法灭菌30min,用无菌pbs清洗3次,加入50ml完全培养基放入特定生物反应器中,于37℃孵育24h,进行无菌检验。确认无菌后,弃去检验液,重新加入100ml完全培养基,将adscs按细胞密度为3*105/ml进行接种,利用间歇搅拌的方式进行培养。
待细胞贴壁达80%左右,分别取1ml微载体细胞悬液放入24孔板,记为a组和b组,a组用无菌dpbs清洗1-2次,直接加入1ml由配套缓冲液配制的calcein-am染色液避光孵育30min,在荧光显微镜下拍照观察(如附图1a1-b1);b组用无菌dpbs清洗1-2次,加入细胞膜通透剂1ml0.1%tritonx-100,室温孵育10min后,弃掉通透剂,加入无血清培养基轻轻漂洗1-2次,弃掉培养基,加入1ml由无血清培养基配制的calcein-am染色液避光孵育30min,染色完成后,加入抗荧光衰减剂1ml质量浓度为0.5%dabco溶液,在荧光显微镜下拍照观察(如附图1a2-b2)。
实施实例2
采用固定床cephodisk片状微载体(滨州贝尔凯瑞生物技术有限公司,山东)培养人脐带间充质干细胞(hu-mscs),具体培养方法为:取100片微载体,加入30-50ml无菌dpbs浸泡30min,高压蒸汽法灭菌30min,用无菌dpbs清洗3次,加入20ml完全培养基放入特定培养瓶中,于37℃孵育24h,进行无菌检验,确认无菌后,弃去检验液,重新加入20ml完全培养基,将hu-mscs按细胞密度1.5-2.5*104/ml进行接种,利用低速间歇搅拌的方式进行培养。培养第三天,设立a组和b组,分别任取1片微载体进行活细胞荧光染色观察,具体方法如下:
a组用无菌dpbs清洗微载体1-2次,加入2ml由配套缓冲液配制的calcein-am染色液避光孵育30min,染色完成后,在荧光显微镜下拍照观察(如附图2a1-b1);b组用无菌dpbs清洗微载体1-2次,加入2ml细胞膜通透剂0.1%tritonx-100,室温孵育10min后,弃掉通透剂,再加入无血清培养基轻轻漂洗1-2次,弃掉培养基,加入2ml由无血清培养基配制的calcein-am染色液避光孵育30min,染色完成后,加入抗荧光衰减剂2ml质量浓度为0.5%dabco溶液,在荧光显微镜下拍照观察(如附图2a2-b2)。
技术特征:
1.一种新的微载体活细胞荧光染色方法,主要包括以下步骤:
(1)取2ml左右贴壁状态良好的微载体细胞悬液,去掉培养基,用无菌dpbs轻轻清洗1~2次,弃掉dpbs洗涤液;
(2)配制活细胞荧光染色液:取10ulcaclein-am原液加入到1ml无血清培养基中,混合均匀;
(3)向洗涤好的微载体中加入刚刚制备好的活细胞荧光染色液进行染色,室温孵育10~30min;
(4)染色完成后,加入1ml抗荧光衰减剂dabco;
(5)将孵育好的微载体放在荧光显微镜或激光扫描共聚焦显微镜及其配套的活细胞工作站下进行观察拍照。
2.根据权利要求1所述的方法,其特征在于,所述步骤(1)中的微载体为国产或者进口的球形或片状等其他类型的微载体材料,专门用于贴壁细胞的培养。
3.根据权利要求1所述的方法,其特征在于,所述步骤(1)中细胞清洗液为dpbs,也可以为pbs、生理盐水或无血清培养基。
4.根据权利要求1所述的方法,其特征在于,所述步骤(1)中的细胞为原代或传代培养的干细胞或其他种类的细胞。
5.根据权利要求1所述的方法,其特征在于,所述步骤(2)中的无血清培养基为培养该细胞的基础培养基(不含血清)。
6.根据权利要求1所述的方法,其特征在于,所述的步骤(2)中的caclein-am原液为浓度为4mmcaclein-am的dmso溶液。
7.根据权利要求1所述的方法,其特征在于,所述的步骤(3)中的染色液必须是现配现用,因为caclein-am对湿度非常敏感,caclein-am水溶液不稳定。
8.根据权利要求1所述的方法,其特征在于,所述的步骤(3)中的染色液的孵育时间为10~30min。
9.根据权利要求1所述的方法,其特征在于,所述的步骤(4)中的抗荧光衰减剂为dabco即1,4-二偶氮双环[2,2,2]-辛烷,其质量浓度通常为0~1.0%。
10.根据权利要求1所述的方法,其特征在于,该种活细胞荧光染色方法适用于但不仅限于微载体培养的贴壁细胞。
技术总结
本发明涉及生物技术领域,具体涉及一种利用微载体技术培养细胞的活细胞荧光染色方法,用来鉴定微载体上细胞的活性。本发明在染色前加入细胞膜通透剂triton X‑100以增强细胞通透性,促进染料进入细胞内与核酸结合;染色时,采用无血清培养基作为缓冲液,配制钙黄绿素‑乙酸甲基酯(Caclein‑AM)活细胞染色液,更接近细胞生长环境,防止细胞脱落;染色后,加入抗荧光衰减剂DABCO即1,4‑二偶氮双环[2,2,2]‑辛烷,有效延长发荧光的时间,从而使检测结果更精准。使用该方法可以根据发绿色荧光的强度判断出微载体上贴壁细胞的活性大小,同时不影响细胞的生长。
技术研发人员:陈锦阳;李静静;刘军权
受保护的技术使用者:浙江卫未生物医药科技有限公司
技术研发日:2020.01.13
技术公布日:2020.05.19
- 还没有人留言评论。精彩留言会获得点赞!
- 用于粘接剂活化的使用光的加热装置及其在预成型装置中的集成的制造方法
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种不依赖激发光强的上转换荧光强度比测温方法与制造工艺
- 一种PEP‑1肽介导绿色荧光蛋白转导水牛胚胎的方法与制造工艺
- 一种利用级联放大效应高敏监测水体PAHs的转荧光蛋白基因斑马鱼的研制方法与制造工艺
- 一株表达绿色荧光蛋白(EGFP)基因的人肠道病毒EV71型重组病毒及其应用的制造方法与工艺
- 一种HPV16型E7蛋白的POCT荧光定量检测试剂盒及其应用的制造方法与工艺
- 一种基于双荧光发色团的力和光双重响应型自组装体及其制备方法与制造工艺
- 基于机器视觉的禽类受精蛋检测方法与制造工艺
- 一种荧光蛋白质染色剂及其制备方法和应用与制造工艺