一种利用还原氧化石墨烯纳米材料改良生物电极构建的方法与流程
本发明涉及一种生物电极的制备方法,尤其是涉及一种利用还原氧化石墨烯纳米材料改良生物电极构建的方法。属于电化学分析测试技术领域。
背景技术:
近年来,生物传感器的发展十分迅速,由于负载了对环境中待测物质具有高选择性的生物识别原件,因此该类型的传感器对于环境中的待测物质检测时更具灵敏性和准确性。故生物传感器在电化学分析测试领域成为了研究的热点。但由于生物识别元件的弱导电特性,电极的相关修饰材料作为连接电极和生物识别元件的桥梁,对提高生物传感器的传感性能起着重要作用。
在传感分析测试领域,检测限和灵敏度是评价一个检测系统的重要参数。虽生物材料具有高选择性,但由于生物材料的弱导电性,导致传感器会出现检测限高,灵敏度低等一些问题。随着纳米材料的发展,因纳米材料所具有的一些特性,如良好的导电性,导热性以及生物相容性等优良特性而被广泛应用于各大领域。在这些纳米材料中,还原氧化石墨烯(reducedgrapheneoxided)是一种具有单原子厚度的二维碳材料,也是一种单原子薄的片状碳纳米管,在传感器领域,可作为电极修饰材料用于传感器的构建。因还原氧化石墨烯具有良好的导电性(106scm-1)和高电荷迁移率(200000cm2v-1s-1),使得电子在催化反应中可以被有效地从生物识别原件转移到电极表面。同时,还原氧化石墨烯也具有优良的生物相容性,在生物传感器构建过程中,提供更多附着位点供识别原件负载。因此,还原氧化石墨烯不仅是一种优良的电子转移载体,而且也是生物分子固定化的良好载体,有望利用还原氧化石墨烯纳米材料的修饰建立一种生物电极构建的方法以克服其所存在的不足。然而,经检索有关在制备的纳米多孔金/玻碳电极表面修饰上还原氧化石墨烯悬浮液,制得还原氧化石墨烯/纳米多孔金/玻碳电极;再在还原氧化石墨烯/纳米多孔金/玻碳电极表面负载生物材料构建得到生物电极的方法还未见报道。
技术实现要素:
针对现有技术中生物传感器对于被检物检测限低及灵敏度不达标的不足,本发明要解决的问题是提供一种利用还原氧化石墨烯纳米材料改良生物电极构建的方法。
本发明所述利用还原氧化石墨烯纳米材料改良生物电极构建的方法,步骤是:在制备的纳米多孔金/玻碳电极表面修饰上还原氧化石墨烯悬浮液,制得还原氧化石墨烯/纳米多孔金/玻碳电极;然后在还原氧化石墨烯/纳米多孔金/玻碳电极表面负载生物材料构建得到生物电极;
其特征在于:
所述纳米多孔金/玻碳电极的制备方法是:用直径为50nm的氧化铝粉末对玻碳电极(gce)进行抛光,之后将其依次置于无水乙醇和超纯水中分别超声清洗30~90秒,备用;将厚度为100±10nm的au/ag合金片置于纯硝酸中,在20~30℃温度下,腐蚀10~30分钟,制得纳米多孔金薄膜,然后将其固定在抛光清洗后的玻碳电极表面,真空干燥1~2小时后制得纳米多孔金/玻碳电极;
所述在制备的纳米多孔金/玻碳电极表面修饰上还原氧化石墨烯悬浮液的方法是:将还原氧化石墨烯纳米材料与分析纯级的无水乙醇充分混合,配制成质量体积比浓度为0.01~1%的还原氧化石墨烯悬浮液,再以24~80千赫兹频率超声分散0.5~12小时;超声后,将其放入4℃冰箱保存,备用;通过悬空滴加的方式将制得的还原氧化石墨烯悬浮液按0.0796~1.592微升/每平方毫米的量修饰至制备的纳米多孔金/玻碳电极表面,然后在无风、无尘、室温条件下固定3~24小时,制得还原氧化石墨烯/纳米多孔金/玻碳电极;
所述在还原氧化石墨烯/纳米多孔金/玻碳电极表面负载生物材料的方法是:取1~5毫升密度为2.0×107~5.0×108个/毫升的已构建的过表达重组细胞,在6000±500转/每分钟的条件下离心5~10分钟,沉淀细胞用磷酸缓冲液重悬后按1.194~2.389微升/每平方毫米的量均匀凃加于制得还原氧化石墨烯/纳米多孔金/玻碳电极表面,然后于4℃条件下固定3~24小时即构建得到生物电极。
上述利用还原氧化石墨烯纳米材料改良生物电极构建的方法中,所述纳米多孔金/玻碳电极的制备优选的方法是:将厚度为100±10nm的au/ag合金片置于纯硝酸中,在30℃温度下,腐蚀30分钟,制得纳米多孔金薄膜,然后将其固定在抛光清洗后的玻碳电极表面,真空干燥2小时后制得纳米多孔金/玻碳电极。
上述利用还原氧化石墨烯纳米材料改良生物电极构建的方法中,所述在制备的纳米多孔金/玻碳电极表面修饰上还原氧化石墨烯悬浮液优选的方法是:将还原氧化石墨烯纳米材料与分析纯级的无水乙醇充分混合,配制成质量体积比浓度为0.5~0.7%的还原氧化石墨烯悬浮液,再以24~50千赫兹频率超声分散9~10小时;超声后,将其放入4℃冰箱保存,备用;通过悬空滴加的方式将制得的还原氧化石墨烯悬浮液按1.0~1.194微升/每平方毫米的量修饰至制备的纳米多孔金/玻碳电极表面,然后在无风、无尘、室温条件下固定12~15小时,制得还原氧化石墨烯/纳米多孔金/玻碳电极。
上述利用还原氧化石墨烯纳米材料改良生物电极构建的方法中,所述在还原氧化石墨烯/纳米多孔金/玻碳电极表面负载生物材料优选的方法是:取1~3毫升密度为3.0×107~3.0×108个/毫升的已构建的过表达重组细胞,在6000转/每分钟的条件下离心10分钟,沉淀细胞用磷酸缓冲液重悬后按1.317~2.163微升/每平方毫米的量均匀凃加于制得还原氧化石墨烯/纳米多孔金/玻碳电极表面,然后于4℃条件下固定12~16小时即构建得到生物电极;其中所述重组细胞是过表达硫醌氧化还原酶的重组大肠杆菌,或是用于设定检测目的的酶或重组细胞。
上述利用还原氧化石墨烯纳米材料改良生物电极构建的方法中,构建得到的生物电极在进行检测操作前,优选需要滴加2~4微升体积比浓度为0.5%的nafion溶液预处理,并储存于4℃的冰箱中备用。
以构建的过表达硫醌氧化还原酶大肠杆菌/还原氧化石墨烯/纳米多孔金的硫化物检测生物传感器为例验证以本发明提供的改良方法构建得到的生物电极,证实其在传感性能方面的检测限与检测灵敏度得到了很大的提升。其突出优势在于,适量的固定还原氧化石墨烯纳米材料可以增强电子在生物识别原件与电极之间的传递效率,能有效减弱因生物识别原件弱导电性带来的电子传递的阻碍,提升生物传感器的传感性。
本发明具有的突出性实质性特点和显著进步体现在:
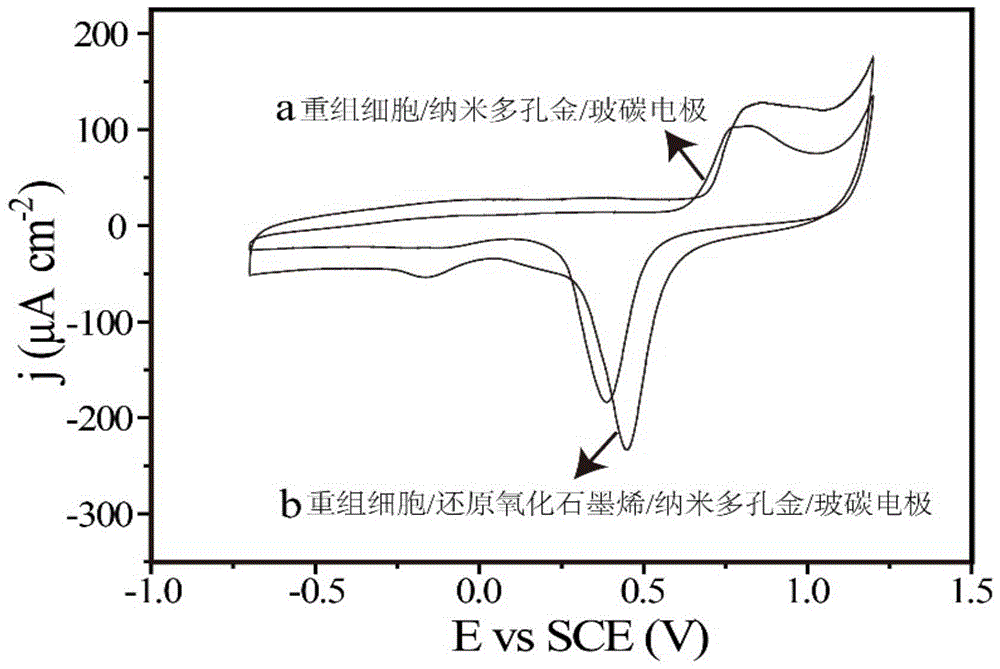
1、本发明提供了一种利用还原氧化石墨烯纳米材料来改良生物电极构建的方法,基于还原氧化石墨烯良好导电性及生物相容性的特点,该方法可有效解决传统生物传感器检测限高与灵敏度低的问题,如图1所示。
2、本发明提供的还原氧化石墨烯悬浮液制备方法,与其他溶剂相比,利用无水乙醇作为溶剂,制备的还原氧化石墨烯具有良好的分散性,其有助于增强电极构建的重复性,如图2所示。同时,本发明的方法利用还原氧化石墨烯修饰能提供更多的附着位点有助于电极表面生物识别原件的固定,增强电极对待检测物质的稳定性,如图3所示。
3、本发明的方法优化了还原氧化石墨烯悬浮液的负载量,如图4所示在实际应用中,为其他不同的检测体系提供了一个负载量的参照,有助于节约资源,提高其利用率。
附图说明
图1为修饰还原氧化石墨烯悬浮液前后生物电极的电流响应表征图。
图中a为尚未负载还原氧化石墨烯悬浮液的生物电极,b为已负载定量还原氧化石墨烯悬浮液的生物电极。
图2为修饰由不同溶剂制备的一定量的还原氧化石墨烯悬浮液在电极表面的分散性表征图。
其中:制备还原氧化石墨烯悬浮液溶剂分别为去离子水(a)、nafion溶液(b)和无水乙醇(c)。
图3为修饰相同体积但溶剂不同制备的还原氧化石墨烯悬浮液构建的传感器,分别检测30μm硫化钠(a)和50μm硫化钠(b)。
图4为修饰不同体积的由无水乙醇作为溶剂制备的还原氧化石墨烯悬浮液构建的传感器,分别检测70μm硫化钠(a)和100μm硫化钠(b)。
具体实施方式
下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
下述实施例中,所使用的材料、试剂、过表达硫醌氧化还原酶重组大肠杆菌、用于设定检测目的的酶或重组细胞等,如无特殊说明,均从商业途径得到。
实施例1:还原氧化石墨烯悬浮液的制备及分散
将还原氧化石墨烯纳米材料与分析纯级的无水乙醇充分混合,配制成质量体积比浓度为0.01%的还原氧化石墨烯悬浮液,再以24千赫兹频率超声分散0.5小时;超声后,将其放入4℃冰箱保存,备用。
实施例2:还原氧化石墨烯悬浮液的制备及分散
将还原氧化石墨烯纳米材料与分析纯级的无水乙醇充分混合,配制成质量体积比浓度为0.5%的还原氧化石墨烯悬浮液,再以40千赫兹频率超声分散6小时;超声后,将其放入4℃冰箱保存,备用。
实施例3:还原氧化石墨烯悬浮液的制备及分散
将还原氧化石墨烯纳米材料与分析纯级的无水乙醇充分混合,配制成质量体积比浓度为1%的还原氧化石墨烯悬浮液,再以80千赫兹频率超声分散12小时;超声后,将其放入4℃冰箱保存,备用。
实施例4:一种还原氧化石墨烯悬浮液的制备
将还原氧化石墨烯纳米材料与去离子水充分混合,配制成质量体积比浓度为0.01%的还原氧化石墨烯悬浮液,再以24千赫兹频率超声分散0.5小时;超声后,将其放入4℃冰箱保存,备用。
实施例5:一种还原氧化石墨烯悬浮液的制备
将还原氧化石墨烯纳米材料与去离子水充分混合,配制成质量体积比浓度为0.5%的还原氧化石墨烯悬浮液,再以40千赫兹频率超声分散6小时;超声后,将其放入4℃冰箱保存,备用。
实施例6:还原氧化石墨烯悬浮液的制备及分散
将还原氧化石墨烯纳米材料与去离子水充分混合,配制成质量体积比浓度为1%的还原氧化石墨烯悬浮液,再以80千赫兹频率超声分散12小时;超声后,将其放入4℃冰箱保存,备用。
实施例7:还原氧化石墨烯悬浮液的制备及分散
将还原氧化石墨烯纳米材料与体积比为0.8%的nafion溶液充分混合,配制成质量体积比浓度为0.01%的还原氧化石墨烯悬浮液,再以24千赫兹频率超声分散0.5小时;超声后,将其放入4℃冰箱保存,备用。
实施例8:还原氧化石墨烯悬浮液的制备及分散
将还原氧化石墨烯纳米材料与体积比为0.8%的nafion溶液充分混合,配制成质量体积比浓度为0.5%的还原氧化石墨烯悬浮液,再以40千赫兹频率超声分散6小时;超声后,将其放入4℃冰箱保存,备用。
实施例9:还原氧化石墨烯悬浮液的制备及分散
将还原氧化石墨烯纳米材料与体积比为0.8%的nafion溶液充分混合,配制成质量体积比浓度为1%的还原氧化石墨烯悬浮液,再以80千赫兹频率超声分散12小时;超声后,将其放入4℃冰箱保存,备用。
实施例10:玻碳电极的抛光与清洗
用直径为50nm的氧化铝粉末对玻碳电极(gce)进行抛光,之后将其依次置于无水乙醇和超纯水中分别超声清洗30秒。
实施例11:玻碳电极的抛光与清洗
用直径为50nm的氧化铝粉末对玻碳电极(gce)进行抛光,之后将其依次置于无水乙醇和超纯水中分别超声清洗60秒。
实施例12:玻碳电极的抛光与清洗
用直径为50nm的氧化铝粉末对玻碳电极(gce)进行抛光,之后将其依次置于无水乙醇和超纯水中分别超声清洗90秒。
实施例13:在玻碳电极上负载催化材料
将厚度为100±10nm的au/ag合金片置于纯硝酸中,在20℃温度下,腐蚀10分钟,制得纳米多孔金薄膜,然后将其固定在抛光清洗后的玻碳电极表面,真空干燥1小时后制得纳米多孔金/玻碳电极。
实施例14:在玻碳电极上负载催化材料
将厚度为100±10nm的au/ag合金片置于纯硝酸中,在25℃温度下,腐蚀20分钟,制得纳米多孔金薄膜,然后将其固定在抛光清洗后的玻碳电极表面,真空干燥1.5小时后制得纳米多孔金/玻碳电极。
实施例15:在玻碳电极上负载催化材料
将厚度为100±10nm的au/ag合金片置于纯硝酸中,在30℃温度下,腐蚀30分钟,制得纳米多孔金薄膜,然后将其固定在抛光清洗后的玻碳电极表面,真空干燥2小时后制得纳米多孔金/玻碳电极。
实施例16:还原氧化石墨烯悬浮液修饰纳米多孔金/玻碳电极
通过悬空滴加的方式将制得的质量体积比浓度为0.01%的还原氧化石墨烯悬浮液按0.0796微升/每平方毫米的量修饰至制备的纳米多孔金/玻碳电极表面,然后在无风、无尘、室温条件下固定9小时,制得还原氧化石墨烯/纳米多孔金/玻碳电极。
实施例17:还原氧化石墨烯悬浮液修饰纳米多孔金/玻碳电极
通过悬空滴加的方式将制得的质量体积比浓度为0.5%的还原氧化石墨烯悬浮液按0.8358微升/每平方毫米的量修饰至制备的纳米多孔金/玻碳电极表面,然后在无风、无尘、室温条件下固定16小时,制得还原氧化石墨烯/纳米多孔金/玻碳电极。
实施例18:还原氧化石墨烯悬浮液修饰纳米多孔金/玻碳电极
通过悬空滴加的方式将制得的质量体积比浓度为1%的还原氧化石墨烯悬浮液按1.592微升/每平方毫米的量修饰至制备的纳米多孔金/玻碳电极表面,然后在无风、无尘、室温条件下固定23小时,制得还原氧化石墨烯/纳米多孔金/玻碳电极。
实施例19:电极表面负载生物材料构建得到生物电极
取1毫升菌浓度为2.0×108个/毫升的已构建的过表达硫醌氧化还原酶重组大肠杆菌,在5500转/每分钟的条件下离心5分钟,沉淀细胞用磷酸缓冲液重悬后按1.194微升/每平方毫米的量均匀凃加于制得还原氧化石墨烯/纳米多孔金/玻碳电极表面,然后于4℃条件下固定9小时即构建得到生物电极。
实施例20:电极表面负载生物材料构建得到生物电极
取3毫升菌浓度为3.0×108个/毫升的已构建的过表达硫醌氧化还原酶重组大肠杆菌,在6000转/每分钟的条件下离心8分钟,沉淀细胞用磷酸缓冲液重悬后按1.7915微升/每平方毫米的量均匀凃加于制得还原氧化石墨烯/纳米多孔金/玻碳电极表面,然后于4℃条件下固定16小时即构建得到生物电极。
实施例21:电极表面负载生物材料构建得到生物电极
取5毫升菌浓度为5.0×108个/毫升的已构建的过表达硫醌氧化还原酶重组大肠杆菌,在6500转/每分钟的条件下离心10分钟,沉淀细胞用磷酸缓冲液重悬后按2.389微升/每平方毫米的量均匀凃加于制得还原氧化石墨烯/纳米多孔金/玻碳电极表面,然后于4℃条件下固定23小时即构建得到生物电极。
实施例22:应用本发明改良方法构建生物传感器
(1)纳米多孔金/玻碳电极的制备方法是:将厚度为100±10nm的au/ag合金片置于纯硝酸中,在30℃温度下,腐蚀30分钟,制得纳米多孔金薄膜,然后将其固定在抛光清洗后的玻碳电极表面,真空干燥2小时后制得纳米多孔金/玻碳电极。
(2)纳米多孔金/玻碳电极表面修饰上还原氧化石墨烯悬浮液的方法是:将还原氧化石墨烯纳米材料与分析纯级的无水乙醇充分混合,配制成质量体积比浓度为0.6%的还原氧化石墨烯悬浮液,再以50千赫兹频率超声分散10小时;超声后,将其放入4℃冰箱保存,备用;通过悬空滴加的方式将制得的还原氧化石墨烯悬浮液按1.1微升/每平方毫米的量修饰至制备的纳米多孔金/玻碳电极表面,然后在无风、无尘、室温条件下固定15小时,制得还原氧化石墨烯/纳米多孔金/玻碳电极。
(3)还原氧化石墨烯/纳米多孔金/玻碳电极表面负载生物材料的方法是:取2毫升密度为1.0×108个/毫升的已构建的过表达硫醌氧化还原酶的重组大肠杆菌细胞,在6000转/每分钟的条件下离心10分钟,沉淀细胞用磷酸缓冲液重悬后按1.8微升/每平方毫米的量均匀凃加于制得还原氧化石墨烯/纳米多孔金/玻碳电极表面,然后于4℃条件下固定15小时即构建得到生物电极。
上述构建得到的生物电极在进行检测操作前,需滴加4微升体积比浓度为0.5%的nafion溶液预处理,并储存于4℃的冰箱中备用。
实施例23:利用纳米多孔金的重组微生物细胞的生物传感器对硫化物标准品的检测
(1)用实施例22方法构建成功的生物传感器作为生物检测电极用作工作电极,以铂电极为对电极,以饱和甘汞电极为参比电极,组装三电极体系的生物传感器;其中,所述纳米多孔金/玻碳电极事先在0.5mh2so4中进行循环伏安法扫描10圈,以还原峰峰电流值表征纳米多孔金/玻碳电极的有效工作面积。
(2)硫化物检测:制得生物传感器在初次使用前,需将其放入磷酸盐缓冲液的反应体系中,加入终浓度为0.1~7000μm的硫化物标准品,采用电流-时间曲线(amperometrici-tcurve),选择外加电压-0.24v,观测加入的已知浓度的硫化物标准品的电流响应,做出电流响应的浓度-电流标准曲线;观测所出现的电流值能否随加入硫化物标准品的浓度发生变化,以此判定溶液中是否存在硫化物;电极对对苯二胺标准品的线性检测范围为0.1~7000μm,检测限为98.5nm,灵敏度为400.42μacm-2mm-1;检测结果如图1所示。
将电极保存在4℃冰箱中4周后,响应电流剩余88.4%,与其他硫化物传感器检测系统相比,具有更低的检测限和更高的灵敏度,如表1所示:
表1
上述步骤所述磷酸盐缓冲液反应体系是:15mlph7.0浓度为50mm磷酸盐缓冲液。所述磷酸盐优选为磷酸钠。
参考文献
1.aziz,m.a.,almadi,r.,yamani,z.h.,indiumtinoxidenanoparticle-modifiedglassycarbonelectrodeforelectrochemicalsulfidedetectioninalcoholicmedium.anal.sci.2018,34:599-604.
2.rossisalamanca-neto,c.a.,scremin,j.,fatibello-filho,o.,clausen,d.n.,sartori,e.r.,assessmentoftheperformanceoftriphenylphosphineforthevoltammetricdeterminationofelementalsulphurincosmeticproducts.analyst2018,143:3600-3606.
3.ghadiri,m.,kariminia,h.,azad,r.r.,spectrophotometricdeterminationofsulfidebasedonperoxidaseinhibitionbydetectionofpurpurogallinformation.ecotox.environ.safe.2013,91:117-121.
4.vosoughi,a.,yazdian,f.,amoabediny,g.,hakim,m.,investigatingtheeffectofdesignparametersontheresponsetimeofahighlysensitivemicrobialhydrogensulfidebiosensorbasedonoxygenconsumption.biosens.bioelectron.2015,70:106-114.
5.savizi,i.s.p.,kariminia,h.r.,ghadiri,m.,roostaazad,r.,amperometricsulfidedetectionusingcoprinuscinereusperoxidaseimmobilizedonscreenprintedelectrodeinanenzymeinhibitionbasedbiosensor.biosens.bioelectron.2012,35:297-301.
6.mirzaei,m.,amoabediny,g.,yazdian,f.,sheikhpour,m.,ebrahimi,e.,zadeh,b.e.h.,animmobilizedthiobacillusthioparusbiosensingsystemformonitoringsulfidehydrogen;optimizedparametersinabioreactor.processbiochem.2014,49:380-385.
7.bian,c.c.,wang,h.m.,zhangx.l.,xiao,s.,liu,z.,wang,x.,sensitivedetectionoflow-concentrationsulfidebasedonthesynergisticeffectofrgo,np-au,andrecombinantmicrobialcell.biosens.bioelectron.2020,151:111985.
- 还没有人留言评论。精彩留言会获得点赞!