一种测定抗凝静脉全血糖化血红蛋白的试剂盒的制作方法
本发明申请为申请日2018年12月29日,申请号为:201811635299.2,名称为“一种测定全血中糖化血红蛋白的试剂盒及方法”的发明专利申请的分案申请。
本发明涉及临床体外诊断检测领域,尤其涉及一种测定抗凝静脉全血糖化血红蛋白的试剂盒。
背景技术:
据国际糖尿病联盟(internationalediabetesfederation,idf)统计,2017年全球糖尿病患者约有4.25亿人。美国糖尿病控制及并发症试验(diabetescontrolandcomplicationtrial,dcct)和英国糖尿病控制与并发症关系研究(ukprospectivediabetesstudy,ukpds)发现糖化血红蛋白(hba1c)是糖尿病患者疾病控制程度的一项良好指标,它反映的是患者在检测前120天内的平均血糖水平,该指标与抽血时间、病人是否空腹、是否使用胰岛素等因素无关。在第59届美国糖尿病协会(americandiabetesassociation,ada)年会上,ada将hba1c作为血糖控制的金标准,提出所有糖尿病患者每年均应至少常规测定hba1c两次,并要求在临床应用中,无论用什么方法反应血糖的变化,最后都要以hba1c的变化作为最终评价一种药物或一个治疗方案的有效检测指标。因此,hba1c检测的临床意义非常重要。
目前hba1c的检测方法主要包括色谱法、免疫法和电泳法。其中色谱法包括高效液相阳离子交换色谱法和高效液相硼酸亲和色谱法等。作为hba1c检测的金标准,高效液相阳离子交换色谱法一向是临床上最具应用价值、最精确的方法。
利用高效液相阳离子交换色谱法测定全血中hba1c的原理是:全血样本用溶血剂溶血释放目标蛋白,由于样本中糖化血红蛋白(hba1c)和非糖化血红蛋白(hba0)的等电点不同,因此,在弱酸性条件下它们各自所带正电荷的数量不同,所以,样品经过糖化血红蛋白分析柱时,与分析柱中带有负电荷的离子交换固定相的吸附和交换能力存在差异,然后采用两种不同盐浓度的洗脱液(洗脱液a和洗脱液b)将各组份分离;首先用低盐浓度的洗脱液a将hba1c洗脱,再用高盐浓度的洗脱液b将hba0洗脱;被洗脱的蛋白依次通过检测器,检测器自动记录其在415nm的光吸收强度变化,并将光信号转化为电信号,得到物质信号谱图,对收集到的谱图数据进行分析计算得出hba1c、hba0峰的面积,hba1c峰面积占总血红蛋白hb峰面积的百分含量即为人全血样本中hba1c的检测结果。
然而,在用上述液相离子交换色谱法测定hba1c的研究时,样本(例如全血样本、全血稀释样本、全血冻干样本等)保存后再进行hba1c检测时,测定值会随着样本的保存时间的推移而变动。
公开号为cn101595230a的发明专利公开了一种hba1c测定方法,同时也指出了含hb试样保存后再进行hba1c检测时,将得到比使用刚采集的含hb试样的测定值低的值。该专利采用在样本中加入抑制剂的方法来避免因保存样本而引起的hba1c测定值的变动,但是,该方法需要测量者的直接参与,使测量过程复杂化,从而大大降低了检测效率。
技术实现要素:
本发明针对现有技术中样本保存后再进行hba1c检测的测定值会随着样本的保存时间的推移而变动的缺点,提供了一种测定全血中糖化血红蛋白的试剂盒及方法,利用该试剂盒可以高效、准确地体外定量测定人全血试样中糖化血红蛋白的浓度,而测定值不受样本保存时间的影响。
为了解决上述技术问题,本发明通过下述技术方案得以解决:
一种测定全血中糖化血红蛋白的试剂盒,包括洗脱液a、洗脱液b和溶血剂,洗脱液a和洗脱液b分别包括缓冲液、表面活性剂和添加剂,溶血剂包括表面活性剂和添加剂,添加剂为苏氨酸、β-丙氨酸、甘氨酸中的一种或一种以上。
作为优选,洗脱液a、洗脱液b和溶血剂中添加剂的添加量均为0.01g/l~1.00g/l,优选为0.05g/l~0.50g/l。
作为优选,缓冲液为磷酸盐缓冲液、柠檬酸盐缓冲液和丁二酸盐缓冲液中的一种或一种以上。由于磷酸盐缓冲液、柠檬酸盐缓冲液和丁二酸盐缓冲液具有较宽的ph缓冲范围,因此,将该缓冲液加入到洗脱液a和洗脱液b中能达到良好的洗脱效果。
作为优选,洗脱液a中缓冲液的摩尔浓度为0.01mol/l~0.50mol/l,优选为0.05mol/l~0.50mol/l,在这个摩尔浓度下的缓冲液不仅具有合适的ph缓冲范围,还能达到合适的洗脱效果。
作为优选,洗脱液b中缓冲液的摩尔浓度为0.02mol/l~1.00mol/l,优选为0.06mol/l~1.00mol/l,在这个摩尔浓度下的缓冲液不仅具有合适的ph缓冲范围,还能达到合适的洗脱效果。
作为优选,表面活性剂为吐温20、曲拉通x-100中的一种或两种,表面活性剂的加入有利于增加生物膜对小分子的渗透性,有利于细胞溶解。表面活性剂的添加量为1.00g/l~20.00g/l,优选为5.00g/l~9.00g/l。
作为优选,洗脱液a、洗脱液b和溶血剂中还包括防腐剂,防腐剂可以抑制微生物生长,增加洗脱液a、洗脱液b和溶血剂的贮藏时间。防腐剂优选为叠氮化钠,因其有抑制细胞中基础代谢酶的合成作用,从而抑制微生物生长,起到防腐作用。洗脱液a、洗脱液b和溶血剂中防腐剂的添加量小于等于5.00g/l,此时即可有效抑制微生物生长。
作为优选,还包括分析柱、质控品和校准品,分析柱的填料为阳离子交换固定相,填料粒径为3μm~10μm,柱长10mm~50mm,柱内径4.0mm~4.6mm;质控品和校准品均为糖化血红蛋白血样冻干粉,校准品的糖化血红蛋白血样冻干粉可以通过ifcc(国际临床化学和实验室医学联盟)溯源。
一种测定全血中糖化血红蛋白的方法,包括以下几个步骤:样本中加入溶血剂进行溶血,溶血后的样本在分析柱中用洗脱液洗脱得到hba1c组分和hba0组分后进行检测,计算得到hba1c的检测结果;洗脱液为上述洗脱液a和上述洗脱液b。
作为优选,洗脱条件为:分析柱的填料为阳离子交换固定相,填料粒径为3μm~10μm,柱长10mm~50mm,柱内径4.0mm~4.6mm;检测波长:415nm;柱温为37℃;洗脱梯度:0s~45s洗脱液a体积100%,洗脱液b体积0%;46s~75s洗脱液a体积0%,洗脱液b体积100%;76s~120s洗脱液a体积100%,洗脱液b体积0%;流速1.5ml/min,进样量10μl。
作为优选,样本为全血样本、全血稀释样本或全血冻干样本。
本发明由于采用了以上技术方案,具有显著的技术效果:
本发明提供的糖化血红蛋白试剂盒,在洗脱液a、洗脱液b和溶血剂中均添加了添加剂,可以避免样本的测定值随着样本的保存时间的推移而发生变动,同时也减少了样本前处理的复杂过程,从而实现糖化血红蛋白的高效、准确检测。此外,本发明提供的测定方法,对保存后的样本也能够实现快速、准确的检测。因此,对于血样采集地点和测试地点不同、或收集一定数量样本后集中检测,需要对样本进行保存后再检测的情况来说,本发明提供的试剂盒和测定方法都具有十分重要的实际应用价值。
附图说明
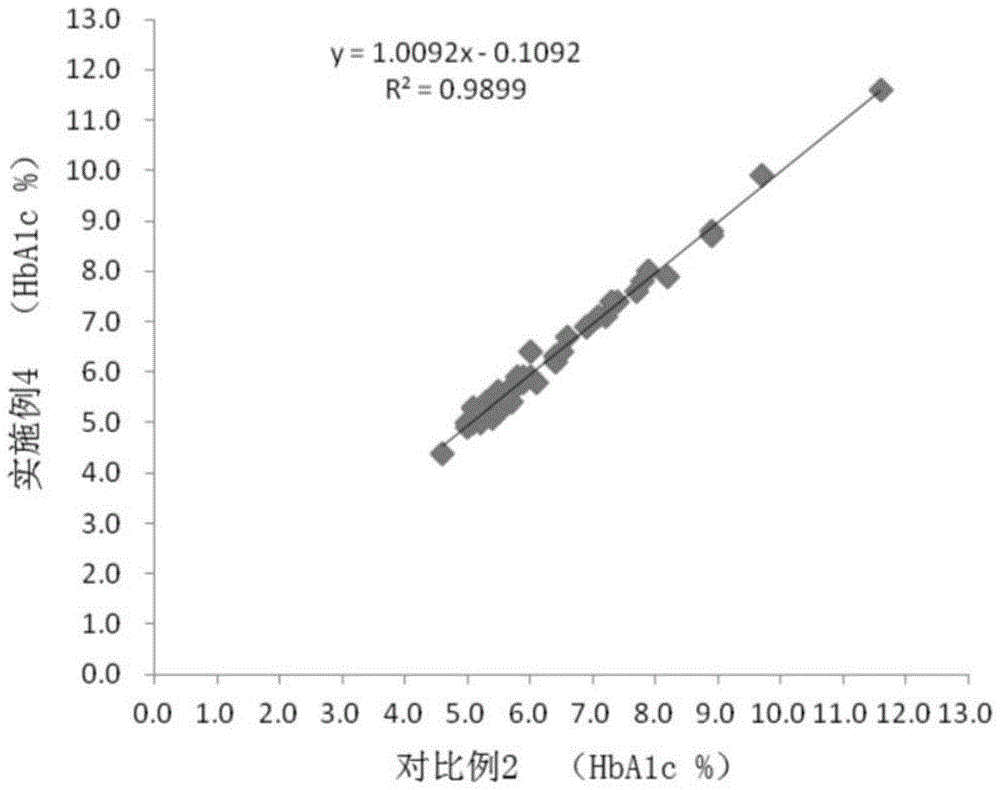
图1是实施例4与对比例2的检测结果的相关性分析。
具体实施方式
下面结合附图与实施例对本发明作进一步详细描述。
实施例1
一种测定全血中糖化血红蛋白的试剂盒,包括洗脱液a、洗脱液b和溶血剂,洗脱液a和洗脱液b分别包括缓冲液、表面活性剂、防腐剂和添加剂,溶血剂包括表面活性剂、防腐剂和添加剂,添加剂为苏氨酸。
洗脱液a、洗脱液b和溶血剂中添加剂的添加量均为0.01g/l。
缓冲液为丁二酸盐缓冲液,洗脱液a中的丁二酸盐缓冲液包括质量体积浓度为2.70g/l的丁二酸和质量体积浓度为18.50g/l的丁二酸钠;洗脱液b的丁二酸盐缓冲液包括质量体积浓度为1.40g/l的丁二酸和质量体积浓度为22.90g/l的丁二酸钠。
洗脱液a中丁二酸盐缓冲液的摩尔浓度为0.09mol/l。
洗脱液b中丁二酸盐缓冲液的摩尔浓度为0.10mol/l。
表面活性剂为曲拉通x-100,洗脱液a、洗脱液b和溶血剂中表面活性剂的添加量为9.00g/l。
防腐剂为叠氮化钠,洗脱液a、洗脱液b和溶血剂中叠氮化钠的添加量为0.50g/l。
还包括分析柱、质控品和校准品,分析柱的填料为阳离子交换固定相,填料粒径为5μm,柱长33mm,柱内径4.0mm;质控品和校准品均为糖化血红蛋白血样冻干粉,校准品的糖化血红蛋白血样冻干粉可以通过ifcc溯源。
对比例1
同实施例1,所不同的是对比例1的试剂盒中不包括添加剂。
实施例1和对比例1的试剂盒中洗脱液a,洗脱液b和溶血剂的配制情况具体见表1。
表1洗脱液a,洗脱液b和溶血剂的配制情况表
实施例2
一种测定全血中糖化血红蛋白的方法,包括以下几个步骤:样本中加入溶血剂后溶血,溶血后的样本在分析柱中用洗脱液洗脱得到hba1c组分和hba0组分,然后进行检测,计算得到hba1c的检测结果。
样本为质控品,质控品为糖化血红蛋白血样冻干粉。
利用实施例1和对比例1的试剂盒对质控品中的hba1c进行检测,检测仪器为糖化血红蛋白仪。
取不同的质控品,编号为质控品1和质控品2,将质控品复溶后,得到质控品溶液,按照体积比为1:200的比例,分别向两组体积为20μl的质控品溶液中加入实施例1和对比例1中的溶血剂进行溶血;溶血后的质控品立即利用分析柱进行洗脱分离和检测,得到hba1c的检测结果,并在2℃~8℃冰箱中保存后检测第3天和第7天的hba1c。检测结果详见表2。
洗脱条件为:分析柱的填料为阳离子交换固定相,填料粒径为5μm,柱长33mm,柱内径4.0mm;检测波长:415nm;柱温为37℃;洗脱梯度:0s~45s洗脱液a体积100%,洗脱液b体积0%;46s~75s洗脱液a体积0%,洗脱液b体积100%;76s~120s洗脱液a体积100%,洗脱液b体积0%;流速1.5ml/min,进样量10μl。
用实施例1的溶血剂进行溶血的质控品利用实施例1的洗脱液a和洗脱液b进行洗脱,用对比例1的溶血剂进行溶血的质控品利用对比例1的洗脱液a和洗脱液b进行洗脱。
表2实施例1和对比例1中hba1c的检测结果(hba1c%)
由表2可知,随着保存时间的推移,利用实施例1的试剂盒以及本实施例的测定方法检测质控品时,hba1c的结果基本不发生变动,而利用对比例1的试剂盒进行检测时,hba1c的结果会发生变动。因此,实施例1中添加的苏氨酸能有效防止hba1c的测定结果发生变动。
实施例3
将实施例1的试剂盒在实施例2提供的测定方法下检测样本中的hba1c,其中,样本为由ifcc溯源用冷冻全血样本24例,从荷兰取样,空运全程用干冰冷冻保存,样本所处环境温度不高于-40℃,然后保存在-80℃超低温冰箱中,在进行样本检测前,将冷冻样本恢复至室温,每例取20μl,分别按照体积比为1:200的比例加入实施例1的溶血剂进行溶血。样品从荷兰取样到进行检测试验历时26天。
检测结果与ifcc标准实验室给定的ifcc靶值进行对比,如表3所示。
表3实施例3的试剂盒的检测结果与ifcc靶值对比
由表3可知,实施例1的试剂盒检测得到的hba1c值与ifcc标准实验室给定的ifcc靶值基本一致。因此,实施例1提供的试剂盒和实施例2提供的检测方法可以准确测定保存一段时间后的冷冻样本。
实施例4
将实施例1的试剂盒在实施例2提供的测定方法下检测样本中的hba1c,其中,样本为edta抗凝静脉全血,在2℃~8℃条件下保存时间不少于7天。样本共49例,每例取20μl,分别按照1:200比例,加入实施例1的溶血剂进行溶血。
对比例2
测定方法采用日本东曹株式会社的g8糖化血红蛋白测试系统的hplc分析方法,试剂盒为日本东曹株式会社的g8糖化血红蛋白测试试剂盒。样本为edta抗凝静脉全血,样本采集后立即进行检测。样本共49例,每例取20μl,g8糖化血红蛋白测试系统自动按照1:200比例加入实施例1的溶血剂进行溶血。
实施例4和对比例2的检测结果详见表4。对实施例4和对比例2的检测结果进行相关性分析,得到一元线性方程:y=1.0092x–0.1092,r2=0.9899,如图1所示。
表4实施例4和对比例2中hba1c的检测结果
由表4和图1可知,在2℃~8℃条件下保存7天的全血样本经实施例1的试剂盒和实施例2的测定方法测定得到的结果与对比例2的检测结果基本一致,相关性很好。因此,本发明的试剂盒及测定方法具有很高的临床应用价值。
实施例5
一种测定全血中糖化血红蛋白的试剂盒,包括洗脱液a、洗脱液b和溶血剂,洗脱液a和洗脱液b分别包括缓冲液、表面活性剂、防腐剂和添加剂,溶血剂包括表面活性剂、防腐剂和添加剂,添加剂为β-丙氨酸。
洗脱液a、洗脱液b和溶血剂中添加剂的添加量均为1.00g/l。
缓冲液为磷酸盐缓冲液,洗脱液a中的磷酸盐缓冲液包括质量体积浓度为1.88g/l的磷酸氢二钠和质量体积浓度为4.41g/l的磷酸二氢钠;洗脱液b的磷酸盐缓冲液包括质量体积浓度为6.90g/l的磷酸氢二钠和质量体积浓度为1.37g/l的磷酸二氢钠。
洗脱液a中磷酸盐缓冲液的摩尔浓度为0.05mol/l。
洗脱液b中磷酸盐缓冲液的摩尔浓度为0.06mol/l。
表面活性剂为吐温20,洗脱液a、洗脱液b和溶血剂中表面活性剂的添加量为1g/l。
防腐剂为叠氮化钠,洗脱液a、洗脱液b和溶血剂中叠氮化钠的添加量为5.00g/l。
还包括分析柱、质控品和校准品,分析柱的填料为阳离子交换固定相,填料粒径为3μm,柱长10mm,柱内径4.0mm;质控品和校准品均为糖化血红蛋白血样冻干粉,校准品的糖化血红蛋白血样冻干粉可以通过ifcc溯源。
实施例6
一种测定全血中糖化血红蛋白的试剂盒,包括洗脱液a、洗脱液b和溶血剂,洗脱液a和洗脱液b分别包括缓冲液、表面活性剂、防腐剂和添加剂,溶血剂包括表面活性剂、防腐剂和添加剂,添加剂为苏氨酸、β-丙氨酸和甘氨酸,苏氨酸、β-丙氨酸和甘氨酸的质量比为1:1:1。
洗脱液a、洗脱液b和溶血剂中添加剂的添加量均为0.50g/l。
缓冲液为柠檬酸盐缓冲液,洗脱液a中的柠檬酸盐缓冲液包括质量体积浓度为0.40g/l的一水合柠檬酸和质量体积浓度为2.38g/l的二水合柠檬酸三钠;洗脱液b的柠檬酸盐缓冲液包括0.29g/l的一水合柠檬酸和质量体积浓度为5.47g/l的二水合柠檬酸三钠。
洗脱液a中柠檬酸盐缓冲液的摩尔浓度为0.01mol/l。
洗脱液b中柠檬酸盐缓冲液的摩尔浓度为0.02mol/l。
表面活性剂为曲拉通x-100和吐温20的混合物,曲拉通x-100和吐温20的质量比为1:1,洗脱液a、洗脱液b和溶血剂中表面活性剂的添加量为20.00g/l。
防腐剂为叠氮化钠,洗脱液a、洗脱液b和溶血剂中叠氮化钠的添加量为0.20g/l。
还包括分析柱、质控品和校准品,分析柱的填料为阳离子交换固定相,填料粒径为10μm,柱长50mm,柱内径4.6mm;质控品和校准品均为糖化血红蛋白血样冻干粉,校准品的糖化血红蛋白血样冻干粉可以通过ifcc溯源。
实施例7
一种测定全血中糖化血红蛋白的试剂盒,包括洗脱液a、洗脱液b和溶血剂,洗脱液a和洗脱液b分别包括缓冲液、表面活性剂、防腐剂和添加剂,溶血剂包括表面活性剂、防腐剂和添加剂,添加剂为β-丙氨酸和甘氨酸,β-丙氨酸和甘氨酸的质量比为1:2。
洗脱液a、洗脱液b和溶血剂中添加剂的添加量均为0.30g/l。
缓冲液为磷酸盐和丁二酸盐混合缓冲液,洗脱液a中的缓冲液包括质量体积浓度为35.43g/l的丁二酸和质量体积浓度为24.00g/l的磷酸二氢钠;洗脱液b中的缓冲液包括质量体积浓度为64.95g/l的丁二酸和质量体积浓度为63.88g/l的磷酸氢二钠。
洗脱液a中磷酸盐和丁二酸盐混合缓冲液的摩尔浓度为0.50mol/l。
洗脱液b中磷酸盐和丁二酸盐混合缓冲液的摩尔浓度为1.00mol/l。
表面活性剂为吐温20,洗脱液a、洗脱液b和溶血剂中表面活性剂的添加量为5.00g/l。
防腐剂为叠氮化钠,洗脱液a、洗脱液b和溶血剂中叠氮化钠的添加量为0.50g/l。
实施例8
一种测定全血中糖化血红蛋白的试剂盒,包括洗脱液a、洗脱液b和溶血剂,洗脱液a和洗脱液b分别包括缓冲液、表面活性剂、防腐剂和添加剂,溶血剂包括表面活性剂、防腐剂和添加剂,添加剂为甘氨酸。
洗脱液a、洗脱液b和溶血剂中添加剂的添加量均为0.05g/l。
缓冲液为磷酸盐、柠檬酸盐和丁二酸盐的混合缓冲液,洗脱液a中的缓冲液包括质量体积浓度为23.62g/l的丁二酸、质量体积浓度为21.01g/l的一水合柠檬酸和质量体积浓度为24.00g/l的磷酸二氢钠;洗脱液b中的缓冲液包括质量体积浓度为108.06g/l的丁二酸钠、质量体积浓度为58.82g/l的柠檬酸三钠和质量体积浓度为56.78g/l的磷酸氢二钠。
洗脱液a中磷酸盐缓冲液、柠檬酸盐缓冲液和丁二酸盐缓冲液的摩尔浓度为0.50mol/l。
洗脱液b中磷酸盐缓冲液、柠檬酸盐缓冲液和丁二酸盐缓冲液的摩尔浓度为1.00mol/l。
表面活性剂为吐温20,洗脱液a、洗脱液b和溶血剂中表面活性剂的添加量为7.00g/l。
防腐剂为叠氮化钠,洗脱液a、洗脱液b和溶血剂中叠氮化钠的添加量为0.20g/l。
总之,以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所作的均等变化与修饰,皆应属本发明专利的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!