一种基于转化反应的高能量密度的镁电池的制作方法
本发明属于新能源技术领域,特别涉及一种基于过渡金属硫化物或过渡金属氟化物的转化反应的高能量密度的镁电池体系的设计。
背景技术:
从手机到笔记本电脑,再到电动汽车,可移动设备在人们的日常生活中正起到越来越重要的作用,而可移动设备的储能单元的发展将决定其在未来人类社会中的地位。未来的储能单元除了应该具有较高的能量密度,能在较广的温度范围内工作,环境友好之外,还应该具有较低的原料和加工成本,以便于大范围推广。就目前来看,锂离子电池是最接近实用和商业化的能量存储技术,但是其生产成本高并且存在安全隐患,与人类的需求存在一定的差距。
金属镁是一种理想的电池负极材料,相比金属锂而言便宜并且安全,预计在未来储能领域将会有广泛的应用。金属镁的体积比容量高达3833mAh cm-3,比金属锂的2205mAh cm-3高出很多,而它的氧化还原电位只比金属锂高0.6V。更为重要的是,金属镁在充放电过程中不会形成枝晶,没有电池短路隐患,可以直接作为电池负极材料使用。
2000年,以色列科学家Aurbach等以Mo6S8为正极,改良的格氏试剂为电解液,金属镁为负极,首先提出了可充放电循环的镁电池体系。虽然镁离子与锂离子有相近的离子半径,但是二价镁离子的电荷密度更高,因此在固相扩散过程中面临更大的阻力。目前较为成功的镁电池正极材料为基于原子簇结构的Chevrel相化合物(如Mo6S8)以及层状化合物(如MoS2、V2O5)等,但是,由于较大的分子量、有限的电子转移或较低的反应电位,它们的能量密度通常有限。除了缺少适合高极性镁离子高速脱嵌的框架结构原型外,宽电化学窗口的镁电解液的缺乏也是阻碍镁电池发展的制约因素之一。
为了绕开目前高电位电解液和电极结构的限制,近来,一种双盐混合电解液体系在镁电池中的应用开始引起人们的重视。双盐电解液体系由不同浓度的镁盐和锂盐溶于醚类有机溶剂而形成,在电池正极,动力学更有利的锂离子(而非镁离子)倾向于在材料晶格中脱嵌,同时在电池负极,镁离子优先于锂离子进行可逆的电沉积和析出。通过这种组合方式,大部分可适用于锂离子电池的正极材料可被拓展到这类镁电池中,极大拓宽了镁电池正极材料的选择;同时,可逆的镁沉积可以有效避免负极枝晶生长带来的安全问题。但是,目前报道的双盐体系镁电池的正极反应仍旧局限于嵌入式框架材料,其电子转移不超过一个电子, 能量密度不超过300Wh/kg,仍旧不能满足移动设备的发展需要。例如CN104538669A公开了一种可充镁电池,其正极材料为二氧化钛、电解液为溶于有机醚的硼氢化镁和硼氢化锂,负极材料为金属镁或镁合金,但是该正极反应基于离子嵌入反应,只发生单电子转移,因此能量密度非常有限(约为135Wh/kg)。CN102460796A公开一种镁电池,其正极材料为FeS2等,电解质包含高氯酸镁和六氟磷酸锂(镁锂双盐)等,负极材料为金属镁或镁合金,但是该电解液易引起Mg负极钝化,主要用于一次电池而非可充电池;而且六氟磷酸锂只用做电解液的添加剂,加入量只有0.5重量%,受限于锂离子的浓度,无法驱动完全的转化反应,电池的比容量(382mAh/g)有限。
技术实现要素:
针对上述问题,本发明的目的在于提供一种基于正极转化反应的高能量密度镁电池。
本发明提供一种基于正极转化反应的高能量密度镁电池,以过渡金属硫化物或过渡金属氟化物为正极材料,镁锂双盐溶液为非水电解液,金属镁或镁合金为负极。
本发明以镁锂双盐混合溶液为非水电解液,避免了高极性二价镁离子在正极材料晶格中固相扩散速率慢的问题,极大拓宽了可适用于镁基电池的正极材料的选择范围。
本发明以过渡金属氟化物或过渡金属硫化物作为这类锂镁混合电池体系的正极材料,在充放电过程中锂离子可容易驱动正极材料的转换反应,同时在正负极实现多电子转换,将电池的正极能量密度最高提升到400Wh/kg左右,这一能量密度值可与目前的锂离子电池相媲美。
本发明以金属镁或镁合金为负极,避免了碱金属枝晶生长而造成电池短路隐患,特别在过渡金属硫化物体系中还能缓解多硫化物产物对镁负极的腐蚀,提升了电池的循环性能和安全性。
较佳地,所述过渡金属硫化物为FeS、FeS2、CoS2、CuS中的至少一种。
较佳地,所述过渡金属氟化物为BiF3、FeF3、FeF2、FeOF、CuF2、CoF2中的至少一种。
较佳地,所述电解液的溶质为硼氢化锂和硼氢化镁的混合物,溶剂为四氢呋喃、二乙二醇二甲醚或者三甘醇二甲醚。
较佳地,溶质硼氢化锂的浓度为0.5~1.5摩尔每升,硼氢化镁的浓度为0.1~0.5摩尔每升。
较佳地,所述电解液的溶质为氯化锂、苯基氯化镁和氯化铝的混合物,四氢呋喃、 二乙二醇二甲醚或者三甘醇二甲醚为溶剂。
较佳地,溶质氯化锂的浓度为0.4~1.5摩尔每升,苯基氯化镁、氯化铝的浓度为0.25~0.5摩尔每升。
较佳地,所述镁合金为锂镁合金或镁锡合金。
较佳地,所述镁电池的正极还包括导电剂和粘结剂。
较佳地,所述导电剂为Super P导电碳材料,所述粘结剂为聚偏二氟乙烯、聚四氟乙烯或羧甲基纤维素钠。
根据本发明的镁电池能够发生锂离子驱动的转换反应,实现动力学有利的多电子参与的电化学过程,是一种基于正极转化反应的高能量密度镁电池。
附图说明
图1为实施例1中初始FeS2样品的粉末SEM图片;
图2为实施例1中FeS2初次放电产物的TEM图片;
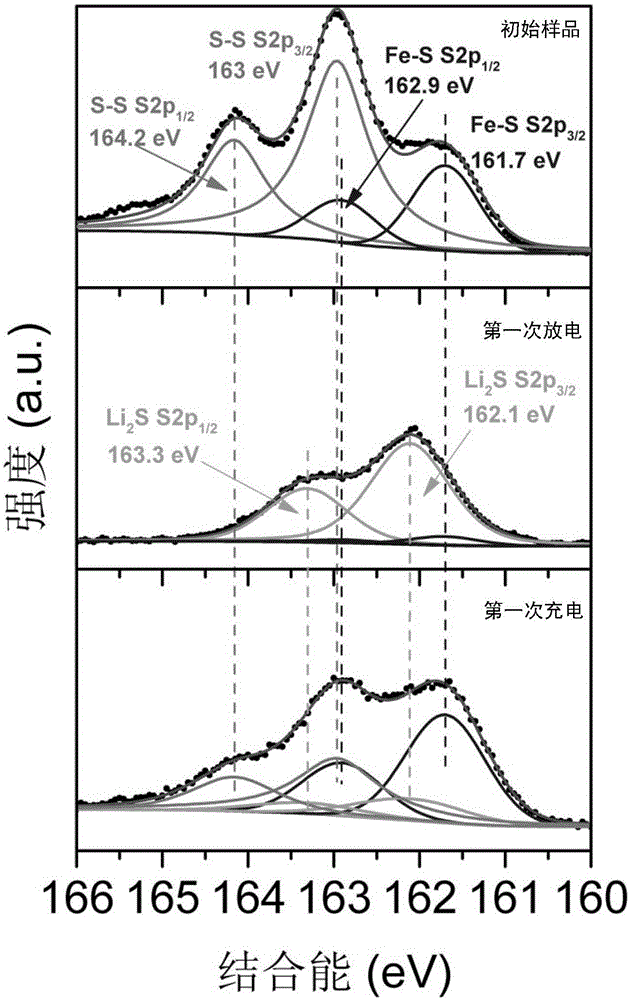
图3为实施例1中FeS2初始样品、第一次放电和第一次充电样品的光电子能谱比较;
图4为实施例1中FeS2在硼氢化锂、硼氢化镁、二乙二醇二甲醚电解液中的循环曲线;
图5为实施例1中FeS2在不同电解液体系中的长循环性能比较;
图6为实施例1中Mg/FeS2双盐电池循环200次后,镁负极的SEM图片。
具体实施方式
以下结合附图和下述实施方式进一步说明本发明,应理解,附图及下述实施方式仅用于说明本发明,而非限制本发明。
本发明的镁电池以过渡金属氟化物或过渡金属硫化物为正极材料,以镁锂双盐混合溶液为非水电解液,在充放电过程中利用锂离子驱动的正极材料的转换反应来实现多电子转化,提升了电池的能量密度;本发明以金属镁(或镁合金)为电池负极,克服了碱金属负极枝晶生长的问题;在过渡金属硫化物体系中能缓解充放电产物多硫化物对负极的腐蚀,保证了电池循环的安全性和稳定性。
所述过渡金属氟化物可为三氟化铁(FeF3)、二氟化铁(FeF2)、氧氟化铁(FeOF)、氟化铜(CuF2)、氟化铋(BiF3)、氟化钴(CoF2)中的一种或者几种。其复合材料可以由商业氟化物和碳一起高能球磨制得,或通过基于含氟离子液体或LiF的氟化方法制备,以回避不安全的HF或F2的使用。基于含氟离子液体或LiF的氟化方法可包括如下步骤:将1克过渡金属硝酸盐(如含结晶水的硝酸铁、硝酸钴或硝酸铜)溶于10毫升易水解的含氟离子液体(如BmimBF4或EmimBF4)中,在80到200℃间加热搅拌8小时;加入丙酮,离心洗 涤5次得到氟化物沉淀,并在80℃真空干燥箱中烘干8小时。
所述过渡金属硫化物可为硫化亚铁(FeS)、二硫化亚铁(FeS2)、二硫化钴(CoS2)、硫化铜(CuS)中的一种或者几种。其复合材料由商业硫化物和碳一起研磨或球磨混合制得,或通过对过渡金属卤化物、(氢)氧化物等前驱体的硫化方法制备。对过渡金属卤化物、(氢)氧化物等前驱体的硫化方法可包括如下步骤:将一定化学计量比的过渡金属卤化物或氧化物与硫单质混合研磨均匀,并放入石英管;将石英管抽真空并用火焰密封,使用化学气相输运法,在管式炉中以600℃加热石英管24小时,开管后即可得到所需的过渡金属硫化物。
所述双盐溶液的溶质可以以硼氢化锂(LiBH4)、硼氢化镁(Mg(BH4)2)为溶质,四氢呋喃、二乙二醇二甲醚或者三甘醇二甲醚为溶剂。溶质硼氢化锂的浓度可为0.5~1.5摩尔每升,硼氢化镁的浓度可为0.1~0.5摩尔每升。
或者,所述双盐溶液也可以以氯化锂(LiCl),苯基氯化镁(C6H5MgCl)和氯化铝(AlCl3)为溶质,四氢呋喃、二乙二醇二甲醚或者三甘醇二甲醚为溶剂。溶质氯化锂的浓度可为0.4~1.5摩尔每升,溶质苯基氯化镁、氯化铝的浓度可为0.25~0.5摩尔每升。
金属镁负极可以为金属镁片、锂镁合金或镁锡合金等。
以下说明本发明的镁电池的制备方法。
正极的制备:在一个示例中,将上述至少一种正极材料(例如商业氟化物或硫化物)、导电碳材料、粘结剂、溶剂均匀混合后,涂覆于集流体上,干燥,即可制得镁电池的正极。其中正极材料、导电碳材料、粘结剂的质量比可为8:1:1、7:2:1或6:2:2。导电碳材料包括但不限于Super P、炭黑等。粘结剂包括但不限于聚偏二氟乙烯(PVDF)、聚四氟乙烯(PTFE)、羧甲基纤维素钠(CMC)等。溶剂包括但不限于N-甲基吡咯烷酮(NMP)、四氢呋喃(THF)等。集流体包括但不限于碳纸、钛箔、不锈钢网等。
锂镁双盐电解液的配制:在惰性气氛下,将电解液的溶质加入到溶剂中,搅拌使溶质充分溶解。
电池组装:将正极、负极、电解液在水值、氧值小于0.1ppm的环境下组装为镁电池。另外,应理解,该镁电池还可以包括公知的其它构件,例如隔膜(glass fiber)等。
本发明在充放电过程中利用电解液中的锂离子与正极材料发生多电子转换反应,避免了二价镁离子在正极材料晶格中固相扩散速率慢的问题;在负极,镁离子优先于锂离子实现更安全的电沉积和析出,解决了负极金属枝晶生长的问题;利用正负极同时发生的多电子参与的电化学过程,将镁电池的正极能量密度最大提升到400Wh kg-1左右。
下面进一步例举实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。下述示例具体的质量、时间、温度等工艺参数也仅是合适范围中的一个示例,即本领域技术人员可以通过本文的说明做合适的范围内选择,而并非要限定于下文示例的具体数值。
实施例1
1)FeS2正极材料的制备
称取商业FeS2粉末样品24mg、Super P 6.8mg,放入研钵中研磨30min。之后加入68μl浓度为20mg/μl的PVDF、NMP溶液,研磨搅拌10~15min。将黑色浆料均匀涂抹在12片面积为50mm2的碳纸上,并放入80℃真空烘箱干燥12小时。将真空干燥后的载有活性物质的碳纸再次进行称量,并装袋,放入手套箱。
2)锂镁双盐电解液的配制
将硼氢化锂、硼氢化镁放入氩气手套箱。将327mg硼氢化锂、54mg硼氢化镁加入到10ml二乙二醇二甲醚溶剂中,并磁力搅拌24小时,使溶质充分溶解。
3)电池的组装和测试
在水值、氧值小于0.1ppm的氩气手套箱中进行2025纽扣电池的组装;在LAND电化学工作站上进行电池的充放电测试,其中测试电压范围设置为0.1~1.7V,电流大小设置为0.1C,FeS2的理论比容量是基于四电子反应的893.675mAh/g。附图1所示为FeS2初始样品的扫描电镜(SEM)形貌图。样品颗粒在100~200nm之间,并且团聚为较大的二次颗粒。附图2所示为FeS2在硼氢化锂、硼氢化镁、二乙二醇二甲醚电解液中初次放电产物的TEM图。放电产物主要是铁和硫化锂,铁的粒径在5~10nm之间,均匀嵌入在反应产物的团聚物中。附图3所示为FeS2初始样品以及在硼氢化锂、硼氢化镁、二乙二醇二甲醚电解液中第一次放电产物和第一次充电产物中的硫元素的X射线光电子能谱图。从中可以看出初次放电产物中有硫化锂生成,这与TEM的结果一致,证明了正极发生的是锂离子驱动主导的转换反应。同时,FeS2在第一次充电过程中重新生成,证明了正极转换反应具有良好的可逆性。附图4为FeS2在硼氢化锂、硼氢化镁、二乙二醇二甲醚电解液中的循环曲线。在0.05C的倍率下,电池初次放电容量可达845mAh/g,可逆容量达到600mAh/g。附图5为FeS2在不同电解液体系中的长循环性能比较以及在硼氢化锂、硼氢化镁、二乙二醇二甲醚电解液中的倍率性能。相比FeS2在基于锂电解液的锂电池中的循环性能,其在基于双盐电解液的镁锂混合电池体系中的循环性能有了很大的提升。附图6所示为FeS2在硼氢化 锂、硼氢化镁、二乙二醇二甲醚电解液中循环200次后负极镁片的SEM图片。可以看出镁沿二维方向沉积,形成六边形金属颗粒,避免了一维枝晶生长造成的安全隐患。
实施例2
1)FeS正极材料的制备
称取FeS粉末样品24mg,Super P 6.8mg,放入研钵中研磨30min。之后加入68μl浓度为20mg/μl的PVDF、NMP溶液,研磨搅拌10~15min。将黑色浆料均匀涂抹在12片面积为50mm2的碳纸上,并放入80℃真空烘箱干燥12小时。将真空干燥后的载有活性物质的碳纸再次进行称量,并装袋,放入手套箱。
2)锂镁双盐电解液的配制
将硼氢化锂、硼氢化镁放入氩气手套箱。将327mg硼氢化锂,54mg硼氢化镁加入到10ml二乙二醇二甲醚溶剂中,并磁力搅拌24小时,使溶质充分溶解。
3)电池的组装和测试
在水值、氧值小于0.1ppm的氩气手套箱中进行2025纽扣电池的组装;在LAND电化学工作站上进行电池的充放电测试,其中测试电压范围设置为0.1~1.7V,电流大小设置为0.1C,电池的理论比容量是基于二电子反应的607mAh/g。
4)反应产物的鉴定和反应机理的探究
使用X射线衍射、透射电子显微镜成像和X射线光电子能谱技术对正极初次放电、初次充电产物进行鉴定。发现初次放电产物中存在Li2S,初次充电产物中存在FeS,由此可以证明锂离子驱动的正极多电子得失的转换反应机理,锂盐在正极反应中起到决定性作用,并且反应具有良好的可逆性。
实施例3
1)FeF3正极材料的制备
称取FeF3粉末样品24mg,Super P 6.8mg,进行高能球磨30min。之后加入68μl浓度为20mg/μl的PVDF、NMP溶液,研磨搅拌10~15min。将黑色浆料均匀涂抹在12片面积为50mm2的碳纸上,并放入80℃真空烘箱干燥12小时。将真空干燥后的载有活性物质的碳纸再次进行称量,并装袋,放入手套箱。
2)锂镁双盐电解液的配制
在10ml 0.25摩尔每升的基于[Mg2Cl3]+[AlPh2Cl2]盐的四氢呋喃溶液中加入636mg氯化锂,并磁力搅拌24小时。
3)电池的组装和测试
在水值、氧值小于0.1ppm的氩气手套箱中进行2025纽扣电池的组装;在LAND电化学工作站上进行电池的充放电测试,其中测试电压范围设置为0.1~2V,电流大小设置为0.1C,电池的理论比容量是基于三电子反应的712mAh/g。
4)反应产物的鉴定和反应机理的探究
使用X射线衍射、透射电子显微镜成像和X射线光电子能谱技术对正极初次放电、初次充电的产物进行鉴定。发现初次放电产物中存在LiF,初次充电产物中存在FeF3,由此可以证明锂离子驱动的正极多电子得失的转换反应机理,锂盐在正极反应中起到决定性作用,并且反应具有良好的可逆性。
- 还没有人留言评论。精彩留言会获得点赞!