用于有机光电器件的有机分子的制作方法
本发明涉及纯有机分子及其在有机发光二极管(oled)和其它有机光电器件中的用途。
背景技术:
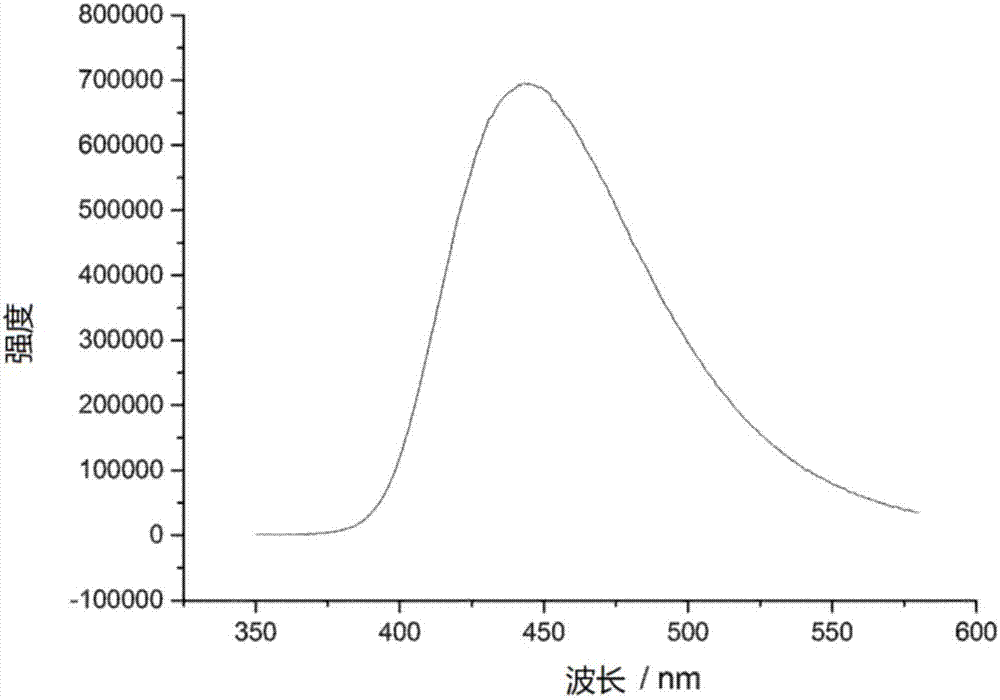
:有机光电器件的特征是将电能转换成光子(有机发光二极管,oled或发光电化学电池,leec)或发生相反过程(有机光伏,opv)。此处重要的是,这些过程尽可能高效地运行。因此,对于oled的部分,理想地使用具有最大光致发光量子产率的材料是必要的。通过使用显示出热活化延迟荧光(tadf)的有效材料可以改进oled材料的有限效率,因为与纯荧光材料相比,可以利用高达100%的激子,而不是在oled中形成的25%的激子。形成的三重态激子在这种情况下也可以转换成单重态激子,即随后可发出光子的状态。这种热再生的前提条件是最低激发单重态能级(s1)和三重态能级(t1)之间的低能量距离。这可以例如通过使用铜(i)配合物(在这方面参见例如:h.yersin,u.monkowius,t.fischer,t.hofbeck,wo2010/149748a1)实现,或者通过纯的有机材料的方法(在这方面参见例如:q.zhang等人,j.am.chem.soc.2012,134,14706,wo2013161437a1)。还存在对新材料的大量需求,例如对于深蓝色tadfoled。现有的蓝色tadf材料通常显示出高的激子寿命,这对于有效和长寿命的oled是不利的。除了材料的上述性质以外,它们的可用性也与商业化有关。这包括合成结构单元的可用性,以及功能材料的实际合成的成本和便利,特别是包括该材料的纯化。技术实现要素:本发明提供新类别的分子,其包括式i的结构或由式i的结构组成:式i其中x=吸电子单元,特别是cn或cf3;d=具有式i-1结构的化学单元:式i-1其中#=式i-1的单元与式i结构中的中心苯环的附着点;a和b=彼此独立地选自由crr1、cr、nr、n组成的组,在a和b之间存在单键或双键以及在b和z之间存在单键或双键;z=直接的键或二价有机桥基,该二价有机桥基为取代或未取代的c1-c9-亚烷基、c2-c8-亚烯基、c2-c8-亚炔基或亚芳基或其组合,-crr1、-c=crr1、-c=nr、-nr-、-o-、-sirr1-、-s-、-s(o)-、-s(o)2-,o-间隔的取代或未取代的c1-c9-亚烷基、c2-c8-亚烯基、c2-c8-亚炔基或亚芳基、苯基单元或取代的苯基单元;其中每个r和r1在每次出现时相同或不同地为h、氘、叠氮化物(n3-)、f、cl、br、i、n(r2)2、cn、cf3、no2、oh、cooh、coor2、co(nr2)2、si(r2)3、b(or2)2、c(=o)r2、p(=o)(r2)2、s(=o)r2、s(=o)2r2、oso2r2、具有1至40个c原子的直链烷基、烷氧基或硫代烷氧基基团,或具有2至40个c原子的直链烯基或炔基基团,或具有3至40个c原子的支链或环状烷基、烯基、炔基、烷氧基或硫代烷氧基基团,在各情况下所述基团可以被一个或多个基团r2取代,一个或多个不相邻的ch2基团可以被r2c=cr2、c≡c、si(r2)2、ge(r2)2、sn(r2)2、c=o、c=s、c=se、c=nr2、p(=o)(r2)、so、so2、nr2、o、s或conr2代替,并且一个或多个h原子可以被氘、f、cl、br、i、cn、cf3或no2代替,或者是具有5至60个芳族环原子的芳族或杂芳族环体系,该环体系可以在各情况下被一个或多个基团r2取代,或者是具有5至60个芳族环原子的芳氧基或杂芳氧基基团,该基团可以被一个或多个基团r2取代,或者是具有10至40个芳族环原子的二芳基氨基、二杂芳基氨基或芳基杂芳基氨基基团,该基团可以被一个或多个基团r2取代,或者是这些体系的组合,或是可交联单元qe,所述可交联单元qe可以在存在或不存在光引发剂的情况下通过酸催化、热或uv交联方法或者通过微波辐射交联;这些取代基r和r1中的两个或更多个可以彼此形成单环或多环、脂族、芳族和/或苯并稠合的环体系;r2,在每次出现时相同或不同地为h、氘、f、cl、br、i、n(r3)2、cn、cf3、no2、oh、cooh、coor3、co(nr3)2、si(r3)3、b(or3)2、c(=o)r3、p(=o)(r3)2、s(=o)r3、s(=o)2r3、oso2r3,具有1至40个c原子的直链烷基、烷氧基或硫代烷氧基基团,或具有2至40个c原子的直链烯基或炔基基团,或具有3至40个c原子的支链或环状烷基、烯基、炔基、烷氧基或硫代烷氧基基团,在各情况下所述基团可以被一个或多个基团r3取代,一个或多个不相邻的ch2基团可以被r3c=cr3、c≡c、si(r3)2、ge(r3)2、sn(r3)2、c=o、c=s、c=se、c=nr3、p(=o)(r3)、so、so2、nr3、o、s或conr3代替,并且一个或多个h原子可以被氘、f、cl、br、i、cn、cf3或no2代替,或者是具有5至60个芳族环原子的芳族或杂芳族环体系,该环体系可以在各情况下被一个或多个基团r3取代,或者是具有5至60个芳族环原子的芳氧基或杂芳氧基基团,该基团可以被一个或多个基团r3取代,或者是具有10至40个芳族环原子的二芳基氨基、二杂芳基氨基或芳基杂芳基氨基基团,该基团可以被一个或多个基团r3取代,或者是这些体系的组合;这些取代基r2中的两个或更多个可以彼此形成单环或多环、脂族、芳族和/或苯并稠合的环体系;r3,在每次出现时相同或不同地为h,氘,f,cf3或者具有1至20个c原子的脂族、芳族和/或杂芳族烃基,其中一个或多个h原子也可以被f或cf3代替;两个或更多个取代基r3可以彼此形成单环或多环、脂族环体系;r'=选自由以下组成的组:h,n(r4)2,or4,具有1至40个c原子的直链烷基或烷氧基或者具有3至40个c原子的支链或环状烷基或烷氧基基团,该基团在各情况下可以被一个或多个基团r4取代,和具有5至60个芳族环原子的芳族或杂芳族环体系,该体系在各情况下被一个或多个基团r4取代;r”=选自由以下组成的组:n(r4)2,or4,具有1至40个c原子的直链烷基或烷氧基或者具有3至40个c原子的支链或环状烷基或烷氧基基团,该基团在各情况下可以被一个或多个基团r4取代,和具有5至60个芳族环原子的芳族或杂芳族环体系,该体系在各情况下被一个或多个基团r4取代;r4,在每次出现时相同或不同地为h,氘,n(r5)2,si(r5)3,具有1至40个c原子的直链烷基、烷氧基或硫代烷氧基或者具有3至40个c原子的支链或环状烷基、烷氧基或硫代烷氧基基团,该基团在各情况下可以被一个或多个基团r5取代,或者是具有5至60个芳族环原子的芳族或杂芳族环体系,该体系在各情况下可以被一个或多个基团r5取代,或者是具有5至60个芳族环原子的芳氧基或杂芳氧基基团,该基团可以被一个或多个基团r5取代,或者是具有10至40个芳族环原子的二芳基氨基、二杂芳基氨基或芳基杂芳基氨基基团,该基团可以被一个或多个基团r5取代,或者是这些体系的组合;这些取代基r5中的两个或更多个可以彼此形成单环或多环、脂族、芳族和/或苯并稠合的环体系;r5,在每次出现时相同或不同地为h,氘或者具有1至20个c原子的脂族、芳族和/或杂芳族烃基;两个或更多个取代基r5还可以彼此形成单环或多环脂族环体系。在另一个实施方案中,r'选自由以下组成的组:h,n(r4)2,or4,噻吩,具有1至40个c原子的直链烷基或烷氧基或者具有3至40个c原子的支链或环状烷基或烷氧基基团,该基团在各情况下可以被一个或多个基团r4取代,和具有5至60个芳族环原子的芳族环体系,该环体系可以被一个或多个基团r4取代;和r”选自由以下组成的组:n(r4)2,or4,噻吩,具有1至40个c原子的直链烷基或烷氧基或者具有3至40个c原子的支链或环状烷基或烷氧基基团,该基团在各情况下可以被一个或多个基团r4取代,和具有5至60个芳族环原子的芳族环体系,该环体系可以被一个或多个基团r4取代;在本发明意义上的芳基含有6至60个芳族环原子;在本发明意义上的杂芳基含有5至60个芳族环原子,其中至少一个表示杂原子。杂原子特别为n,o和/或s。这是基本定义。如果在本发明的说明书中陈述了其它优选,例如关于存在的芳族环原子或杂原子的数目,则这些适用。本文的芳基或杂芳基分别为简单的芳环即苯,或简单的杂芳环如吡啶、嘧啶或噻吩,或杂芳族多环体系,例如菲、喹啉或咔唑。在本专利申请意义上的稠合(融合)芳族或杂芳族多环体系由两个或更多个彼此融合的简单芳族和/或杂芳族环组成。在各情况下可以被上述基团取代并且可以通过芳族或杂芳族部分上的任何所需位置连接的芳基或杂芳基特别理解为指衍生自以下的基团:苯、萘、蒽、芘、二氢芘、(chrysene)、苝、荧蒽、苯并蒽、苯并菲、并四苯、并五苯、苯并芘、呋喃、苯并呋喃、异苯并呋喃、二苯并呋喃、噻吩、苯并噻吩、异苯并噻吩、二苯并噻吩;吡咯、吲哚、异吲哚、咔唑、吡啶、喹啉、异喹啉、吖啶、菲啶、苯并-5,6-喹啉、异喹啉、苯并-6,7-喹啉、苯并-7,8-喹啉、吩噻嗪、吩噁嗪、吡唑、吲唑、咪唑、苯并咪唑、萘并咪唑、菲并咪唑、吡啶并咪唑、吡嗪并咪唑、喹喔啉并咪唑、噁唑、苯并噁唑、萘并噁唑、蒽噻唑、菲咯噁唑、异噁唑、1,2-噻唑、1,3-噻唑、苯并噻唑、哒嗪、苯并哒嗪、嘧啶、苯并嘧啶、喹喔啉、吡嗪、吩嗪、萘啶、氮杂咔唑、苯并喹啉、菲咯啉、1,2,3-三唑、1,2,4-三唑、苯并三唑、1,2,3-噁二唑、1,2,4-噁二唑、1,2,5-噁二唑、1,2,3,4-四嗪、嘌呤、蝶啶、中氮茚和苯并噻二唑或这些基团的组合。在本发明意义上的环状烷基、烷氧基或硫代烷氧基是指单环、双环或多环基团。出于本发明的目的,其中各个h原子或ch2基团也可以被上述基团取代的c1-至c40-烷基是指例如基团甲基、乙基、正丙基、异丙基、环丙基、正丁基、异丁基、仲丁基、叔丁基、环丁基、2-甲基丁基、正戊基、仲戊基、叔戊基、2-戊基、新戊基、环戊基、正己基、仲己基、叔己基、2-己基、3-己基、新己基、环己基、1-甲基环戊基、2-甲基戊基、正庚基、2-庚基、3-庚基、4-庚基、环庚基、1-甲基环己基、正辛基、2-乙基己基、环辛基、1-二环[2.2.2]辛基、2-二环[2.2.2]辛基、2-(2,6-二甲基)辛基、3-(3,7-二甲基)辛基、金刚烷基、三氟甲基、五氟乙基、2,2,2-三氟乙基、1,1-二甲基-正己-1-基、1,1-二甲基-正庚-1-基-、1,1-二甲基-正辛-1-基-、1,1-二甲基-正癸-1-基、1,1-二甲基-正十二烷-1-基-、1,1-二甲基-正十四烷-1-基-、1,1-二甲基-正十六烷-1-基-、1,1-二甲基-正十八烷-1-基-、1,1-二乙基-正己-1-基、1,1-二乙基-正庚-1-基-、1,1-二乙基-正辛-1-基-、1,1-二乙基-正癸基-1-基-、1,1-二乙基-正十二烷-1-基-、1,1-二乙基-正十四烷-1-基-、1,1-二乙基-正十六烷-1-基-、1,1-二乙基-正十八烷-1-基-、1-(正丙基)-环己-1-基-、1-(正丁基)-环己-1-基-、1-(正己基)-环己-1-基-、1-(正辛基)-环己-1-基-、和1-(正癸基)-环己-1-基。烯基是指例如乙烯基、丙烯基、丁烯基、戊烯基、环戊烯基、己烯基、环己烯基、庚烯基、环庚烯基、辛烯基、环辛烯基或环辛二烯基。炔基是指例如乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基或辛炔基。c1-至c40-烷氧基是指例如甲氧基、三氟甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基或2-甲基丁氧基。本发明分子中的化学单元d具有供体性质。技术人员从原理上分别意识到供体和受体性质。在一个实施方案中,化学单元d是供电子的。它具有+m效应(正介电效应)。特别地,合适的供体取代基具有带有自由电子对的原子,例如n,o或s原子。本文中优选具有正好一个环杂原子的5元环杂芳基。这些杂芳基还可以具有与它们稠合的其它芳基。在本文中特别优选的是咔唑基或咔唑衍生物。其它合适的供体取代基是吩噁嗪基团或吩噁嗪衍生物。在后者的情况下,吩噁嗪的氧可以被例如-crr1、-c=crr1、-c=nr、-nr-、-sirr1-、-s-、-s(o)-、-s(o)2-,o-间隔的取代或未取代的c1-c9-亚烷基、c2-c8-亚烯基、c2-c8-亚炔基或亚芳基、苯基单元或取代的苯基单元代替。在一个实施方案中,吸电子基团x发挥-m效应(负介电效应)或-i效应(负诱导效应)。因此,基团x是受体取代基。合适的受体取代基特别为氰基或cf3。在芳族部分上的供体的邻位,本发明的分子具有取代基。这允许有机分子的homo和lumo的有效分离。本发明的分子显示出热活化延迟荧光,并特别在可见光谱的深蓝色区域发射。本发明的分子在光电器件如oled中的使用导致器件部分的更高的效率。此外,可以实现深蓝色光谱中的oled。相应的oled比具有已知发射体材料和相当颜色的oled具有更大的稳定性。在一个实施方案中,可交联单元qe包括选自氧杂环丁烷、炔烃和叠氮化物组成的组的化合物,更特别地用于点击反应(clickreaction),以及以下烯烃衍生物:在可选的实施方案中,z是共价单键或选自取代和未取代的亚烷基(包括支链或环状)、亚烯基、亚炔基、亚芳基和杂亚芳基、o、nr、c=cr2、c=nr、sir2、s、s(o)、s(o)2、br、pr、p(o)r,以及可能这些基团的组合(例如o-间隔的亚烷基(包括支链或环状)、亚烯基、亚炔基、亚芳基和亚杂芳基)的二价有机桥。在一个实施方案中,彼此独立的d在各情况下是具有供电子性质的供体基团,其选自由以下组成的组:取代和未取代的咔唑、取代或未取代的吲哚、取代和未取代的二氢吲哚、取代和未取代的二氢吖啶、取代和未取代的苯并咪唑、取代和未取代的2,3,4,9-四氢咔唑、取代和未取代的1,2,3,4-四氢喹啉、取代和未取代的吩噻嗪、取代和未取代的吩噁嗪、取代和未取代的二氢吩嗪、取代和未取代的螺环化合物。在有机分子的一个实施方案中,具有式i-1的供电子性质的供体基团包括式ii的结构:式ii其中#、z和r的定义如上文关于式i所述。在一个实施方案中,具有式i-1的供电子性质的供体基团可以包括式iii的结构:式iii:其中#和r的定义如上文关于式i所述。本发明的供体的实例:式i的接受单元x在一个实施方案中为cn,在另一个实施方案中为cf3。在本发明的另一个实施方案中,式i的基团r'是氢原子,即h。在另一方面,本发明涉及用于制备本文所述类型的本发明的有机分子的方法(以及可能的后续反应(possiblesubsequentreaction))。在这种情况下,氮杂环在亲核芳香取代中与芳基卤化物,特别是芳基氟化物反应。典型的条件包括例如在非质子极性溶剂如二甲基亚砜(dmso)或n,n-二甲基甲酰胺(dmf)中使用碱,如磷酸三钾或氢化钠。可选的合成途径包括通过铜或钯催化偶联将氮杂环引入至芳基卤或芳基类卤化物,特别是芳基溴、芳基碘、芳基三氟甲磺酸酯或芳基甲苯磺酸酯。所述的制备模式可以表示最后的合成反应,亦或是提供前体分子,其可以通过后续反应例如通过改变基团r、r'和/或r”转换成本发明的分子。本发明的另一方面涉及本文所述类型的有机分子在有机光电器件中作为发光发射体或作为吸收剂和/或作为主体材料和/或作为电子输送材料和/或作为空穴注射材料和/或作为作为空穴阻挡材料的用途。在这种用途的上下文中,有机光电器件更特别地选自由以下组成的组:●有机发光二极管(oled),●发光电化学电池,●oled传感器,特别是非密封外部屏蔽的气体和蒸气传感器,●有机二极管,●有机太阳能电池,●有机晶体管,●有机场效应晶体管,●有机激光器和●下变频元件(down-conversionelement)。在使用的情况下,在有机光电器件中,更具体地在oled中,有机分子在发射层中的分数为1%至99%,更特别地为5%至80%(重量%)。在可选的实施方案中,有机分子在发射层中的比例为100%。在一个实施方案中,发光层不仅包括本发明的有机分子,而且还包括三重态(t1)和单重态(s1)能级高于有机分子的三重态(t1)和单重态(s1)能级的主体材料。在另一方面,本发明涉及一种有机光电器件,其包括本文所述类型的有机分子,更具体地以选自由以下组成的组的器件的形式:有机发光二极管(oled)、发光电化学电池、oled传感器、更特别地是非密封外部屏蔽的气体和蒸气传感器、有机二极管、有机太阳能电池、有机晶体管、有机场效应晶体管、有机激光器和下变频元件。在一个实施方案中,这种类型的有机光电器件具有:-基材,-阳极和-阴极,阳极或阴极特别地直接施加到基材上,和-至少一个发光层,其设置在阳极和阴极之间,并且包括本发明的有机分子。在一个实施方案中,光电器件是oled。典型的oled具有例如以下层构造:1.基材(支承材料)2.阳极3.空穴注射层(hil)4.空穴输送层(htl)5.电子阻挡层(ebl)6.发射层(eml)7.空穴阻挡层(hbl)8.电子输送层(etl)9.电子注射层(eil)10.阴极。一些层仅任选地存在。此外,这些层中的多个可以彼此同时存在。并且一些层可以在组件中多次存在。根据一个实施方案,有机组件的至少一个电极在形式上是半透明的。在此处和下文中,“半透明”表示对可见光透射的层。该半透明层可以是透明清晰的即透明的,或者可以是至少部分光吸收的和/或部分光散射的,使得半透明层也可以例如具有漫射或乳状半透明。特别地,本文中被识别为半透明的层在形式上尽可能透明,因此,特别地,光的吸收尽可能小。根据另一实施方案,有机组件,更具体地oled,具有逆变器结构。逆变器结构的特征在于,阴极位于基材上,并且其它层相应地以相反的顺序施加:1.基材(支承材料)2.阴极3.电子注射层(eil)4.电子输送层(etl)5.空穴阻挡层(hbl)6.发射层(eml)7.电子阻挡层(ebl)8.空穴输送层(htl)9.空穴注射层(hil)10.阳极一些层仅任选地存在。此外,这些层中的多个可以彼此同时存在。并且一些层可以在组件中多次存在。在一个实施方案中,在倒转的oled的情况下,典型构造的阳极层,例如ito层(氧化铟锡)作为阴极连接。根据另一实施方案,有机组件,更特别地是oled,具有堆垛构造。在这种情况下,各个oled彼此上下排列,而不是以通常的形式彼此并排排列。堆垛构造可允许混合光的产生。该构造可以用于例如产生白光,白光由通常通过来自蓝色,绿色和红色发射器发射的光的组合对整个可见光谱成像而产生。此外,对于几乎相同的效率和相同的亮度,与常规oled相比可以实现明显更长的寿命。对于堆垛构造,任选地,在两个oled之间使用称为电荷产生层(cgl)的层。该层由n-掺杂层和p-掺杂层组成,n-掺杂层通常更靠近阳极施加。在一个实施方案中——称为串联oled——在阳极和阴极之间存在两个或更多个发射层。在一个实施方案中,三个发射层一个在另一个之上排列,其中一个发射层发射红光,一个发射层发射绿光,一个发射层发射蓝光,并且任选地,在各个发射层之间施加另外的电荷产生层、阻挡层或输送层。在另一实施方案中,各发射层直接相邻地施加。在另一个实施方案中,在各发射层之间存在电荷产生层。也可以在oled中将由电荷产生层分离的相邻的发射层和发射层直接组合。在电极和有机层上,可以另外设置封装装置。封装装置可以例如以玻璃盖的形式或以薄膜封装的形式实现。用作光电器件的支承材料可以是例如玻璃,石英,塑料,金属,硅晶片或任何其它合适的固体或柔性的、任选地透明的材料。支承材料可以包括例如形式为层、膜、板或层压体的一种或多种材料。用作光电器件的阳极可以是例如透明导电金属氧化物,例如ito(氧化铟锡)、氧化锌、氧化锡、氧化镉、氧化钛、氧化铟或氧化铝锌(azo)、zn2sno4、cdsno3、znsno3、mgin2o4、gaino3、zn2in2o5或in4sn3o12、或不同透明导电氧化物的混合物。本文中用作hil的材料可以是例如pedot:pss(聚-3,4-亚乙基二氧噻吩:聚苯乙烯磺酸)、pedot(聚3,4-亚乙基二氧噻吩)、间-mtdata(4,4',4”-三[苯基(间-甲苯基)氨基]三苯胺)、螺-tad(2,2',7,7'-四(n,n-二苯基氨基)-9,9-螺二芴)、dntpd(4,4'-双[n-[4-{n,n-双(3-甲基-苯基)氨基}苯基]-n-苯基氨基]联苯)、npnpb(n,n'-二苯基-n,n'-二-[4-(n,n-二苯基-氨基)苯基]苯)、meo-tpd(n,n,n',n'-四(4-甲氧基苯基)苯)、hat-cn(1,4,5,8,9,11-六氮杂苯并菲六腈)、螺-npd(n,n'-二苯基-n,n'-双(1-萘基)-9,9'-螺二芴-2,7-二胺)。用作htl的材料可以是叔胺、咔唑衍生物、聚苯乙烯磺酸掺杂聚乙烯二氧噻吩、樟脑磺酸掺杂聚苯胺、聚-tpd(聚(4-丁基苯基二苯胺))、[α]-npd(聚(4-丁基苯基二苯胺))、tapc(4,4'-亚环己基-双[n,n-双(4-甲基苯基)-苯胺])、tcta(三(4-咔唑基-9-基苯基)胺)、2-tnata(4,4',4”-三[2-萘基(苯基)氨基]三苯胺)、螺-tad、dntpd、npnpb、meo-tpd、hat-cn或trispcz(9,9'-二苯基-6-(9-苯基-9h-咔唑-3-基)-9h,9'h-3,3'-二咔唑)。htl可以具有p-掺杂层,其在有机空穴传导基质中包括无机或有机掺杂剂。可以利用的无机掺杂剂的实例包括过渡金属氧化物,例如氧化钒、氧化钼或氧化钨。可以使用的有机掺杂剂包括例如四氟四氰基醌二甲烷(f4-tcnq),五氟苯甲酸铜(cu(i)pfbz)或过渡金属配合物。用作电子阻挡层的材料可以是例如mcp(1,3-双(咔唑-9-基)苯)、tcta、2-tnata、mcbp(3,3-二(9h-咔唑-9-基)联苯)、三-pcz(9,9'-二苯基-6-(9-苯基-9h-咔唑-3-基)-9h,9'h-3,3'-二咔唑)、czsi(9-(4-叔丁基苯基)-3,6-双(三苯基甲硅烷基)-9h-咔唑)或dcb(n,n'-二咔唑基-1,4-二甲苯)。发射层eml包括或由以下组成:发射体材料或包括至少两种发射体材料和任选的一种或多种主体材料的混合物。合适的主体材料的实例是mcp、tcta、2-tnata、mcbp、sif87(二苯并[b,d]噻吩-2-基三苯基硅烷)、sif88(二苯并[b,d]噻吩-2-基)二苯基硅烷)、cbp(4,4'-双-(n-咔唑基)联苯)或dpepo(双[2-((氧代)二苯基膦基)苯基]醚)。对于以绿色或红色发射的发射体材料或者包括至少两种发射体材料的混合物,共同的基体材料例如cbp是合适的。对于以蓝色发射的发射体材料或包括至少两种发射体材料的混合物,可以使用uhg基体材料(超高能量间隙材料)(参见例如methompson等人,chem.mater.2004,16,4743)或其它所谓的宽间隙基体材料。空穴阻挡层hbl可以包括,例如,bcp(2,9-二甲基-4,7-二苯基-1,10-菲咯啉=深亚铜试剂(bathocuproin)),双(2-甲基-8-羟基喹啉)-(4-苯基苯酚)-铝(iii)(balq),nbphen(2,9-双(萘-2-基)-4,7-二苯基-1,10-菲咯啉),alq3(铝-三(8-羟基喹啉)),tspo1(二苯基-4-三苯基甲硅烷基苯基氧化膦)或tcb/tcp(1,3,5-三(n-咔唑基)苯/1,3,5-三(咔唑-9-基)苯)。电子输送层etl可以包括例如基于alq3、tspo1、bpytp2(2,7-二(2,2'-联吡啶-5-基)三苯基)或btb(4,4'-双[2-(4,6-二苯基-1,3,5-三嗪基)]-1,1'-联苯)的材料。可用于薄电子注射层eil的材料的实例包括csf、lif、8-羟基喹啉合锂(liq)、li2o、baf2、mgo或naf。用作阴极层的材料可以是金属或合金,例如al、al>alf、ag、pt、au、mg、ag:mg。典型的层厚度为100nm-200nm。特别地,例如通过薄的保护性氧化物层的形成,使用一种或多种在空气中稳定和/或自钝化的金属。适于封装的材料的实例是氧化铝、氧化钒、氧化锌、氧化锆、氧化钛、氧化铪、氧化镧和氧化钽。本领域技术人员知道用于包括本发明的有机分子的光电器件的材料的组合。在本发明的有机光电器件的一个实施方案中,本发明的有机分子用作发光层中的发射材料,用作纯的层或与基体材料的组合。在另一实施方案中,在发光层中的本发明的有机分子,在光学发光器件中更具体地在oled中的发光层中的分数在5%和80%之间。在本发明的有机光电器件的一个实施方案中,将发光层施加至基材;特别地将阳极和阴极施加至基材并且在阳极和阴极之间施加发光层。发光层可以仅以100%浓度具有本发明的有机分子,其中将阳极和阴极施加至基材并且在阳极和阴极之间施加发光层。在本发明的有机光电器件的一个实施方案中,在阳极和阴极之间施加空穴注射层和电子注射层,并且在空穴注射层和电子注射层之间施加空穴输送层和电子输送层,并且在空穴输送层和电子输送层之间施加发光层。在本发明的另一个实施方案中,有机光电器件包括以下:基材、阳极、阴极,以及在各情况下至少一个空穴注射层和电子注射层,以及在各情况下至少一个空穴输送层和电子输送层,和至少一个发光层,其包括本发明的有机分子和其三重态(t1)和单重态(s1)能级显著高于有机分子的三重态(t1)和单重态(s1)能级的主体材料,其中将阳极和阴极施加至基材,并且在阳极和阴极之间施加空穴注射层和电子注射层,并且在空穴注射层和电子注射层之间施加空穴输送层和电子输送层,在空穴输送层和电子输送层之间施加发光层。根据本发明还提供一种包括本发明的有机分子和主体材料的发光材料,主体材料的三重态(t1)和单重态(s1)能级显著高于有机分子的三重态(t1)和单重态(s1)能级,其中发光材料发射荧光或热活化延迟荧光,并且在最低激发单重态(s1)状态和三重态(t1)状态之间具有小于3000cm-1的adeltae(s1-t1)值。在另一方面,本发明涉及光电组件的生产方法。在这种情况下使用本发明的有机分子。在一个实施方案中,生产方法包括通过真空蒸发方法或从溶液中加工本发明的有机分子。根据本发明,还提供包括至少一层光电器件的本发明的光电器件的生产方法:-通过升华方法涂布,-通过ovpd(有机气相沉积)方法涂布,-通过载气升华涂布,和/或-由溶液或通过印刷方法生产。实施例一般操作方案:光物理测量光学玻璃的预处理在每次使用后,清洁光学玻璃(由熔融石英制成的杯和基材,直径:1cm)。用二氯甲烷、丙酮、乙醇、软化水各洗涤三次。置于5%hellmanex溶液中24小时,用软化水彻底冲洗,用氮气吹气以干燥光学玻璃。样品制备:溶液将1-2mg样品溶解在100ml的各溶剂中,浓度为10-5mol/l。将杯气密封闭并脱气10分钟。样品制备,膜:旋涂仪器:spin150,sps欧洲。样品浓度为10mg/ml,在甲苯或氯苯中制备。程序:1)在400rpm下3s;2)在1000rpm下以1000rpm/s(每分/秒的转数)20s;3)在4000rpm下以1000rpm/s10s。涂布后,在来自lhg的精密热板上在70℃的空气中将膜干燥1分钟。吸收光谱法溶液:在来自thermoscientific的evolution201仪器上记录uv-vis光谱。(参见样品制备:溶液)光致发光光谱法和tcspc使用来自horibascientific的配备有150w氙弧灯、激发和发射单色器和hamamatsur928光电倍增管以及还具有tcspc选项的fluoromax-4荧光光谱仪进行稳态发射光谱法。使用标准校正曲线校正发射和激发光谱。量子效率的确定使用来自hamamatsuphotonics的absoluteplquantumyieldmeasurementc9920-03g系统测量光致发光量子产率。该系统由150w氙气放电灯、可自动调节的czerny-turner单色仪(250–950nm)和具有高反射spektralon(特氟龙衍生物)涂层的乌布利希球组成,通过玻璃纤维线缆连接到具有1024×122像素(尺寸24×24μm)的bt(背面变薄)ccd芯片的pma-12多通道检测器。使用版本3.6.0的u6039-05软件分析量子效率和cie坐标。发射最大值以nm表示,量子产率φ以%表示,cie色度坐标以x,y值表示。根据以下方案测定聚合物膜、溶液和粉末样品的plqy:使用的参考材料是在乙醇中的已知浓度的蒽。首先测定样品的最大吸收,并用于激发样品。随后在氮气气氛下对脱气的溶液和膜测定绝对量子产率。该系统自身根据以下等式使用光子数n光子和强度int进行计算:根据密度泛函理论的计算使用bp86功能(becke,a.d.phys.rev.a1988,38,3098–3100;perdew,j.p.phys.rev.b1986,33,8822–8827),利用恒等分辨率(ri)近似(sierka,m.;hogekamp,a.;ahlrichs,r.j.chem.phys.2003,118,9136–9148;becke,a.d.,j.chem.phys.98(1993)5648-5652;lee,c;yang,w;parr,r.g.phys.rev.b37(1988)785-789)优化分子结构。在使用bp86通过使用b3lyp功能性的时间依赖性dft(td-dft)方法优化结构的情况下计算激发能量(becke,a.d.,j.chem.phys.98(1993)5648-5652;lee,c;yang,w;parr,r.g.phys.rev.b37(1988)785-789;vosko,s.h.;wilk,l.;nusair,m.can.j.phys.58(1980)1200-1211;stephens,p.j.;devlin,f.j.;chabalowski,c.f.;frisch,m.j.j.phys.chem.98(1994)11623-11627)。所有计算使用def2-sv(p)库集(weigend,f.;ahlrichs,r.phys.chem.chem.phys.2005,7,3297–3305;rappoport,d.;furche,f.j.chem.phys.2010,133,134105/1–134105/11)和m4网格进行数字积分。所有dft计算使用turbomole程序包(版本6.5)(turbomolev6.42012,universityofkarlsruhe和forschungszentrumkarlsruhegmbh的研究,1989-2007,turbomolegmbh,自2007;可从http://www.turbomole.com获得)进行。实施例1合成(阶段1):将3-溴-4-氟苯甲腈(125mmol)、苯基硼酸(188mmol)、乙酸钯(2.5mmol)、2-二环己基膦基-2',6'-二甲氧基-1,1'-联苯(sphos;5mmol)和磷酸三钾(tribasicpotassiumphosphate)(250mmol)在氮气下悬浮在200ml甲苯中。加入10ml脱气的水后,将反应混合物用氮气保护(blanket)20min。在110℃下搅拌18小时并且冷却至室温后,过滤反应溶液并且用乙酸乙酯洗涤固体。滤液经mgso4干燥。除去溶剂后,粗产物从正己烷中重结晶。获得为白色固体的3-苯基-4-氟苄腈(15.9g,80.6mmol,64%)。1hnmr(500mhz,氯仿-d)δ7.77(dd,j=7.1,2.2hz,1h)7.64(ddd,j=8.5,4.5,2.2hz,1h),7.54–7.42(m,5h)7.27(dd,j=9.9,8.5hz,1h)。阶段2:将3-苯基-4-氟苄腈(65.9mmol)、3,6-二甲氧基咔唑(65.9mmol)和磷酸三钾(132mmol)在氮气下悬浮在dmso(120ml)中并且在110℃下搅拌(16h)。随后将反应混合物引入700ml水中并搅拌1小时。通过过滤分离固体并且用水(1l)洗涤。随后将固体在50℃下减压干燥。粗产物通过从甲苯中重结晶而纯化。获得为白色固体的产物1(23.1g,57.1mmol,87%)。1hnmr(500mhz,氯仿-d)δ7.95(d,j=1.9hz,1h),7.80(dd,j=8.2,2.0hz,1h),7.64(d,j=8.1hz,1h),7.45(d,j=2.4hz,2h),7.10–7.02(m,3h),7.02–6.98(m,2h),6.92(dd,j=8.9,0.7hz,2h),6.89(dd,j=8.9,2.3hz,2h)3.90(s,6h)。1在2-甲基四氢呋喃中的溶液的吸收光谱如图1所示。可以在图2中看到1的膜发射(在pmma中为10%)。发射最大值在443nm。光致发光量子产率(plqy)为56%。密度泛函理论计算给出2.86ev的单重态(s1)能量(singlet(s1)energy)和2.59ev的三重态(t1)能量。1的基态(groundstate)的计算前沿轨道(frontierorbitals)如图3所示。实施例2将9,10-二氢-9,9-二甲基吖啶(10mmol)、4-溴-3-甲基苄腈(15mmol)和乙酸钯(0.5mmol)在氮气下悬浮在50ml甲苯中。当氮气通过反应混合物30min后,加入三叔丁基膦(0.75mmol)和叔丁醇钠(15mmol),并且混合物在搅拌下回流2.5小时。随后在室温下搅拌16小时后,加入50ml水,并且用50ml乙酸乙酯萃取混合物两次。将合并的有机相用饱和nacl溶液洗涤并且经mgso4干燥。除去溶剂后,残余物从乙醇重结晶。获得产物2(4.9mmol,49%)。1hnmr(500mhz,氯仿-d)δ7.81(d,j=1.9hz,1h),7.75(dd,j=8.1,1.9hz,1h),7.53-7.46(m,2h)7.38(d,j=8.0hz,1h),7.04–6.91(m,4h),6.07–5.97(m,2h),2.14(s,3h),1.74(s,3h)1.68(s,3h)。2在2-甲基四氢呋喃中的溶液的吸收光谱如图4所示。在图5中可以看到2的膜发射(在pmma中为10%)。发射最大值在441nm。光致发光量子产率(plqy)为55%。实施例3将3-苯基-4-氟苄腈(10mmol)、2,3:5,6-二苯并-1,4-噁嗪(10mmol)和磷酸三钾(20mmol)在氮气下悬浮在dmso(20ml)中并且在125℃下搅拌(14h)。然后将反应混合物引入400ml饱和氯化钠溶液中并且用二氯甲烷(3×150ml)萃取。将合并的有机相用饱和氯化钠溶液(2×150ml)洗涤并且经硫酸镁干燥,然后除去溶剂。粗产物最终通过从甲苯中重结晶来纯化。获得为黄色固体的产物3。1hnmr(500mhz,氯仿-d)δ7.91(d,j=1.9hz,1h),7.85(dd,j=8.1,2.0hz,1h),7.57(d,j=8.1hz,1h),7.35–7.29(m,5h),6.65–6.59(m,4h),6.59-6.54(m,2h),5.90-5.83(m,2h)。在图6中可以看到3的膜发射(在pmma中为10%)。发射最大值在494nm。光致发光量子产率(plqy)为65%。实施例41hnmr(500mhz,氯仿-d)δ7.88(s,1h),7.83(d,j=7.6hz,1h),7.57(d,j=8.2hz,1h),7.39–7.27(m,5h),6.69–6.51(m,6h),5.89(d,j=7.6hz,2h)。在图7中可以看到4的膜发射(在pmma中为10%)。发射最大值在466nm。光致发光量子产率(plqy)为31%。发射寿命为51μs。实施例51hnmr(500mhz,氯仿-d)δ7.87(s,2h),7.30(d,j=2.4hz,2h)7.05–7.00(m,2h),6.99–6.94)(m,4h),6.94–6.89(m,4h),6.77(dd,j=8.8,2.4hz,2h),6.72(d,j=8.8hz,2h),3.84(s,6h)。在图8中可以看到5的膜发射(在pmma中为10%)。发射最大值在449nm。光致发光量子产率(plqy)为65%。实施例61hnmr(500mhz,氯仿-d)δ=7.93(d,1h),7.90(dd,1h),7.48(d,1h),7.38(dd,2h),7.21–7.13(m,5h),6.97(dt,2h)6.91(dt,2h),6.15(dd,2h),1.80(s,3h),1.04(s,3h)ppm。在图9中可以看到6的膜发射(在pmma中为10%)。发射最大值在456nm。光致发光量子产率(plqy)为60%。实施例71hnmr(500mhz,氯仿-d)δ7.77(d,j=1.8hz,1h),7.72(dd,j=8.0,1.9hz,1h),7.43(d,j=8.0hz,1h),6.76–6.65(m,4h),6.60(td,j=7.6,1.7hz,2h),5.71(dd,j=7.9,1.4hz,2h),2.29(s,3h)。在图10中可以看到7的膜发射(在pmma中为10%)。发射最大值在477nm。光致发光量子产率(plqy)为71%。实施例81hnmr(500mhz,氯仿-d)δ=7.98(d,1h),7.89(d,1h),7.85(dd,1h),7.77(d,1h),7.72(d,1h),7.31–7.27(m,1h),7.23–7.16(m,5h),7.14–7.11(m,1h),7.08–7.01(8h),6.98–6.94(m,4h),6.88(d,1h)ppm。在图11中可以看到8的膜发射(在pmma中为10%)。发射最大值在462nm。光致发光量子产率(plqy)为40%。实施例91hnmr(500mhz,氯仿-d)δ=8.30(d,2h),8.02(d,1h),7.87(d,1h),7.72(d,1h),7.68(dd,4h),7.55(dd,2h),7.47(t,4h),7.35(t,2h),7.11–7.04(m,7h)ppm。在图12中可以看到9的膜发射(在pmma中为10%)。发射最大值在404nm。光致发光量子产率(plqy)为28%。实施例10–oled组件a在具有以下构造的oled组件中试验分子1:ito/m-mtdata/hat-cn/tris-pcz/1:dpepo(20%)/tspo1/bpytp2/liq/al。表1:组件a的组件数据。电流密度和亮度相对于电压的关系如图13所示。功率效率和电流效率相对于电压的关系如图14所示。外部量子效率与电流密度的关系如图15所示。在10v下操作时oled的电致发光光谱如图16所示。实施例11-oled组件b在具有以下构造的oled组件中试验分子1:ito/m-mtdata/α-npd/tcta/czsi/1(10%):dpepo/dpepo/tpbi/liq/al。表2:组件b的组件数据。实施例12测量19的膜发射(在pmma中为10%)。发射最大值在407nm。光致发光量子产率(plqy)为30%。实施例13测量20的膜发射(在pmma中为10%)。发射最大值在440nm。光致发光量子产率(plqy)为50%。实施例14测量21的膜发射(在pmma中为10%)。发射最大值在442nm。光致发光量子产率(plqy)为52%。实施例15测量22的膜发射(在pmma中为10%)。发射最大值在408nm。光致发光量子产率(plqy)为41%。实施例16测量23的膜发射(在pmma中为10%)。发射最大值在399nm。光致发光量子产率(plqy)为31%。实施例17测量24的膜发射(在pmma中为10%)。发射最大值在441nm。光致发光量子产率(plqy)为32%。半峰全宽(fwhm)为91nm。实施例18在图f9中可以看到25的膜发射(在pmma中为10%)。发射最大值在474nm。光致发光量子产率(plqy)为52%。实施例19测量26的膜发射(在pmma中为10%)。发射最大值在448nm。光致发光量子产率(plqy)为53%。实施例20测量27的膜发射(在pmma中为10%)。发射最大值在392nm。光致发光量子产率(plqy)为30%。实施例21测量28的膜发射(在pmma中为10%)。发射最大值在425nm。光致发光量子产率(plqy)为16%。实施例22测量29的膜发射(在pmma中为10%)。发射最大值在416nm。光致发光量子产率(plqy)为13%。实施例23测量30的膜发射(在pmma中为10%)。发射最大值在433nm。光致发光量子产率(plqy)为34%。实施例24测量31的膜发射(在pmma中为10%)。发射最大值在397nm。光致发光量子产率(plqy)为33%。实施例25测量32的膜发射(在pmma中为10%)。发射最大值在405nm。光致发光量子产率(plqy)为37%。实施例26测量33的膜发射(在pmma中为10%)。发射最大值在394nm。光致发光量子产率(plqy)为37%。实施例27测量34的膜发射(在pmma中为10%)。发射最大值在477nm。光致发光量子产率(plqy)为33%并且半峰全宽为99nm。在具有以下构造的oled组件(“组件x2”)中试验分子5:(发射层中本发明的分子的分数以质量百分比报告):层厚度10100nmal92nmliq830nmtpbi710nmdpepo620nm5(20%):dpepo510nmczsi420nmtcta370nmnpb220nmm-mtdata1120nmito具有根据式i的结构的有机分子的其它实例:附图说明图1:1在2-甲基四氢呋喃中的溶液的吸收光谱。图2:1的膜发射(在pmma中为10%)。图3:1的基态的计算前沿轨道图4:2在2-甲基四氢呋喃中的溶液的吸收光谱。图5:2的膜发射(在pmma中为10%)。图6:3的膜发射(在pmma中为10%)。图7:4的膜发射(在pmma中为10%)。图8:5的膜发射(在pmma中为10%)。图9:6的膜发射(在pmma中为10%)。图10:7的膜发射(在pmma中为10%)。图11:8的膜发射(在pmma中为10%)。图12:9的膜发射(在pmma中为10%)。图13:oled组件ito/m-mtdata/hat-cn/tris-pcz/1:dpepo(20%)/tspo1/bpytp2/liq/al的电流密度和亮度。图14:oled组件ito/m-mtdata/hat-cn/tris-pcz/1:dpepo(20%)/tspo1/bpytp2/liq/al的功率效率和电流效率相对于电压的关系。图15:oled组件ito/m-mtdata/hat-cn/tris-pcz/1:dpepo(20%)/tspo1/bpytp2/liq/al的外部量子效率与电流密度的关系。图16:在10v下操作时oled组件ito/m-mtdata/hat-cn/tris-pcz/1:dpepo(20%)/tspo1/bpytp2/liq/al的电致发光光谱。图17:oled组件x2的电流密度和亮度。图18:oled组件x2的功率效率。图19:oled组件x2的电流效率。图20:oled组件x2的外部量子效率。图21:在14v下操作时的oled组件x2的电致发光光谱。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1