一种用细胞组织学技术判定油棕幼嫩花序性别的方法与流程
本发明属植物生物学领域,涉及一种花序性别的判定方法,具体是一种用细胞组织学技术判定油棕幼嫩花序性别的方法。
背景技术:
植物花序的性别分化是有花植物发育过程中极为重要的阶段,是植物生命延续的关键环节,是一个复杂的形态建成过程,也是一种特殊的器官发生现象。了解植物的花序性别分化过程,包括细胞组织学特征及相关内源激素含量的变化,对于理解其发育生物学和生殖生物学特性、在生产中实现花期和性别比例调控、杂交、杂种优势利用等具有重要意义。
油棕是重要的木本油料作物,其单位面积的产油量遥遥领先于世界上其他的油料作物,被称为“世界油王”。油棕花序发育和性别分化过程决定能否形成优质雌、雄花序和果实,这是获得高产优质棕榈油的前提条件。油棕花序发育和性别分化过程可能与种植地的温度、湿度等环境因素,以及非生物因素(如水分胁迫)、代谢因素(如碳储量)、肥料元素种类和水平、激素水平等因素等非生物因素有关。在生产上通过调控各种因素有可能实现油棕花期和雌、雄花序性别比例调控、杂种优势利用、组织培养以及形成优质花序和果实,以期提高油棕产量,获得高产优质棕榈油。因此开展油棕花序性别分化过程与外界因子之间的关系的研究非常重要。
由于油棕花序为雌雄同株异序,从花序开始发育到开放要经历2~3年的时间(Corley,1976),过程漫长,这显著区别于其他大多数植物,而且花序开放后,雌花序的花序轴由大约150个小穗轴组成,而雄花序的花序轴由100~300个小穗轴组成(Jacquemard,1995)。常规油棕花序性别鉴定约在花序开放时期才能进行,时间长,不利于研究。鉴于此,提早判定雌、雄花序性别,及时了解花序性别分化过程与外界因子之间的关系,有效地缩短研究时间,加快研究进程,为进一步研究油棕花序性别分化过程与外界因子之间的关系提供基础。
我国南方冬季的气温较为寒冷,本地栽培的油棕对环境具有适应性,与赤道附近栽培的油棕有显著差别,但国内迄今没有其花序性别分化细胞组织学研究的相关报道。
技术实现要素:
本发明的目的是提供一种用细胞组织学技术判定油棕幼嫩花序性别的方法,根据雌、雄花序在形态学和细胞组织学水平的差异,提早在雌雄未显性期判定雌、雄花序性别,为进一步研究油棕花序性别分化机制与外界因子的关系提供基础,这对于在油棕生产中实现花期和性别比例调控、提高产量等具有重要意义。
本发明的技术原理:
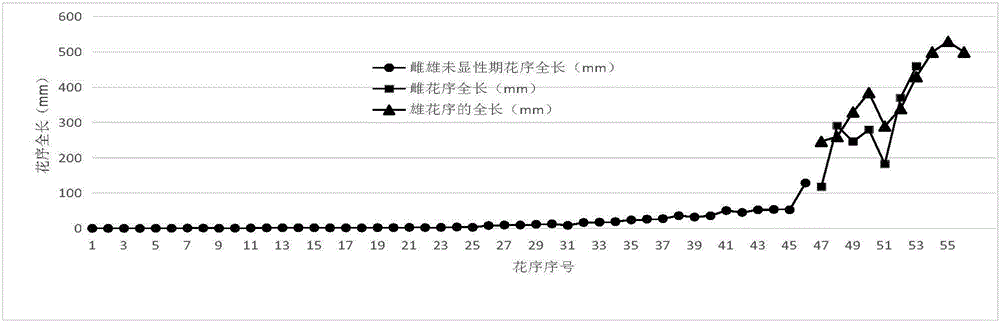
油棕成龄树的各花序都处于不同的发育期,本发明的发明人以茎顶端分生组织记为0,最靠近它的花序记为N1,接着是N2、N3……,按顺序依次对花序排序编号,不同的花序编号代表花序不同的发育阶段。每个花序的整体长度,以及去除苞片后的长度变化规律见表1、附图1、附图2。每个花序的整体质量,以及去除苞片后的花序质量变化规律见表2、图3、图4。
表1油棕花序发育过程中长度变化情况
表2油棕花序发育过程中质量变化情况
从表1、表2以及图1~4可以看出,N1~N44阶段,花序的发育速度非常缓慢。从N45开始,花序迅速发育,花序长度和质量呈指数式显著增长,这一时期为花序发育指数增长期(the exponential growth stage of the inflorescence,EGSI)。油棕花性别分化之初,花序开始迅速发育,进入EGSI。雌、雄花序的生长曲线大致相同,大体上雄花序的长度大于雌花序的长度。作为花序的保护性器官,苞片的长度和质量增长在花序生长中占有重要部分。去除苞片的花序的质量增长相对于苞片的质量增长有迟滞现象。随着花序不断发育,苞片持续生长并木质化。
研究分析表明,油棕花序的发育过程可分为雌雄未显性期(N1~N46)和雌雄显性期(N47~N56)两个主要阶段,其中雌雄未显性期发育时间要比雌雄显性期长得多,约占总时期的80%。
雌雄未显性期:包括Ⅰ期、Ⅱ期、Ⅲ期:Ⅰ期是性别未分化期,包括N1~N26花序阶段;Ⅱ期是过渡期,包括N27~N37花序阶段(在N27阶段,小穗轴分生组织出现;N35时小穗轴分生组织即形成花苞片原基;N36时小穗轴分生组织发育出花苞片);Ⅲ期是性别分化期,包括N38~N46花序阶段,花序发育间隔时间总长约为4.5个月,是可用细胞组织学技术判定花序性别时期,花序发育后,花序在小穗轴上依循花苞片原基生长(N38阶段)→花苞片以及新的花苞片原基生长(N39、N40)→花原基分生组织形成(N41~46阶段)这个顺序发育分化,雄花序、雌花序在小穗轴上的相关花苞片原基数、花苞片数以及新的花苞片原基数、花原基分生组织数有着数量级的差别(根据统计,成熟雌花序每个小穗轴上长有5~30朵三基花,而成熟雄花序每个小穗轴上长有400~500朵雄花),可以据此判定幼嫩花序性别。例如,在花原基分生组织形成阶段,某一花序小穗轴上的花原基分生组织数都远远大于雌花序小穗轴花原基分生组织数(1个花原基分生组织将发育成1朵成熟花),具有数量级的差别,而且处于雄花序每小穗轴花原基数目的区域,而且它们都还在生长,花原基的数目仍在增加,可判定该花序为雄花序。
本发明的发明人通过对雌雄未显性期花序发育过程进行切片观察(如图5所示):
N1阶段,在叶原基下存在一簇细胞,为花序原基(图5-1),大小为0.3mm,是在光学显微镜下看到的花序发育的最早时期。此时细胞含有1个较大的细胞核。
N6阶段,花序原基起始发育出先出叶原基(图5-2),整个花序的大小为0.85mm。此时,花序原基的中央为圆顶状,两侧为先出叶原基。随后,先出叶伸长(图5-3)。
N10阶段,先出叶完全包裹住花序原基,此时整个花序的大小为1.15mm;而且,花序原基两侧出现花梗苞片原基(图5-4)。花梗苞片原基细胞继续分裂、生长成为花梗苞片(图5-5)。此时,先出叶出现维管化。花梗苞片继续伸长。N14阶段,花梗苞片完全包裹住花序分生组织(图5-6),此时花序长度为2.2mm。
当先出叶和花梗苞片包裹住花序分生组织以后,花序轴两侧出现小穗轴苞片原始细胞,此时为N15花芽阶段(图5-7),花序长度仍为2.2mm。小穗轴苞片原始细胞继续发育成小穗轴苞片原基、小穗轴苞片(图5-8)。此时花梗苞片出现维管化。
随着小穗轴苞片的生长及数目的增多,在小穗轴苞片的基部出现小穗轴分生组织(图5-9:N27花序阶段),此时花序长度为10mm。小穗轴分生组织的细胞有较大的核质比。小穗轴分生组织的发育方式为自顶部向基部发育(图5-10显示:在花序轴顶部的小穗轴苞片基部已出现小穗轴分生组织,而基部的小穗轴苞片还未出现小穗轴分生组织)。小穗轴分生组织呈圆锥形(图5-11),围绕花序轴呈螺旋状排列(图5-12)。
小穗轴分生组织继续发育。N36阶段时,小穗轴分生组织发育出花苞片,此时花序大小为26.5mm(图5-13)。从图5-14可以看出,顶部小穗轴的发育速度快于基部的小穗轴。
本发明的发明人通过对雌雄显性期的雌花序发育过程进行切片观察(如图6所示):
在雌花序中,小穗轴上每个花苞片下会长出一朵三基花。三基花由中间一朵有功能的雌花及其两侧的伴随雄花组成。发育到一定阶段,伴随雄花会败育脱落。三基花为蝎尾状聚伞花序。
约N47阶段,小穗轴分生组织形成的三基花苞片腋下出现花分生组织(图6-1)。此时花分生组织的细胞含有1个较大的核,处于活跃状态。花分生组织由三部分组成(图6-2):最外层是明显的一层细胞(L1),将来发育成表皮细胞;L1层下是数层活跃的等径细胞,含有较大细胞核;等径细胞下的区域内,细胞核质比较小,细胞中有液泡出现。花分生组织分化出小苞片1(B1),B1腋下发育出伴随雄花1(asf1)(图6-3)。在B1的腋下与asf1之间出现一簇细胞,将来发育出小苞片2(B2),B2的腋下靠近B1的位置随后发育出伴随雄花2(asf2)。位置排列顺序为B1、asf2、B2、asf1。伴随雄花1和伴随雄花2之间的发育是不同步的,asf1的发育快于asf2。
N48阶段,在B2的腋下与asf2之间出现一簇分生细胞(图6-4),这些细胞随后发育出小苞片3(B3),B3的腋下发育出雌花(ff),ff在B2和B3之间。此时asf1已发育出萼片和花瓣原基,asf2的萼片原基也已出现。这种发育方式符合蝎尾状聚伞花序的特点。
N49阶段,伴随雄花的萼片和花瓣都已出现(图6-5),而且部分伴随雄花已发育出雄蕊原基(图6-6)。雄花萼片末端的细胞液泡化。此阶段时,雄花的花梗伸长,直到高于雌花。雌花的分生组织生长变大,但仍只发育出小苞片(B3),此时的雌花小于雄花。
N51阶段,雌花的分生组织开始发育,而此时伴随雄花保持原样(图6-7)。随后,雌花的生殖器官继续发育,同时发育出雌蕊群和雄蕊群(图6-8)。此时,雌花萼片末端的细胞液泡化。同时,伴随雄花发育出发药(图6-9)。花药的一侧细胞出现液泡化,而另一侧的细胞有一个较大的细胞核。
N52阶段,雌花发育速度快于雄花。雌花迅速变大,而伴随雄花大小保持不变(图6-10)。伴随雄花中的萼片、花瓣及花药末端的一些细胞中积累多酚,花瓣的一些细胞空泡化。并且,花药中出现花粉囊(图6-11)。雌花中,心皮基部已发育出子房原基(图6-12)。雌花萼片、花瓣末端的细胞出现液泡化现象。
N53阶段,雌花继续发育,雄花仍保持不变(图6-13)。伴随雄花会在花成熟前脱落。绝大多数雌花有3片萼片,3片花瓣(图6-14,其中1、2为小苞片2、小苞片3),但也有个别雌花有4片萼片,4片花瓣(图6-15,其中1、2为B2、B3);其外形和质地相同,都为淡黄色。剥去花瓣和萼片,在体视显微镜下观察,可以看到雌花有3个自由心皮(图6-16)。根据雌花横切片可以看出,子房为3心室,每个心室都有1个胚珠(图6-17)。在心皮的基部和末端之间有1个通道,为花柱道(图6-18),它是花粉管在受精之前的通道。
本发明的发明人通过对雌雄显性期的雄花序发育过程进行切片观察(如图7所示):
约N47阶段,花苞片下长出花分生组织(图7-1)。花分生组织呈圆锥形,细胞都有1个较大的核(图7-2)。
N49阶段,花分生组织一侧长出萼片(图7-3)。从此图可以看出雄花的分生组织也可分为3层:最外层是明显的一层细胞(L1),将来发育成表皮细胞;L1层下是数层活跃的等径细胞,含有较大细胞核(L2);等径细胞下的区域内,细胞核质比较小,细胞中有液泡出现(L3)。
N50阶段,花分生组织两侧起始发育出花瓣原基(图7-4)。此时,萼片末端的细胞出现液泡化。
N51阶段,雄花的雄蕊原基开始发育(图7-5)。此时,萼片及花瓣末端区域的细胞液泡化。N52阶段,雄蕊出现(图7-6)。N53阶段,雄花中花药出现(图7-7)。此时,花药的细胞都含有一个较大的细胞核,表明发育初期的花药由分裂活跃的细胞组成。由花药纵切图可以看出,花药由最外层的一层表皮和内部的同型细胞组成(图7-8)。随后随着花药的发育,表皮下出现4组孢原细胞,孢原细胞的细胞核大于表皮内部其它细胞的细胞核(图7-9)。由雄花横切面可看出:每朵雄花有3片萼片,3片花瓣,6个雄蕊(图7-10)。孢原细胞通过1次平周分裂分为内外两层,内层为造孢细胞,将来发育成小孢子母细胞,外层为初生壁细胞。
N55阶段,花粉囊内出现小孢子母细胞并且开始进行减数分裂。小孢子母细胞较大,细胞质浓(图7-11)。N56阶段,小孢子母细胞开始积累胼胝质壁,并且小孢子母细胞的细胞核大(图7-12)。此时,观察花药横切面可看到其横切面似蝶形(图7-13)。随后,小孢子母细胞开始进行减数分裂,第1次减数分裂后产生一个小孢子二分体(图7-14),第2次减数分裂后形成4个单倍体细胞,即4个小孢子。减数分裂刚完成时,4个小孢子仍然被包裹在胼胝质内,排列成四面体型(图7-15)。后来随着胼胝质壁的消失,4个小孢子被释放出来(图7-16)。刚释放出来的小孢子形状不规则。小孢子继续发育,最终形成似三角形的花粉粒(图7-17)。
发明人的研究表明,油棕雌花在性别分化前期有一个两性期阶段,由1个在中央的有功能的雌花和分别在其两侧的2个伴随雄花组成,随着花序的发育,伴随雄花选择性败育,在开花之前脱落。而雄花在性别分化后雌蕊不生长,只保留了一个退化雌蕊,不存在两性期阶段,直接进入单性期。这种差别说明一旦进入性别分化期之后,就很难对雌、雄花的性别进行转换,要想调控提高雌花比例,应在性别分化前采取措施,即在雌雄未显性期的Ⅱ期(过渡期)N35阶段前进行油棕花序性别调控。
本发明所采用的技术方案:
一种用细胞组织学技术判定油棕幼嫩花序性别的方法,其具体步骤如下:
1、取材
在油棕树上选取处于雌雄未显性期Ⅲ期(性别分化期)的花序,先去掉先出叶和花梗苞片,然后再投入到FAA固定液中。
2、脱水与透明
将固定好的花序样品依次在30%、50%、70%、100%的乙醇中放置2~3h。然后用正丁醇作为透明剂,在其中放置40~50h,每8h换一次透明剂。
3、浸蜡与包埋
55~65℃下,在体积比为1:1的正丁醇和石蜡的混合液中放置10~15h,然后在纯蜡中再浸蜡10~15h,在这期间每4h换一次纯蜡。然后用KEDEE KD-M生物组织包埋机对雌雄未显性期Ⅲ期的幼嫩花序的小穗轴进行包埋。
4、切片与烤片
将包埋好的样品进行修块,然后用Leica RM2235旋转切片机进行纵向切片(小穗轴的纵向),厚度为5~10μm。在KD-H烘片机上,40~50℃进行烤片,时间为6~10h。
5、脱蜡与染色
(1)把蜡带切片用松节油浸泡20min;(2)更换新的松节油,浸泡蜡带切片20min;(3)用体积比位1:1的松节油和纯酒精的混合液浸泡3min;(4)纯酒精浸泡3min;(5)95%酒精浸泡2min;(6)85%酒精浸泡2min;70%酒精浸泡2min;(7)50%酒精浸泡2min;(8)1%的高碘酸浸泡(当环境温度不超过20℃,氧化5~10min;当环境温度高时则适当减少氧化时间);(9)流水冲洗5~10min,然后用蒸馏水浸洗;(10)Schiff试剂避光染色10~30min;(11)0.5%的偏重亚硫酸钠浸洗两次,每次1~2min已达到分色目的;(12)流水冲洗5~10min,蒸馏水浸洗10~20min;(13)50~60℃情况下,1%的苯胺蓝黑染色10min;(14)7%醋酸快速浸泡一下去除多余染料,空气中干燥,然后用蒸馏水洗涤;(15)纯酒精浸洗3min;(16)更换新的纯酒精,浸洗3min;(17)更换新的纯酒精,浸洗3min;(18)用体积比为1:1的纯酒精和松节油混合液浸泡3min;(19)松节油浸泡5min;(20)更换新的松节油,浸泡5min;(21)用中性树胶进行封片。最后利用装有LEICA DFC500镜头的LEICA DMLB显微镜对切片进行观察并拍照,计算花苞片原基数、花苞片数以及新的花苞片原基数、花原基分生组织数。
6、油棕幼嫩花序性别的判定
油棕幼嫩花序性别的判定规则:若A>50,或B>50,或C>50,则该花序为雄花序;若A<30,或B<30,或C<30,则该花序为雌花序。
A:每个小穗轴上的花苞片原基数;
B:每个小穗轴上的花苞片数以及新的花苞片原基数;
C:每个小穗轴上的花原基分生组织数。
本发明根据油棕的雌、雄花序在形态学和细胞组织学水平的差异,利用细胞组织学技术提早在雌雄未显性期判定雌、雄花序性别,有效地缩短研究时间,加快研究进程,为进一步研究油棕花序性别分化机制与外界因子的关系提供基础,这对于在油棕生产中实现花期和性别比例调控、提高产量等具有重要意义。
附图说明
图1:油棕花序发育完整过程长度变化规律
图2:油棕花序(去除苞片)发育完整过程长度变化规律
图3:整个发育过程中油棕花序的质量变化规律
图4:整个发育过程中油棕花序(去除苞片)的质量变化规律
图5:雌雄未显性期油棕花序发育的细胞组织学观察和分析
图中:1:花序原基起始发育。2:先出叶起始发育。3:先出叶生长。4:花梗苞片原基起始发育。5:花梗苞片生长。6:花梗苞片完全包裹住花序分生组织。7:小穗轴苞片原基起始。8:小穗轴苞片出现。9:小穗轴分生组织起始发育。10:小穗轴分生组织数目增多。11:小穗轴分生组织生长。12:小穗轴呈螺旋状排列。13:花苞片起始发育。14:花苞片生长。
缩略词:Fb,花苞片;fpb,花梗苞片;Im,花序分生组织;Ip,花序原基;p,先出叶;pbp,花梗苞片原基;pp,先出叶原基;pv,维管束原带;rab,小穗轴苞片;rabi,小穗轴苞片原始细胞;rabp,小穗轴苞片原基;Ram,小穗轴分生组织。
图6:雌花发育的细胞组织学观察和分析
图中:1:雌花分生组织起始发育。2:花分生组织生长。3:小苞片1(B1)出现。4:雌花分生组织出现。5:雌花分生组织生长。6:伴随雄花1出现雄蕊原基。7:雌花萼片发育。8:心皮起始发育。9:伴随雄花中花药发育。10:三基花的排列方式。11:伴随雄花出现花粉囊。12:子房原基出现。13:雌花生长,而雄花停止发育。14,15:花被排列。16:体视显微镜下观察到的心皮。17:胚珠出现。18:花柱道的纵切图。
缩略词:a,花药;asf1,伴随雄花1;asf2,伴随雄花2;B1,小苞片1;B2,小苞片2;B3,小苞片3;c,心皮;ff,雌花;Fm,花分生组织;o,胚珠;ovp,子房原基;pd,花梗;pe,花瓣;ps,花粉囊;pv,维管束原;s,萼片;sta,退化雄蕊;stp,雄蕊原基。
图7:雄花发育的细胞组织学观察和分析
图中:1:雄花分生组织出现。2:雄花分生组织生长。3:萼片起始发育。4:花瓣起始发育。5:雄蕊原基起始发育。6:雄蕊起始发育。7:花药起始发育。8:雄蕊的横切面。9:孢原细胞出现。10:雄蕊的排列方式。11:小孢子母细胞出现。12:小孢子母细胞开始积累胼胝质壁。13:花药横切面。14:小孢子二分体出现。15:小孢子四分体出现。16:4个小孢子被释放出来。17:花粉呈近似三角形。
缩略词:arc,孢原细胞;con,药隔;ep,表皮细胞;L1,L2,L3:第一、二、三层细胞;msp,小孢子母细胞;st,雄蕊。
具体实施方式
下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
油棕花序从开始发育到开放要经历2~3年的时间(Corley,1976),过程漫长,这为油棕生产中实现花期和性别比例调控、杂种优势利用、提高产量和育种带来很大困难。研究表明,至少有四种不同类型的因素可能参与性别决定和分化:非生物因素(如水分胁迫)、代谢因素(如碳储量)、激素水平和遗传因素。在水分胁迫下有利于形成雄花序(Corley,1976)。干旱条件具有使油棕雌花雄化的作用,但其生理学和遗传学机理仍有待阐明。有早期文献认为油棕具有性别可塑性。
实施例
步骤1.做好田地规划和实验设计。
用50亩地栽培油棕试管无性系苗,油棕苗龄、品种等须整齐一致。按照生产上的栽培密度进行规划:1亩地种10株油棕。
设计非生物因素(如水分胁迫)、代谢因素(如碳储量)、肥料元素种类和水平、激素水平等因素对油棕苗进行实验处理。
步骤2.取材
随机在种植园的三个地点(呈三角形分布)分别标记为A、B、C,每个地点挑选五株油棕树,选取油棕处于雌雄未显性期Ⅲ期的花序,分三个阶段选取:①花苞片原基生长阶段;②花苞片以及新的花苞片原基生长阶段;③花原基分生组织形成阶段。去除相应叶片,取出花序。
步骤3.花序长度和质量的测量
选取的花序的长度直接用刻度尺依次测量。每个花序测量整体长度,并测量去除苞片后的花序长度。
较大花序的质量在油棕园用电子天平(常熟市佳衡天平仪器有限公司恒佳牌DT-1000E型,最大称量1000g,最小称量0.01g,检定分度值0.01g)称量,较小花序(N47以下)的质量用千分之一电子天平(型号:Precisa XS365M-SCS,最大称量365g,最小称量0.001g,检定分度值0.001g)称量。每个花序称量整体质量,并称量去除苞片后的花序质量。
将所取花序的整体长度、去除苞片后的花序长度、整体质量以及去除苞片后的花序质量与表1~表2的相应数据进行对比,观察其吻合程度,确定所选取的花序是否为目标材料。
步骤4.油棕花序石蜡组织切片的制做和细胞组织学分析
根据实际情况,对雌雄未显性期Ⅲ期的幼嫩花序做纵向切片进行显微观察。
4.1油棕花序石蜡组织切片的制做
4.1.1固定
将样品花序先去掉先出叶和花梗苞片,然后再投入到FAA固定液中。在FAA固定液中放置至少24h,也可长期保存。
4.1.2脱水与透明
将固定好的材料依次在30%、50%、70%、100%的乙醇中放置2h。然后用正丁醇作为透明剂,在其中放置2天,每8h换一次透明剂。
4.1.3浸蜡与包埋
60℃下,在体积比为1:1的正丁醇和石蜡的混合液中放置12h,然后在纯蜡中再浸蜡12h,在这期间每4h换一次纯蜡。然后用KEDEE KD-M生物组织包埋机对花序的小穗轴进行包埋。
4.1.4切片与烤片
将包埋好的样品进行修块,然后用Leica RM2235旋转切片机沿着小穗轴的纵向进行切片,厚度为8μm。在KD-H烘片机上,45℃进行烤片,时间为8h。
4.1.5脱蜡与染色
(1)把蜡带切片用松节油浸泡20min;(2)更换新的松节油,浸泡蜡带切片20min;(3)用体积比为1:1的松节油和纯酒精的混合液浸泡3min;(4)纯酒精浸泡3min;(5)95%酒精浸泡2min;(6)85%酒精浸泡2min;70%酒精浸泡2min;(7)50%酒精浸泡2min;(8)1%的高碘酸浸泡(当环境温度不超过20℃,氧化7.5min;当环境温度高时则适当减少氧化时间);(9)流水冲洗7.5min,然后用蒸馏水浸洗;(10)Schiff试剂避光染色20min;(11)0.5%的偏重亚硫酸钠浸洗两次,每次1.5min已达到分色目的;(12)流水冲洗7.5min,蒸馏水浸洗15min;(13)55℃情况下,1%的苯胺蓝黑染色10min;(14)7%醋酸快速浸泡一下去除多余染料,空气中干燥,然后用蒸馏水洗涤;(15)纯酒精浸洗3min;(16)更换新的纯酒精,浸洗3min;(17)更换新的纯酒精,浸洗3min;(18)用体积比为1:1的纯酒精和松节油混合液浸泡3min;(19)松节油浸泡5min;(20)更换新的松节油,浸泡5min;(21)用中性树胶进行封片。
步骤5.雌雄未显性期Ⅲ期的幼嫩花序组织切片分析和性别判断
利用装有LEICA DFC500镜头的LEICA DMLB显微镜对切片进行观察并拍照,计算花苞片原基数、花苞片数以及新的花苞片原基数、花原基分生组织数量,各项指标小于30个为一组,编号1;大于50个为一组,编号2,分别计算平均数,结果见表3。
表3油棕雌雄未显性期Ⅲ期花序小穗轴上各项判定指标
上述结果表明,雄花序、雌花序每个小穗轴上的相关花苞片原基数、花苞片数以及新的花苞片原基数、花原基分生组织数显著不同,有数量级的差别,而且花序都还在生长,在过渡到雌雄显性期时花原基的数目仍在增加,据此可以判定在花苞片原基数、花苞片数以及新的花苞片原基数或花原基分生组织数小于30个时为雌性、大于50个时为雄性。因此,本发明利用细胞组织学技术提早在雌雄未显性期判定雌雄花序性别,大大缩短研究时间,加快研究进程,为研究不同实验因素和处理对于油棕花序性别调控的影响提供基础,具有重要意义。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!