一种脂肪组织离体保存液及其制备方法与流程
本发明属于细胞工程技术领域,具体涉及一种脂肪组织离体保存液及其制备方法。
背景技术
干细胞(stemcell)是一类具有自我复制能力(self-renewing)的多潜能细胞,随着对干细胞研究的不断深入,越来越多不同来源的干细胞成为各研究机构的研究热点,如骨髓源间充质干细胞、胎盘源间充质干细胞、牙髓源间充质干细胞、脂肪源间充质干细胞等。
随着脂肪组织工程的发展,脂肪源干细胞(又成脂肪源血管基质细胞)越来越多的受到重视,其主要应用于医疗美容等领域。2001年zuk等在脂肪组织中发现具有多项分化潜能的、成纤维细胞的干细胞以来,脂肪干细胞的多向分化潜能等特性有望成为组织工作的“种子细胞”之一。
脂肪组织储量丰富且获取简便,从脂肪组织中获得的脂肪干细胞(adiposetissue-derivedstemcells,adscs)在不同的诱导环境中能够向成脂、成骨、成软骨方向分化,且能够分泌多种生长因子和细胞因子,有望策划归纳为临床应用中的理想的干细胞来源,为再生医学领域的应用提供了新的思路。
脂肪是由甘油和脂肪酸组成的三酰甘油酯,其中甘油的分子比较简单,而脂肪酸的种类和长短却不相同。脂肪酸分三大类:饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸。脂肪可溶于多数有机溶剂,但不溶解于水。是一种或一种以上脂肪酸的甘油脂c3h5(oocr)3,为延长脂肪组织的离体保存期限并保证脂肪干细胞提取成功率,离体的脂肪组织需保存在脂肪组织保存液中,为脂肪组织提供营养供给。
如果离体脂肪组织长时间在常温条件下运输保存,容易损伤离体脂肪组织,而且脂肪不溶于水,且密度较轻,保存液中的脂肪组织会悬浮于保存液中,使得脂肪组织无法与保存液充分接触,无法满足脂肪组织运输保存的需要。
技术实现要素:
针对现有技术中的上述不足,本发明提供一种脂肪组织离体保存液,可有效解决脂肪组织在离体保存时,出现的悬浮于保存液上,无法与保存液充分接触的问题。
为实现上述目的,本发明解决其技术问题所采用的技术方案是:
一种脂肪组织离体保存液,包括以下重量份的组分:
自体血小板裂解物0.5~1.5份、透明质酸钠0~5份、人血白蛋白1~5份、vc0~1份、海藻糖0.1~0.3份、温敏水凝胶10~20份、抗菌药物0.3~1.5份,以及磷酸盐缓冲液80~90份。
进一步地,包括以下重量份的组分:
自体血小板裂解物1份、透明质酸钠2份、人血白蛋白3份、vc1份、海藻糖0.2份、温敏水凝胶12份、抗菌药物0.82份,以及磷酸盐缓冲液84份。
进一步地,温敏水凝胶的制备方法如下:
将聚丙烯酰胺、甲基丙烯酸、丙烯酸以及交联剂混合,再加入引发剂,搅拌均匀,静置反应10~15h后,取出反应产物洗涤3~5次;其中,聚丙烯酰胺、甲基丙烯酸、丙烯酸、交联剂以及引发剂的重量比为5~10:0.5~1:0.5~1:0.15~0.3:0.5~1。
进一步地,聚丙烯酰胺、甲基丙烯酸、丙烯酸、交联剂以及引发剂的重量比为8:1:0.6:0.15:1。
进一步地,交联剂为壳聚糖。
进一步地,引发剂为过硫酸铵、过硫酸钾、过氧化月桂酰或过硫酸钠。
进一步地,抗菌药物包括青霉素、链霉素和两性霉素;其中,青霉素、链霉素和两性霉素b的重量比为:0.2~0.6:0.1~0.5:0.01~0.05。
进一步地,青霉素、链霉素和两性霉素b的重量比为:0.5:0.3:0.02。
进一步地,磷酸盐缓冲液ph值为7.2~7.6。
上述脂肪组织离体保存液的制备方法,包括以下步骤:
在无菌条件下,按配方将权利要求1中各组分混合,制备得到脂肪组织离体保存液。
本发明的有益效果为:
1、温敏水凝胶是由聚丙烯酰胺、甲基丙烯酸和丙烯酸交联聚合后形成的具有三维网络结构的水凝胶,能够根据环境温度变化从而发生体积相变现象;当温度高于最低临界溶解温度(lcst)时,大分子链上的印迹位点相互靠近,呈溶胀失忆状态,即在常温下呈液态;当温度低于最低临界溶解温度(lcst)时,大分子链上的印迹位点相互远离,处于收缩记忆状态,即在低温下呈固态;由此,通过在保存液中添加该温敏水凝胶,然后在常温下将需要保存的脂肪组织加入至该保存液中,震荡混匀,然后在0~8℃下保存,同时,在该水凝胶未凝固前不时震荡,使脂肪组织能够均匀的分布于保存液中,并使得该保存液在运输过程中处于凝胶状态,以保证脂肪组织能够与保存液充分接触,利于脂肪组织及细胞的长期储存。
2、自体血小板裂解物是从脂肪供者自身血液中提取分离得到的,其中包括大量的细胞生长因子、转化生长因子、血管内皮细胞生长因子等,可以为脂肪组织、脂肪细胞提供更好的营养供给环境;抗坏血酸-维生素c的加入可以帮助脂肪细胞维持各种过氧化物酶的活性,防止氧自由基对细胞膜和细胞器造成损伤,对保存脂肪组织起到关键作用。
3、人血白蛋白可作为稳定剂和保护剂,并且是细胞培养基的重要成分,具有较强的保护作用,能够促进细胞的增长,延长细胞存活的时间;增加血容量和维持渗透压,主要调节组织与血管之间水分的动态平衡,并可作为氮源为组织提供营养。
4、海藻糖(trehalose)是一种自然界中广泛存在的非还原性双糖,无毒副作用,化学性质十分稳定,除了具有低聚糖的一般特性,还有独特的生物学特性,在严酷环境下可保护生物体的组织和大分子的功能和活性;1)稳定生物膜和蛋白质的结构;2)保护生物体免受热和干燥的损伤;3)保护生物体免受氧化应激的损伤;氧自由基可使细胞蛋白质中的氨基酸受损而导致对细胞的损伤,而细胞中高浓度的海藻糖可防止这种损伤,这表明海藻糖具有氧自由基清除剂的作用;4)海藻糖可保护哺乳动物细胞免受缺氧的损伤。
5、本发明方法制备得到的保存液,不仅能使得脂肪组织能充分的与保存液接触,还能有效的延长脂肪组织的保存时间。
附图说明
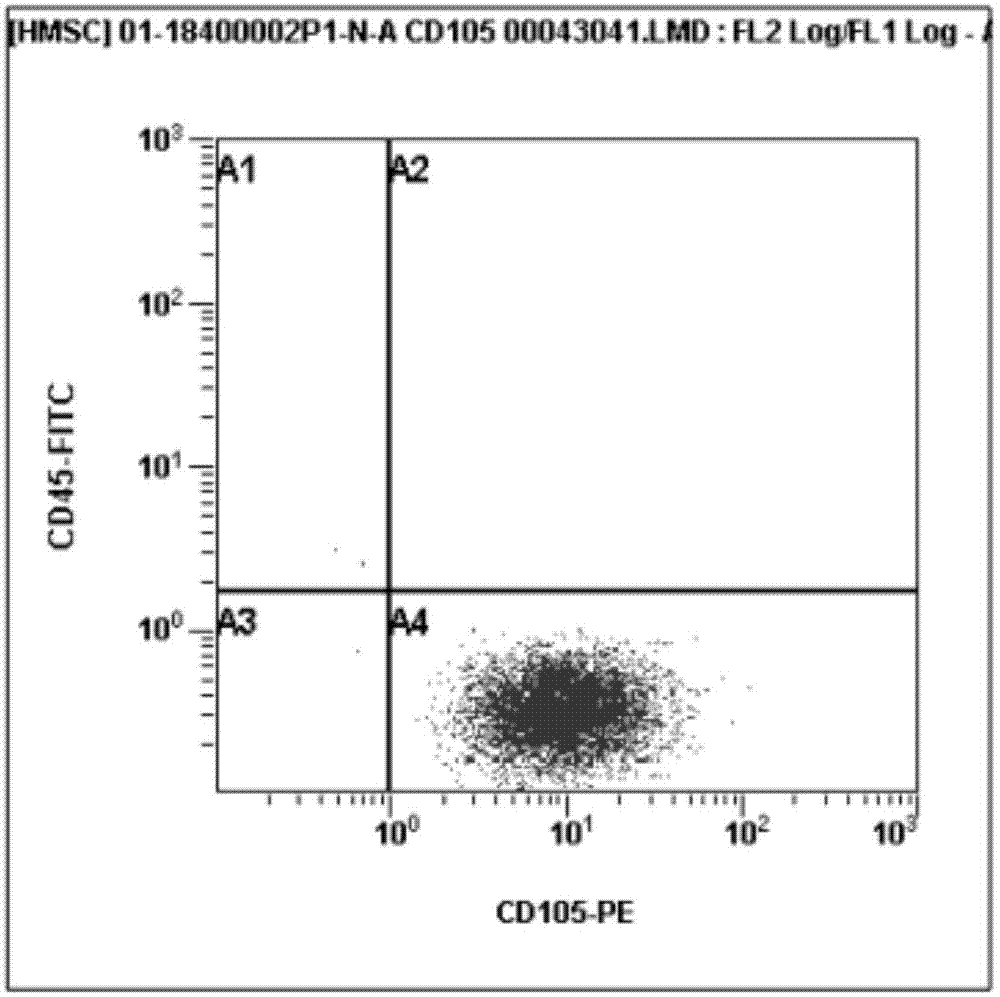
图1为cd105和cd45表达量的流式检测图;
图2为cd90表达量的流式检测图;
图3为cd19表达量的流式检测图;
图4为cd11b表达量的流式检测图;
图5为cd34表达量的流式检测图;
图6为cd73和hla-dr表达量的流式检测图;
图7为温敏凝胶胶凝温度检测图谱。
具体实施方式
下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
实施例1
一种脂肪组织离体保存液,该保存液每100ml中含有自体血小板裂解物1ml、透明质酸钠2g、人血白蛋白3ml、vc1g、海藻糖0.2g、温敏水凝胶12ml、青霉素0.5g、链霉素0.3g、两性霉素b0.02g,其余溶质介质为ph值为7.4的磷酸盐缓冲液。
其中,温敏水凝胶的制备方法为:将聚丙烯酰胺、甲基丙烯酸、丙烯酸以及壳聚糖混合,然后加入过硫酸铵,搅拌均匀,静置反应15h后,洗涤3次反应产物,得温敏水凝胶;其中,聚丙烯酰胺、甲基丙烯酸、丙烯酸、壳聚糖以及过硫酸铵的重量比为8:1:0.6:0.15:1。
该保存液的制备方法为:
在无菌条件下,将上述各成分混合均匀,制备得到脂肪组织离体保存液。
采用该保存液保存脂肪组织的方法如下:
将脂肪组织与保存液按照0.5:1的料液比在常温状态下混合,震荡混匀,然后置于0~8℃下保存,同时,在该保存液未凝固前不时震荡,直至该保存液完全凝固为止。
实施例2
一种脂肪组织离体保存液,该保存液每100ml中含有自体血小板裂解物0.5ml、人血白蛋白1ml、vc0.5g、海藻糖0.3g、温敏水凝胶20ml、青霉素0.6g、链霉素0.5g、两性霉素b0.05g,其余溶质介质为ph值为7.6的磷酸盐缓冲液。
其中,温敏水凝胶的制备方法为:将聚丙烯酰胺、甲基丙烯酸、丙烯酸以及壳聚糖混合,然后加入过硫酸钠,搅拌均匀,静置反应15h后,洗涤3次反应产物,得温敏水凝胶;其中,聚丙烯酰胺、甲基丙烯酸、丙烯酸、壳聚糖以及过硫酸钠的重量比为10:0.5:0.8:0.2:0.6。
该保存液的制备方法为:
在无菌条件下,将上述各成分混合均匀,制备得到脂肪组织离体保存液。
采用该保存液保存脂肪组织的方法如下:
将脂肪组织与保存液按照0.5:1的料液比在常温状态下混合,震荡混匀,然后置于0~8℃下保存,同时,在该保存液未凝固前不时震荡,直至该保存液完全凝固为止。
实施例3
一种脂肪组织离体保存液,该保存液每100ml中含有自体血小板裂解物1.5ml、透明质酸钠5g、人血白蛋白5ml、海藻糖0.1g、温敏水凝胶10ml、青霉素0.2g、链霉素0.1g、两性霉素b0.01g,其余溶质介质为ph值为7.2的磷酸盐缓冲液。
其中,温敏水凝胶的制备方法为:将聚丙烯酰胺、甲基丙烯酸、丙烯酸以及壳聚糖混合,然后加入过氧化月桂酰,搅拌均匀,静置反应15h后,洗涤3次反应产物,得温敏水凝胶;其中,聚丙烯酰胺、甲基丙烯酸、丙烯酸、壳聚糖以及过氧化月桂酰的重量比为6:0.8:1:0.3:1。
该保存液的制备方法为:
在无菌条件下,将上述各成分混合均匀,制备得到脂肪组织离体保存液。
采用该保存液保存脂肪组织的方法如下:
将脂肪组织与保存液按照0.5:1的料液比在常温状态下混合,震荡混匀,然后置于0~8℃下保存,同时,在该保存液未凝固前不时震荡,直至该保存液完全凝固为止。
实验例
1、温敏凝胶胶凝温度检测
于室温条件下,将实施例1中制备得到的温敏凝胶置于磁力搅拌器上,其中,搅拌子大小为0.6mm×1.5mm,搅拌速率为200r/min,然后分别升温降温,直至搅拌子停止转动为止,并检测此时温敏凝胶胶体温度,其胶凝温度检测图谱如图7所示。
由图7可知,在大于等于25℃时,搅拌子在温敏凝胶中的搅拌速率无任何变化,而随着温度的降低,搅拌子的搅拌速率逐渐降低,直至在3~5℃时,完全停止,由此,表明该温敏凝胶在温度大于室温时,其呈液态,在温度降低至3~5℃时,其呈固态。
2、脂肪组织的采集
供者要求病原微生物检测结果阴性,具体如下:hbv、hcv、hiv、htlv、ebv、tp,脂肪来源不仅限于腰腹部、臀部、大腿部等,采取抽脂的方式进行采集,平均分成两份,其中一份立即送往实验室进行提取培养,另一份放入本发明实施例1制备得到的保存液中,于2-8℃环境中保存3周后进行提取培养。
3、取常温静置分层后的上层脂肪组织,用等体积的无菌生理盐水充分混匀后于2000rpm/min、20℃条件下离心5min,去除油滴、白色筋膜、血细胞。
4、重复3步骤得清洗后的脂肪组织。
5、将脂肪组织接种于培养瓶中,每瓶2-3ml;置于37℃、5%二氧化碳浓度的饱和湿度培养箱中培养。
6、观察细胞贴壁状态,约每3-5天换液,待贴壁细胞长至60-80%时进行传代处理,弃去脂肪组织,并用无菌生理盐水清洗1-2次,加入恢复至室温的0.25%含edta的胰蛋白酶消化2-3min。
7、按照1~1.5x104个/cm2的接种比例进行传代扩增培养。
对新鲜脂肪和经本发明实施例1制备得到的保存液储存后的脂肪的细胞状态进行检测,其检测结果见表1。
表1脂肪组织提取的细胞量及活率
检测结果如表1所示,脂肪组织经过本发明实施例1所述方法制备得到的保存液保存3周后,进行脂肪干细胞的提取培养,所获得的原代及扩增后的细胞数量和活率和新鲜脂肪组织提取的脂肪干细胞几乎相同,说明本发明方法制备得到的保存液能够有效的保证提取出来的脂肪组织的活性。
再对本发明方法提取出的p1代细胞的免疫表型进行鉴定,其结果分别见表2和图1~图6;其中,图1为cd105和cd45表达量的流式检测图;图2为cd90表达量的流式检测图;图3为cd19表达量的流式检测图;图4为cd11b表达量的流式检测图;图5为cd34表达量的流式检测图;图6为cd73表达量的流式检测图;
表2脂肪干细胞中免疫标志物的表达量
根据图1~图6,以及表2的检测数据可知,经过本保存液保存的脂肪组织所提取所得干细胞具有典型间充质干细胞表面标志物特征,高表达量的标志物为cd73、cd90、cd105,且阳性表达率均大于99%,低表达量的标志物为cd11b、cd19、cd34、cd45、hla-dr,阴性表达率均小于2%。
- 还没有人留言评论。精彩留言会获得点赞!