岭南湿热证动物模型的建立方法与流程
本发明涉及动物模型实验技术,特别是涉及一种岭南湿热证动物模型的建立方法。
背景技术:
湿热证是常见的中医证型,其主要表现为头身困重、懒气少言、便溏等不适。除了轻度不适之外,其也可见于多种疾病,成为合并其他疾病的一种证型。根据其病因学,主要可分为外感湿热、和内生湿热,外感湿热一般是由环境因素引起的,内生湿热一般是由饮食情绪等引起的,一般认为二者具有相互关联的机制和通路。在中国东南部岭南地区,由于地理气候环境潮湿炎热,日照时间长、气温高、雨水充沛,易致地湿上蒸,外感湿热证极为多见,属于岭南医学中“岭南湿热证”范畴。对其证候实质的基础研究、治疗方法及药物的研究和开发,都有着深远意义。
湿热证的动物模型是开展上述研究的重要工具。然而,实际操作中其造模一般由研究者根据其工作侧重点、自行设计和制备,包括采用不同的环境湿度和温度制造湿热环境、结合各种高糖高脂饮食、外源生物感染等。传统的造模方法复杂,尤其是饮食及外源感染等因素,有悖于岭南地区气候地理环境及习俗文化,也难于规范化、标准化。最重要的是,这些模型的评价方法及检测指标,往往局限于动物的外观、粪便性状、活动度等大体评价,缺乏能阐释湿热证实质的、且适宜标准化的科学指标。这些不足为岭南湿热证证候基础研究、岭南湿热证临床药物机制研究及新药开发带来了较大的障碍。
技术实现要素:
基于此,有必要针对现有建立动物湿热证的技术存在的问题,提供一种岭南湿热证动物模型的建立方法。
一种岭南湿热证动物模型的建立方法,包括以下步骤:
将小鼠置于湿热环境进行建模饲养,饲养14~28天,获得动物模型;
饲养期间给予所述小鼠饲料和垫料,每天更换饮用水以及垫料;
所述湿热环境条件为白天34℃~33℃,湿度85~90%,12h,夜间18℃~22℃,湿度55~35%,12h。
在其中一个实施例中,还包括在进行建模饲养之前将所述小鼠置于动物房适应性饲养一周的步骤,所述适应性饲养一周的饲养条件是温度为22℃,湿度为55%,光照时间为12h。
在其中一个实施例中,所述小鼠为六周龄、体重为20~24g的balb/c小鼠。
在其中一个实施例中,所述动物房为spf级动物房,所述饲料为spf级饲料,所述的垫料为spf级垫料。
在其中一个实施例中,还包括:根据动物模型的体征指标、舌像指标、分子生物学指标以及肠道微生态指标对构建得到的岭南湿热动物模型进行评价和检测分析。
在其中一个实施例中,所述体征指标包括大便形态和硬度、皮毛粗糙程度以及体重。
在其中一个实施例中,所述舌像指标包括舌苔厚度。
在其中一个实施例中,所述分子生物学指标包括结肠组织nf-κbp35和aqp3的检测。
在其中一个实施例中,所述肠道微生态指标包括allobaculum和sutterella的含量。
在其中一个实施例中,所述allobaculum和sutterella的含量是在科、属水平的含量变化。
与传统技术相比,本发明的岭南湿热证动物模型的建立方法至少具有以下有益效果:本发明建立的湿热证动物模型更贴合岭南地区气候、地理环境及习俗文化,造模方法也更简单,造模稳定性和重复性好、易于操作和控制,为岭南湿热证证候基础研究、岭南湿热证临床药物机制研究及新药开发提供一种更科学的方法。
为更好地实现本发明的目的,本发明选用以下方法对岭南湿热证的动物模型进行评价,小鼠体征、小鼠舌像、分子生物学指标以及肠道微生态指标,这些评价指标比传统的评价指标更具有科学性,更能够阐释湿热证的实质、且适宜标准化的科学指标。
附图说明
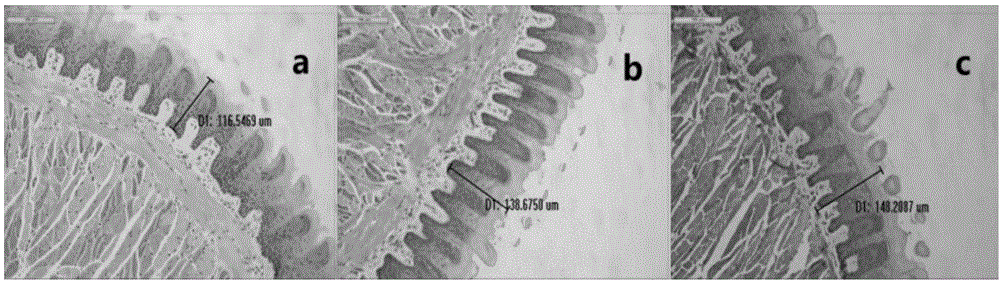
图1为岭南湿热小鼠模型的he舌苔染色图;(a)为正常组,即nc组;(b)为14天模型组,即14天hth组;(c)为28天模型组,即28天hth组;
图2为岭南湿热小鼠模型nf-κbp35与aqp3关系柱状图;
图3为allobaculum属和sutterella(萨特菌)属的相对含量(allobaculum:nc组0±0,hth组3.07347±1.2995;sutterella:nc组0.0081±0.013,hth组1.07954±1.00799);
图4为基于肠道菌群13srrna的kegg信号通路的功能预测(picrust分析),其中environmentalinformation_processing为环境信息处理相关,metabolism为代谢相关,humandiseases为疾病相关;
图5为肠道病理、免疫组化及特殊染色,其中(a)为lps免疫组化图;(b)为荧光桃红-酒石酸染色图;(c)为杯状细胞pas染色图;(d)为杯状细胞数量柱状图;(e)为绒毛及隐窝he染色图。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
本发明提供了一种岭南湿热证动物模型的建立方法,其通过选用六周龄、体重为20~24g的balb/c小鼠,将小鼠置于湿热环境进行建模饲养,饲养14~28天,获得动物模型。饲养期间给予小鼠饲料和垫料,每天更换饮用水以及垫料。优选地,饲料为spf级饲料,的垫料为spf级垫料。湿热环境条件为白天34℃~33℃,湿度85~90%,12h,夜间18℃~22℃,湿度55~35%,12h。
进一步,在一个具体示例中,该岭南湿热动物模型的建立方法还包括在进行建模饲养之前将小鼠置于动物房适应性饲养一周的步骤,动物房为spf级动物房,适应性饲养一周的饲养条件是温度为22℃,湿度为55%,光照时间为12h。在购买小鼠运输的途中,小鼠可能会受到惊吓等不适因素影响,适应性饲养是为了缓解小鼠的不安的情绪,提高本发明的准确性。
更进一步的,在一个具体示例中,该建立方法还包括将建模得到的湿热证动物模型进行评价和检测分析的步骤。优选地,指标包括体征指标、舌像指标、分子生物学指标以及肠道微生态指标对构建得到的岭南湿热动物模型进行评价和检测分析。体征指标包括大便形态和硬度、皮毛粗糙程度以及体重。从对小鼠体征指标的分析可以得出其表征符合中医学对湿热证证候特点的认识。分子生物学指标包括结肠组织nf-κbp35和aqp3的检测,结肠组织nf-κbp35及aqp3免疫组化检测od值说明nf-κbp35及aqp3的蛋白含量变化,呈现与岭南湿热证相关的客观的特征性改变。肠道微生态指标包括allobaculum和sutterella(萨特菌)的含量,allobaculum和sutterella(萨特菌)的含量是在科、属水平的含量变化,通过对allobaculum和sutterella(萨特菌)的含量的测定,能够更为客观的分析小鼠的湿热证表现,因为这两种肠菌带来的表现与湿热证更为吻合。
本发明涉及一种岭南湿热证动物模型的建立方法,包括以下步骤:
步骤s1:建模前的准备。
选用六周龄、体重为20~24g的balb/c小鼠,优选的,小鼠体重为22g。小鼠在进行建模实验之前将小鼠置于spf级动物房适应性饲养一周,适应性饲养一周的饲养条件是温度为22℃,湿度为55%,光照时间为12h。给予小鼠spf级饲料和垫料,每天更换饮用水以及spf级垫料。
步骤s2:模型的建立。
将小鼠置于湿热环境饲养14~28天,环境条件为白天34℃~33℃,湿度85~90%,12h,夜间20℃,湿度55~35%,12h。优选的,环境条件为白天35℃,湿度88%,12h,夜间20℃,湿度30%,12h。给予小鼠spf级饲料和垫料,每天更换饮用水以及spf级垫料。
最后根据动物模型的体征指标、舌像指标、分子生物学指标以及肠道微生态指标对构建得到的岭南湿热证动物模型进行评价和检测分析。体征指标包括大便形态和硬度、皮毛粗糙程度以及体重;舌像指标包括舌苔厚度;分子生物学指标包括结肠组织nf-κbp35和aqp3的检测;肠道微生态指标包括allobaculum和sutterella(萨特菌)的含量,allobaculum和sutterella(萨特菌)的含量是在科、属水平的含量变化。
上述建立的湿热证动物模型的方法更贴合岭南地区气候、地理环境及习俗文化,造模方法也更简单,造模稳定性和重复性好、易于操控和控制。为更好地实现本发明的目的,本发明选用以下方法对岭南湿热证的动物模型进行评价和检测分析,小鼠体征、小鼠舌像、分子生物学指标以及肠道微生态指标,这些评价指标是能够阐释湿热证的实质、且适宜标准化。
为了便于理解本发明,以下结合具体实施例对本发明作进一步详细的说明。
实施例1
1模型制备材料及方法
1.1动物:spf级balb/c小鼠12只,雌雄各半,3周龄,体重20~24g,由广东省实验动物中心提供,实验动物许可证号:syxk(粤)2015-0109,将小鼠置于spf动物房适应性饲养一周,条件为温度为22℃,湿度为55%,光照时间为12h后,进行实验。
1.2spf级垫料和spf级饲料
1.3试剂:
糖原pas染色液(北京雷根生物技术有限公司)
lendrum氏荧光桃红酒石黄(潘氏细胞)染色试剂盒(上海歌凡生物科技有限公司)
无水乙醇(国药集团化学试剂有限公司)
二甲苯(国药集团化学试剂有限公司)
edta(ph8.0)(碧云天)
pbs缓冲液(gibco)
抗原修复液
双氧水(国药集团化学试剂有限公司)
bsa(solarbio)
苏木素染液(武汉博士德)
盐酸(国药集团化学试剂有限公司)
氨水(国药集团化学试剂有限公司)
中性树胶(碧云天)
一抗:lps(cloud-clonecorp,货号mab523ge21)
二抗:hrp标记山羊抗兔鼠通用二抗(dako,货号k5007)
1.4仪器:
rxz-158a-led型人工气候箱(宁波江南仪器厂)
亚都yc-d205型超声波加湿器(北京亚都环保科技有限公司)
长协电子cx2000小鼠电子秤(东莞市水葫芦商贸有限公司)
dmil荧光生物显微镜(德国leica公司)
bk-dm500型数码显微镜(重庆奥体光学显微镜有限公司)
leica2015-rm型切片机(德国徕卡有限公司)
mikro200r型高速冷冻离心机(德国hettich公司)
震荡器os-10(购于德国boeco公司)
jj-12j脱水机(武汉俊杰电子有限公司)
jb-p5包埋机(武汉俊杰电子有限公司)
jb-l5冻台(武汉俊杰电子有限公司)
kd-p组织摊片机(浙江省金华市科迪仪器设备有限公司)
dhg-9140a烤箱(上海慧泰仪器制造有限公司)
80312-3181载玻片(江苏世泰实验器材有限公司)
10212432c盖玻片(江苏世泰实验器材有限公司)
mm823la3-ns微波炉(美的微波电器制造有限公司)
wd-9405a脱色摇床(北京市六一仪器厂)
tyxh-ii涡旋混合器(天悦电子)
ke0003087/ka0053573移液枪(dragon)
gt1001组化笔(genetech)
nikonds-u3成像系统(日本尼康)
nikoneclipseti-sr正置荧光显微镜(日本尼康)
2.方法
2.1建立模型:将小鼠随机分为两组,一组为湿热模型组,一组为正常对照组,每组12只。将小鼠置于主动调温调湿式人工气候箱中饲养14-28天,白天35℃,湿度88%,12h,夜间20℃,湿度30%,12h,昼夜交替。给予小鼠spf级维持饲料,spf级垫料。每天需更换洁净饮用水、垫料,杜绝湿热环境导致的饮用水和饲料被细菌污染的可能。
2.2湿热模型各项性能指标的检测
2.2.1小鼠体征:观察小鼠的外观、毛发状况、活跃度、饮食情况、粪便情况、体重、等体征;
2.2.2舌像:建模第14、28天后,取湿热证小鼠,并利用he染色观察舌苔厚度;
2.2.3分子生物学指标:采血检测nf-κb,肠道黏膜的aqp3检测;
2.2.4肠道微生态指标:建模第28天收集小鼠粪便,进行13srna测序,测定肠道菌群,检测方法包括、但不限于高通量测序、定量pcr,以及allobaculum和sutterella两种细菌含量的比较。
3.结果
3.1体征指标
实验前所有小鼠精神状态良好,活泼好动、反应灵敏,皮毛柔亮有光泽、食欲正常、大便正常,呈黑硬成形。实验后,正常对照组与实验前无明显差异,体重逐渐增加。而实验组小鼠进入人工气候箱后日间精神萎靡,四肢不收,反应迟钝,夜间活动状态尚可;3天后小鼠体重为21~25g,毛发疏松,大便成型,便质稍软,期间饮水量增加,约为正常对照组的1.5~2倍,进食量无明显变化;7天后体重为23~25g,大便成型,便质稍软而黏,饮水量依旧较正常对照组老鼠多;14天后体重为23~27g,小鼠毛发疏松粗糙,日间倦怠乏力,精神萎靡,夜间尚可,大便尚能成型,便质软黏,饮水量多于正常对照组小鼠,饮食量无明显增加或减少;21天后体重为24~27g,日间小鼠活动量减少,反应迟钝,夜间活动尚可;28天后体重为25~28g,小鼠大便成型,便软而黏,倦怠喜卧,毛发粗糙。
3.2舌像
处死动物后,取小鼠舌组织和放入4%多聚甲醛固定。脱水,透明,浸蜡,包埋制成切片,进行he染色。在显微镜下拍摄200x的照片,测量小鼠舌苔厚度。
图1显示各组实验小鼠的舌苔he染色,正常组(nc组)小鼠的舌苔厚度小于湿热组(hth组)小鼠的舌苔厚度,实验组的舌苔厚度大于130μm,
3.3分子生物学指标
图2显示了各组实验小鼠的结肠组织nf-κbp35(核转录因子)及aqp3(水通道蛋白3)免疫组化检测od值随造模时间延长而升高,呈相关性。结果如表1所示:
表1小鼠结肠nf-κbp35、aqp3平均光密度结果比较(od值)
表1
注:与正常组比较,***p<0.001。
3.4肠道微生态指标
通过13srrna测序技术检测allobaculum和sutterella两种菌的含量。如这两种细菌在的nc组以及hth组中的含量是不同,结果如图3所示,可以看出hth组的这两种细菌的含量都大于nc组。具体的测试结果如表2所示:
表2小鼠粪便allobaculum和sutterella比较
表2
注:与正常组相比较,**p<0.01。
从表2可以看出,hth组的这两种细菌的含量都大于nc组。
造模结束处死小鼠前,采集小鼠大肠内容物,通过13srrna测序技术,分析小鼠大肠的肠道菌群差异,以明确肠道菌群的变化。
粪便样本总dna的提取:取约200mg湿重粪便样品,对样品进行检测;检测合格的样品构建文库:回收目的amplicon(扩增子)片段,用t4dnapolymerase、klenowdnapolymerase和t4pnk将打断形成的粘性末端修复成平末端,再通过3'端加碱基“a”,使得dna片段能与3'端带有“t”碱基的特殊接头连接;或者设计合成含有测序接头的双index融合引物,以基因组dna为模板,进行融合引物pcr,磁珠筛选目的amplicon片段,最后,用合格的文库进行cluster制备和测序。再进一步进行文库多样性分析,评估测序量和各个文库的物种多样性、物种丰富度以及多变量统计分析,研究各样本的空间分布和样本之间的关系。
图4显示了利用本发明的方法造模后,并基于13srrna的组成及含量,经kegg(京都基因与基因组百科全书)预测,结果显示与代谢有关的功能增强、但对环境信息处理的能力下降、疾病相关的菌群增强。
3.5肠道粘膜的病理学
处死动物后,取小鼠结肠组织和放入4%多聚甲醛固定。脱水,透明,浸蜡,包埋制成切片,进行荧光桃红-酒石酸或pas染色。
图5中(a)与正常组(nc组)相比较,模型组(hth组)肠道lps(内毒素)黏附在绒毛上皮或穿过绒毛和官腔,提示lps移位增加;(b)中的经荧光桃红-酒石酸染色后,与nc组相比较,hth组中潘氏细胞退化、增生或结构破坏、细胞内颗粒弥漫分布;(c)经pas染色后,与nc组相比,hth组pas阳性细胞数量减少、体积变小;以及(d)中对pas染色结果进行图文分析,杯状细胞(goblet细胞)数量减少;(e)与nc组相比较,hth组的肠绒毛上皮层出现断裂,绒毛的中新生毛细血管增加(上),且hth组的粘膜固有层内绒毛之间非结构组织增多(下)。综上所述,病理显示hth组小鼠的肠道呈轻度肠炎的表现。
4、结论
由以上可知:本发明的岭南湿热证动物模型的建立方法是可行的,能够很好地反应岭南湿热证的情况,为岭南湿热证证候基础研究、岭南湿热证临床药物机制研究及新药开发奠定基础。
以上所述实施例仅表达了本发明的一种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!