一种无血清干细胞冻存液及干细胞冻存方法与流程
本发明属于生物医药技术领域,尤其是涉及一种无血清干细胞冻存液及干细胞冻存方法。
背景技术:
干细胞治疗是器官功能衰竭、肿瘤及遗传性疾病等复杂疾病的一种新型治疗方法,干细胞也是疾病机制和药理研究的热点之一。干细胞在细胞治疗和再生医学上具有广阔的应用前景,因此在科研及临床的应用也越来越广泛。但是,目前临床使用的干细胞大多是经体外培养、低温保存后的,研究表明,早期代数的干细胞生物学效果要明显由于传代较多的晚期干细胞。此外,也有人认为由于干细胞高增殖活性,长时间培养后会容易导致基因型改变、染色体畸变和表型不稳定等问题。因此,干细胞的早期冻存是维持其使用时细胞状态稳定性和有效性的必要条件,找到对干细胞存活和功能影响最小的冻存方法,也是干细胞应用于临床治疗的挑战之一。
干细胞冻存液是目前干细胞冻存必须使用的一种复合缓冲液,其主要作用包括:1)保持干细胞特性稳定;2)保护干细胞在低温冷冻过程中受到破坏和伤害;3)保持干细胞冻存复苏后仍具有较高的活力、增殖性和功能。
该干细胞冻存液中的一个关键成分是冷冻保护剂。二甲基亚砜(dmso)是一种被广泛使用的渗透性冷冻保护剂,其主要作用是防止冻存过程中细胞内冰晶形成、避免高浓度冻存剂的毒性和使细胞在耐受度内脱水。不过有研究发现如果dmso使用浓度过低,可能无法实现其冷冻保护的作用,但是浓度过高则可能影响细胞活力甚至产生细胞毒性。因此选择最佳dmso浓度对于发挥其冷冻保护剂的作用非常关键。
另一个重要因素是冷冻液中血清的使用。大多数细胞冻存液都是含有动物血清的,浓度范围从5%到90%不一。动物血清除了可以为细胞提供营养之外,在低温长期存储时还有稳定细胞膜、调整渗透压和避免自由基形成的作用。因此在干细胞冻存液中也有应用。但是对于临床使用的干细胞而言,动物血清的存在并不一定合适。首先,动物血清存在携带传播病原体及其他致病因素的风险;其次,由于血清的组分非常复杂、来源和生产批次存在差异可能会造成不良或不一致的影响;第三,血清中富含各种细胞因子、激素和其他活性成分,容易对干细胞的生物特性产生干扰和影响。因此,近年来对无血清干细胞冻存液的开发和探索也越来越受到重视。
目前常见的干细胞冻存液尚存在一些不足:1)专一性较高,普适性差,同一种冻存液在不同种类或不同种属来源干细胞的冻存保护效果差异较大;2)有血清冻存液成分复杂,容易产生干扰,且效应不可控;3)部分冻存液不适宜长期冻存,随冻存时间延长,细胞活力下降明显。
本发明即是在上述技术问题的技术上进行改进的。
技术实现要素:
有鉴于此,本发明旨在提出一种适用于神经干细胞和肿瘤干细胞的无血清干细胞冻存液,经实验室评价和实际应用测试,均说明该冻存液性能稳定,效果良好,是一种稳定有效的无血清干细胞冻存液。
为达到上述目的,本发明的技术方案是这样实现的:
一种干细胞冻存液,包括dmso、无血清培养基及其他成分,以体积百分含量计,其中dmso占8-12%,无血清培养基为占总体积的83-87%,其他成分占3-8%,优选地,其他成分含量为5%。
进一步,所述无血清培养基为dmem/f12:rpmi1640,二者体积比为2:1。
进一步,所述其他成分为混合溶液,其中hepes为5mm/l,糖类为8.1g/l,成纤维细胞生长因子为10ng/ml;人寡肽-1为20ng/ml;营养因子1为100mg/l;营养因子2为5mg/l;不饱和脂肪酸为80mg/l(按照二十碳五烯酸和二十二碳六烯酸1:1的比例配制);胆固醇为220mg/l;亚硒酸盐为5.2μg/l;
所述营养因子1为脯氨酸,营养因子2为谷胱甘肽。
需要说明的是,hepes提供细胞较强的缓冲能力,为细胞提供相对稳定的ph值;成纤维生长因子和营养因子1和2共同提供细胞活性成份,保护细胞冷冻及复苏后的活性及干性;营养因子1为脯氨酸,有助于细胞分散及活力保护,营养因子2为谷胱甘肽,为抗氧化保护剂;不饱和脂肪酸构成体内脂肪的一种脂肪酸,亦为人体必需的脂肪酸,保护细胞冷冻及复苏后的活性;胆固醇提供细胞必须成份,加入体外保存和培养的培养基中,对维持细胞状态和活性起到重要作用;人寡肽-1对细胞活性剂增殖性其重要作用。
进一步,所述干细胞冻存液用于冻存神经干细胞、肿瘤干细胞或间充质干细胞中的一种。
本发明的另一目的在于提出一种干细胞冻存方法,采用上述冻存液冻存干细胞。
进一步,细胞冻存密度为1*105-1*107细胞/ml。
进一步,所述冻存的温度为≤﹣80℃。
进一步,所述干细胞为神经干细胞、肿瘤干细胞或间充质干细胞中的一种。
相对于现有技术,本发明所述的干细胞冻存液及冻存方法具有以下优势:
1)采用无血清配方,消除血清对干细胞性质的干扰和影响;
2)选择适宜的dmso浓度,在获得有效的冷冻保护作用的同时将其细胞毒性控制在最低;
3)采用适宜的缓冲液配方,在较长冷冻时间内保持干细胞活力和特性;
4)优化成分配比,以获得对不同种类和不同种属来源干细胞的良好冻存保护效果。
附图说明
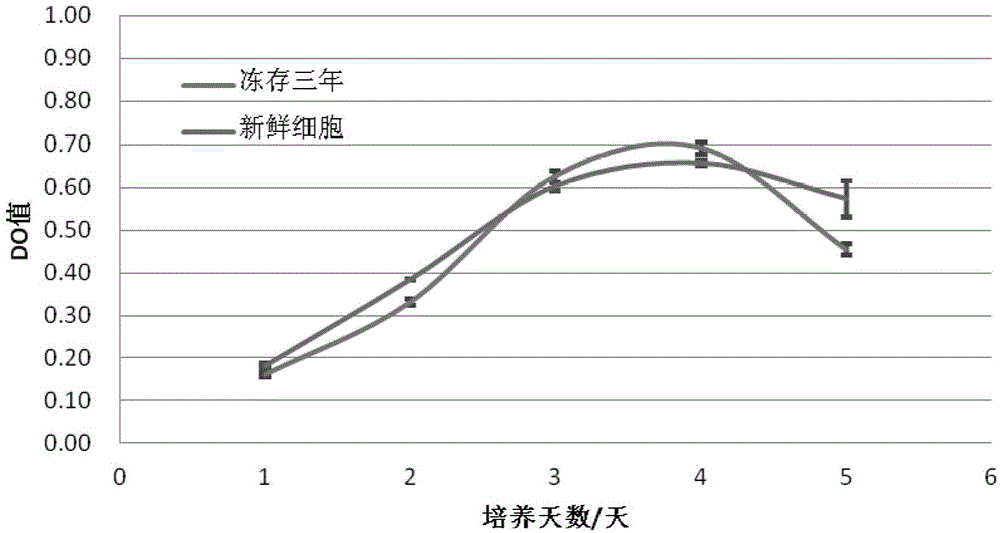
图1所示为冻存三年的大鼠神经干细胞与新鲜干细胞生长曲线的比较;与新鲜神经干细胞相比,冻存三年的干细胞在各检测时间点的细胞活力差异均无统计学意义。
图2所示为冻存三年的小鼠神经干细胞与新鲜干细胞生长曲线的比较;与图1类似的,冻存三年的干细胞在各检测时间点的细胞活力与新鲜干细胞相比,差异无统计学意义。
图3所示为冻存三年的人神经干细胞与新鲜干细胞生长曲线的比较;冻存三年的干细胞在各检测时间点的细胞活力与新鲜干细胞相比,差异无统计学意义。
图1-图3结果表明,该配方冻存液对于多种来源干细胞冻存均具有良好的保护作用,且这种保护作用在较长冻存时间下也具有很好的保护效果。
图4显示的是不同来源干细胞采用本配方冻存液冻存复苏后的细胞存活率;在对包括大鼠神经干细胞、小鼠神经干细胞、人神经干细胞、人源肿瘤干细胞(神经瘤来源)、人源肿瘤干细胞(胃癌来源)、人骨髓间充质干细胞及大鼠骨髓间充质干细胞冻存一周和冻存三年后复苏的细胞存活率进行检测发现,采用本配方冻存液冻存不同来源干细胞不同时间,复苏后细胞存活率均高于80%(84.0~94.7%),提示本配方冻存液对不同来源干细胞具有广谱的适应性和保护作用,同时,冻存时间延长但干细胞存活率无明显差异,说明改配方冻存液保护作用的有效性长,对短期冻存和长期冻存均具有应用价值。
图5为人神经干细胞复苏后形态的连续观察结果,正常干细胞由于其具有增殖分化能力,随着培养时间延长,干细胞形成集落,呈球形或团簇状,集落数量和大小反应干细胞的增值分化活力。其中图a为培养第1天形态,图b为培养第2天形态,图c为培养第3天形态,图d为培养第4天形态。
图6为冻存复苏后培养人神经干细胞纯度和分化能力检测结果。其中图a红色染色为神经干细胞特征性蛋白nestin蛋白,检测结果显示,集落细胞纯度高;图b显示的是神经干细胞分化后β-ⅲtubulin染色(绿色)及gfap染色(红色),表明干细胞具有良好的分化能力。
图7为冻存复苏后培养大鼠神经干细胞纯度和分化能力检测结果。其中图a绿色染色为神经干细胞特征性蛋白nestin蛋白,蓝色为细胞核染色,检测结果显示,集落细胞纯度高;图b显示的是神经干细胞分化后β-ⅲtubulin染色(绿色)及gfap染色(红色),表明干细胞具有良好的分化能力。
图8为冻存后复苏培养小鼠神经干细胞纯度和分化能力检测结果。其中图a绿色染色为神经干细胞特征性蛋白nestin蛋白,蓝色为细胞核染色,检测结果显示,集落细胞纯度高;图b显示的是神经干细胞分化后β-ⅲtubulin染色(绿色)、dapi染色(蓝色)及gfap染色(红色),表明干细胞具有良好的分化能力。
图9为不同dmso浓度冻存液冻存细胞后的细胞存活率。
具体实施方式
除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。
下面结合实施例及附图来详细说明本发明。
实施例1干细胞的分离、鉴定及存活率检测
人源组织干细胞的分离(以肿瘤组织为例):将获得的肿瘤组织置于无菌盒中,加入500ml生理盐水,并转运至gmp实验室。无菌状况下,撕去胎盘的羊膜,用剪刀剪取胎盘绒毛膜,并剪成1cm左右条块状,用镊子挤压,同时用生理盐水反复冲洗至澄清,用镊子挤压干净血液和水份后,用电子天平称量,获得绒毛膜湿重。然后加入适量生理盐水,用手持电动匀浆器处理至细小颗粒状(约米粒大小),再次用生理盐水反复冲洗至澄清,接着继续用匀浆器处理至肉糜状(稍有颗粒感,能够用吸管自由吸取);离心500r/min,5min,去除上清液,沉淀中加入同体积的胰蛋白酶和胶原酶ⅱ,于37℃,消化0.5~3h。用生理盐水洗涤两次后,加入培养基,按照每10g绒毛膜组织接种一t75培养瓶的份量进行接种。然后置于饱和湿度、37℃、体积分数为5%co2的培养箱中静止培养7d后,置倒置显微镜下观察并记录细胞状态。倒出培养液,并用少量生理盐水冲洗培养瓶底,重新加入新鲜培养基。待培养瓶中,细胞生长到80%~90%融合状态时,用胰蛋白酶消化后按1∶2传代。
动物组织干细胞分离(以大鼠为例):取孕14d的sprague-dawley(sd)大鼠,引颈处死后,剪开子宫壁,取出胚胎,于体式显微镜下去除胚胎头部的两层膜暴露整个脑部,取出海马区域脑组织,用剪刀剪成1mm3的碎片加入accutasetm1ml。37℃震荡酶解15min,120×g离心5min,获得rnscs后进行原代及继代培养。增殖培养基为dmem/f12/rpmi-1640(1:l:1)混合作为基础培养基,添加生长因子egf,20ng/ml;bfgf,10ng/ml;heparin,5mg/ml;hepes,5mmol/l;glucose,23.33mmol/l;glutamax,3mmol/l;bsa,2mg/ml;加入2%荷尔蒙添加剂b27后用nahco3调节ph值至7.2。
干细胞的鉴定:
(1)神经干细胞的鉴定:取第3代细胞,倒置相差显微镜下观察细胞形态;并行nestin免疫细胞化学染色进行鉴定,镜下观察染色呈阳性则为神经干细胞。
(2)免疫荧光法:细胞采用pbs浸洗3次后,多聚甲醛固定,采用免疫荧光法检测细胞标志物,其中肿瘤干细胞检测cd133,骨髓间充质干细胞检测cd29/cd45/cd73/cd90/cd105。
干细胞存活率检测:培养第8天时取细胞以0.01mol/lpbs浸洗3次,每次5min。按照试剂盒操作说明配制工作液,每孔添加200μl工作液孵育25min,吸弃染液;0.01mol/lpbs浸洗3次,每次5min。荧光显微镜下观察细胞生长形态,活细胞呈绿色荧光,死细胞呈红色荧光。200倍视野下计数细胞总数和活细胞数,计算细胞存活率,每个样品至少取五个不同视野。
实施例2干细胞的冻存、复苏及增殖培养
冻存液的配制:
(1)dmem/f12(2.5×)储备液
将可供配制1l培养基的dmem粉末和可供配制1l培养基的袋装f12粉末溶于二蒸水中搅拌均匀,终体积为800ml,过滤灭菌,4℃保存。
(2)rpmi1640(2×)储备液
将可供配制1l培养基的粉末rpmi1640粉末溶于二蒸水中搅拌均匀,终体积为500ml。过滤灭菌,4℃保存。
(3)hepes(1m)储备液
将23.8ghepes溶于二蒸水中搅拌均匀,终体积为100ml。过滤灭菌,4℃保存。
(4)葡萄糖(30%w/v)储备液
称取30g葡萄糖粉末,溶于二蒸水中,终体积为100ml。过滤灭菌,4℃保存。
(5)bfgf(10μg/ml)储备液
碱性成纤维生长因子(bfgf),每支含冻干粉50μg,先用100μltris-hcl(ph=7.6)将其溶解,加入10μl无菌20%bsa,然后用二蒸水稀释,终体积1ml,bsa含量达到至少0.1%,以每管100μl分装于1.5mlep管中,-20℃保存。
(6)双抗储备液
将160万单位/瓶的青霉素g钠一支溶于16ml无菌三蒸水,将100万单位/瓶的硫酸链霉素一支溶于10ml无菌三蒸水,-20℃保存,使用时每100ml培养液加双抗储备液各100μl。
(7)冻存液的配置
取无菌的100ml瓶子、一次性无菌吸管、无菌枪头等喷洒酒精后放入安全柜中,分别加入以下试剂:dmem/f12(2.5×)26.67ml、rpmi1640(2×)16.67ml、hepes(1m)500ul、glucose(30%)2.7ml、双抗200μl,然后用无菌水补加至99ml。其他营养因子根据总体积计算相应添加的浓度或量。
干细胞的冻存:将分离、培养好的第2代细胞吸除培养液,转移至本配方冻存液中,先置于4℃环境静置2h,再置于-20℃环境保持2h,再转移至-70℃超低温环境保持2h,然后置于液氮中冻存。
干细胞的复苏:将冻存管置于37℃水浴,至溶解90%左右时,移入37℃预热的dmem培养基,1000r/min离心5min,弃上清液,培养基重悬细胞,即可进行活细胞计数或培养。
干细胞的增殖培养:复苏后的细胞调整为1×106/l,在37℃,体积分数为5%co2,饱和湿度条件下培养。在相应培养时间做相关检测。
冻存液关键成分浓度筛选
采用新分离大鼠神经干细胞作为受试对象,分别对主要成分dmso及无血清培养基浓度进行筛选,其中dmso浓度设置为5%、10%、15%、20%,无血清培养基dmem/f12:rpmi1640(体积比2:1)补足剩余体积,其他成分分别为hepes为5mm/l,糖类为8.1g/l,成纤维细胞生长因子为10ng/ml;人寡肽-1为20ng/ml;不饱和脂肪酸为80mg/l;胆固醇为220mg/l;亚硒酸盐为5.2μg/l,冻存一周后检测细胞复苏存活率。结果显示dmso浓度为10%时冻存效果较好,故主要成分dmso的浓度选择为10%(见图9)。
对其他成分的筛选中,分别设置营养因子1浓度为0,100,200,300mg/l,营养因子2浓度为0,5,10,15mg/l,其他成分dmso为10%,hepes为5mm/l,糖类为8.1g/l,成纤维细胞生长因子为10ng/ml;人寡肽-1为20ng/ml;不饱和脂肪酸为80mg/l;胆固醇为220mg/l;亚硒酸盐为5.2μg/l;无血清培养基dmem/f12:rpmi1640(体积比2:1)补足剩余体积。以新分离的大鼠神经干细胞为研究对象,冻存一周后检测细胞复苏存活率,结果如表1所示。最终确定为dmso浓度为10%,营养因子1为100mg/l,营养因子2为5mg/l。
表1两种营养因子浓度对细胞冻存效果的筛选结果
表2不同来源神经干细胞不同冻存时间后细胞增殖情况测定
注:rat-nscs:大鼠神经干细胞;mnscs:小鼠神经干细胞;hnscs:人神经干细胞。
表3不同来源干细胞细胞不同冻存时间后复苏存活率的检测结果(计算均值后的结果)
注:rat-nscs:大鼠神经干细胞;mnscs:小鼠神经干细胞;hnscs:人神经干细胞;冻存后复苏效率=活细胞/细胞总数*100%。
实施例3干细胞活性检测及分化能力检测
干细胞的处理:
吸弃细胞培养液,每孔加入100gl(含10%cck-8试剂液)的活力测定液,置于37℃培养箱中孵育3h后,在450nm波长下测定d值。
人神经干细胞冻存后进行活性检测及分化能力检测:
对人神经干细胞冻存后复苏的生长活力进行检测和比较,具体结果见图3、图4、表2、表3,结果表明本配方冻存液对神经干细胞具有良好的保护作用。对人神经干细胞复苏后的培养观察结果也显示,冻存复苏后的干细胞仍具有良好的增殖分化能力,见图5、图6。
大鼠神经干细胞冻存后进行活性检测及分化能力检测:
对大鼠神经干细胞冻存后复苏的生长活力进行检测和比较,具体结果见图1、图4、表2、表3,结果表明本配方冻存液对神经干细胞具有良好的保护作用。对大鼠经干细胞复苏后的培养观察结果也显示,冻存复苏后的干细胞仍具有良好的增殖分化能力,见图7.
小鼠神经干细胞冻存后进行活性检测及分化能力检测:
对大鼠神经干细胞冻存后复苏的生长活力进行检测和比较,具体结果见图2、图4、表2、表3,结果表明本配方冻存液对神经干细胞具有良好的保护作用。对小鼠神经干细胞复苏后的培养观察结果也显示,冻存复苏后的干细胞仍具有良好的增殖分化能力,见图8.
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!