一种成熟脂肪细胞特异性β-catenin敲除小鼠的构建方法与流程
本发明属于肥胖治疗领域,特别涉及一种成熟脂肪细胞特异性β-catenin敲除小鼠的构建方法。
背景技术:
众多研究已经证实,wnt信号通路是调节脂肪组织发育的一个关键通路。ormonda.macdougald在2000年公布一项研究,发现在3t3-l1细胞中过表达wnt1或激活型β-catenin能够抑制脂肪细胞生成,利用药物抑制gsk3β也能够阻断脂肪细胞的分化。更进一步的结果发现,wnt信号通路激活可通过阻止pparγ和cebp/α的诱导表达,从而发挥对脂肪细胞分化的抑制作用。相反,通过过表达组成型(constitutiveactitive)axin或者持续失活型(dominantnegative)tcf7l2会导致脂肪前体细胞的自发性分化。需要注意的是,上述干预都发生在脂肪诱导分化的极早期;而wnt通路在成熟细胞中的生理功能未被涉及。
然而,wnt信号通路核心分子β-catenin体内水平如何调节脂肪功能仍不清楚。
技术实现要素:
本发明所要解决的技术问题是提供一种成熟脂肪细胞特异性β-catenin敲除小鼠的构建方法,该方法证实了β-catenin能够抑制saa3的转录表达,揭示了经典wnt信号通路如何影响成熟脂肪细胞的功能进而影响肥胖发生,或为肥胖治疗提供新的思路。
本发明提供了一种成熟脂肪细胞特异性β-catenin敲除小鼠的构建方法,包括:
将c57bl/6背景的β-cateninflox/flox小鼠与adiponectin-cre小鼠交配,获得
adiponectin-cre;β-cateninflox/wt小鼠之后,与β-cateninflox/flox小鼠交配,后代中获得对照小鼠β-cateninflox/flox和敲除小鼠adiponectin-cre;β-cateninflox/flox,即成熟脂肪细胞特异性β-catenin敲除小鼠,记作abko敲除小鼠。
所述小鼠均饲养在spf级屏障环境中。
所述环境温度为20-22℃。
有益效果
本发明证实了β-catenin能够抑制saa3的转录表达,揭示了经典wnt信号通路如何影响成熟脂肪细胞的功能进而影响肥胖发生,或为肥胖治疗提供新的思路。
附图说明
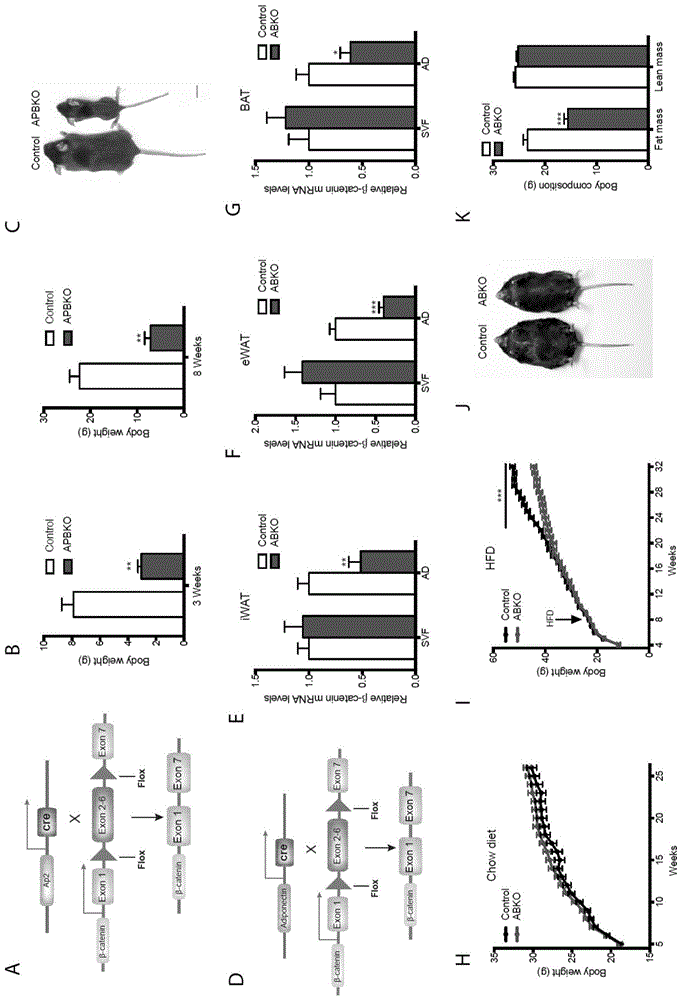
图1a为ap2-cre;β-cateninflox/flox脂肪细胞条件敲除小鼠构建模式图。
图1b为对照小鼠和apbko小鼠3周和8周龄体重。
图1c为8周龄对照小鼠和apbko小鼠代表性大体照。
图1d为adiponectin-cre;β-cateninflox/flox脂肪细胞条件敲除小鼠构建模式图。
图1e-g为对比皮下脂肪组织、内脏脂肪组织和棕色脂肪组织中,β-catenin在成熟脂肪细胞和svf细胞中的表达水平。
图1h-i为对照小鼠和abko小鼠在正常饮食和高脂饮食喂养情况下的体重曲线。
图1j为24周龄高脂喂养的对照小鼠和abko小鼠的代表性大体照片。
图1k为高脂饮食喂养对照小鼠和abko小鼠的fatmass和leanmass。
图2a为高脂饮食喂养的对照和abko小鼠在16小时饥饿后进行葡萄糖耐量实验。
图2b为葡萄糖耐量实验的曲线下面积统计结果。
图2c为高脂饮食喂养的对照和abko小鼠在6小时饥饿后进行胰岛素耐量实验。
图2d为胰岛素耐量实验的曲线下面积统计结果。
图2e为高脂饮食喂养的对照和abko小鼠血浆空腹胰岛素水平。
图2f左图为高脂饮食喂养的对照和abko小鼠皮下脂肪组织的磷酸化akt和总akt蛋白质印迹检测结果;右图为磷酸化akt和总akt灰度统计结果。
图2g-h为高脂饮食喂养的对照和abko小鼠血浆甘油三酯和总胆固醇水平。
图2i为高脂饮食喂养的对照和abko小鼠肝脏he染色代表性图片,比例尺为100μm。图2j为高脂饮食喂养的对照和abko小鼠肝脏甘油三酯定量结果。
图2k为高脂饮食喂养的对照和abko小鼠皮下脂肪组织中巨噬细胞标志物f4/80、cd68和cd11c的mrna表达水平。
图2l左图为高脂饮食喂养的对照和abko小鼠皮下脂肪中巨噬细胞的流式分析代表性图片;右图为流式分析统计结果。
图2m为高脂饮食喂养的对照和abko小鼠皮下脂肪组织中m1型巨噬细胞标志物的mrna表达水平。
图2n-p为高脂饮食喂养的对照和abko小鼠血浆leptin、resistin和pai-1水平。
图3a为对照小鼠和abko小鼠棕色脂肪组织、皮下脂肪组织和内脏脂肪组织的代表性照片。
图3b-c为高脂饮食喂养的对照小鼠和abko小鼠的脂肪组织绝对重量和组织/体重百分比。图3d为高脂饮食喂养的对照小鼠和abko小鼠皮下脂肪组织的he染色代表性图片。
图3e左图为高脂饮食喂养对照小鼠和abko小鼠皮下脂肪组织脂肪细胞直径的分布频率;右图为两组小鼠皮下脂肪组织脂肪细胞直径的箱型图。
图3f为高脂饮食喂养对照小鼠和abko小鼠皮下脂肪组织he染色图片单个视野下的脂肪细胞数目。
图3g左图为高脂饮食喂养对照小鼠和abko小鼠的皮下脂肪组织流式分析pdgfrα+细胞比例结果代表性图片;右图为pdgfrα+细胞在对照小鼠和abko小鼠皮下脂肪svf细胞中的比例统计。
图3h左图为对照小鼠和abko小鼠皮下脂肪组织pdgfrα和brdu染色代表性图片;右图为对照小鼠和abko小鼠皮下脂肪组织中,pdgfrα+brdu+细胞在pdgfrα细胞中的比例统计。
图4a为高脂饮食喂养的对照小鼠和abko小鼠皮下脂肪组织基因表达谱,热图显示两组差异表达基因,倍数变化大于1.5,对应p值小于0.05。
图4b为qpcr验证两组小鼠皮下脂肪组织中saa3表达。
图4c为qpcr检测敲低β-catenin后诱导分化的3t3-l1细胞中saa3表达。
图4d为wnt3a处理诱导分化的3t3-l1细胞16小时,检测saa3表达。
图4e为wnt信号通路抑制剂pkf115处理诱导分化的svf细胞48小时,检测saa3表达。图4f左图为saa3启动子区域潜在tcf4结合位点模式图;右图为在3t3-l1细胞系中转染报告基因质粒,48小时后报告基因检测结果。prl-tk(表达海肾荧光素酶)用作内参。图4g为在3t3-l1细胞中用tcf-4抗体进行染色质免疫共沉淀,通过pcr检测saa3启动子dna片段。
图4h为在3t3-l1细胞中用β-catenin抗体进行染色质免疫共沉淀,通过pcr检测saa3启动子dna片段。
图4i为saa3重组蛋白刺激raw264.7细胞,用上清处理3t3-l1细胞实验设计模式图。
图4j-l为不同浓度saa3重组蛋白刺激raw264.7细胞后,上清中pdgf-aa、mcp-1和cxcl2的浓度。
图4m为不同浓度saa3重组蛋白刺激raw264.7细胞获得的上清进一步处理3t3-l1细胞的活力检测结果。
图4n为不同浓度pdgf-aa重组蛋白处理3t3-l1细胞的活力检测结果。
图4o-p为各组的f4/80表达水平和pdgfrα+细胞比例。
图4q为长期高脂饮食过程中saa3表达水平显著升高。
图4r为saa3表达水平与β-catenin存在显著相关性。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
1.adiponectin-cre;β-cateninflox/flox敲除小鼠繁殖:
将c57bl/6背景的β-cateninflox/flox小鼠与adiponectin-cre小鼠交配,获得adiponectin-cre;β-cateninflox/wt小鼠之后,与β-cateninflox/flox小鼠交配,后代中获得对照小鼠β-cateninflox/flox和敲除小鼠adiponectin-cre;β-cateninflox/flox,即成熟脂肪细胞特异性β-catenin敲除小鼠,记作abko敲除小鼠。后续繁殖过程中用adiponectin-cre;β-cateninflox/flox与β-cateninflox/flox小鼠交配。
小鼠饲养在上海交通大学医学院动物科学部和上海南方模式生物科技股份有限公司的spf级屏障环境中,所有动物在标准小鼠笼中按以下条件饲养:环境温度20-22℃;自由摄食和饮水,标准商业小鼠饲料(4.5%脂肪,4%纤维素,21%蛋白质、1.404kcal/g),高脂饲料购自researchdiet(60%脂肪,20%碳水化合物,20%蛋白质);稳定的12小时昼夜循环。将brdu溶解在pbs中(20mg/ml),随后稀释到小鼠饮水中,终浓度为0.4mg/ml。brdu处理abko高脂小鼠为期一周,包含brdu的饮水每隔一天更换一次,处理结束后取小鼠皮下脂肪组织通过免疫荧光检测brdu标记情况。高脂喂养24周的对照和abko敲除小鼠,在每只小鼠一侧的腹股沟皮下脂肪位置多点注射clodronate脂质体(110mg/kg),同只小鼠另一侧的腹股沟皮下脂肪位置多点注射等量的对照脂质体。首次注射3天后再注射一次,首次注射6天后取小鼠皮下脂肪组织固定在4%多聚甲醛中。
2.成熟脂肪细胞特异性敲除β-catenin能够抵抗高脂饮食诱导的肥胖
为揭示成熟脂肪细胞中β-catenin如何调节脂肪扩张过程,首先利用ap2-cre构建脂肪组织相对特异性β-catenin的敲除小鼠(图1a)。虽然该小鼠体重显著轻于对照小鼠(图1b),但由于ap2-cre在除脂肪组织外的下丘脑、骨和肌肉等组织中存在非特异性表达,也难以排除发育障碍对体重的影响(图1c)。
为了更好的阐明β-catenin对脂肪及肥胖的影响,又利用adiponectin-cre与β-cateninflox/flox小鼠交配构建了脂肪组织特异性敲除小鼠(图1d)。β-catenin在成熟脂肪细胞中得到特异且比较有效的敲除,并没有影响svf细胞中β-catenin的表达(图1e-g)。
abko小鼠在正常饮食情况下没有体重没有显著变化(图1h),但在长期高脂喂养的情况下,abko小鼠表现出体重、脂肪含量低于对照小鼠的肥胖抵抗表型(图1i-k)。
在成熟脂肪细胞中敲除β-catenin可以显著降低小鼠体重和肥胖度,而肥胖是造成糖脂代谢异常的重要风险因素,因此推测在abko小鼠体内因高脂饮食造成的代谢紊乱也能够得到极大改善。葡萄糖耐量实验(图2a-b)表明abko小鼠的葡萄糖耐受性得到显著增强,并且胰岛素耐量实验结果(图2c-d)、血浆胰岛素水平(图2e)和皮下脂肪组织akt磷酸化水平(图2f)都提示abko小鼠的胰岛素敏感性得到显著改善。除此之外,abko小鼠的血浆脂质水平(图2g-h)低于对照小鼠,脂肪肝(图2i-j)也得到缓解。肥胖发生过程伴随脂肪组织巨噬细胞的浸润,并且巨噬细胞是参与脂肪组织扩张和胰岛素抵抗的重要因素。因此检测了皮下脂肪组织中的巨噬细胞标志物f4/80、cd68和cd11c(图2k)、巨噬细胞数量(图2l)以及部分m1型巨噬细胞标志物(图2m),结果表明敲除β-catenin能够显著改善巨噬细胞浸润情况,这可能也是abko小鼠胰岛素敏感性提高的重要原因。伴随肥胖度下降和代谢水平改善也出现了血浆leptin(图2n)、resistin(图2o)和pai-1(图2p)水平的下降,这些结果都表明在成熟脂肪细胞中敲除β-catenin可以显著改善全身代谢平衡。
3.在高脂饮食喂养过程中,成熟脂肪细胞缺失β-catenin会导致脂肪前体细胞、成熟脂肪细胞数目减少
众所周知,脂肪组织扩张是肥胖发生过程中最典型的特征之一,脂肪组织扩张包括细胞肥大(细胞体积变大)和细胞增生(细胞数目变多)两个过程。发现在高脂饮食喂养下,abko表现出体重、脂肪含量显著低于对照小鼠的肥胖抵抗表型,但是组织称重结果进一步显示,abko小鼠的皮下脂肪组织重量显著小于对照小鼠,而内脏脂肪重量和棕色脂肪重量并没有表现出显著差异(图3a-c)。通过对皮下脂肪组织的切片进行he染色并进行观察发现,虽然敲除小鼠的皮下脂肪重量显著小于对照小鼠,但两者脂肪细胞大小并无显著不同(图3d-f)。
在排除了β-catenin参与脂肪细胞肥大过程之后,推测β-catenin可能影响了成熟脂肪细胞的数目。脂肪细胞是一群高度分化无法进行有丝分裂的细胞类型,因此敲除小鼠皮下脂肪细胞数目的减少可能是由于前体脂肪细胞数目的减少所导致。分离了高脂饮食喂养的对照小鼠和敲除小鼠皮下脂肪组织中的脂肪前体细胞(svf)细胞进行流式分析,发现pdgfrα阳性的脂肪前体细胞数目在敲除小鼠中显著减少(图3g),并且pdgfrα细胞群中被brdu标记的细胞也显著少于对照小鼠(图3h),这些结果提示敲除小鼠皮下脂肪组织中脂肪前体细胞数目减少以及增殖能力下降是限制皮下脂肪组织扩张的关键原因。
4.wnt/β-catenin信号途径通过调节saa3表达实现“成熟脂肪细胞-巨噬细胞-脂肪前体细胞”之间对话
在成熟脂肪细胞中敲除β-catenin,并未影响脂肪前体细胞中β-catenin的表达,因此推测成熟脂肪细胞中敲除β-catenin可能导致一些成熟脂肪细胞分泌的脂肪因子表达受到影响,进而影响了脂肪前体细胞的增殖。利用microarray对高脂饮食喂养下对照小鼠和敲除小鼠的皮下脂肪组织转录组进行了检测分析(图4a),在表达发生变化的分泌因子中,发现脂肪因子saa3在敲除小鼠中变化非常显著,这一结果得到了qpcr结果的验证(图4b)。在体外的细胞实验中,也发现在脂肪细胞中抑制或激活经典wnt信号通路可以相应地抑制或激活saa3表达(图4c-e)。之前并未有研究报道经典wnt信号通路对saa3的表达有调控关系,因此首先对saa3的启动子区域进行了分析,发现其启动子区域存在几个潜在的tcf/lef结合位点,因此以小鼠基因组为模板扩增了saa3转录起始位点上下游大约1kb的基因片段将其连接在荧光素酶报告基因pgl4.12载体上,通过双荧光素酶报告基因实验发现过表达β-catenin能够显著增强saa3启动子的活性。为了进一步确定saa3启动子上tcf/lef的结合位点,对6个潜在结合位点(ctttg(a/t)(a/t))进行了点突变和缺失突变,报告基因实验结果表明-84~-90位置的碱基缺失之后,能够显著消除β-catenin诱导的saa3转录活性增强,而其他位点的点突变和缺失突变则不会对β-catenin的作用产生影响(图4f)。为了进一步证实β-catenin/tcf4复合体与saa3启动子的结合,首先分离了白色脂肪组织的前体细胞并诱导其向白色脂肪细胞方向分化,诱导成熟以后,利用成熟的脂肪细胞进行染色质免疫共沉淀实验,结果表明无论是用β-catenin抗体还是tcf4抗体都可以特异性地将saa3转录起始位点上游-84~-90位置的dna片段结合下来(图4g-h),这进一步证实了在成熟脂肪细胞中saa3是经典wnt/β-catenin信号通路的直接靶基因。
在体外实验中首先用重组saa3蛋白刺激巨噬细胞细胞系raw264.7,发现能够显著增强巨噬细胞中多种生长因子和炎症因子的水平(图4i-l),收集saa3处理后的巨噬细胞培养上清,再用上清处理3t3l1细胞,能够比较明显地提高3t3l1细胞的生长速率(图4m),pdgf-aa直接处理也能够显著提高3t3l1细胞的生长速率(图4n),达到与上清处理类似的效果。为了进一步确认皮下脂肪组织中的巨噬细胞是否影响了pdgfrα阳性脂肪前体细胞的维持,在高脂饮食喂养的对照小鼠和敲除小鼠的一侧皮下脂肪注射了clodronate脂质体以清除巨噬细胞,在另一侧皮下脂肪组织注射了等量对照脂质体,结果发现对照小鼠清除一侧的巨噬细胞标志物f4/80表达水平下降到与敲除小鼠对照一侧一致,而敲除小鼠清除一侧的巨噬细胞标志物f4/80表达水平进一步下降(图4o)。重要的是,无论是对照小鼠还是敲除小鼠,巨噬细胞清除侧的pdgfrα阳性脂肪前体细胞比例均显著下降,且变化趋势与巨噬细胞标志物f4/80的表达水平一致(图4p)。这些结果提示敲除小鼠皮下脂肪组织中pdgfrα阳性脂肪前体细胞比例下降可能与巨噬细胞数目减少有关,并且saa3表达下降影响了巨噬细胞的招募和生长因子、炎症因子分泌,这一过程介导了β-catenin敲除对白色脂肪组织扩张的影响。总得来说,这些结果支持了β-catenin在成熟脂肪细胞中的敲除引起saa3表达下降,进而抑制了白色脂肪组织中巨噬细胞浸润,导致前体细胞的增殖能力降低,由此,限制了高脂饮食诱导的脂肪组织扩张(脂肪前体细胞新一轮增殖分化)。除此之外,在高脂饮食喂养过程中,皮下脂肪组织中saa3的表达也得到了强力诱导,并与β-catenin的表达存在正相关关系(图4q-r),这也提示saa3在脂肪组织扩张和肥胖发生中的作用。
5.结论
本实施例表明经典wnt信号下游的核心分子β-catenin在成熟脂肪细胞中发挥重要作用,是调节白色脂肪组织扩张和肥胖发生的关键因子。此外,借助动物模型,发现在高脂饮食诱导的肥胖过程中“成熟白色脂肪细胞”和“非脂肪细胞”之间存在对话(crosstalk):通过wnt/β-catenin/saa3信号途径开启了新一轮的脂肪细胞生成。
本发明证实了β-catenin能够抑制saa3的转录表达,揭示了经典wnt信号通路如何影响成熟脂肪细胞的功能进而影响肥胖发生,或为肥胖治疗提供新的思路。
- 还没有人留言评论。精彩留言会获得点赞!