一种提升梨组培苗大田移栽成活率的方法与流程
本发明涉及微嫁接技术领域,涉及一种提升梨组培苗大田移栽成活率的方法。
背景技术:
组织培养技术也被称为离体培养技术,组织培养就是将植株的器官、组织、细胞分离,接种在培养基中,在人为创造的无菌环境中生长发育成完整植株。将从大田获得的带有嫩芽的梨新梢作为外植体进行消毒,接种在特定培养基中培养,获得无根组培苗,以进行脱毒、转基因等方面的研究,这一技术已经相当成熟。但是,如何将无根的试验材料再从组培环境中高效转移至大田,获得长势良好、稳定的梨苗,这一过程还存在很多问题。目前,普遍使用的方法是,首先在培养基中添加植物激素,促进组培苗底端的根部分化,进而对生根良好的梨苗进行炼苗,最后移栽。研究表明,此方法周期长,生根时间长;由激素催生的根部较弱,且根部长势不一致,与植物体连接不紧密;生根率低;移栽成活率低,移栽后梨苗很难适应大田环境,生长缓慢,抗性差。
技术实现要素:
针对以上技术的不足,本发明提供了一种利用微嫁接技术高效提升梨组培苗大田移栽成活率的方法。
本发明的目的可通过以下技术方案实现:
一种利用微嫁接技术高效提升梨组培苗大田移栽成活率的方法,包含以下步骤:
(1)砧木准备:对消毒后的梨洁净种胚进行培养,长至3~5厘米时选择单根幼苗作为砧木;
(2)接穗准备:选择继代培养20~30天,带有2~3片叶子,茎上无多余分生且叶片舒展的梨组培苗作为接穗;
(3)砧木和接穗处理:砧木处理:将单根砧木幼苗从子叶下方横切,去除子叶及以上部分,保留根部和部分茎段,然后从其顶端纵向劈开约1厘米;接穗处理:将接穗底端削成楔形,与砧木长度尽量保持一致;
(4)微嫁接:将接穗插入砧木劈口中,绑缚锡箔纸并用镊子将四周捏合紧密,将嫁接苗于生根培养基1/2ms+iba0.6mg/l+蔗糖30g/l+琼脂7.0g/lph=5.90~5.95中进行培养14~16天;
(5)炼苗:选择生根良好的嫁接苗,无菌环境中将锡箔纸摘除,闭瓶炼苗7天,忌开瓶炼苗引入杂菌;
(6)移栽:将嫁接苗移栽到灭菌的营养土中,浇透水并在营养钵上方覆盖保鲜膜,戳适量小洞透气,置于植物光照培养箱中培养,一周左右嫁接苗生长稳定后摘除保鲜膜继续培养。
作为本发明的一种优选实施方式,所述的步骤(1)砧木选择野生梨,优选山梨、杜梨和川梨。
作为本发明的一种优选实施方式,步骤(1)砧木准备:取消毒后的梨洁净种胚在ms+30g蔗糖+7.5g琼脂ph=5.80~6.0培养基中进行暗培养,待种子子叶变绿,胚根开始伸长,转移至生长培养基ms+6-ba1.0mg/l+iba0.5mg/l+蔗糖30g+琼脂7.5gph=5.80~6.0中光下培养,长至3~5厘米时选择单根幼苗作为砧木。
作为本发明的一种优选实施方式,步骤(1)中梨洁净种胚通过以下方法获得:选择干净的野生梨种子,于无菌环境中进行消毒,消毒方法:75%无水乙醇消毒1分钟,10%次氯酸钠溶液消毒5分钟,期间反复震荡,充分消毒杀菌,每一步消毒处理后用灭菌蒸馏水冲洗3~5次;在灭过菌的滤纸上,用镊子按住消毒后的种子,将刀从种子上方垂直插入远离胚根的一端,尽量不伤害种胚,后倾斜角度沿种子侧边划开种皮,去除内外种皮,取出种胚,期间应避免伤及胚根。
作为本发明的一种优选实施方式,(2)接穗准备:接穗为在ms+6-ba2.0mg/l+iba0.2mg/l+蔗糖30g/l+琼脂7.5g/lph=5.8~6.0的培养基中继代培养20~30天的梨组培苗,带有2~3片叶子,茎上无多余分生且叶片舒展。
作为本发明的一种优选实施方式,步骤(6):移栽时用清水将嫁接苗根部残留的培养基轻轻涮洗干净,移栽到经过121℃20min高温高压灭菌后的营养土中,移栽后浇透水并在营养钵上方覆盖保鲜膜,戳适量小洞透气,置于植物光照培养箱,光照16h;光强2500lx;温度24℃±1℃中培养,一周左右嫁接苗生长稳定后摘除保鲜膜继续培养。
有益效果:
本发明对砧木和接穗的选择、嫁接方式、嫁接苗的选择和培养、嫁接苗移栽都做了详细考察优化,提供了一套完整的梨微嫁接方法,极大的提升了嫁接的成活率,并且移栽至大田的成活率达到100%。此外,嫁接完成后,嫁接苗只需要在无菌环境中生长14天左右即可移栽。
本发明利用微嫁接技术,在无菌环境中将梨组培苗与实生砧木进行嫁接,由于砧木本身具备生根能力,因此使生根时间大大缩短,并且根部长势旺盛;砧木为野生梨,抗性优良,这就为嫁接苗的大田移栽和移栽后的生长发育提供了保障。本发明提供了一种最适宜梨种子消毒、萌发和生长的方法,通过调节生长素和细胞分裂素的配比,培养出最适宜微嫁接的实生砧木幼苗;本发明还提供了一套以劈接为基础操作的微嫁接方法,以锡箔纸进行绑缚,其中劈接能够使砧木和接穗更大程度的接触贴合,并且对砧穗粗细的一致程度要求较小,锡箔纸可以提供有效支撑,并且保持接口密闭不透光,提供黑暗环境以促进愈伤组织生成,使砧木和接穗快速建立联系;最后通过合理炼苗、移栽得到成活率100%且长势良好的嫁接苗。
附图说明
图1为在无菌环境中培养的适宜作为砧木的梨苗状态。
图2为适宜进行嫁接且底部被削成楔形的接穗。
图3为劈接示意图(上为秋子梨接穗,下为杜梨砧木)
图4为锡箔纸绑缚示意图,即嫁接完成后的状态。
图5为炼苗后移栽至大田初期的处理方法。
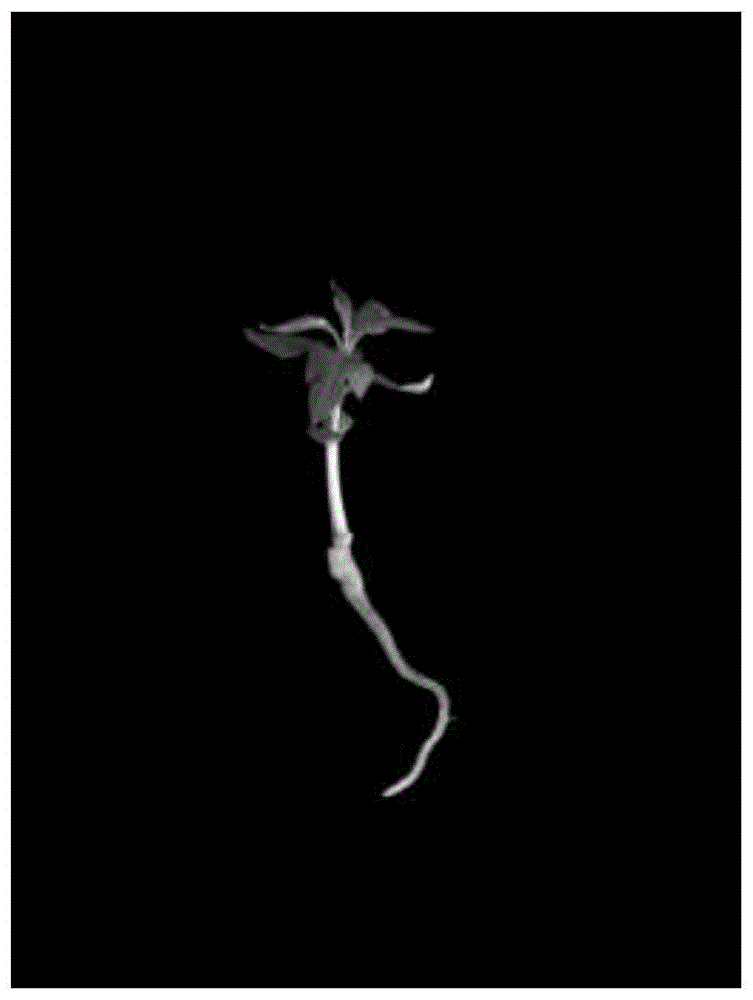
图6为移栽成活(有新叶长出)的嫁接苗生长状态。
具体实施方式
实施例1
步骤1.选择干净的野生梨种子,于无菌环境中进行消毒,消毒方法:75%无水乙醇消毒1分钟,10%次氯酸钠溶液消毒5分钟,期间反复震荡,充分消毒杀菌,每一步消毒处理后用灭菌蒸馏水冲洗3~5次。
步骤2.在灭过菌的滤纸上,用镊子按住消毒后的种子,将刀从种子上方垂直插入远离胚根的一端,尽量不伤害种胚,后倾斜角度沿种子侧边划开种皮,去除内外种皮,期间应避免伤及胚根。
步骤3.取出洁净种胚后在ms+30g蔗糖+7.5g琼脂ph=5.80~6.0培养基中进行暗培养,待种子子叶变绿,胚根开始伸长,转移至生长培养基ms+6-ba1.0mg/l+iba0.5mg/l+蔗糖30g+琼脂7.5gph=5.80~6.0中光下培养,长至3~5厘米时选择单根幼苗作为砧木(图1)。
步骤4.接穗为在ms+6-ba2.0mg/l+iba0.2mg/l+蔗糖30g/l+琼脂7.5g/lph=5.8~6.0的培养基中继代培养20天的梨组培苗,带有2~3片叶子,茎上无多余分生且叶片舒展。
步骤5.砧木处理:选择长至3~5厘米的单根砧木幼苗,从子叶下方横切,去除子叶及以上部分,保留根部和部分茎段,然后从其顶端纵向劈开约1厘米;接穗处理:将接穗底端削成楔形,与砧木长度尽量保持一致(图2);
步骤6.微嫁接:将接穗插入砧木劈口中(图3),绑缚锡箔纸并用镊子将四周捏合紧密,四角折合(图4)。后将嫁接苗于生根培养基1/2ms+iba0.6mg/l+蔗糖30g/l+琼脂7.0g/lph=5.90~5.95中进行培养14天。
步骤7.选择生根良好的嫁接苗,无菌环境中将锡箔纸摘除,闭瓶炼苗7天,忌开瓶炼苗引入杂菌,最后移栽。
步骤8.移栽时用清水将嫁接苗根部残留的培养基轻轻涮洗干净,移栽到经过121℃20min高温高压灭菌后的营养土(蛭石:营养土=1:1)中,注意移栽期间要及时喷水,避免叶片萎蔫。移栽后浇透水并在营养钵上方覆盖保鲜膜,戳适量小洞透气,置于植物光照培养箱(光照16h;光强2500lx;温度24℃±1℃)中培养(图5),期间检查嫁接苗生长状态,翻动土壤或喷洒水,防止环境湿度过大出现沤根现象,或过小出现萎蔫,一周左右嫁接苗生长稳定后摘除保鲜膜继续培养。
移栽后以植株正常生长且长出新叶为标准统计成活率,发现接口愈合紧密,新叶不断生长,根系发达,三次各移栽30棵、20棵、20棵成活率均达到100%。
本发明方法中部分条件优化实验如下:
1.不同消毒方法效果的考察
表1不同消毒方法效果比较
75%的乙醇具有消毒杀菌的作用,但是时间要控制在50到60秒之间,因为无水乙醇易挥发,会使种子脱水,影响种子萌发。10%次氯酸钠也同样具有消毒的作用,随着消毒时间的延长,消毒效果逐渐提高,种子的污染率逐渐降低,5分钟时具有最佳的消毒效果,延长时间至10分钟,种胚开始变黄,胚根尖端变黑,萌发率降低。因此在进行梨种子消毒时,宜采用75%无水乙醇处理1min,10%次氯酸钠处理5min,消毒效果较好。
2.筛选砧木培养基
以杜梨种子为材料,用上述消毒和萌发培养方法进行培养,待其萌发后转移至生长培养基。实践证明,单根且茎段粗长的梨苗更适宜用做砧木进行嫁接,须根旺盛的梨苗在嫁接过程中易被刀镊损伤进而产生大量愈伤组织,影响根部生长,茎段细或短的苗子在劈接过程中不易操作,因此,为了培养出适宜砧木,需在萌发培养基中添加一定量的激素。设置如下:培养基a:ms+iba0.5mg/l;培养基b:ms+iba0.5mg/l+6-ba1.0mg/l;培养基c:ms+iba0.5mg/l+6-ba1.5mg/l。结果如表2所示。
表2
3.筛选最适宜与秋子梨组培苗嫁接的砧木品种
砧木和接穗的亲和性是影响嫁接成活的关键因素,本发明中选择了四个野生梨种,分别是山梨、豆梨、杜梨和川梨。杜梨、山梨和川梨作为砧木时,嫁接成活率较高,其中杜梨嫁接成活率最高,为95.0%,且愈合和生长状况优良,嫁接苗叶片舒展;川梨成活率可达到93.3%,虽然川梨的茎较秋子梨接穗要细,但是配合锡箔纸足以支撑嫁接苗直立生长,并且愈合情况良好;山梨嫁接成活率为90.0%,嫁接过程中,由于山梨幼苗茎较为粗壮,与继代培养的秋子梨接穗茎粗相差较小,吻合程度高,所以操作简便,节省时间,能够更大程度地保证在接穗叶片失水萎蔫之前完成嫁接,但嫁接苗生长缓慢,老叶不断革质化,新叶抽生迟缓;豆梨相对来说成活率较低,仅为31.7%,嫁接后接穗出现枯黄萎蔫,无新叶长出,生长状态较差,这可能是由于豆梨长至适宜嫁接的高度时,茎段底部变红,劈开时明显感觉木质化,而在其未木质化时,植株矮小操作困难。综上所述,与秋子梨进行微嫁接成活率最高且最适宜进行嫁接的砧木为杜梨。表3为不同砧木对嫁接成活率的影响。
表3
4.筛选嫁接苗生根培养基
由于本发明砧木为实生苗,本身具备生根能力,且嫁接时所选择的苗木为单根幼苗,因此嫁接苗的生根难度比组培苗诱导生根大大降低。本发明中,首先以1/2ms为基本培养基,添加不同浓度的iba,发现不添加激素时,嫁接苗生根速度慢且根部弱;在iba浓度为0.6mg/l时嫁接苗生根率最高,达到85.7%,且根部发达;增加iba浓度至1.0mg/l,生根率下降,根部以单根为主,新生侧根短少;以ms为基本培养基,添加0.6mg/l的iba,与基本培养基为1/2ms时相比较,生根率降低,根部生长弱。由此可见,最适宜嫁接苗生根的培养基为:1/2ms+iba0.6mg/l。表4为不同培养基对嫁接苗生根的影响。
表4
5.嫁接完成后光照条件筛选
嫁接完成后,选择合适的培养基进行生根培养,然后给予一定时间长度的暗培养,观察嫁接苗长势。暗培养0天时,嫁接苗生根和生长正常;暗培养10天发现嫁接苗根部生成大量愈伤组织,这可能是因为在嫁接过程中扯伤根部,伤口处在黑暗环境中生成愈伤组织,并且暗培养10天的嫁接苗叶片小而皱缩,这可能与叶片黑暗环境中光合作用受到抑制有关;将暗培养10天的嫁接苗转移至光下继续培养约20天左右,发现从根部大量的愈伤组织中又长出须根。可见,暗培养不会加快嫁接苗的生根,并会对嫁接苗的生长造成不良影响。因此,嫁接完成后光培养即可。
- 还没有人留言评论。精彩留言会获得点赞!