干细胞冻存保护剂、制备方法及应用与流程
本发明涉及医疗领域,特别是涉及一种干细胞冻存保护剂、制备方法及应用。
背景技术:
干细胞具有分化为成脂、成骨以及成软骨等中胚层来源细胞的潜能,同时还能通过旁分泌信号传导机制分泌刺激组织再生的生长因子和细胞因子等生物活性分子,为软组织填充、糖尿病、肝损伤、难愈性创面及自身免疫性疾病提供替代治疗,甚至可以进行同种异体移植治疗,已成为医学界最前沿、最热门的研究领域之一。如能长期保存干细胞,即可很好的解决手术时机的限制并可为以后的临床应用提供具有稳定遗传特性且充足数量的细胞。冷冻保存是长期保存的主要形式,然而冷冻保存的过程中,细胞内冰晶形成等过程会对细胞形成冷冻损伤,对干细胞活性和功能有明显影响。冷冻保护剂的加入可保护细胞免受低温冻存中的冷冻损伤,能更好的保存细胞的生物性能。
目前针对干细胞冻存经典保护剂为10%二甲基亚砜(dmso)+90%胎牛血清(fbs),其中二甲基亚砜在常温下为细胞毒性物质,在临床使用时难以保证其冻存后能够被洗脱到无存留,而胎牛血清含异种抗原,有造成人畜共患病及导致免疫反应等风险,因此两者均可能对患者造成不良影响。其他一些保护剂使用方法复杂或成本高昂,不适于推广和应用。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种干细胞冻存保护剂、制备方法及应用,用于解决现有技术中冻存保护剂毒性高、冻存效果差的问题。
为实现上述目的及其他相关目的,本发明第一方面提供一种干细胞冻存保护剂,以干细胞冻存保护剂总量为基准计,所述干细胞冻存保护剂包含:
甘油体积分数为10%-30%;
海藻糖0.25mol/l-1.5mol/l;
溶剂为生理盐水或磷酸盐缓冲液。
本发明第二方面提供前述干细胞冻存保护剂用于干细胞冻存的用途。
本发明第三方面提供一种干细胞冻存保护剂的制备方法,包括如下步骤:
1)将海藻糖加入到生理盐水或磷酸盐缓冲液中,配制海藻糖溶液;
2)以甘油为溶质,海藻糖溶液为溶剂配成干细胞冻存保护剂。
本发明第四方面提供一种干细胞冻存的方法,包括如下步骤:
1)将前述的干细胞冻存保护剂与干细胞以体积比1:1混合,得到混合物1;
2)将混合物1置于程序降温盒中,于-80摄氏度下程序降温;
3)将步骤2)得到的混合物1置于液氮中冻存,得到冻存的干细胞。
如上所述,本发明的干细胞冻存保护剂、制备方法及应用,具有以下有益效果:
本发明的干细胞冻存保护剂,具有有效低温保存干细胞活性和功能的冷冻保护剂,高效且无毒无异种抗原,具有更高的生物安全性和临床应用可能性;不使用任何高分子聚合物及生物毒性物质,使用试剂均无细胞毒性,并且易洗脱;本发明无任何异种来源的血制品,无异种抗原,发生超敏反应的可能性较低;发明较现有的细胞冻存保护剂成本较低,大剂量应用的可能性大;操作方便,易于推广。
附图说明
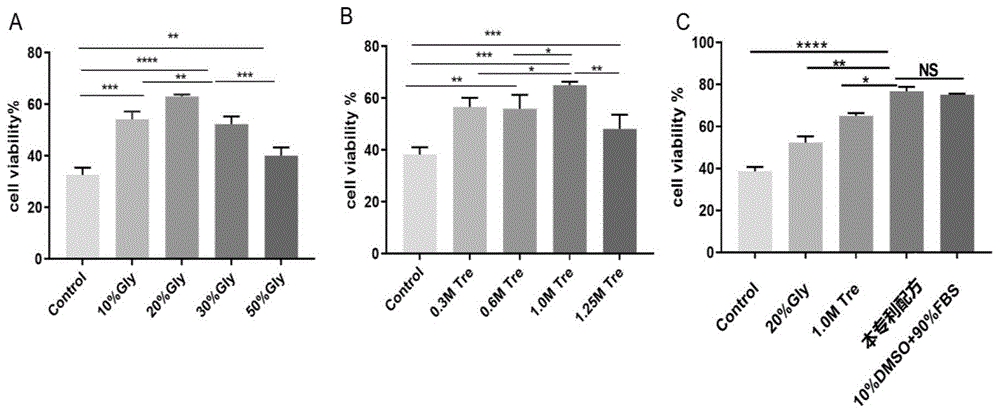
图1:脂肪干细胞在不同冷冻保护剂保护下-196冻存180天后,复苏,通过台盼蓝检测细胞活性。
图2:脂肪干细胞在不同冷冻保护剂保护下-196冻存180天后,复苏,通过cck8检测细胞的增值能力。
图3:脂肪干细胞在不同冷冻保护剂保护下-196冻存180天后,复苏,通过划痕实验检测细胞迁移能力。
图4:脂肪干细胞在不同冷冻保护剂保护下-196冻存180天后,复苏,检测细胞的三向分化能力。
具体实施方式
现有技术中,暂无明确可临床应用的脂肪干细胞冻存保护剂,仅少数低毒性配方在实验方案中使用,如2017年wangc等人使用97%人类血小板裂解物(pl)+3%dmso冻存脂肪干细胞;2018年seahp等人使用9%人血白蛋白/90%人血清/90%无血清培养基+10%dmso冻存脂肪干细胞。
现有的冻存保护剂具有以下缺点:
①冻存剂渗透性不佳,细胞冻存保护效果不佳。
②仍存在生物毒性,如仍旧使用高分子聚合物或dmso,临床应用时无法保证洗脱干净。
③使用胎牛血清等含异种抗原的血制品,可能引发超敏反应。
④使用人血白蛋白等血制品生物制剂,成本较高昂,存在血源性疾病风险。
⑤技术复杂,成本高昂,难以推广,使用如海藻酸钠等纳米材料包裹细胞。
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。
本发明一实施例为干细胞冻存保护剂,以干细胞冻存保护剂总量为基准计,所述干细胞冻存保护剂包含:
甘油体积分数为10%-30%;
海藻糖0.25mol/l-1.5mol/l
溶剂为生理盐水或磷酸盐缓冲液。
通过两类具有不同作用的保护剂联合使用可通过以下2方面提高细胞保护效率:(1)利用渗透性保护剂(甘油)促进非渗透性保护剂(海藻糖)转移进入细胞,提高非渗透性保护剂作用效率;(2)渗透性保护剂和非渗透性保护剂作用互补。
可选的,所述干细胞冻存保护剂中,甘油的体积分数可以为10%-15%,15%-20%,20%-25%,25%-30%。
可选的,所述干细胞冻存保护剂中,海藻糖的浓度可以为0.25mol/l-0.35mol/l,0.35mol/l-0.45mol/l,0.45mol/l-0.55mol/l,0.55mol/l-0.65mol/l,0.65mol/l-0.75mol/l,0.75mol/l-0.85mol/l,0.85mol/l-0.95mol/l,0.95mol/l-1.0mol/l,1.0mol/l-1.1mol/l,1.1mol/l-1.2mol/l,1.2mol/l-1.3mol/l,1.3mol/l-1.4mol/l,1.4mol/l-1.5mol/l。
生理盐水为浓度0.9%的氯化钠溶液。
所述磷酸盐缓冲液为本领域常规的缓冲液配方。
所述磷酸盐缓冲液的配方或者组分选择时,能够满足不会对干细胞渗透压等参数产生影响的磷酸盐缓冲液均可。例如在一种实施方式中,以磷酸缓冲液的总量为标准计,磷酸盐缓冲液组分为磷酸二氢钾1.4-2.0mmol/l,磷酸氢二钠3.5-10mmol/l,氯化钠137mmol/l,氯化钾2.7mmol/l。
进一步的,所述干细胞冻存保护剂不包含生物毒性物质、高分子聚合物、异种抗原或异种来源的血制品。
所述生物毒性物质可以为二甲基亚砜(dmso)。
所述高分子聚合物可以为海藻酸钠、葡聚糖、壳聚糖或聚乙烯吡咯烷酮等。
所述异种抗原可以为胎牛血清。
所述异种来源的血制品可以为牛血白蛋白(bsa)或血小板裂解物等。
进一步的,所述干细胞冻存保护剂能使干细胞在-196℃条件下能稳定存储至少180天。
在一种实施方式中,所述干细胞选自脂肪干细胞。
前述的干细胞冻存保护剂可以用于干细胞冻存。
进一步的,所述干细胞冻存保护剂可以用于低温保存干细胞活性和功能。其功能可以为细胞的迁移能力以及多向分化能力。
本发明一实施例提供的干细胞冻存保护剂的制备方法,包括如下步骤:
1)将海藻糖加入到生理盐水或磷酸盐缓冲液中,配制海藻糖溶液;
2)以甘油为溶质,海藻糖溶液为溶剂配成干细胞冻存保护剂。
以干细胞冻存保护剂总量为基准计,干细胞冻存保护剂中,海藻糖的所述浓度为0.25mol/l-1.5mol/l。
进一步的,步骤1)还包括对得到的海藻糖溶液进行高压蒸汽灭菌。
生理盐水为浓度0.9%的氯化钠溶液。
以磷酸缓冲液的总量为标准计,磷酸盐缓冲液组分为磷酸二氢钾1.8mmol/l,磷酸氢二钠10mmol/l,氯化钠137mmol/l,氯化钾2.7mmol/l。
以干细胞冻存保护剂总量为基准计,干细胞冻存保护剂中,所述干细胞冻存保护剂含有体积分数为10%-30%的甘油。
进一步的,步骤2)在无菌条件下进行。
所述甘油为医用无菌甘油。
本发明一实施例提供的干细胞冻存的方法,包括如下步骤:
1)将前述干细胞冻存保护剂与干细胞以体积比1:1混合,得到混合物1;
2)将混合物1置于程序降温盒中,于-80摄氏度下程序降温;
3)将步骤2)得到的混合物1置于液氮中冻存,得到冻存的干细胞。
可选的,所述干细胞为脂肪干细胞。
进一步的,步骤1)中还包括对混合物1进行密封。
步骤2)中,程序降温时间至少为12个小时。
本发明所述的干细胞冻存的方法均不涉及诊断和治疗目的。可以为保健目的,或者为基础研究目的。
实施例1
按以下配方配制干细胞冻存保护剂:
甘油体积分数为20%;
海藻糖1.0mol/l;
溶剂为生理盐水。
实施例2
按以下配方配制干细胞冻存保护剂:
甘油体积分数为10%;
海藻糖0.3mol/l;
溶剂为生理盐水。
实施例3
按以下配方配制干细胞冻存保护剂:
甘油体积分数为15%;
海藻糖0.6mol/l;
溶剂为磷酸盐缓冲液(磷酸二氢钾2.0mmol/l,磷酸氢二钠10mmol/l,氯化钠137mmol/l,氯化钾2.7mmol/l)。
实施例4
按以下配方配制干细胞冻存保护剂:
甘油体积分数为25%;
海藻糖1.2mol/l;
溶剂为生理盐水。
实施例5
按以下配方配制干细胞冻存保护剂:
甘油体积分数为30%;
海藻糖1.5mol/l;
溶剂为生理盐水。
实施例6
按以下配方配制干细胞冻存保护剂:
甘油体积分数为20%;
海藻糖0.25mol/l;
溶剂为磷酸盐缓冲液(磷酸二氢钾1.4mmol/l,磷酸氢二钠3.5mmol/l,氯化钠137mmol/l,氯化钾2.7mmol/l)。
实施例7
1.抽脂,在无菌条件下,将脂肪通过酶消化法消化成svf,在细胞培养箱培养至p3代,使用胰酶消化融合至90%的p3代脂肪干细胞,将消化后的脂肪干细胞(1×106个/ml)分别与(1)实施例1的保护剂(本专利配方),(2)10%、20%、30%、40%、50%的甘油(gly);(3)0.3mol/l、0.6mol/l、1.0mol/l、1.25mol/l海藻糖(tre)(4)10%dmso+90%fbs(经典保护剂);按体积比1:1混匀,以加入等量的生理盐水作为对照,将混匀后的冻存管上下颠倒后混匀。
2.将混匀后的冻存管放入程序降温盒,并放入-80℃冰箱,降温12小时后,转移至-196℃液氮中。
3.180天后,将冻存管从液氮中取出,并放置入37℃水浴中,2分钟复温。
4.将本冻存管转移至无菌条件下,将内容混合物置于无菌离心管中,先使用9%高渗氯化钠溶液洗脱一次混合物,以1500rpm,离心5分钟,弃上清,得到下层沉淀。再用0.9%氯化钠溶液洗脱一次,以1500rpm,离心5分钟,弃上清,得到下层沉淀。
5.将经过洗脱的下层脂肪干细胞通过台盼蓝染色法、cck8检测细胞活性,通过划痕实验检测细胞迁移能力。
结果表明,20%gly组冻存脂肪干细胞180天后,细胞活性显著高于10%gly,30%gly及50%gly组(图1a),1.0mtre组冻存脂肪干细胞180天后,细胞活性显著高于0.3mtre,0.6mtre及1.25mtre组(图1b),本专利配方组冻存脂肪干细胞180天后,细胞活性显著高于单独使用20%gly组及1.0mtre组,且与经典保护剂组(10%dmso+90%fbs)无显著性差异(图1c)。如图1可以看出,采用其他比例如50%的甘油(图1a)以及1.25mol/l海藻糖(图1b)冻存保护剂相比,本发明所述的细胞冻存保护剂对细胞保存的良好(图1c),本发明所述的细胞冻存保护剂(图1c)细胞活性与经典保护剂一致,无潜在生物毒性。
如图2所示,本专利配方组冻存脂肪干细胞180天后,细胞增值能力显著高于单独使用20%gly组及1.0mtre组,且与经典保护剂组无显著性差异。如图3所示,本专利配方组冻存脂肪干细胞180天后,细胞迁移能力显著高于经典保护剂组,且与新鲜细胞无显著性差异。如图4所示,本专利配方组冻存脂肪干细胞180天后,细胞仍具有分化成脂、成骨以及成软骨能力,且与经典保护剂组及新鲜细胞无显著性差异。
图2,3,4的结果表明,复苏后细胞具有较高的增值能力以及与新鲜细胞相比具有相似的迁移能力以及多向分化能力,说明本发明所述的细胞冻存保护剂对细胞功能的保持有更好的作用。
本发明还利用实施例2-6中的干细胞冻存保护剂进行了经过细胞实验验证,结果据表明在应用本发明进行细胞冻存后,本发明所述的细胞冻存保护剂对细胞保存的良好,细胞活性与经典保护剂一致,无潜在生物毒性;复苏后细胞具有较高的增值能力以及与新鲜细胞相比具有相似的迁移能力以及多向分化能力,说明本发明所述的细胞冻存保护剂对细胞功能的保持有更好的作用。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!