一种明叶藓多倍体的培育方法与流程
1.本发明涉及多倍体诱导技术领域,具体涉及一种明叶藓多倍体的培育方法。
背景技术:
2.苔藓植物种类繁多,全世界约有23000种苔藓植物,包括15000种藓类,8000种苔类,100种角苔类。苔藓植物大多个体微小,其长度仅数毫米至数厘米,最大者可达100厘米,结构较为简单。苔藓植物形态各异,有的苔藓密集群生呈垫状,有的苔藓匍匐生长交织成片,有的苔藓直立生长挺立如树,利用苔藓的特性结合其他园林园艺技术进行造景,能够创造出古意盎然,富有自然美的苔藓景观。此外,苔藓适应性较强,不易产生病虫害,并且苔藓大多青翠常绿,长势一致,生长整齐且无需修剪,造景后的景观能保持较长时间。苔藓微景观、苔藓球、苔藓墙、庭院苔藓小景等这些苔藓景观因其独特的魅力吸引了大量消费者的目光,苔藓作为一种新兴的园艺植物受到越来越多消费者的青睐与追捧。由于苔藓植物具有较高的观赏价值,但目前苔藓市场上缺少良好的苔藓品种,并且缺乏完善的种植体系,在经济利益的驱使下,大量野生苔藓被直接采挖贩卖。野生苔藓被过度利用,这使苔藓植物生存与苔藓植物资源的可持续利用受到严重威胁。为保护野生苔藓种质资源多样性及促进苔藓产业健康快速发展,筛选适合大规模人工种植的苔藓并选育苔藓新品种迫在眉睫。
3.明叶藓(vesicularia montagnei(bel.)broth.)属灰藓目灰藓科明叶藓属明叶藓种。明叶藓植物体中等大,亮绿色或暗绿色,茎匍匐交织丛生,并且还具有沉水生长或依附沉木、石块生长的特性。明叶藓因叶片像圣诞树的分枝而得商品名为圣诞莫斯(christmas moss),明叶藓是目前苔藓市场上的主用苔藓之一,常作为水陆缸中底床植被材料,或被种植在苔藓墙的“山石”、“平原”、“瀑布”等周围,作为主景或点缀。
4.基因组多倍化是物种进化的重要因子,多倍化现象普遍存在于物种进化过程中,多倍化提高了物种的遗传多样性,有利于增强了后代的竞争能力。多倍体育种应用广泛并且成效显著,是植物遗传育种的重要途径。多倍体育种有人工诱导染色体组加倍和选择染色体自然加倍的突变体这两种途径,但是染色体自然加倍的频率较低,在自然群体中选育出多倍体的概率较低,远不能满足育种的需求,而人工诱变具有高效、快速的优点,所以现有的多倍体育种大多采用人工诱导染色体加倍的方法。目前,该方法尚未应用于苔藓植物中。
技术实现要素:
5.本发明的目的在于提供一种明叶藓多倍体的培育方法。本发明操作简单,能够降低嵌合体发生率,育种时间短,所得到的多倍体遗传稳定。
6.本发明提供了一种明叶藓多倍体的培育方法,包括下述步骤:
7.(1)使用秋水仙素溶液对明叶藓原丝体进行浸泡处理,得到诱变后的明叶藓原丝体;
8.(2)将步骤(1)得到的诱变后的明叶藓原丝体连续继代3次,得到继代后的原丝体;
9.(3)对步骤(2)得到的继代后的原丝体分化出的配子体进行倍性鉴定,鉴定得到基因组加倍的突变体;
10.(4)对步骤(3)得到的基因组加倍的突变体进行5次继代,筛选出基因组加倍且稳定遗传的突变体;
11.(5)观察步骤(4)得到的基因组加倍且稳定遗传的突变体的表型,筛选具有全新表型的明叶藓突变体作为明叶藓新品系。
12.优选的是,步骤(1)所述明叶藓原丝体为生长旺盛的幼嫩的明叶藓原丝体;所述明叶藓原丝体的制备方法包括以下步骤:选取生长健壮的成熟明叶藓孢蒴消毒后进行孢子萌发,获得的无菌原丝体培养7d后连续继代培养2次,得到生长旺盛的幼嫩的明叶藓原丝体。
13.优选的是,步骤(1)所述浸泡处理在避光,转速为60r/min的条件下进行。
14.优选的是,步骤(2)所述连续继代的过程中,还包括分离去除嵌合体的过程。
15.优选的是,步骤(2)所述连续继代为每隔7d打磨继代一次。
16.优选的是,所述打磨继代的方法包括以下步骤:将新长出的原丝体与水混合,打磨粉碎原丝体,得到明叶藓悬浮液,将明叶藓悬浮液接种后进行培养。
17.优选的是,所述步骤(3)中,继代后的原丝体分化出的配子体长度为0.5~1cm时,进行倍性鉴定。
18.优选的是,步骤(3)所述倍性鉴定采用流式细胞术进行,以野生型明叶藓作为对照,g0/g1期细胞荧光强度为野生型明叶藓的2倍判定为基因组加倍的突变体。
19.优选的是,步骤1)所述诱变的处理后,对诱变后的明叶藓原丝体进行培养的条件包括以下步骤:黑暗条件下培养2d后进行正常培养,所述正常培养的光周期为16h光照8h黑暗,光照的强度为60~80μmol photons m
‑2s
‑1。
20.优选的是,所述培养的温度为25℃。
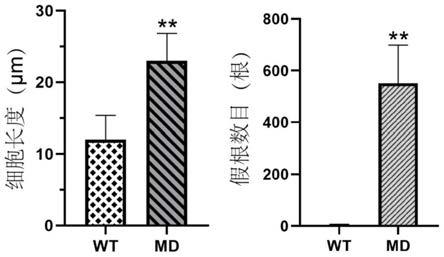
21.本发明提供了一种明叶藓多倍体的培育方法。本发明所述方法可操作性强,育种时间短,且多倍体基因组稳定。通过本发明方法所获基因组加倍突变体具有良好的生物学性状,能够为苔藓产业的发展提供新的优良种质资源。试验结果表明,本发明提供了一种快速培育苔藓植物明叶藓新品种的方法,将多倍体育种首次应用于苔藓这种新兴园艺观赏植物的遗传育种中,结合明叶藓的组织培养技术,在实验室中7个月就能获得稳定遗传的纯合多倍体新品种,极大的缩短育种时间,提高了育种效率。相比于野生型明叶藓,所获得的多倍体细胞长度、宽度及长宽比均显著增大,假根数目显著增多,并且,突变体生长发育正常,能正常完成生活史。
附图说明
22.图1为本发明提供的野生型明叶藓的流式细胞术直方图;
23.图2为本发明提供的基因组加倍明叶藓的流式细胞术直方图;
24.图3为本发明提供的嵌合体明叶藓的流式细胞术直方图;
25.图4为本发明提供的野生型明叶藓和多倍体的对比图;
26.图5为本发明提供的基因组加倍明叶藓表型变化图。
photons m
‑2s
‑1,温度为25℃。
36.得到诱变后的明叶藓原丝体后,本发明将诱变后的明叶藓原丝体连续继代3次,尽量分离嵌合体,得到继代后的原丝体。在本发明中,所述连续继代优选为每隔7d打磨继代一次。在本发明中,所述打磨继代的方法优选包括以下步骤:将新长出的原丝体与水混合,打磨粉碎原丝体,得到明叶藓悬浮液,将明叶藓悬浮液接种后进行培养。本发明对所述打磨的方法没有特殊限定,采用常规打磨方法即可,如使用匀浆仪进行打磨。在本发明中,所述打磨的参数优选为15s/次,5次/材料。打磨后,本发明优选将粉碎后的原丝体接种至新的培养基中进行培养,所述培养优选在光照培养箱中进行正常培养。本发明通过连续打磨继代3次来分离嵌合体,减少嵌合体,获得同质多倍体。
37.得到继代后的原丝体后,本发明对继代后的原丝体分化出的配子体进行倍性鉴定,鉴定得到基因组加倍的突变体。本发明优选挑取第3次继代得到的原丝体进行单簇培养。在本发明中,继代(第3次继代)后的原丝体生长2个月分化出的配子体长度为0.5~1cm时,优选进行取样进行倍性鉴定。在本发明中,所述倍性鉴定优选采用流式细胞术进行,以野生型明叶藓作为对照,g0/g1期细胞荧光强度为野生型明叶藓的2倍判定为基因组加倍的突变体。本发明将流式细胞术应用于明叶藓秋水仙素诱变后代的倍性鉴定,少量样品即可满足制样需求,操作简单,鉴定结果准确、稳定可靠,并且可以实现样品的批量、快速检测。
38.得到基因组加倍的突变体后,本发明对基因组加倍的突变体进行5次继代,筛选出基因组加倍且稳定遗传的突变体。本发明优选每隔7d进行一次继代,共进行5次,淘汰基因组不完全加倍的非整倍体,获得稳定遗传的多倍体。
39.得到基因组加倍且稳定遗传的突变体后,本发明观察基因组加倍且稳定遗传的突变体的表型,筛选具有全新表型的明叶藓突变体作为明叶藓新品系,优选筛选假根增多,细胞变大的表型。具体的,在本发明实施例中,优选筛选细胞显著增大,并且假根数目显著增强的明叶藓品种。
40.下面结合具体实施例对本发明所述的一种明叶藓多倍体的培育方法做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
41.实施例1
42.(1)选取生长健壮的明叶藓孢蒴进行组织培养获得的无菌原丝体,原丝体培养7d后将所获原丝体连续继代培养1次。继代培养步骤为:将生长于培养基表面的明叶藓原丝体用无菌勺子刮取约0.1g,混合10ml无菌水,用匀浆仪打磨粉碎制成苔藓悬浮液,打磨参数为10s/次,10次/材料,将苔藓悬浮液接种到新培养基上培养,悬浮液中的原丝体碎片再生出原丝体。
43.(2)秋水仙素母液的配制步骤为:用分析天平准确称取1g秋水仙素,将秋水仙素置于无菌的蓝盖试剂瓶中,加入100μl的二甲基亚砜(dimethyl sulfoxide,dmso)助溶,加入100ml无菌蒸馏水,搅拌溶解使秋水仙素充分溶解于蒸馏水中,配制好的秋水仙素溶液用0.22μm的滤菌器过滤除菌,4℃避光保存。
44.(3)对明叶藓原丝体进行浸泡诱导,其具体步骤为:将培养基表面的明叶藓原丝体用勺子刮取汇集后分别浸入装有10ml不同浓度(0%、0.1%)秋水仙素溶液的无菌离心管中(0%是没有秋水仙素的对照),将离心管避光置于60r/min的摇床上处理6h,处理结束后倒出秋水仙素溶液,用无菌水将原丝体冲洗5遍。完全去除秋水仙素后用匀浆仪将原丝体粉
碎,打磨参数为10s/次,10次/材料。粉碎后原丝体的长度大约为10μm,然后将苔藓混悬液接种于培养基上。将培养皿置于黑暗条件下培养两天,再转移到光照培养箱中进行正常培养。
45.(4)诱变后的材料每隔7天打磨继代一次,具体步骤为:用无菌镊子刮取培养皿上新长出的原丝体,将原丝体混合10ml无菌水,用匀浆仪打磨粉碎原丝体,打磨参数为15s/次,5次/材料,将原丝体制成苔藓悬浮液。然后,将粉碎后的苔藓悬浮液接种到培养基上培养,接种后的培养皿放置在光照培养箱中进行培养。连续打磨继代3次来分离嵌合体,获得同质多倍体。
46.(5)诱变后的明叶藓原丝体分化出配子体后,采用流式细胞术对配子体进行倍性检测,并以此确定并选取明叶藓多倍体。野生型明叶藓的流式细胞术直方图如图1,基因组加倍明叶藓g0/g1期细胞的荧光强度为野生型明叶藓的2倍,其直方图如图2,嵌合体的直方图中同时出现3个峰(如图3),根据流式细胞术的结果去除嵌合体,保留非嵌合体多倍体;
47.(6)筛选出的基因组加倍明叶藓每隔7d连续进行5次继代,淘汰基因组不完全加倍的非整倍体,获得稳定遗传的多倍体;
48.(7)观察并记录步骤6)中多倍体的表型变化;获得细胞显著增大,并且假根数目显著增强的明叶藓新品种md(见图4);
49.(8)培养温度为25℃,光强为60~80μmol photons m
‑2s
‑1,光周期为16h光照8h黑暗。
50.明叶藓孢子接种后1周萌发后得到初代无菌原丝体,初代原丝体每隔1周连续进行2次打磨继代,即3周可获得可供诱变的生长旺盛的原丝体。原丝体浸泡诱变后,用匀浆仪打磨粉碎后接种培养基上培养1周,再进行连续3次打磨继代,即分离诱变后的原丝体需要4周。诱变后的原丝体生长2个月分化出配子体时,取样用流式细胞术进行倍性鉴定。对于基因组加倍的材料每隔1周进行连续5次打磨继代,第五次继代后再次通过流式细胞术对倍性进行检测,即鉴定倍性稳定性需要5周。对倍性稳定的材料进行2个月的培养,使其分化成配子体。综上所述,通过对明叶藓的原丝体进行诱变,7个月即可获得基因组加倍且稳定遗传的突变体。
51.由上述内容可知,本发明以无菌组织培养的明叶藓原丝体为材料,利用秋水仙素溶液浸泡明叶藓原丝体的方式诱导多倍体,通过流式细胞术对长期多次继代培养的突变体进行鉴定,筛选获得细胞显著增大、假根数目显著增多的多倍体(见图4、图5)。本发明获得的明叶藓多倍体植株,更适用于立体绿化及具有复杂图案的园林园艺造景,对苔藓植物的新品种培育具有重要的指导意义。
52.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1