细菌性3-植酸酶用于饲料产品或食品的用途的制作方法
本发明涉及细菌性3-植酸酶在饲料产品或食品生产中的用途。此外,本发明涉及细菌性3-植酸酶用于饲喂动物和用于生产食品或饲料添加剂的用途。
背景技术:
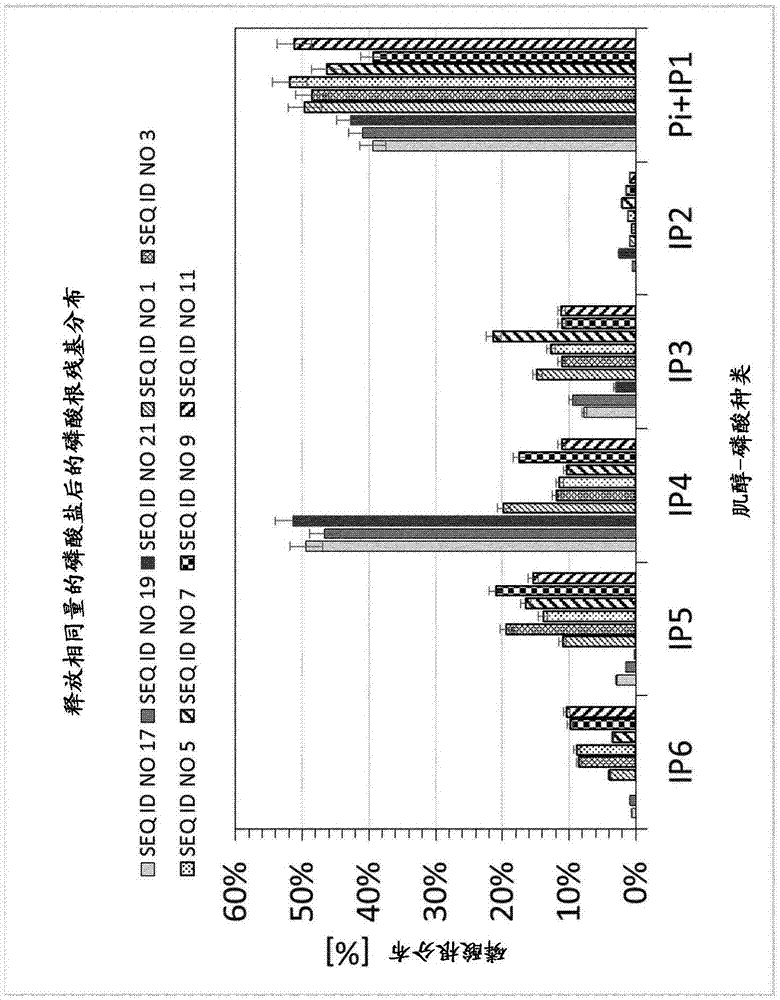
:植酸酶是可从有机磷酸化合物如肌醇六膦酸中除去磷酸根的酶。许多类型的植酸酶是本领域已知的,并且它们中的一些已经用作动物饲料产品的添加剂,以改善天然存在于动物饲料如玉米、小麦和大豆中的肌醇六膦酸的代谢和利用。植酸酶的分类首先取决于从肌醇六膦酸分子中裂解磷酸根的起始位置。3-植酸酶从肌醇六膦酸分子的3位磷酸根开始。6-植酸酶从位置6的磷酸根开始。根据植酸酶的类型,还可以在其他位置发生裂解。向动物饲料中添加植酸酶可以更好地代谢饲料中的天然肌醇六膦酸含量,因为磷酸盐是动物饮食中的重要元素,而且会导致动物排泄物中残余磷的减少。动物排泄物中的高磷含量通常导致其作为粪肥使用的严重限制,因为许多国家设定了严格的限制。为了克服天然肌醇六膦酸的代谢不足和饲料的昂贵的人工磷富集的这些缺点,已知这些缺点特别增加了粪肥中剩余的磷含量,已经在动物饲料产品中引入植酸酶以增加动物胃和消化道中的肌醇六膦酸代谢。目前可商购的此类植酸酶的实例源自大肠杆菌、布氏柠檬酸杆菌、布丘氏菌属和黑曲霉。这些植酸酶产物中的每一种至少在比活性、剂量要求、反应时间和抑制中间体化合物的积累方面具有局限性。首先,它的产品含有真菌性3-植酸酶,其需要高酶量才能达到理想的效果。目前可获得的商业饲料产品试图通过使用细菌来源的6-植酸酶来克服这种影响。然而,这些6-植酸酶的严重缺点是中间体化合物肌醇-四磷酸的积累,其严重限制了有效的肌醇六膦酸代谢。此外,肌醇六膦酸及其中间体,特别是肌醇-四磷酸,与二价离子如ca2+、zn2+和mg2+形成络合物。此外,本领域已知的许多植酸酶产品需要使用大量的植酸酶以保证足够的磷酸盐释放,因为饲料在动物胃中的实际临界保留时间最多为1.5小时。因此,在现有技术中需要提供更高效的方法来改善饲喂动物时的肌醇六膦酸代谢。现在,本发明的发明人惊奇地发现,通过使用细菌性3-植酸酶可以弥补这种需要。技术实现要素:在第一方面,本发明因此涉及至少一种细菌性3-植酸酶用于生产饲料产品或食品的用途。在第二方面,本发明涉及至少一种细菌性3-植酸酶用于饲喂动物的用途。并且在最后一个方面,本方面涉及至少一种细菌性3-植酸酶用于生产食品或饲料添加剂的用途。在本申请中,术语“3-植酸酶”应理解为属于ec3.1.3.8类别的任何植酸酶,并且也称为:1-植酸酶、肌醇-己糖磷酸3-磷酸水解酶、肌醇六膦酸1-磷酸酶或肌醇六膦酸3-磷酸酶。本申请中的术语“细菌性植酸酶”应理解为包含细菌来源的任何植酸酶。“细菌来源”涉及任何经修饰或未经修饰形式的植酸酶,例如从任何种类的细菌基因组分离的所谓野生型植酸酶,但也涉及经修饰的植酸酶,例如经遗传修饰或基因工程化或突变形式的植酸酶。根据本发明,特别优选来自迪基氏菌属和沙雷氏菌属的植酸酶,其中来自迪基氏菌(dickeyasp.)、沙雷氏菌(serratiasp.)、玉米迪基氏菌(dickeyazeae)、菊迪基氏菌(dickeyachrysanthemi)、达旦提迪基氏菌(dickeyadadantii)、茄迪基氏菌(dickeyasolani)或香蕉迪基氏菌(dickeyaparadisiaca)的植酸酶是最优选的。在特别优选的实施方案中,使用植酸酶,其特征在于在使用0.2u/ml的酶剂量在37℃和ph5.5的2.7mmol/l肌醇六膦酸的测定中,在35%无机磷酸盐释放后中间产物肌醇-四磷酸的积累少于25%(重量/重量游离磷酸盐)。这种植酸酶是特别有利的,因为中间产物肌醇-四磷酸的积累阻碍了动物胃内饲料的相关剩余时间内肌醇六膦酸的完全磷酸盐释放。此外,中间体肌醇-四磷酸的积累阻碍了二价离子的利用。通常用于动物饲料产品的植酸酶积累了大量的这种中间产物,在饲料物质离开动物的胃进一步消化之前阻止了完全的磷释放。通过实施0.2u/ml的极低酶剂量,进一步实现中间产物肌醇-四磷酸的小于25%(重量/重量)的积累。因此,出于经济原因,这种植酸酶也是非常有利的。特别优选使用植酸酶,其特征在于在使用0.2u/ml的酶剂量在37℃和ph5.5的2.7mmol/l肌醇六膦酸的测定中,在35%无机磷酸盐释放后中间产物肌醇-四磷酸的积累小于20%(重量/重量游离磷酸盐)或小于15%(重量/重量游离磷酸盐),最优选小于10%(重量/重量游离磷酸盐)。在另一个实施方案中,使用植酸酶,其特征在于使用0.21μg/ml的酶浓度1小时后在ph5.5下从2.7mmol/l肌醇六膦酸中释放至少15%的磷酸盐。优选使用这些植酸酶,因为饲料在动物胃内的保留时间通常约为1小时。因此,优选在1小时的时间范围内释放大部分磷的植酸酶。在胃保留时间内可释放的磷酸盐越多,在饲料产品中可使用的植酸酶就越少。这将进一步有助于经济优势。因此特别优选使用植酸酶,其特征在于使用0.21μg/ml的酶浓度1小时后在ph5.5下从2.7mmol/l肌醇六膦酸释放至少20%、甚至更优选至少25%、还特别优选至少30%、或至少35%以及至少40%或至少45%、最优选至少50%的磷酸盐。由于在动物胃中消化期间的温度变化很大,在特别优选的实施方案中使用温度最佳为37-42℃的植酸酶,其中特别优选35-45℃的温度和最优选30-50℃的温度。在本发明的植酸酶用于饲喂鱼的情况下,使用温度最佳为1-45℃、优选15-35℃的植酸酶。由于一次消耗的各饲料比,动物胃内的ph变化很大,在特别优选的实施方案中使用植酸酶,其显示最佳ph范围为3.5至4.5,更优选ph3.0至5.0,最优选ph2.5至5.5。另一个特别优选的范围是ph5.0至5.5。在另一个特别优选的实施方案中,使用与seqidno1具有至少70%的序列同一性,优选与seqidno1具有至少75%的同一性,进一步优选与seqidno1具有至少80%的同一性,特别优选与seqidno1具有至少85%同一性,还优选与seqidno1具有至少90%同一性,并且特别优选与seqidno1具有至少95%同一性,最优选与seqidno1具有至少99%同一性的细菌性3-植酸酶。特别优选的细菌性3-植酸酶是seqidno3、seqidno5、seqidno7、seqidno9、seqidno11、seqidno13和seqidno15。本申请中使用的术语“饲料”产品涉及本领域技术人员已知的适合饲喂任何种类动物,优选哺乳动物和鸟类,例如但不限于反刍动物、猪、鹿、家禽,但也包括鱼类或其他通常被称为海鲜的水生动物的任何产品。特别优选的是用于非反刍动物的饲料产品,非反刍动物例如家禽、肉鸡、鸟类、鸡、火鸡、鸭、鹅和飞禽;反刍动物,例如奶牛、牛、马和羊;猪、生猪、仔猪、生长猪和母猪;宠物,包括但不限于:猫、狗、啮齿动物和兔子;鱼类,包括但不限于鲑鱼、鳟鱼、罗非鱼、鲶鱼和鲤鱼;和甲壳类动物,包括但不限于小虾和对虾。本申请中使用的术语“食品”产品涉及本领域技术人员已知的适合人类消费的任何产品。本发明的饲料产品或食品优选含有淀粉。含淀粉的饲料组分通常包括植物材料,例如谷物,例如玉米(玉米)、小麦、大麦、黑麦、大米、高粱和小米中的一种或多种,和/或块茎作物,例如马铃薯、木薯和甘薯。可以研磨植物材料,例如湿磨或干磨的谷物,或蒸馏干燥的谷物固体。本发明的饲料产品或食品优选含有富含蛋白质的饲料成分,例如大豆(优选大豆粉)、油菜籽、棕榈仁、棉籽和向日葵。在进一步的实施方案中,饲料产品或食品包含至少一种选自维生素、矿物质、有机酸、益生菌成分、油、脂肪、色素、生长因子和抗菌剂的化合物。在另一个实施方案中,饲料产品或食品除细菌性3-植酸酶外还包含至少一种或多种酶,特别是改善饲料消化率的饲料酶,例如,另一种植酸酶、淀粉酶或蛋白酶、氨肽酶、糖酶、羧肽酶、过氧化氢酶、纤维素酶、几丁质酶、角质酶、环糊精糖基转移酶、脱氧核糖核酸酶、酯酶、α-半乳糖苷酶、β-半乳糖苷酶、葡糖淀粉酶、α-葡萄糖苷酶、β-葡萄糖苷酶、卤过氧化物酶、转化酶、漆酶、脂肪酶、甘露糖苷酶、氧化酶、果胶分解酶、肽-谷氨酰胺酶、过氧化物酶、多酚氧化酶、蛋白水解酶、核糖核酸酶、转谷氨酰胺酶或木聚糖酶。饲料酶可以来自微生物,例如细菌或真菌,或来自植物或动物。在另一个优选的实施方案中,饲料产品或食品是颗粒状、压实状、挤出物或液体形式。本发明的另一方面涉及细菌性3-植酸酶用于饲喂动物的用途。因此,细菌性3-植酸酶不掺入单独的产品中,而是直接给予动物。如果将细菌性3-植酸酶直接给予动物,植酸酶优选以挤出物或颗粒的形式提供,特别是涂覆的颗粒,例如涂覆含盐(例如至少60%w/w的盐)的涂层。盐可选自nacl、kcl、na2so4、k2so4和mgso4。本发明的另一方面涉及细菌性3-植酸酶用于生产食品或饲料添加剂的用途。食品或饲料添加剂是可以掺入商业食品中的产品,例如谷物、玉米、干草、糖蜜和稻草的颗粒状或挤出混合物,并且可以是干燥或液体形式。如前定义的用于生产饲料产品或食品的3-植酸酶是特别优选的。如本文所用,“液体形式”涉及优选还包含缓冲剂、稳定剂和抗微生物剂的组合物,并且甚至可以包含至少一种其他酶,其中酶是淀粉酶、纤维素酶、乳糖酶、脂肪酶、蛋白酶、过氧化氢酶、木聚糖酶、β-葡聚糖酶、甘露聚糖酶、淀粉酶、酰胺酶、环氧化物水解酶、酯酶、磷脂酶、转氨酶、胺氧化酶、纤维二糖水解酶、氨裂解酶或其任何组合。如本文所用,“干燥形式”涉及优选还包含一种或多种下列组分的组合物:载体、缓冲剂、稳定剂、粘合剂、增塑剂、抗微生物剂。特别优选的是包含蔗糖、氯化钠、山梨糖醇、柠檬酸钠、山梨酸钾、苯甲酸钠、丙酸钠、瓜尔胶和/或小麦粉的干燥形式。附图说明下面进一步通过实施例和附图描述本发明。需要强调的是,实施例和附图仅具有示例性特征,并不限制本发明的范围。图1显示了根据本发明的细菌性3-植酸酶和现有技术中目前用于饲喂动物的细菌性6-植酸酶在ph5.5和37℃下对中间产物肌醇-四磷酸盐的积累的比较。图2显示了根据本发明的细菌性3-植酸酶和现有技术中也已知用于饲喂动物并且过去曾用于磷酸盐释放的真菌性3-植酸酶在ph5.5和37℃的测定中使用的相同量的植酸酶的比较。图3显示了根据本发明的细菌性3-植酸酶和现有技术中目前用于饲喂动物的细菌性6-植酸酶在ph5.5和37℃下从中间产物肌醇-四磷酸盐中释放磷酸盐的比较。图4显示了根据本发明的细菌性3-植酸酶和现有技术中目前用于饲喂动物的细菌性6-植酸酶在ph5.0和40℃下对中间产物肌醇-四磷酸盐的积累的比较。图5显示了根据本发明的细菌性3-植酸酶和现有技术中也已知用于饲喂动物并且过去曾用于磷酸盐释放的真菌性3-植酸酶在ph5.0和40℃下测定中使用的相同量的植酸酶的比较。图6显示了根据本发明的细菌性3-植酸酶和现有技术中目前用于饲喂动物的细菌性6-植酸酶在ph5.0和40℃下对中间产物肌醇-四磷酸盐的积累的比较。具体实施方式方法在实施例中已应用以下方法:现有技术的植酸酶以下植酸酶已经在实施例中进行了测试:酶浓度的测定使用其摩尔消光系数通过uv吸光度测定seqidno1浓度。使用seqidno1校准曲线通过内部sds凝胶定量方法定量所有其他植酸酶溶液和提取物。将植酸酶样品应用于sds凝胶,随后用syproruby(thermofisher:s12000)染色。在标准bio-rad凝胶记录仪器上记录凝胶图像。使用imagelab软件(bio-rad)进行图像分析。通过在相同sds凝胶上使用seqidno1校准曲线的植酸酶特异性sds凝胶条带的信号积分来确定蛋白质浓度。植酸酶活性的测定将5μl酶溶液(在100mmol/l乙酸钠缓冲液中,ph5.5,0.05%(w/v)tritonx-100)与95μl2.88mmol/l植酸钠(sigma68388,批号bcbm4006v)在100mmol/l乙酸钠缓冲液中ph5.5、37℃下温育15分钟。通过添加100μl10%(w/v)三氯乙酸终止反应。随后,将100μl停止的酶促反应与100μl钼酸盐试剂(1.2%(w/v)钼酸铵水溶液;4.4%(v/v)硫酸和27mg/ml(w/v)硫酸亚铁)混合,将溶液在室温下温育15分钟。测定700nm处的吸光度,并使用无机磷酸盐标准溶液(0-1.5mmol/l)计算释放的无机磷酸盐的量。一个植酸酶活性单位定义为在37℃下每分钟释放1μmol磷酸盐的酶的量。商品肌醇六膦酸制剂中肌醇六膦酸含量的测定标准物质肌醇六膦酸钠盐水合物(sigmaart.68388,批号bcbm4006v)含有肌醇六膦酸、钠和水。肌醇六膦酸含量没有记载在分析证书中,而是通过酸水解和随后通过icp-oes测定游离磷来确定。200毫克植酸钠盐水合物(sigmaart.68388,批号bcbm4006v)在聚四氟乙烯管中称重。随后,加入1ml水、1ml98%硫酸和4ml30%过氧化氢溶液。用盖子和爆破帽封闭管子,并在高压釜中于300℃温育1小时。将水解产物定量转移至50ml容量瓶中,并用水填充至50ml。根据dineniso11885e22,通过icp-oes分析该溶液的磷含量。通过重量、磷含量和摩尔质量计算肌醇六膦酸的含量。植酸钠盐水合物肌醇六膦酸(sigmaart.68388,批号bcbm4006v)中的游离肌醇六膦酸的含量为54.7%。用hpaec-uv测定不同的肌醇-磷酸种类通过高效阴离子交换色谱法与柱后衍生化使用290nm的uv检测器(hpaec-uv)进行不同肌醇-磷酸种类的测定。色谱系统是带有双泵(ic-3000dp)、双柱温箱(ics-3000dc)、冷却自动进样器(ics-3000as)和uv检测器(thermofishermwd-3000)的dionexics-3000。代替柱后递送系统,使用针织反应线圈(4mm系统,375μl)来混合两个泵系统的流以在检测之前进行衍生化反应。系统1用于通过使用4×50mm的dionexcarbopacpa100guard柱和4×250mm的dionexcarbopacpa100分析柱分离不同的肌醇-磷酸种类。对于梯度洗脱,使用hplc级水(泵系统1/管a)和0.5m盐酸(泵系统1/管b),流速为1.0ml/min。梯度条件如下:0分钟,5%b;0-8分钟,5-10%b;8-25分钟,10-35%b;25-35分钟,35-100%b;35-42分钟,100%b;42-43分钟,100-5%b;43-55分钟,5%b。泵系统2以0.4ml/min的流速提供柱后反应溶液(含有0.1%fe(no3)3的0.33m高氯酸)至t形连接器与针织线圈的组合。在30℃的柱温和10℃的自动取样器温度下,注射体积为约50μl。运行时间为55分钟。在290nm处检测信号并手动积分。如下制备标准储备溶液:将100mg肌醇六膦酸钠盐水合物(sigmaart.68388,批号bcbm4006v)稀释于100ml磷酸盐标准溶液1000mg/l(merckart.119898)中。用水(hplc级)稀释至几个校准水平,最终得到以下浓度:0.1mg/ml肌醇六膦酸钠盐水合物/磷酸盐,0.2mg/ml肌醇六膦酸钠盐水合物/磷酸盐,0.4mg/ml肌醇六膦酸钠盐水合物/磷酸盐,0.6mg/ml肌醇六膦酸钠盐水合物/磷酸盐,0.8mg/ml肌醇六膦酸钠盐水合物/磷酸盐。肌醇-磷酸种类的保留时间列表:物质保留时间[分钟]磷酸盐3.451,4-肌醇-二磷酸11.814,5-肌醇-二磷酸12.331,2,3-肌醇-三磷酸17.861,4,5-肌醇-三磷酸18.271,5,6-肌醇-三磷酸18.691,2,4,5-肌醇-四磷酸24.381,3,4,5-肌醇-四磷酸25.392,4,5,6-肌醇-四磷酸27.631,4,5,6-肌醇-四磷酸28.821,2,3,4,5-肌醇-五磷酸32.121,2,4,5,6-肌醇-五磷酸34.401,2,3,4,5,6-肌醇-六磷酸(肌醇六膦酸)39.07实施例实施例1肌醇六膦酸降解模式的测定通过将2.7mmol/l肌醇六膦酸溶液(sigma68388,批号bcbm4006v)在ph5.5的100mmol/l乙酸钠缓冲液中于37℃与0.2u/ml植酸酶一起温育来进行酶促反应。通过在热摇床中在99℃下立即温育10分钟,在不同时间点停止酶促反应来记录时间分辨的酶促肌醇六膦酸降解数据。根据“通过hpaec-uv测定不同的肌醇-磷酸种类”方法分析样品。将肌醇-磷酸异构体的峰面积(具有相同量磷酸根残基的肌醇-磷酸)加合。随后,通过将信号归一化至不同肌醇-磷酸种类的磷酸根残基量来校正峰面积(即肌醇六膦酸含有六个磷酸根残基,导致检测器响应因子比无机磷酸盐的高六倍)。为了比较降解模式,采集动态时间点的数据,在该时间点释放等量的磷酸盐。结果如图1所示。实施例2在相同酶量的植酸酶下测定磷酸盐释放数据将5μl酶溶液(在100mmol/l乙酸钠缓冲液中,ph5.5,0.05%(w/v)tritonx-100)与95μl2.88mmol/l肌醇六膦酸钠(sigma68388,批号bcbm4006v)在100mmol/l乙酸钠缓冲液中ph5.5、37℃下一起温育1小时。反应中最后的酶浓度为0.21μg/ml。通过添加100μl10%(w/v)三氯乙酸来终止反应。随后,将停止的酶促反应稀释1/10并将100μl稀释液与100μl钼酸盐试剂(1.2%(w/v)钼酸铵水溶液;4.4%(v/v)硫酸)和27mg/ml(w/v)硫酸亚铁)混合。将溶液在室温下温育15分钟。测定700nm处的吸光度,并使用无机磷酸盐标准溶液(0-1.5mmol/l)计算释放的无机磷酸盐的量。结果如图2所示。实施例3测定从肌醇-四磷酸的磷酸盐释放通过将2.7mmol/l肌醇六膦酸与0.1u/mlseqidno.17在100mmol/l乙酸钠缓冲液(ph5.5)中于37℃温育1小时,制备肌醇-四磷酸制剂。反应后,通过在95℃温育30分钟使酶失活。所得的2.7mmol/l肌醇-四磷酸溶液用作根据实施例2的酶促反应中的底物,最终植酸酶浓度为0.2u/ml。结果如图3所示。图中使用的缩写是:ip6:肌醇-六磷酸;ip5:肌醇-五磷酸;ip4:肌醇-四磷酸;ip3:肌醇-三磷酸;ip2:肌醇-二磷酸;ip1:肌醇-一磷酸;pi:磷酸盐。实施例4肌醇六膦酸降解模式的测定实施例4如实施例1进行,但ph设定为5,温育温度为40℃。结果如图4所示。实施例5肌醇六膦酸降解模式的测定实施例2如实施例1进行,但ph设定为5,温育温度为40℃。结果如图5所示。实施例6肌醇六膦酸降解模式的测定实施例3如实施例1进行,但ph设定为5,温育温度为40℃。结果如图6所示。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1