一种具有缓解二型糖尿病功能的益生菌膳食补充剂及其应用的制作方法
本发明涉及一种具有缓解二型糖尿病功能的益生菌膳食补充剂及其应用,是一种具有降糖功能的益生菌膳食补充剂,属于食品技术领域。
背景技术:
糖尿病是一种慢性代谢性疾病,其特征为高血糖引起的机体功能紊乱。糖尿病的发病机制有三个:一、胰岛素分泌缺陷;二、胰岛素作用障碍即胰岛素低敏感性,胰岛素障碍即为胰岛素于胰岛素受体的亲和力下降,导致胰岛素不足以促进糖的代谢吸收,引起血糖异常;三、胰岛β细胞受损,其主要分为胰岛素依赖型的ⅰ型糖尿病和非胰岛素依赖型的ⅱ型糖尿病,其他类型和妊娠糖尿病四种类型,其中ⅱ型糖尿病患者约占90%以上。在全球范围内,糖尿病已成为第三大危害人类生命健康的慢性疾病。据统计,2015年全球20-79岁的人中有越4.15亿人患糖尿病(患病率8.8%),另外有3.18亿人糖耐量受损(前期患病率6.7%)。中国是全球糖尿病患者第一大国,2015年病患人数高达1.096亿人,130万人死于糖尿病以及并发症。同时据idf预测,如果不加干预,2040年全球糖尿病患者将达6.42亿。糖尿病前期人群4.81亿,我国患者数量将上升1.54亿。
ⅱ型糖尿病是因为胰岛素分泌相对不足而引起的以高血糖为主要特征的代谢性疾病。其主要特点表现为胰岛素抵抗(insulinresistance,ir),即自体产生胰岛素后细胞无法对它作出反应。ⅱ型糖尿病的发生主要是由遗传因素、精神因素、免疫功能紊乱、微生物感染及其毒素、自由基毒素等各种致病因子作用于糖尿病机体导致胰岛的功能减退和胰岛素抵抗,从而引发的糖、脂和电解质等一系列代谢紊乱综合症。现有研究发现女性糖尿病患病率高于男性,且随着年龄的增加,患病几率增大,而且随着物质生活的丰富,患病几率组逐年增加。
市场上传统的治疗二型糖尿病的药物在控制血糖的同时,其药物使用的局限性和副作用也十分严重。磺脲类药物是治疗糖尿病的药物之一,该类药物对于有一定胰岛功能的患者疗效较好,但是对于严重肝肾功能不全者、合并严重感染者以及妊娠高血糖者具有明显的不良反应。双胍类降糖药是增加外周组织对葡萄糖的利用,减少胃肠道对葡萄糖的吸收,降低体重。但是可能会导致胃肠道反应,主要表现为恶心、呕吐等症状以及头痛、头晕和乳酸酸中毒等症状。其他的降糖药物还有α葡萄糖苷酶抑制剂和胰岛素增敏剂,主要不良反应有腹痛、肠胀气、腹泻、肛门排气增多。
因此努力探索更加安全、更加有效,同时又经济的方法缓解糖尿病的症状是是十分必要的,特别是目前糖尿病患者的年龄有低龄化趋势,因此安全有效的疗法尤为重要。
营养健康理念的不断转变,有病治病,无病强身的乳酸菌微生态制剂产品越来越受欢迎,然而在乳酸菌微生态制剂中,以液态乳酸菌益生菌制剂更为常见,而粉剂形式的益生菌益生菌复配剂并不常见。因此研发出粉剂形式,具有缓解糖尿病的益生菌菌粉、活性多糖、膳食益生元的益生菌复配剂,是一种非常健康的治疗方案,具有广阔的市场应用前景。
技术实现要素:
本发明是提供一种具有缓解二型糖尿病功能的益生菌膳食补充剂及其制备方法与应用,将鼠李糖乳杆菌和植物乳杆菌冷冻干燥获得菌粉,辅以活性多糖,添加适宜辅料后制备成粉剂形式的益生菌和降糖活性多糖的膳食补充剂,含有活菌含量大于1011cfu/g的鼠李糖乳杆菌和活菌含量大于1011cfu/g的植物乳杆菌x1,具有降糖效果。
本发明采用如下技术方案:
一种具有缓解二型糖尿病功能的益生菌膳食补充剂,包括冻干菌粉、活性多糖、膳食益生元;所述冻干菌粉为鼠李糖乳杆菌冻干菌粉和植物乳杆菌x1冻干菌粉;优选的,按质量百分数,冻干菌粉、活性多糖、膳食益生元分别为5%-25%、13%-28%、47%-82%。
本发明中,鼠李糖乳杆菌具有下列性质:
(1)菌体特征:革兰氏染色阳性杆状细菌,菌体约0.9-1.2µm宽,3-8µm长,无芽孢形成;
(2)菌落特征:在培养基上形成明显地菌落,直径在0.3-2mm之间,正面形态圆形,侧面形态呈凸起状,边缘整齐,乳白色,不透明,表面湿润光滑;
(3)生长特性:该菌株最低生长温度为20℃,最高生长温度为40℃,在温度30-370c生长最佳,最高和最低初始生长ph为9.0和2.5,最适初始生长ph为7.0。
本发明中,植物乳杆菌x1具有下列性质:
(1)菌体特征:革兰氏染色呈阳性,细胞呈短杆状,菌体约0.5-1.0μm宽,2-4μm长,成单、成对或者成链,不形成芽孢,两端圆形;
(2)菌落特征:在培养基上形成明显地菌落,直径在0.3-2mm之间,圆形,乳白色,半透明,表面湿润光滑,不产生色素;
(3)生长特性:该菌株最低生长温度为20℃,最高生长温度为40℃,在温度30-370c生长最佳,最高和最低初始生长ph为9.0和2.5,最适初始生长ph为7.0。该植物乳杆菌的延迟期相对较短,12h就达到稳定期。
本发明中,鼠李糖乳杆菌冻干菌粉的制备方法为,将鼠李糖乳杆菌活化后依次进行扩大培养、离心、洗涤,然后加入冻干保护剂重悬菌体,得到菌体悬浮液;菌体悬浮液经过预冻后冷冻干燥,得到鼠李糖乳杆菌冻干菌粉。优选的,菌体悬浮液中,活菌浓度大于1011cfu/ml,冻干保护剂为100-250g/l的脱脂乳溶液。
本发明中,植物乳杆菌x1冻干菌粉的制备方法为,将植物乳杆菌x1活化后依次进行扩大培养、离心、洗涤,然后加入冻干保护剂重悬菌体,得到菌体悬浮液;菌体悬浮液经过预冻后冷冻干燥,得到植物乳杆菌x1冻干菌粉。优选的,菌体悬浮液中,活菌浓度大于1011cfu/ml,冻干保护剂为100-250g/l的脱脂乳溶液;冷冻干燥的工艺是-50℃/2h+-30℃/30h+25℃/2h。
本发明的冷冻干燥方法适用于全溶液产品,通过使溶质收缩干燥发酵液,产品干燥后易再水化,保护剂在冷冻干燥和贮存过程中起重要作用,保护剂可以改变菌类冷冻干燥时的物理化学环境,减轻或者防止冷冻干燥或者复水对菌类的损害,保持原有各种生理活性,直接影响冷冻干燥后的菌类存活率与保存期;相对其他菌类,乳酸菌的抗逆性相对较差,易受到环境的影响,限制了乳酸菌生理作用的发挥。本发明采用100-250g/l的脱脂乳溶液为冻干保护剂,结合预冻、冷冻干燥工艺,得到的冻干菌粉乳酸菌活性高,本发明公开的膳食补充剂中,鼠李糖乳杆菌的活菌含量达到1011cfu/g以上,植物乳杆菌x1的活菌含量达到1011cfu/g以上,比如本发明实施例中,膳食补充剂复溶后鼠李糖乳杆菌的活菌含量达到2.57*1011cfu/g以上,植物乳杆菌x1的活菌含量达到1.92*1011cfu/g以上。上述具有缓解二型糖尿病功能的益生菌膳食补充剂的制备方法,包括以下步骤,
(1)将鼠李糖乳杆菌活化后依次进行扩大培养、离心、洗涤,然后加入冻干保护剂重悬菌体,得到菌体悬浮液;菌体悬浮液经过预冻后冷冻干燥,得到鼠李糖乳杆菌冻干菌粉;
(2)将植物乳杆菌x1活化后依次进行扩大培养、离心、洗涤,然后加入冻干保护剂重悬菌体,得到菌体悬浮液;菌体悬浮液经过预冻后冷冻干燥,得到植物乳杆菌x1冻干菌粉;
(3)将鼠李糖乳杆菌冻干菌粉、植物乳杆菌x1冻干菌粉、活性多糖、膳食益生元混合得到基于益生菌的膳食补充剂。
上述技术方案中,步骤(1)为,将鼠李糖乳杆菌菌种按1-2%的接种量接种到培养基中,然后在37℃下培养18h,然后用磷酸盐缓冲液清洗后再用冷冻干燥保护剂重悬,得到菌体悬浮液,之后在-80℃下预冻3h后再进行冷冻干燥得到鼠李糖乳杆菌冻干菌粉;所述菌体悬浮液中,活菌浓度大于1011cfu/ml。
上述技术方案中,步骤(2)为,将植物乳杆菌x1按1-2%的接种量接种到培养基中,然后在37℃下培养18h,然后用磷酸盐缓冲液清洗再用冷冻干燥保护剂重悬,得到菌体悬浮液,之后在-80℃下预冻3h后再进行冷冻干燥得到植物乳杆菌x1冻干菌粉;所述菌体悬浮液中,活菌浓度大于1011cfu/ml。
本发明中,活性多糖包括壳寡糖、岩藻多糖;膳食益生元包括菊粉、低聚木糖。
优选的,按质量百分数,冻干菌粉、壳寡糖、岩藻多糖、菊粉、低聚木糖分别为5%-25%、1%-10%、12%-18%、30%-42%、17%-40%。进一步优选的,按质量百分数,冻干菌粉、壳寡糖、岩藻多糖、菊粉、低聚木糖分别为8%、5%、15%、37%、35%。
优选的,鼠李糖乳杆菌与植物乳杆菌的质量比为2:1。
本发明还公开了一种具有缓解二型糖尿病功能的益生菌膳食补充剂的制备方法,包括以下步骤,
(1)将鼠李糖乳杆菌活化后依次进行扩大培养、离心、洗涤,然后加入冻干保护剂重悬菌体,得到菌体悬浮液;菌体悬浮液经过预冻后冷冻干燥,得到鼠李糖乳杆菌冻干菌粉;
(2)将植物乳杆菌x1活化后依次进行扩大培养、离心、洗涤,然后加入冻干保护剂重悬菌体,得到菌体悬浮液;菌体悬浮液经过预冻后冷冻干燥,得到植物乳杆菌x1冻干菌粉;
(3)将鼠李糖乳杆菌冻干菌粉、植物乳杆菌x1冻干菌粉、活性多糖、膳食益生元混合得到基于益生菌的膳食补充剂。
上述技术方案中,步骤(1)为,将鼠李糖乳杆菌菌种按1-2%的接种量接种到培养基中,然后在37℃下培养18h,然后用磷酸盐缓冲液清洗后再用冷冻干燥保护剂重悬,得到菌体悬浮液,之后在-80℃下预冻3h后再进行冷冻干燥得到鼠李糖乳杆菌冻干菌粉;所述菌体悬浮液中,活菌浓度大于1011cfu/ml。
上述技术方案中,步骤(2)为,将植物乳杆菌x1按1-2%的接种量接种到培养基中,然后在37℃下培养18h,然后用磷酸盐缓冲液清洗再用冷冻干燥保护剂重悬,得到菌体悬浮液,之后在-80℃下预冻3h后再进行冷冻干燥得到植物乳杆菌x1冻干菌粉;所述菌体悬浮液中,活菌浓度大于1011cfu/ml。
本发明中,活性多糖包括壳寡糖、岩藻多糖;膳食益生元包括菊粉、低聚木糖。
优选的,按质量百分数,冻干菌粉、壳寡糖、岩藻多糖、菊粉、低聚木糖分别为5%-25%、1%-10%、12%-18%、30%-42%、17%-40%。进一步优选的,按质量百分数,冻干菌粉、壳寡糖、岩藻多糖、菊粉、低聚木糖分别为8%、5%、15%、37%、35%。
优选的,鼠李糖乳杆菌冻干菌粉与植物乳杆菌冻干菌粉的质量比为2:1。在本发明的一种实施方式中,冻干菌粉的制备包括以下步骤:
a.培养基的制备:1%蛋白胨、1%牛肉膏、0.5酵母粉、2%葡萄糖、0.2%无水乙酸钠、0.05%七水硫酸镁、0.025%一水硫酸锰、0.2%柠檬酸二铵、0.26%三水磷酸氢钾、0.1%吐温80,加入纯净水混匀后,调节ph至6.2-6.4,115-121℃下灭菌15-20min,得到培养基;
b.冷冻干燥保护剂的制备:使用水与保护剂原料混合制备,得到相应浓度的冻干保护剂;
c.鼠李糖乳杆菌菌种、植物乳杆菌x1按所述培养基质量的1-2%计的接种量分别接种到在温度115℃下灭菌20min后冷却的培养基中,然后在37℃下培养18h,用ph7.2磷酸盐缓冲液清洗2-4次,用步骤b的冷冻干燥保护剂重悬使活菌浓度达到1011cfu/ml以上,之后进行预冷、冷冻干燥得到相应冻干菌粉。
本发明还公开了上述具有缓解二型糖尿病功能的益生菌膳食补充剂在制备降糖食品或者降糖保健品中的应用;本发明的具有缓解二型糖尿病功能的益生菌膳食补充剂可以与饮用水混合相溶,制备降糖食品或者降糖保健品,直接服用,具有明显的降糖作用,可以与降糖药物媲美,而且没有降糖药物带来的副作用。
本发明的有益效果:
(1)本发明制备得到同时含有益生菌和活性多糖的膳食补充剂,具有明显的降糖效果。
(2)本发明的膳食补充剂活性成分含量高;益生菌活菌含量可达1011cfu/g以上。
(3)本发明的膳食补充剂能够降低小鼠的血糖水平,能够显著降低糖基化血红蛋白和内毒素含量,提升胰岛素和肝糖原的水平,非常具有应用前景。
附图说明
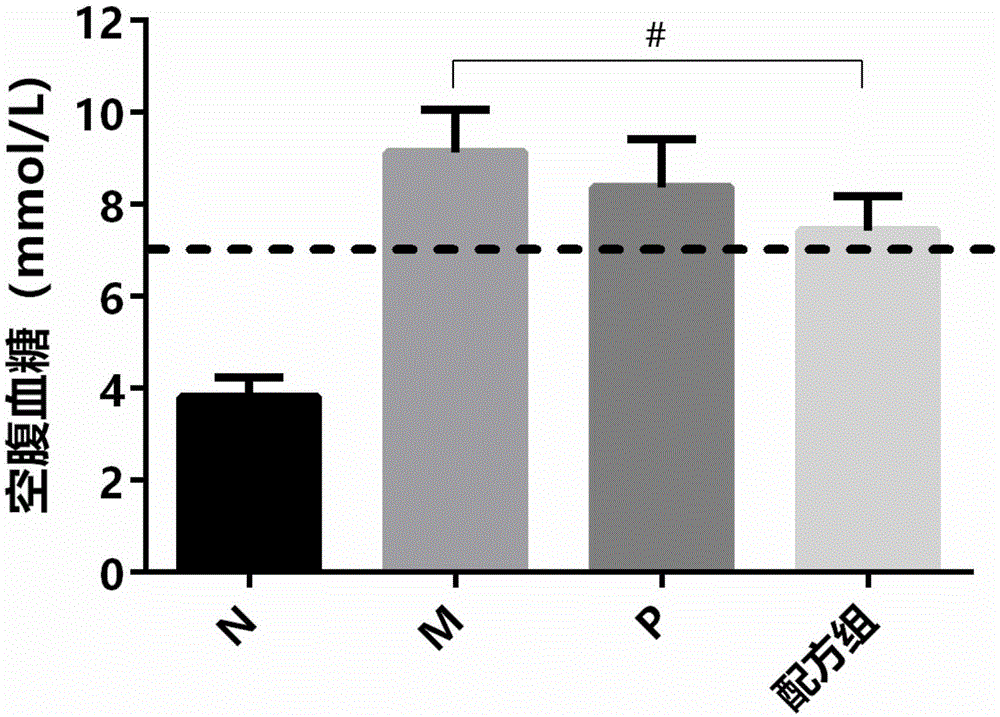
图1是造模一周后各组小鼠空腹血糖结果;
图2是造模一周后各组小鼠餐后血糖结果;
图3是小鼠空腹血糖水平变化结果;
图4是小鼠餐后血糖水平变化结果;
图5是造模成功后各组小鼠糖耐受性比较结果;
图6是造模成功后各组小鼠auc比较结果;
图7是实验结束时各组小鼠糖耐受性比较结果;
图8是实验结束时各组小鼠auc比较结果。
具体实施方式
实施例1:具有缓解二型糖尿病功能的益生菌膳食补充剂
1、培养基的制备:1%蛋白胨、1%牛肉膏、0.5酵母粉、2%葡萄糖、0.2%无水乙酸钠、0.05%七水硫酸镁、0.025%一水硫酸锰、0.2%柠檬酸二铵、0.26%三水磷酸氢钾、0.1%吐温80,加入纯净水混匀后,调节ph至6.2-6.4,121℃下灭菌20min,得到培养基;
2、培养方法:鼠李糖乳杆菌菌种、植物乳杆菌x1按照以上述培养基的重量计1%接种量分别接种,在370c下恒温培养箱中培养18h,得到可达稳定期菌液;
3、保护剂的制备:称取脱脂乳粉100g,均匀溶解于900g蒸馏水中,105℃巴氏灭菌10min后,即得到所述保护剂;
4、冷冻干燥保存方法:将益生菌稳定期菌液用无菌的磷酸盐缓冲液(ph7.2)清洗2次后,用所述的保护剂重悬达到浓度1011cfu/ml,即得菌体悬浮液,让菌体悬浮液在温度-80℃下预冻3h,之后进行冷冻干燥(冷冻干燥的工艺是-50℃/2h+-30℃/30h+25℃/2h)得到鼠李糖乳杆菌冻干菌粉、植物乳杆菌x1冻干菌粉;
5、按质量百分数,将冻干菌粉、壳寡糖、岩藻多糖、菊粉、低聚木糖混合,得到基于益生菌的膳食补充剂,其中冻干菌粉、壳寡糖、岩藻多糖、菊粉、低聚木糖分别为8%、5%、15%、37%、35%,鼠李糖乳杆菌冻干菌粉与植物乳杆菌冻干菌粉的质量比为2:1。
用水复溶后鼠李糖乳杆菌的活菌含量达到2.57*1011cfu/g以上,植物乳杆菌x1的活菌含量达到1.92*1011cfu/g以上;如果采用现有糖类(海藻糖)作为冻干保护剂,复溶鼠李糖乳杆菌的活菌含量为1.33*107cfu/g;如果将冷冻干燥工艺改变为-50℃/40h+25℃/2h,复溶鼠李糖乳杆菌的活菌含量为5.11*1010cfu/g。
实施例2:膳食补充剂的急性毒性实验
1、急性毒性实验
取3周龄健康雄、雌性c57bl6小鼠各10只,在24小时灌胃一次0.2ml的膳食补充剂溶液(取2g实施例1中制得的益生菌膳食补充剂溶于2ml双蒸水中制备而成,以下实施例都采用此溶液作为配方组),观察14日,记录小鼠体重、摄食量及死亡状况,空白组不喂食膳食补充剂。
结果如表1和表2所示,喂食膳食补充剂未对小鼠造成任何负面影响,小鼠正常生长,无死亡现象产生,且无任何病理症状。
表1喂食膳食补充剂对小鼠体重(g)的影响
表2喂食膳食补充剂对小鼠摄食量的影响
实施例3:膳食补充剂的喂养实验
取3周龄健康雄、雌性c57bl6小鼠各10只,每24小时灌胃一次0.2ml的膳食补充剂,观察28日,记录小鼠体重及死亡状况。实验结束后处死所有小鼠,称量肝肾脾脏器的重量,计算脏器系数;收集全血,进行血常规测定;离心血液得血清,采用试剂盒(南京建成生物工程研究所)测定血生化指标。
表3喂食膳食补充剂对小鼠体重的影响
表4喂食膳食补充剂对小鼠摄食量的影响
血常规检测是一种血液基础检测,通过观察血细胞数量,形态判断疾病。使用全自动血液分析仪测定小鼠血液常规指标,结果如表5所示。
由表5知,喂养试验各组小鼠在血红蛋白,红细胞计数,白细胞计数及分类上均无显著差异,说明膳食补充剂对小鼠血液常规参数没有影响。
表528天喂养试验小鼠血液常规指标
脏器系数为小鼠脏器湿重量与小鼠体重的比值,在处死小鼠前称量一次体重,处死小鼠后取小鼠肝脏、肾脏、脾脏用生理盐水清洗后称重,计算脏器系数,结果如表6所示。
表628天喂养试验雄性小鼠脏器系数指标
由表6可知,由于性别不同雄性小鼠与雌性小鼠在各个脏器系数间有差异。但喂养试验中雄性小鼠与雌性小鼠的各个分组间的各个脏器系数都没有出现显著性差异,说明膳食补充剂对小鼠脏器系数指标没有影响。
血液生化检查通过检测血液中酶、脂类、代谢产物等物质,为疾病的判断提供了依据,按试剂盒说明书的要求测定小鼠血液生化指标,结果如表7所示。
由表7可知,喂养试验中雄性小鼠与雌性小鼠的各组间的各个指标都没有出现显著性差异,因此说明,说明膳食补充剂对小鼠血液生化指标没有影响。
表728天喂养试验小鼠血液生化指标
实施例4:膳食补充剂对ⅱ型糖尿病小鼠的体重和摄食量的调节作用
取3周龄健康雌性c57bl6小鼠40只,随机分为四组:空白组(n)、糖尿病模型组(m)、药物组(p)和膳食补充剂干预组(配方组),每组含小鼠10只。前3周,除空白组喂食基础饲料外,其它各组均喂食高脂饲料,同时膳食补充剂干预组灌胃对应的补充剂溶液。第3周结束,所有小鼠禁食不禁水12h,除空白组外,其余各组小鼠均按照100mg/kg体重注射新鲜配制的链脲佐菌素stz(50mmol/l),将一定量stz溶于50mmol/l柠檬酸-柠檬酸钠缓冲液中(ph4.5),现配现用,冰浴保存,空白组注射0.85%的生理盐水。造模1周后,造模成功的糖尿病小鼠其空腹血糖高于7.0mmol/l,餐后2h血糖高于11.0mmol/l。然后药物组开始灌胃吡格列酮,剂量为10mg/kg体重,配方组小鼠灌胃膳食补充剂,直至实验结束。试验期间所有小鼠自由饮水和饮食,每周定时称量体重和采食量。
实验结束时(13周结束)各组小鼠的体重变化及进食量如表8所示。n组小鼠的最终体重高于其它各组小鼠。n组小鼠的平均体重增长为11.69g,而m组仅为7.98g,m组与n组相比显著降低了31.74%(p<0.05)。然而,n组的平均进食量为2.88g/d,m组的进食量高于n组,但是各组进食量与n组无显著差异(p>0.05)。实例例4结果表明,喂食膳食补充剂后可以明显改善糖尿病小鼠的进食量,但对体重变化没有显著影响。
表8各组小鼠体重及进食变化
#代表与空白组比较有显著差异,p<0.05;
*代表与造模组比较有显著差异,p<0.05;
n:空白组;m:造模组;p:药物组;配方组:膳食补充剂干预组。
实施例5:膳食补充剂对ⅱ型糖尿病小鼠的血糖水平的调节作用
取3周龄健康雌性c57bl6小鼠40只,随机分为四组:空白组(n)、糖尿病模型组(m)、药物组(p)和膳食补充剂干预组(配方组),每组含小鼠10只。前3周,除空白组喂食基础饲料外,其它各组均喂食高脂饲料,同时膳食补充剂干预组灌胃对应的配方,具体灌胃方法同上。第3周结束,所有小鼠禁食不禁水12h,除空白组外,其余各组小鼠均按照100mg/kg体重注射新鲜配制的链脲佐菌素stz(50mmol/l),将一定量stz溶于50mmol/l柠檬酸-柠檬酸钠缓冲液中(ph4.5),现配现用,冰浴保存,空白组注射0.85%的生理盐水。造模1周后(第4周结束),造模成功的糖尿病小鼠其空腹血糖高于7.0mmol/l,餐后2h血糖高于11.0mmol/l。然后药物组开始灌胃吡格列酮,剂量为10mg/kg体重,配方组小鼠灌胃膳食补充剂,直至实验结束(13周结束)。试验期间所有小鼠自由饮水和饮食,每周定时测量血糖,造模成功后和实验结束前测定口服葡萄糖耐量检测(ogtt)。
高脂饲料喂食3周后注射stz进行造模,造模结束后,测定实验各组的空腹血糖和餐后血糖,结果显示除n组外其余各组的空腹血糖水平均高于参考值7.0mmol/l,餐后2h血糖高于11.0mmol/l,可以判断为ⅱ型糖尿病小鼠模型造模成功,实验结果如附图1、2所示。
自高脂饲料开始至实验结束的13周期间,各组小鼠的空腹血糖及餐后血糖水平变化如图3、4所示,高脂喂食期间(1-3周),各组小鼠空腹血糖均无明显变化,腹腔注射stz一周后,即第4周时,除n组外,其它各组空腹血糖均显著增高(p<0.05),由于stz对小鼠胰岛细胞具有选择性的破坏作用,在高脂饲料喂食后,又经适量stz注射,使小鼠的胰岛细胞功能遭到部分破坏,造成外周组织对胰岛素不敏感,所以各组小鼠的空腹血糖明显升高,实验结束后,药物组和配方组小鼠血糖水平明显降低。
造模成功后(第4周结束),各组小鼠的ogtt结果及auc如图5、6所示:如图5所示,灌胃15min内,各组小鼠血糖均急速上升,空白组变化较平缓,在2h后恢复至正常水平,其它各组小鼠的血糖值显著高于n组,在2h后依然保持在较高水平,说明葡萄糖耐受能力明显降低,符合ⅱ型糖尿病糖耐量降低的特征,再次证明造模成功;从图6中可看出配方组的auc显著低于m组(p<0.05),说明配方组可以改善糖尿病小鼠的糖耐量。
实验结束时(第13周),处死小鼠前各组糖耐受的结果如图7、图8所示。n组的血糖值变化不大,糖耐受性依然保持平稳。p组的血糖值及耐受性接近于n组,且auc值与n组无显著性差异,说明吡格列酮的治疗效果显著。配方组的auc值均比m组显著降低,说明配方组对ⅱ型糖尿病小鼠的糖耐量具有显著改善作用。实施例5结果表明,喂食膳食补充剂后可以降低糖尿病小鼠血糖水平。
实施例6:膳食补充剂对ⅱ型糖尿病小鼠相关生化指标的影响作用
取3周龄健康雌性c57bl6小鼠40只,随机分为四组:空白组(n)、糖尿病模型组(m)、药物组(p)和膳食补充剂(配方组)干预组,每组含小鼠10只。前3周,除空白组喂食基础饲料外,其它各组均喂食高脂饲料,同时膳食补充剂干预组灌胃对应的配方,具体灌胃方法同上。第3周结束,所有小鼠禁食不禁水12h,除空白组外,其余各组小鼠均按照100mg/kg体重注射新鲜配制的链脲佐菌素stz(50mmol/l),将一定量stz溶于50mmol/l柠檬酸-柠檬酸钠缓冲液中(ph4.5),现配现用,冰浴保存,空白组注射0.85%的生理盐水。造模1周后(第4周结束),造模成功的糖尿病小鼠其空腹血糖高于7.0mmol/l,餐后2h血糖高于11.0mmol/l。然后药物组开始灌胃吡格列酮,剂量为10mg/kg体重,配方组小鼠灌胃膳食补充剂,直至实验结束(13周结束)。试验期间所有小鼠自由饮水和饮食,直至实验结束。第13周实验结束时,小鼠禁食不禁水12h后,麻醉后摘取眼球取血,4℃低温下,4000×g离心10min后小心收集上层透明液体为血清,冻存于-80℃备用。小鼠眼球取血后,脱颈处死,迅速取出肝脏组织于冰冷的生理盐水中漂洗拭干。肝脏组织称重后剪碎倒入玻璃匀浆管中,加入9倍组织块重量的冷生理盐水充分研磨,使组织匀浆化,并将制备好的匀浆液3000×g离心15min后,吸取上清为肝匀浆液,冻存于-80℃备用。
实验结束时各组小鼠血清中hba1c、胰岛素、内毒素及肝组织匀浆中肝糖原的含量如表6所示。m组hba1c、胰岛素、内毒素和肝糖原的含量与n组含量相比均有显著性差异。配方组的hba1c的含量比m组含量分别显著降低了47.73%,并且配方组的hba1c与p组相比无显著性差异。配方组的内毒素的含量比m组含量分别降低了12.24%。m组胰岛素和肝糖原水平分别比n组显著降低了43.19%和7.4%,喂食配方后配方组的胰岛素和肝糖原水平均呈不同程度的上升趋势。配方组的胰岛素水平在实验结束时已恢复到正常水平。配方组的肝糖原水平与p组相比均无显著性差异。实施例9结果表明,喂食膳食补充剂后可以降低糖尿病小鼠的糖基化血红蛋白和内毒素水平,提高胰岛素和肝糖原水平;如果将鼠李糖乳杆菌冻干菌粉、植物乳杆菌x1冻干菌粉混合菌粉替换为其中的任何一种,其余不变,测得肝糖原为2.29~2.31mg/g;如果仅采用鼠李糖乳杆菌冻干菌粉、植物乳杆菌x1冻干菌粉混合菌粉作为补充剂,肝糖原为2.27mg/g;如果不采用鼠李糖乳杆菌冻干菌粉、植物乳杆菌x1冻干菌粉混合菌粉,没有降糖效果肝糖原水平基本与模型组一致;如果不加入活性多糖,肝糖原为2.34mg/g;如果不加入膳食益生元,肝糖原为2.37mg/g。
表9膳食补充剂对小鼠血清中糖基化血红蛋白、胰岛素、内毒素及肝组织匀浆中肝糖原的影响
#代表与空白组比较有显著差异,p<0.05;
*代表与造模组比较有显著差异,p<0.05;
n:空白组;m:造模组;p:药物组;配方组:膳食补充剂干预组。
实施例7:膳食补充剂对ⅱ型糖尿病小鼠血脂的影响作用
取3周龄健康雌性c57bl6小鼠40只,随机分为四组:空白组(n)、糖尿病模型组(m)、药物组(p)和膳食补充剂(配方组)干预组。前3周,除空白组喂食基础饲料外,其它各组均喂食高脂饲料,同时膳食补充剂干预组灌胃对应的配方,具体灌胃方法同上。第3周结束,所有小鼠禁食不禁水12h,除空白组外,其余各组小鼠均按照100mg/kg体重注射新鲜配制的链脲佐菌素stz(50mmol/l),将一定量stz溶于50mmol/l柠檬酸-柠檬酸钠缓冲液中(ph4.5),现配现用,冰浴保存,空白组注射0.85%的生理盐水。造模1周后(第4周结束),造模成功的糖尿病小鼠其空腹血糖高于7.0mmol/l,餐后2h血糖高于11.0mmol/l。然后药物组开始灌胃吡格列酮,剂量为10mg/kg体重,配方组小鼠灌胃膳食补充剂,直至实验结束(13周结束)。试验期间所有小鼠自由饮水和饮食,直至实验结束。第13周实验结束时,小鼠禁食不禁水12h后,麻醉后摘取眼球取血,4℃低温下,4000×g离心10min后小心收集上层透明液体为血清,冻存于-80℃备用。
实验结束时各组小鼠血清中的血脂含量见表10所示。m组的hdl-c水平较n组显著降低了19.12%,配方组的水平均有上升;m组的ldl-c水平较n组显著提高了47.22%,其它各组的ldl-c水平均与空白组无显著性差异;m组的tc水平较n组显著增加了12.7%,其他组的水平与m组相比无显著性差异,其余各组均可显著降低tc水平;m组tg水平较n组显著增加了27.94%,其中p组与配方组的tg水平与n组无显著性差异。实施例7结果表明,配方组可以显著降低小鼠的血脂使其恢复至空白组的水平。
表10膳食补充剂对小鼠血清中血脂的影响
#代表与空白组比较有显著差异,p<0.05;
*代表与造模组比较有显著差异,p<0.05;
n:空白组;m:造模组;p:药物组;配方组:膳食补充剂干预组。
本发明中,乳酸菌是益生菌的一种,是人体必需的必需菌群之一,具有多种重要生理功能,包括调节人体微生态平衡,调节自身免疫,还可以有效降低血糖,对于缓解糖尿病病症效果明显;壳聚糖具有提高免疫、活化细胞、调节机体环境等作用,可用于医药、保健、食品领域;岩藻多糖含有硫酸根,从而具有阴离子高分子化合物的特性,具有增强机体免疫机能等多种生理活性。通过益生菌和具有降糖效果的活性多糖的联合使用,可以避免、或者降低降糖药物的使用剂量,降低降糖药物的副作用,更适合用药,更加有益于身体健康。
随着营养健康理念的不断转变,有病治病,无病强身的乳酸菌微生态制剂产品越来越受欢迎。在乳酸菌微生态制剂中,液态乳酸菌益生菌制剂相较粉剂形式更为常见,而粉剂形式益生菌制剂相较液态制剂而言则更方便携带和储存。因此本发明开发出粉剂形式具有缓解糖尿病的益生菌的膳食补充剂,配以辅助降糖的活性多糖及具有益生菌增殖效果的益生元,是一种非常健康的治疗方案,具有广阔的市场应用前景。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!