一种利用发酵罐气升法制备益生菌微胶囊的方法
1.本发明涉及一种利用发酵罐气升法制备益生菌微胶囊的方法,属于生物技术领域。
背景技术:
2.益生菌,是一类活的微生物,摄入足量的益生菌能够促进肠道健康,保持宿主肠道菌菌群平衡,从而起到改善宿主健康的作用。简单来说,益生菌是一种广泛存在于动物肠道中,并能起到抑制有害细菌、促进肠道运动、提高肠道机能等作用的一系列活菌。首先发现益生菌益生功能的是俄国科学家mctchnikoff,他发现益生菌能够在肠道内增殖,抑制有害菌的生长,从而调节肠道内微生态平衡,促进人体健康。益生菌发挥益生作用需要两个条件:有足够的益生菌能够通过胃液到达肠道;有足够的益生菌定植于肠道中。但益生菌菌体直接通过胃液并定植于肠道是非常困难的。因为益生菌在低ph值、高胆盐等环境下容易失活。而益生菌制剂后确保了高存活率,长保质期及耐胃酸、胆盐和消化酶。针对这些要求,益生菌微胶囊技术逐渐进入国内外研究者们的视野。
3.微胶囊技术一般是指通过化学法、物理法,以天然或合成高分子可成膜的聚合物为囊壁,将气体、液体、固体等微小物质进行包埋及固化,并在一定条件下起到缓释的作用。益生菌微胶囊的常用制备方法有:挤压法、乳化法等;乳化法是通过乳化作用将菌体与凝胶的混合溶液分散,从而快速制备益生菌微胶囊,该方法具有能够高效产出直径较小的颗粒、操作简单、设备要求低、适合大规模工业化生产等优点。此外作为包埋壁材的藻酸盐因具有保护作用强,操作简便、无毒性、价格低廉、生物相容性高和易加工等优点成为了应用于微胶囊固定化技术中最为广泛的聚合物。
4.传统乳化法制备出的微胶囊,因液体培养基和益生菌代谢产生的二价阳离子会与海藻酸钠的na
+
发生离子交换反应,从而堆积提前形成交联网络结构,而影响后期的包埋效果,因此需要提前对益生菌液进行分离纯化,传统上利用离心机对菌液进行分离纯化去除上清液,但因为离心机的限制,处理的菌液量有限,且离心时间长,高速旋转下对于益生菌活性也有损伤,往往只能进行小批量的微胶囊制备,且耗时长,无法大规模工业上的应用。不仅如此,传统乳化法制备出的微胶囊,制备过程中易染菌,导致菌体容易失活;制备好湿胶囊后,为了提高微胶囊的保质时间、增加稳定性和降低运输成本,通常使用喷雾干燥与冷冻干燥降低微胶囊的含水量,而喷雾干燥对实验环境要求较严格;冷冻干燥产率低,耗能高,也大大限制了微胶囊在工业上大规模的应用。
技术实现要素:
5.针对现有技术存在的问题,本发明提供一种利用发酵罐气升法制备益生菌微胶囊的方法,该方法利用普通生物发酵罐实现了益生菌微胶囊的工业化制备,本发明首次采用中空纤维柱切向流系统对发酵液中的菌体进行分离纯化,在短时间内分离纯化大量菌液,并且降低对益生菌活性的损伤;然后通过蠕动泵将纯化后的益生菌泵到发酵罐中进行微胶
0.4mol/l的灭菌氯化钙溶液,微胶囊形成并缓慢沉降,最后采用补料蠕动泵依次吸走油相和水相后,得到粒径100-400μm的微胶囊;(5)通过控制器启动补料蠕动泵将质量浓度0.4-0.6%的壳聚糖溶液泵入发酵罐中与微胶囊混合,在400-600rpm下搅拌10min后从发酵罐底部出料口放出微胶囊悬液,经过120目筛网过滤后,滤渣用水洗涤2-3次,得到包埋湿微胶囊;(6)按质量比1:2-4的比例,将湿微胶囊与硅藻土混合,制得唾液乳杆菌微胶囊。
8.上述方法中是在115℃下灭菌处理20min。
9.步骤(4)中分离的油相用于下一批微胶囊的制备,由于油相是本发明制备微胶囊过程成本的主要组成部分,占微胶囊整个制备成本的90%以上,因此大豆油每重复利用一次可降低最终产品成本近45%,重复利用次数越多,成本降低越显著。
10.本发明方法中控制器为常规控制器,控制器与搅拌器、空气压缩机、蠕动泵、补料蠕动泵、加热器连接,按常规方法控制上述组件的开闭。
11.本发明优点和技术效果如下:(1)采用发酵罐气升法制备益生菌微胶囊,操作简单,降低了方法的复杂性,大大减少了设备成本,同时全封闭操作降低了染菌风险;(2)利用中空纤维柱切向流系统对发酵液中的菌体进行分离纯化,相对于利用离心机纯化,缩短60%以上的分离纯化时间,可进行大批量的菌液分离纯化,并且降低了益生菌活性的损伤,此技术更适合大规模工业化生产;(3)充分利用发酵罐高速可控稳定的搅拌系统和自动补料系统,可以恒定转速和精确补加溶剂,降低手工操作的误差,提高实验结果的可重复性,同时也方便微胶囊沉淀及从发酵罐底部排放微胶囊,此技术更适合大规模工业化生产;(4)本发明气升法制备益生菌微胶囊,基于乳化凝胶化原理,比现有乳化法和挤压法的发酵前包被具有更好的球形度、产品得率和单分散性,其产品得率可达95%以上,包埋率最高达到87.1%;(5)在水相中添加了保护剂,其中的营养物质使菌体可继续在微胶囊微环境下继续增殖,提高微囊化菌体密度更高,也更有利于微生物细胞保持稳定的活性;(6)添加食品级的硅藻土对微胶囊进行干燥,使其转变成一种稳定的细粉颗粒,改变微生物存在的形态,产品具有良好的流动性和分散性,能够有效地防止菌体失活,提高微生物类产品的稳定性,降低微胶囊产品的运输成本;体内应用时还能防止胃液的破坏,从而使尽可能多的菌体到达肠道,真正起到保健和治疗的作用;比现有喷雾干燥法和冷冻干燥法的成本低,生产效率高,使其更适合大规模工业化生产。
12.总之本发明方法益生菌活性高,成球率高,制备微胶囊速度快,制得的微胶囊结构稳定,还能最大程度保留菌体的活性,缓释性好。
附图说明
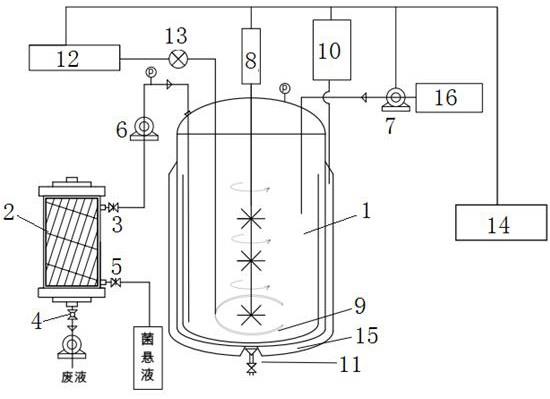
13.图1为本发明方法使用的装置示意图;图2为微胶囊在不同放大倍数下的光学显微镜下照片;图3为微胶囊在自然光(a)和荧光(b)下的倒置显微镜下照片;图4为微胶囊在人工胃液中的存活率结果示意图;
图5为不同作用时间对微胶囊在人工肠液中的崩解效果比较;图6为无保护剂微胶囊在4 ℃条件下存活率随储存时间的变化趋势(a)和统计结果(b);图7为添加保护剂微胶囊在4 ℃条件下存活率随储存时间的变化趋势(a)和统计结果(b);图中:1-发酵罐;2-中空纤维柱;3-止流阀ⅰ;4-双向阀;5-止流阀ⅱ;6-蠕动泵;7-补料蠕动泵;8-搅拌器;9-鼓气管;10-加热器;11-出料口;12-空气压缩机;13-空气过滤器;14-控制器;15-夹套;16-补料罐。
具体实施方式
14.下面结合具体实施例,进—步阐述本发明。但这些实施例仅限于说明本发明而不用于限制本发明的保护范围。以下实施例中的实验方法如无特别说明均为常规方法。以下实施例中所用材料、试剂等如无特别说明均可从商业途径得到,实施例中唾液乳杆菌(lactobacillus salivarius)分离自云南乌骨鸡肠道,对该株细菌的16s rdna序列进行同源性比较,经比较发现该菌与lactobacillus salivarius strain 5631序列的同源性达到99%,故鉴定为唾液乳杆菌;实施例中灭菌均是在115℃下处理20min;如图1所示,下述实施例中使用的装置包括发酵罐1、中空纤维柱2、控制器14、空气压缩机12、空气过滤器13,其中发酵罐内设置有搅拌器8,发酵罐罐体顶部开有进料口、菌液出口,出液口通过管道、蠕动泵6、止流阀ⅰ3与中空纤维柱2连接,中空纤维柱2废液出口处设置有双向阀4,中空纤维柱2菌液出口处设置有止流阀ⅱ5,带若干孔的环形鼓气管9设置在发酵罐内底部且通过空气过滤器13与空气压缩机12连接,发酵罐罐体外设置有夹套,加热器10为蒸汽加热器且与夹套连通,,发酵罐底部设置有出料口11,发酵罐罐体顶部的进料口通过4个补料蠕动泵7与4个补料罐16分别放置益生菌菌悬液或壳聚糖溶液、油相、冰醋酸、氯化钙溶液)连接,控制器14分别与加热器、补料蠕动泵、搅拌器、空气压缩机、空气过滤器、蠕动泵连接;实施例1:5 l发酵罐生产唾液乳酸杆菌微胶囊(1)将冷冻保藏的唾液乳酸杆菌在mrs固体培养基上划线,37℃活化培养48h,挑取单菌落置于mrs液体培养基中37℃静置培养24h,再以2%接种量接种到装有1000ml mrs液体培养基的发酵罐1中培养18h后,启动蠕动泵,打开止流阀ⅰ3和双向阀4,将发酵罐中的菌液输送到中空纤维柱2中进行过滤浓缩,菌液过滤完成后,立刻通过控制器14启动补料蠕动泵7将3000ml无菌水泵入中空纤维柱中,对隔绝在纤维柱外的益生菌进行洗涤;洗涤完毕后,关闭双向阀,打开止流阀ⅱ5,再将500ml无菌水泵入中空纤维柱中,通过止流阀ⅱ用灭菌后的容器收集益生菌菌悬液; 2、在发酵罐中加入500ml水、18g食品级海藻酸钠、18g caco3混合均匀,然后将保护剂(40g的海藻糖、60g的蔗糖、20g的乳糖、30g的甘油)加入发酵罐中搅拌,115℃下灭菌20min,冷却至37℃,然后将步骤1制得的有效活菌数为109cfu/ml的益生菌菌悬液500ml,通过控制器启动补料蠕动泵泵入到发酵罐中,混匀后制得水相; 3、量取2 l大豆油加入到补料瓶中,然后加入6ml司盘85,在115℃下灭菌20min制得油相;
ꢀ
4、按水相与油相的体积比为1∶2的比例,通过控制器启动补料蠕动泵将油相加入发酵罐的水相中,并设置发酵罐中搅拌器转速为400rpm,通过控制器开启空气压缩机12,空气通过空气过滤器13净化后以2倍罐体体积/min的量通入发酵罐中,搅拌5min,通过控制器启动补料蠕动泵将体积浓度10%的冰醋酸溶液40ml加入发酵罐中,固定化10min,停止搅拌,通过控制器启动补料蠕动泵向发酵罐中加入沉降剂0.3mol/l的灭菌氯化钙溶液100ml,微胶囊形成并缓慢沉降,最后采用补料蠕动泵依次吸走油相和水相后,收集微胶囊,得到直径为100-400μm的微胶囊,分离后油相用于下一批微胶囊制备; 5、通过控制器启动补料蠕动泵将质量浓度0.5%的壳聚糖溶液1l泵入发酵罐中与微胶囊混合,在400rpm下搅拌10min后从发酵罐底部出料口放出微胶囊悬液,经过120目筛网过滤后,滤渣用水洗涤2次,得到包埋湿微胶囊,微胶囊成粒性较好,粘连不明显,粒径均匀,如图2、3所示;微胶囊包埋率的测定:取1g的微胶囊置于锥形瓶中,然后加入100ml的0.06mol/l的柠檬酸钠溶液;在37℃恒温摇床中以180r/min震荡60min使唾液乳酸杆菌微胶囊完全溶解;溶解完成后,取0.1ml的溶解溶液进行稀释涂布,计算微胶囊活菌数;然后通过公式包埋率=微胶囊活菌数/包埋前活菌数
×
100%,计算包埋率;唾液乳酸杆菌的包埋率为87.1%。
15.实施例2:微胶囊在人工胃肠液中的耐酸特性实验用分析天平称取10g胃蛋白酶并置于烧杯中,再加入16.4ml 0.1mol/l的稀盐酸,充分搅拌后,用蒸馏水定容至1000ml的容量瓶中,使用ph计将ph调节至1.2,再使用0.2μm的滤膜过滤备用,制成人工胃液;将实施例1制得的1g微胶囊置于50ml已配置好的人工胃液中,在37℃、180r/min的条件下处理30 min、60 min、90 min、120 min,处理完成后离心收集微胶囊,并于50ml 0.06 mol/l的柠檬酸钠溶液中进行溶解,检测活菌数,同时使用实施例1步骤1中的制得的唾液乳酸杆菌种子液1ml替换微胶囊做对照实验。
16.由图4可知,唾液乳酸杆菌微胶囊起始浓度为7.23(lg(cfu/g)),在人工胃液中的环境中,微胶囊和裸菌的活菌数均有下降,其中裸菌在2h后出现显著下降。经过微胶囊化后的唾液乳酸杆菌在人工胃液中的下降率较裸菌较小,还存在7.10152(lg(cfu/g));结果表明,经过人工胃液处理2h后,微胶囊中唾液乳酸杆菌成活率达74.1%,微胶囊化对唾液乳酸杆菌起到明显的保护作用,从而帮助唾液乳酸杆菌抵抗人工胃液的侵蚀作用,能显著增强其在酸性环境中的存活率。
17.实施例3:微胶囊在模拟人工肠液中的崩解特性实验取称取6.5g磷酸二氢钾并置于烧杯中,再添加50ml的水将磷酸二氢钾溶解,使用0.1mol/l的氢氧化钠溶液将溶液的ph值调节至7.4,称取10g胰蛋白酶溶于上述溶液,用水定容至1000ml,再用0.2μm无菌滤膜过滤备用,制成人工肠液。取1g微胶囊置于50ml已配置好的人工肠液中,在37℃、180 r/min的条件下处理2 h;分别于30 min、60 min、90 min、120 min采样涂布进行活菌计数;为了让唾液乳酸杆菌在机体肠道中发挥预期功能,唾液乳酸杆菌微胶囊在肠道中需要尽快崩解,释放出唾液乳酸杆菌,结果如图5所示,唾液乳酸杆菌微胶囊于30min释放出唾液乳酸杆菌,但依旧存在微胶囊颗粒;在30 min到180 min之间,唾液乳酸杆菌缓慢释放,150 min到180 min唾液乳酸杆菌活菌数维持稳定,最终活菌数为7.16(lg(cfu/g))。
18.由此可见,唾液乳酸杆菌微胶囊具有较好的肠溶性,并且具有一定的缓释性,从而
能够在肠道中起到相应的益生作用。
19.实施例4:唾液乳酸杆菌微胶囊不同条件下保存时间的变化,实验检测组设置如下:1、实施例1制备的唾液乳酸杆菌微胶囊;2、实验方法同实施例1,制备唾液乳酸杆菌微胶囊时,水相中不添加保护剂;3、按质量比1:1、1:2、1:3、1:4的比例,将实施例1制备的唾液乳酸杆菌微胶囊与硅藻土混合干燥;4、实验方法同实施例1,制备唾液乳酸杆菌微胶囊时,水相中不添加保护剂,按质量比1:1、1:2、1:3、1:4的比例,将制得的唾液乳酸杆菌微胶囊与硅藻土混合干燥;5、唾液乳酸杆菌不制备成微胶囊;将上述各组在4℃下储存35天,并检测各组的活菌数,结果见图6、7,结果表明,随着储存时间的延长,各组活菌存活率都显著降低。未经微胶囊化的唾液乳酸杆菌只存活0.919%,极大地降低了其应用价值。而采用微胶囊化的唾液乳酸杆菌存活率显著上升,最低存活率的分组为未加保护剂和硅藻土的微胶囊,在35天降低至7.33%,而添加海藻糖等保护剂能够有效增加其活菌率,为8.49%,但新鲜微胶囊的储存效果依旧未达到理想效果,故添加硅藻土对新鲜微胶囊进行保护;添加4倍硅藻土能够显著增加唾液乳酸杆菌微胶囊的储藏稳定性,添加保护剂制备的微胶囊以1:4的比例混合硅藻土,在第5周具有51.62%的存活率,故在制备微胶囊制剂时,添加保护剂和用硅藻土混合,能提高唾液乳酸杆菌的存活率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1