提高脂溶性活性因子荷载量和稳定性的方法
1.本发明涉及食品加工技术领域,具体为提高脂溶性活性因子荷载量和稳定性的方法。
背景技术:
2.功能性食品的开发需要在食品中强化或补充生物活性因子,如胡萝卜素、虾青素、多酚、甾醇、维生素、功能性油脂、活性肽等。然而,由于受化学结构等因素的影响,许多活性因子存在溶解性弱、适口性差、生物利用度低、加工或储藏过程中易降解、胃肠道环境中稳定性不佳等问题。如何改善这些生物活性因子的水溶性,提高其稳定性和生物利用度,一直是食品加工过程中的难点,也是食品科学领域研究的热点问题。
3.食品蛋白因具有天然两亲性及胶体自组装性,被公认为是功能因子保护和输送的优良载体,被广泛用于食品胶体输送体系的构建,以改善活性因子溶解性弱、生物利用度低、加工或储藏稳定差等问题。当前,产业化应用的蛋白主要集中在水溶性较强的植物蛋白和乳蛋白,而对于疏水性较强的蛋白利用极为有限。相较水溶性蛋白而言,疏水性蛋白具有更丰富的疏水位点,可借助疏水相互作用实现脂溶性物质的包埋和输送,亦具有潜在的应用前景。然而,较弱的水溶性致使其难以在体系中均匀分散,限制了其广泛应用。
4.肌原纤维蛋白是肌肉中重要的结构蛋白,占肌肉蛋白总量的50-55%,在维持肉制品持水性、凝胶性、乳化性等功能中发挥重要作用。然而,其在水溶液中的溶解性并不高,单独作为乳化剂的潜力也有限,限制了它在某些食品中的应用。因此,为了拓宽肌原纤维蛋白的应用范围,亟需拓宽思路,寻求合适的技术对其进行改性处理。目前,用于蛋白质改性的方法很多,主要包括物理改性、化学改性和酶法改性等。利用多糖对蛋白质进行修饰,可以依靠多糖类物质的空间位阻效应有效抑制蛋白质的聚集,提高蛋白质的溶解性、稳定性和胶体稳定性。例如,中国专利申请cn201310697737.9提出利用葡萄糖对大豆分离蛋白进行糖基化修饰,得到的蛋白溶解性较修饰前提高了4.38倍,但是该方法对肌原纤维蛋白溶解度的改善还是非常有限的。此外,肌原纤维蛋白的氧化稳定性较弱,在氧化条件下容易发生结构改变(羰基化程度提高、巯基向二硫键转化增加等),氧化后蛋白质的两亲性和胶体性质等均会发生改变。因此,针对水溶性较弱肌原纤维蛋白,亟需通过合适的分子修饰技术同步提高蛋白质的溶解性、稳定性及胶体性质。
5.酶法改性是蛋白质改性的常见方式。黄建昭等采用木瓜蛋白酶对spi进行改性,发现spi的溶解性得到了显著提高;radha等对大豆蛋白进行酶法改性,发现酶解后蛋白质的溶解性得到改善,且蛋白的其他功能不受影响。中国专利cn201510013536.1利用超高压均质联合酶法对大豆分离蛋白进行改性也发现蛋白质的溶解性、保水性、保油性得到了改善。然而,当前对于肉蛋白的酶解改性报道的较少。结合多糖的较大空间位阻及酶解在改善蛋白两亲性的优越性对疏水性蛋白进行改性,有望实现疏水性蛋白作为疏水性活性物质载体在食品胶体输送体系中的应用。
6.然而,当前用于食品胶体输送体系构建的蛋白主要集中于水溶性较强的蛋白质,
疏水性蛋白质成功的案例较为罕见,国内外还没有公开任何关于联合酶解和糖基化修饰改善疏水性蛋白溶解性及胶体性质的案例。
技术实现要素:
7.本发明目的在于针对目前存在的现状,为解决上述问题,本发明提供提高脂溶性活性因子荷载量和稳定性的方法。
8.提高脂溶性活性因子荷载量和稳定性的方法:
9.首先通过胃肠消化酶对蛋白质进行有限酶解,使蛋白质分子结构内的亲水基团暴露,提高片段化蛋白的两亲性和自组装特性;然后利用多糖对蛋白酶解产物进行糖基化处理,得到改性后的蛋白重组颗粒;随后,加入脂溶性活性因子,利用环境响应特性诱发改性后蛋白重组颗粒与疏水性配体的包载,经冷冻干燥后获得包载脂溶性活性因子的复合物。
10.具体步骤如下:
11.s1、肌原纤维蛋白的酶解改性:将肌原纤维蛋白溶解分散在20mm磷酸盐缓冲液(含0.6mol/l nacl,ph7.4),使其蛋白浓度为20mg/ml,取50ml,调节ph值至7.0,加入0.1g胰蛋白酶(1500u/mg),在37℃下连续搅拌酶解2h,酶解后沸水灭酶5min,灭酶后用冰水冷却,冷却后水解液在10000rpm离心20min,去除沉淀;
12.s2、肌原纤维蛋白酶解产物的糖基化修饰:将上述酶解液置于磁力搅拌器中(300rpm),缓慢添加d-右旋糖酐粉末至添加量达到20mg/ml,将溶液ph调整至7.0后,继续充分搅拌并反应4h,所得溶液进行真空冷冻干燥,得到的粉末在60℃和79%相对湿度(rh)的饱和kbr溶液中反应24h,即为肌原纤维蛋白肽糖基化产物;
13.s3、d-右旋糖酐-肌原纤维蛋白肽纳米自组装颗粒的制备:将步骤(2)得到的肽糖基化产物在25℃下水浴搅拌3h,使之重新分散在20mm的磷酸盐缓冲溶液中至颗粒浓度为2mg/ml,随后转移至4℃静置过夜,使颗粒完全膨胀;
14.s4、糖基化肌原纤维蛋白肽-脂溶性因子复合胶体颗粒的制备:利用超声(250w,10min)将上述肌纤蛋白肽糖基化颗粒分散于在ph7.4的磷酸盐缓冲溶液中,得到2mg/ml壁材分散液;利用超声(250w,10min)分别将活性因子分散于无水乙醇中,得到活性因子含量为10mg/ml的芯材分散液,取出0.5ml的芯材分散液,在磁力搅拌器环境下(300rpm)逐滴加入到50ml-100ml的壁材分散液中,搅拌10min后将溶液继续在250w下超声10min,得到嵌入脂溶性因子的糖基化肌原纤维蛋白肽纳米组装颗粒。
15.本发明的有益效果:
16.本发明中,相较于未改性修饰的肌原纤维蛋白、单一酶法改性的肌原纤维蛋白、单一糖基化改性的肌原纤维蛋白等,联合酶法及糖基化修饰后肌纤蛋白重组颗粒具有更高的溶解性,其包载的虾青素、姜黄素和槲皮素等脂溶性成分的稳定性更好,整个储藏过程中体系仍呈现均一的状态。制备得到的包埋颗粒的包埋率高于80%。这说明本发明技术对肌原纤维蛋白的改性修饰,不仅改善了蛋白质溶解性和稳定性,且显著提高了脂溶性活性因子的包埋率和稳定性,有助于实现疏水性蛋白作为食品胶体输送体系载体在功能食品加工中应用。
附图说明
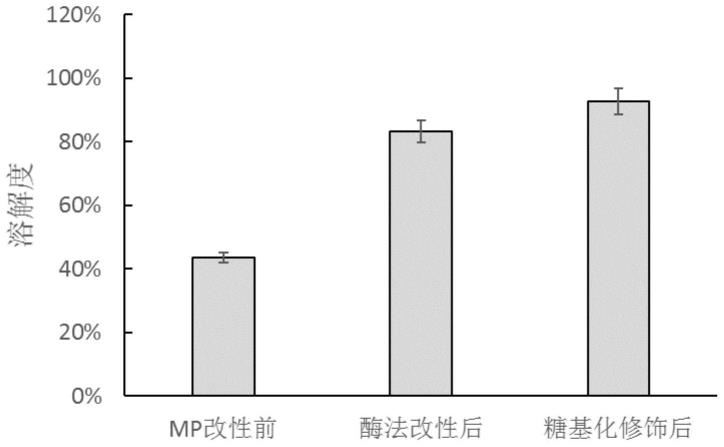
17.图1为mp修饰前后溶解性的变化;
18.图2为微胶囊中活性因子的包埋率;
19.图3为微囊中活性因子在不同光照环境下的稳定性;
20.图4为微囊中活性因子在不同加热环境下的稳定性。
具体实施方式
21.下面将结合本发明实施例中的附图表,对本发明的技术方案进行进一步详细的描述,但本发明并不局限于下述实施例。基于本发明中的实施例,在本领域中的普通技术人员没有做出创造性劳动的前提下所取得的所有其他实施例,都属于本发明的保护范围。
22.实施例1利用肌原纤维蛋白提高虾青素的荷载量和稳定性的方法:
23.s1、肌原纤维蛋白的酶解改性:将肌原纤维蛋白溶解分散在20mm磷酸盐缓冲液(含0.6mol/l nacl,ph7.4),使其蛋白浓度为20mg/ml,取50ml,调节ph值至7.0,加入0.1g胰蛋白酶(1500u/mg),在37℃下连续搅拌酶解2h,酶解后沸水灭酶5min,灭酶后用冰水冷却,冷却后水解液在10000rpm离心20min,去除沉淀;
24.s2、肌原纤维蛋白酶解产物的糖基化修饰:将上述酶解液置于磁力搅拌器中(300rpm),缓慢添加d-右旋糖酐粉末至添加量达到10mg/ml-20mg/ml,将溶液ph调整至7.0后,继续充分搅拌并反应4h,所得溶液进行真空冷冻干燥,得到的粉末在60℃和79%相对湿度(rh)的饱和kbr溶液中反应24h,肌原纤维蛋白肽糖基化产物,溶解性达到;
25.s3、d-右旋糖酐-肌原纤维蛋白肽纳米自组装颗粒的制备:将步骤(2)得到的肽糖基化产物用均质机(3000rpm,30s)重新分散在20mm的磷酸盐缓冲溶液中至颗粒浓度为2mg/ml,让上述溶液在25℃下水浴搅拌3h,随后转移至4℃静置8h,使颗粒完全膨胀;
26.s4、糖基化肌原纤维蛋白肽-虾青素复合胶体颗粒的制备:利用超声(250w,10min)将上述肌纤蛋白肽糖基化颗粒分散于在ph7.4的磷酸盐缓冲溶液中,得到2mg/ml壁材分散液;利用超声(250w,10min)将虾青素分散于无水乙醇中,得到活性因子含量为10mg/ml的芯材分散液,取出0.5ml的醇溶液,在磁力搅拌器环境下(300rpm)逐滴加入到50ml-100ml的壁材分散液中,搅拌10min后将溶液继续在250w下超声10min,得到嵌入脂溶性因子的糖基化肌原纤维蛋白肽纳米组装颗粒,微囊中虾青素的包埋率达到85.40%,微囊颗粒在光照48h后槲皮素的保留率达到64.28%,90℃加热30min后,槲皮素保留率为57.28%。
27.实施例2利用肌原纤维蛋白提高姜黄素的荷载量和稳定性的方法:
28.s1、肌原纤维蛋白的酶解改性:将肌原纤维蛋白溶解分散在20mm磷酸盐缓冲液(含0.6mol/l nacl,ph7.4),使其蛋白浓度为20mg/ml,取50ml,调节ph值至7.0,加入0.01g胰蛋白酶,在37℃下连续搅拌酶解2h,酶解后沸水灭酶15min,灭酶后用冰水冷却,冷却后水解液在10000rpm离心20min,随后用10kda的超滤膜去除大颗粒物质,再于4℃冰箱中用100da透析袋透析过夜;
29.s2、肌原纤维蛋白酶解产物的糖基化修饰:将上述酶解液置于磁力搅拌器中(300rpm),缓慢添加d-右旋糖酐粉末至添加量达到20mg/ml,将溶液ph调整至7.0后,继续充分搅拌并反应4h,所得溶液进行真空冷冻干燥,得到的粉末在60℃和79%相对湿度(rh)的饱和kbr溶液中反应24h,肌原纤维蛋白肽糖基化产物;
30.s3、d-右旋糖酐-肌原纤维蛋白肽纳米自组装颗粒的制备:将步骤(2)得到的肽糖基化产物用均质机(3000rpm,30s)重新分散在20mm的磷酸盐缓冲溶液中至颗粒浓度为2mg/ml,让上述溶液在25℃下水浴搅拌3h,随后转移至4℃静置8h,使颗粒完全膨胀;
31.s4、糖基化肌原纤维蛋白肽-姜黄素复合胶体颗粒的制备:利用超声(250w,10min)将上述肌纤蛋白肽糖基化颗粒分散于在ph7.4的磷酸盐缓冲溶液中,得到2mg/ml壁材分散液;利用超声(250w,10min)将姜黄素分散于无水乙醇中,得到活性因子含量为10mg/ml的芯材分散液,取出0.5ml的醇溶液,在磁力搅拌器环境下(300rpm)逐滴加入到50ml-100ml的壁材分散液中,搅拌10min后将溶液继续在250w下超声10min,得到嵌入脂溶性因子的糖基化肌原纤维蛋白肽纳米组装颗粒,微囊中姜黄素的包埋率达到88.6%,微囊颗粒在光照48h后槲皮素的保留率达到72.19%,90℃加热30min后,槲皮素保留率为65.19%。
32.实施例3利用肌原纤维蛋白提高槲皮素的荷载量和稳定性的方法:
33.s1、肌原纤维蛋白的酶解改性:将肌原纤维蛋白溶解分散在20mm磷酸盐缓冲液(含0.6mol/l nacl,ph7.4),使其蛋白浓度为20mg/ml,取50ml,调节ph值至7.0,加入0.01g胰蛋白酶,在37℃下连续搅拌酶解2h,酶解后沸水灭酶15min,灭酶后用冰水冷却,冷却后水解液在10000rpm离心20min,随后用10kda的超滤膜去除大颗粒物质,再于4℃冰箱中用100da透析袋透析过夜。
34.s2、肌原纤维蛋白酶解产物的糖基化修饰:将上述酶解液置于磁力搅拌器中(300rpm),缓慢添加d-右旋糖酐粉末至添加量达到10mg/ml-20mg/ml,将溶液ph调整至7.0后,继续充分搅拌并反应4h,所得溶液进行真空冷冻干燥,得到的粉末在60℃和79%相对湿度(rh)的饱和kbr溶液中反应24h,肌原纤维蛋白肽糖基化产物;
35.s3、d-右旋糖酐-肌原纤维蛋白肽纳米自组装颗粒的制备:将步骤(2)得到的肽糖基化产物用均质机(3000rpm,30s)重新分散在20mm的磷酸盐缓冲溶液中至颗粒浓度为2mg/ml,让上述溶液在25℃下水浴搅拌3h,随后转移至4℃静置8h,使颗粒完全膨胀;
36.s4、糖基化肌原纤维蛋白肽-槲皮素复合胶体颗粒的制备:利用超声(250w,10min)将上述肌纤蛋白肽糖基化颗粒分散于在ph7.4的磷酸盐缓冲溶液中,得到2mg/ml壁材分散液;利用超声(250w,10min)将槲皮素分散于无水乙醇中,得到活性因子含量为10mg/ml的芯材分散液,取出0.5ml的醇溶液,在磁力搅拌器环境下(300rpm)逐滴加入到50ml-100ml的壁材分散液中,搅拌10min后将溶液继续在250w下超声10min,得到嵌入脂溶性因子的糖基化肌原纤维蛋白肽纳米组装颗粒,微囊中槲皮素的包埋率达到90.7%,微囊颗粒在光照48h后槲皮素的保留率达到75.29%,90℃加热30min后,槲皮素保留率为64.29%。
37.上述实施例只为说明本发明的技术构思及特点,但本发明的实施方式并不受上述实施例的限制,其目的在于让本领域专业技术人员了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1