羟基多甲氧基黄酮类化合物及/或其衍生物的用途的制作方法
本发明涉及天然化合物的用途,特别涉及一种羟基多甲氧基类黄酮类化合物及/或其衍生物的用途。
背景技术:
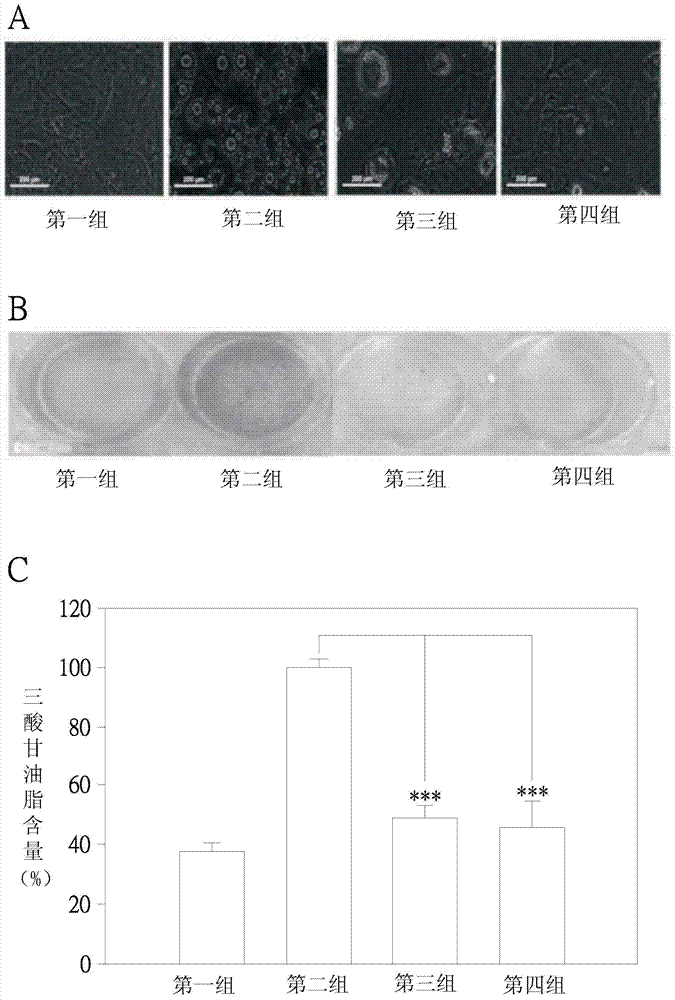
:目前,肥胖发生的主要原因在于个体摄取的热量高于其所消耗的热量,使过多能量以三酸甘油脂的型态累积于脂肪组织中,进而堆积于胰脏、肝脏、骨骼肌等处,促使肥胖及代谢症候群(metabolicsyndrome)的产生,如心血管疾病、高血压、高血脂症、第二型糖尿病等。目前世界卫生组织将肥胖列为一种慢性疾病,而台湾2004~2008年的营养健康调查结果显示营养过剩的结果会导致许多慢性疾病的发生。肥胖的治疗方法众多,如透过运动、控制热量、外科手术等方式,然而,现代人工作繁忙,且饮食习惯均以外食为主,因而欲以运动及控制热量等手段减重均无法有良好效果,另以如抽脂手术、胃绕道手术等外科手术的手段减重,其所需花费较高,并且术中会对于个体造成不确定风险。另有透过药物,如代谢刺激剂、食欲抑制剂、淀粉阻断剂等,达到减重的功效,然而长期服用药物仍有可能对于人体造成副作用。而为了避免服用药物可能对人体健康产生的潜在不良影响,目前有许多研究揭露天然成分或天然萃取物得通过抑制食欲、增加能量代谢等机制,达到抑制肥胖的功效,如咖啡因抑制磷酸二脂酶(phosphodiesterase)而提高细胞内环腺苷酸(cyclicadenosinemonophosphate)以增加能量的代谢、蝴蝶亚仙人掌萃取物得以抑制食欲、夏枯草萃取物得以抑制唾液淀粉酶的活性而作为淀粉阻断剂、仙连素或车前子得以促进脂质代谢而降低血液中三酸甘油脂。基于上述天然成分或天然萃取物的作用机制为非直接通过调节脂肪细胞的生命周期、抑制脂肪细胞分化、促进脂肪细胞分解作用等机制而达成的,因而减肥效果较为不显著,因此,为能更有效地抑制脂肪累积及抑制肥胖,目前许多研究致力于开发出能够透过调解脂肪细胞功能或抑制脂肪形成的天然成分。技术实现要素:本发明的主要目的在于提供一种羟基多甲氧基黄酮类(hydroxylpolymethoxylflavones;HPMFs)化合物及/或其于药学上能接受的盐类及/或上述形式以任意比例所形成的组合物的用途,其用于制备抑制肥胖的药物,用以抑制个体体内脂肪生成及脂肪分化,并且于不改变摄食率的状况下,可降低脂肪组织于脏器的累积,其中,该羟基多甲氧基黄酮类化合物来自一柑橘属植物的果皮,而该柑橘属植物可以为柚、柑、橘、橙或柠檬等。本发明的另一目的在于提供一种羟基多甲氧基黄酮类(hydroxylpolymethoxylflavones;HPMFs)化合物及/或其于药学上能接受的盐类及/或上述形式以任意比例所形成的组合物的用途,其用于制备治疗脂肪肝的药物,用以改善脂肪肝病变,并且减少于肝脏中所累积油滴,其中,该羟基多甲氧基黄酮类化合物来自一柑橘属植物的果皮,而该柑橘属植物可以为柚、柑、橘、橙或柠檬等。本发明的次一目的在于提供一种食品,其用以提供作为个体于日常预防代谢症候群或相关症状之用,而该食品至少包含一羟基多甲氧基黄酮类化合物,其中,该羟基多甲氧基黄酮类化合物来自一柑橘属植物的果皮,而该柑橘属植物可以为柚、柑、橘、橙或柠檬等。本发明的优点在于:通过本发明所揭羟基多甲氧基黄酮类化合物具有抑制脂肪分化、抑制脂肪成熟、改善脂肪肝、降低脂肪堆积的能力,能够作为一药物的有效成分,达到抑制肥胖或治疗脂肪肝的目的,此外,基于该羟基多甲氧基黄酮类化合物来自于天然植物,对于细胞无毒性,降低了对个体的副作用,另也能作为食品组成成分而制备成为日常保健食品,达到预防肥胖及改善脂肪肝的目的。附图说明图1A为3T3-L1前脂肪细胞培养第0天的细胞型态。图1B为3T3-L1前脂肪细胞培养第2天的细胞型态。图1C为3T3-L1前脂肪细胞培养第4天的细胞型态。图1D为3T3-L1前脂肪细胞培养第6天的细胞型态。图1E为3T3-L1前脂肪细胞培养第8天的细胞型态。图1F为3T3-L1前脂肪细胞培养第8天以油红O染色的结果。图2A及B分别为经不同处理的3T3-L1前脂肪细胞于分化第8天以油红O染色的结果。图2C表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其三酸甘油脂的含量。图3A表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其PPARγ的表现。图3B表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其C/EBPα的表现。图4A表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其脂肪酸合成酶表现。图4B表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其脂肪酸连结蛋白2表现。图4C表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其乙酰辅脢A羧化酶表现。图5A表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其腺苷酸活化蛋白激酶α及磷酸化腺苷酸活化蛋白激酶α上Thr172的表现。图5B表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其腺苷酸活化蛋白激酶β及磷酸化腺苷酸活化蛋白激酶β上Ser108的表现。图5C表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其固醇调节元件结合蛋白1c的表现。图6表示经不同处理的3T3-L1前脂肪细胞于分化第8天时,其PI3K及磷酸化PI3K上Tyr508与AKT及磷酸化AKT上的Ser473的表现。图7为经不同处理的3T3-L1前脂肪细胞的细胞周期分析的结果。图8为经不同条件饲养的各组小鼠的体重变化。图9为经不同条件饲养的各组小鼠的摄食量。图10为经不同条件饲养的各组小鼠的外观。图1IA至图11D分别为经不同条件饲养的各组小鼠的性腺脂肪外观。图12A至图12D依序分别为经不同条件饲养的小鼠的腹部脂肪外观。图13为经不同条件饲养的各组小鼠的性腺脂肪重量。图14为经不同条件饲养的各组小鼠的腹部脂肪重量。图15为经不同条件饲养的各组小鼠的肠道脂肪重量。图16A至图16D依序分别为经不同条件饲养的各组小鼠的肝脏切片染色图。具体实施方式本发明所揭羟基多甲氧基黄酮类化合物及/或其衍生物的用途是有关于抑制脂肪生成、抑制脂肪分化及降低脂肪累积,而该羟基多甲氧基黄酮类化合物及/或其衍生物可以一有效剂量而作为制备用于抑制肥胖或治疗脂肪肝的药物的有效成分,也可以用于制备一食品组成物,其中,该羟基多甲氧基黄酮类化合物来自于一柑橘属植物的果皮。通过对一个体投予该药物或该食品组成物,用以抑制该个体体内脂肪细胞分化以及降低脂肪细胞累积。更进一步而言,该羟基多甲氧基黄酮类化合物是将多甲氧基黄酮类(polymethoxylflavones;PMFs)上的至少一甲氧基(-OCH3)转变为氢氧基(-OH)而得到的。过去研究中指出3T3-L1前脂肪细胞分化为成熟脂肪细胞涉及许多因子的作用,如透过刺激脂质生合成相关的转录因子,如PPAR及C/EBPs,则能促进3T3-L1前脂肪细胞分化,其中,C/EBPs能活化脂肪代谢酵素的基因,如脂肪酸连结蛋白2(fattyacidbindingprotein2;aP2);固醇调节元件结合蛋白(SREBP-1)为脂肪分化的决定因子,能用以转录出许多重要的脂肪生成基因,如脂肪酸合成酶(fattyacidsynthase;FAS)、乙酰辅脢A羧化酶(acetyl-CoAcarboxylase;ACC),而能加速合成脂肪酸及脂肪,更可用以活化PPARγ。此外,透过LKB1/STK11会磷酸化腺苷酸活化蛋白激酶α(AMPKα)上的Thr172而使之活化,进而磷酸化乙酰辅脢A羧化酶活性降低,抑制脂肪酸合成,换言之,调节腺苷酸活化蛋白激酶(Adenosinemonophosphate-activatedproteinkinase;AMPK),因而其成为抗脂肪生成的指标。由于本发明所述的羟基多甲氧基黄酮类化合物调节脂肪分化的转录因子及相关路径,因而能够具有抑制脂肪分化及减缓脂肪成熟知能力,详言之,该羟基多甲氧基黄酮类化合物能够抑制脂肪细胞分化过程中重要的转录因子表现,如PPARγ及C/EBPα,并且抑制下游目标基因的蛋白质表现,如乙酰辅脢A羧化酶、脂肪酸合成酶、aP2,而能减缓三酸甘油酯的累积,再者,其能活化腺苷酸活化蛋白激酶的信息传递路径及抑制PI3K/Akt的信息传递路径,而能达到抑制前脂肪细胞分化的目的。而本发明说明书与权利要求中所述的名词分别说明如下,然而,下列说明仅为例示性说明,非作为限制本发明说明书及权利要求。所谓“药物”,指由一有效成分,如本发明所揭羟基多甲氧基黄酮类化合物、其于药学上能接受的盐类或上述形式以任意比例所形成的组合物,与至少一医药上可接受载体及/或赋形剂结合而制成适当投予形式,其中,适当投予形式为如粒剂、粉剂、锭剂、胶囊剂、栓剂、汁液、悬浮剂、滴剂、可用以注射的溶剂等。所谓“药学上可接受的盐类”,是指羟基多甲氧基黄酮类化合物的酸性或碱性产物,而可以其盐类或游离形式存在,其中,可形成盐的羟基多甲氧基黄酮类化合物,包含其立体异构物形式。所谓“有效剂量”,是指依据个体种类、个体重量及投予方式进行计算后所得。所谓“投予”,是指口服、吸入、经直肠内、经皮肤吸收、或通过皮下、动脉、静脉、腹膜等注射方式。所谓“食品”,是指以任何形式存在而供个体食用的,如粒状制品、粉状制品、固体、液态制品、悬浮液制品、半固态制品、乳品等食品。以下将兹举若干实例及图式作更进一步说明如后。实例1:制备羟基多甲氧基黄酮类化合物取10克橘皮萃取物,其内含有40%多甲氧基黄酮类,以95%的乙醇溶解后再加入3M的盐酸(hydrochloricacid;HCl)。将上述混合溶液进行加热回流12小时,其反应过程均以TLC和LC/MS监测,待反应结束后冷却,并以真空装置去除乙醇,加入乙酸乙酯和水进行萃取。收集有机层萃取物,水层萃取物再以乙酸乙酯萃取后合并。完成合并的有机萃取层以稀释的碳酸氢钠(sodiumbicarbonate)溶液、水及盐水(30%NaCl)溶液洗涤,并且以无水硫酸钠(sodiumsulfate)去除水分予以干燥。而后经由过滤、减压浓缩与冻干(lyophilized)后所得到呈淡黄色固体为羟基多甲氧基黄酮类化合物。实例2:3T3-L1前脂肪细胞培养将3T3-L1前脂肪细胞培养以含10%小牛血清,10,000units/mL盘尼西林与10,000μg/mL链霉素的DMEM培养基中,于10公分培养盘中,置于5%二氧化碳的37℃细胞培养箱中进行培养。当细胞生长至约7~8分满时,去除培养液并以磷酸盐缓冲液冲洗后,于37℃加入适量胰蛋白酶(trypsin-EDTA)后,轻拍培养盘使所培养出的细胞脱离培养盘底部,再以新鲜的培养基终止胰蛋白酶的作用,利用吸量管抽吸数次将细胞均匀打散后,以固定比例将细胞均匀分配至各种大小的培养盘中,置于5%二氧化碳的37℃细胞培养箱中培养。实例3:3T3-L1前脂肪细胞分化试验将3T3-L1前脂肪细胞种入24孔培养盘中,以一含有小牛血清(fetalcalfserum)的DMEM培养基培养3天后,再将培养基换成另一含有小牛血清(fetalbovineserum)的DMEM培养基培养2天而将此培养完成日定义为第0天,并得依据不同处理条件于第2天加入DMI诱导剂(DEX、MIX、insulin)培养基培养2天,用以使3T3-L1前脂肪细胞分化。再将培养基换成一含10%小牛血清(fetalbovineserum)及5μg/mL药剂INS的DMEM培养基,培养2天后,于第4天、第6天及第8天时分别将培养基换成一含有10%小牛血清(fetalbovineserum)的培养基。而于第0天至第8天的培养过程中每2天观察3T3-L1前脂肪细胞的细胞型态,结果如图1A至图1E所示,并将完成第8天培养的3T3-L1前脂肪细胞以油红O染色,结果如图1F所示,其中,红色部分为脂肪细胞内的红色脂肪球。由图1的结果显示未分化的3T3-L1前脂肪细胞的细胞型态为纺锤状(如图1A);而于第2天时,部分3T3-L1前脂肪细胞的细胞型态逐渐变为圆形;于第4天时,3T3-L1前脂肪细胞内始产生小型油滴;于第6天时,3T3-L1前脂肪细胞内所聚集的油滴增加;而于第8天时,90%以上的3T3-L1前脂肪细胞分化为成熟的脂肪细胞,其内有大小油滴聚集。实例4:3T3-L1前脂肪细胞内脂质堆积试验如同实例3的步骤进行3T3-L1前脂肪细胞的分化至第8天,并且于分化过程中以不同处理条件予以分为四组,其中,第一组为空白组,第二组为仅于第2天加入DMI培养基的,作为对照组,第三组与第四组则分别于第2天加入DMI培养基,并分别于培养第0天、第2天、第4天、第6天添加剂量为10μg/mL及20μg/mL的羟基多甲氧基黄酮类化合物。将各组于8天培养完成,将细胞进行染色(OilRedO),并以显微镜观察并拍照,结果如图2A及图2B所示。再以分光光度计(510nm)进行定量,结果如图2C所示。由图2的结果显示,未加入DMI诱导剂的第一组,其3T3-L1前脂肪细胞为未分化的状态,细胞型态呈现纺锤状;仅以DMI诱导剂处理的第二组,其3T3-L1前脂肪细胞细分化成为成熟的脂肪细胞,细胞型态呈圆形,并且可观察到成熟的脂肪细胞内所具有红色脂肪球;而第三组及第四组所得的3T3-L1前脂肪细胞内红色脂肪球分别相较第二组减少许多。换言之,羟基多甲氧基黄酮类化合物可抑制经DMI诱导剂诱导3T3-L1前脂肪细胞脂质合成作用。因此,由图2结果显示,以羟基多甲氧基黄酮类化合物处理后,3T3-L1前脂肪细胞内脂质含量有减少的趋势,并且得显著性抑制前脂肪细胞内脂质堆积。实例5:羟基多甲氧基黄酮类化合物抑制脂肪分化的机制分析如同实例3及实例4的步骤将3T3-L1前脂肪细胞进行分化培养至第8天,并于分化过程中以不同处理条件而予以分为四组,其中,第一组为空白组,第二组为仅于第2天加入DMI培养基的,作为对照组,第三组与第四组则分别于第2天加入DMI培养基,并分别于培养第0天、第2天、第4天、第6天添加剂量为10μg/mL及20μg/mL的羟基多甲氧基黄酮类化合物。收集各组的全细胞溶解液,以西方点墨法进行各组的蛋白质表现的分析,结果如图3至图5所示,其中,图3A为各组PPARγ的表现,图3B为各组C/EBPα的表现,图4A为各组的脂肪酸合成酶表现结果,图4B为各组脂肪酸连结蛋白2的表现,图4C为各组乙酰辅脢A羧化酶的表现;图5A为各组腺苷酸活化蛋白激酶α及磷酸化腺苷酸活化蛋白激酶α上Thr172(p-AMPKα(Thr172))的表现,图5B为各组腺苷酸活化蛋白激酶β及磷酸化腺苷酸活化蛋白激酶β上Ser108(p-AMPK(Ser108))的表现,图5C为各组的固醇调节元件结合蛋白1c(SREBP-lc)表现。另如同上述步骤而分为三组,第一组为空白组,第二组为仅于第2天加入DMI培养基的,作为对照组,第三组为于第2天加入DMI培养基,并于培养第0天、第2天、第4天、第6天添加剂量为20μg/mL的羟基多甲氧基黄酮类化合物。而后收集各组的全细胞溶解液,以西方点墨法进行各组的蛋白质表现的分析,结果如图6所示,其中,图6为各组PI3K及磷酸化PI3K上Tyr508(p-PI3K(Tyr508))与AKT及磷酸化AKT上的Ser473(p-Akt(Ser473))的表现。由图3及图4的结果可知仅以DMI诱导剂处理的第二组,其PPARγ、C/EBPα、乙酰辅脢A羧化酶、脂肪酸合成酶及aP2等蛋白质的表现量均较第一组增加,而以羟基多甲氧基黄酮类化合物处理的第三组或第四组,其PPARγ、C/EBPα、乙酰辅脢A羧化酶、脂肪酸合成酶及脂肪酸连结蛋白2等蛋白质的表现量较第二组的表现量下降。由图5的结果可知磷酸化腺苷酸活化蛋白激酶α上Thr172与磷酸化腺苷酸活化蛋白激酶β上Ser108的表现量于第一组与第二组中无差异,而相较于第二组,第三组或第四组中磷酸化腺苷酸活化蛋白激酶α上Thr172与磷酸化腺苷酸活化蛋白激酶β上Ser108的表现量随着羟基多甲氧基黄酮类化合物的浓度增加而上升,并减少固醇调节元件结合蛋白1c的表现量。由图6的结果可知第二组的磷酸化PI3K上Tyr508及磷酸化AKT上的Ser473的表现较第一组者为增加,而第三组中磷酸化PI3K上Tyr508及磷酸化AKT上的Ser473的表现则较第二组减少。由图3至图6的结果显示由于羟基多甲氧基黄酮类化合物得抑制脂肪细胞分化过程中所必须的转录因子PPARγ、C/EBPα及下游蛋白质乙酰辅脢A羧化酶、脂肪酸合成酶及aP2的表现,并增加磷酸化腺苷酸活化蛋白激酶α及腺苷酸活化蛋白激酶β上的蛋白质而活化腺苷酸活化蛋白激酶信息传递路径,减少固醇调节元件结合蛋白表现量而抑制PPARγ基因表现及下游蛋白质乙酰辅脢A羧化酶和脂肪酸合成酶表现,且减少磷酸化PI3K上Tyr508及磷酸化AKT上的Ser473而抑制PI3K/Akt信息传递路径,据此,可达到抑制3T3-L1前脂肪细胞分化的功效。实例6:3T3-L1前脂肪细胞的细胞周期分析将3T3-L1前脂肪细胞种入24孔盘中,以一含有小牛血清(fetalcalfserum)的DMEM培养基培养3天,再将培养基换成另一含有小牛血清(fetalbovineserum)的DMEM培养基培养2天后,将此培养完成日定义为第0天,而后依据不同培养条件予以分组,培养2天,其中,第一组为空白组,第二组为仅于第2天加入DMI培养基者,作为对照组,第三组与第四组则分别于第2天加入DMI培养基,并分别添加剂量为10μg/mL及20μg/mL的羟基多甲氧基黄酮类化合物。于18及24小时,分别将各组细胞固定而以碘化丙啶染色,通过流式细胞仪及软体(ModFitLT)分析各组的细胞周期分布,结果如图7及下表一所示。表一:各组经不同培养时间的细胞周期分布由图7的结果可知于处理18小时后,第一组有76.72%的3T3-L1前脂肪细胞停滞于G0/G1期,仅由15.36%的3T3-L1前脂肪细胞进入S期,第二组有71.89%的3T3-L1前脂肪细胞进入S期,第三组29.64%的3T3-L1前脂肪细胞进入S期,第四组有12.21%的3T3-L1前脂肪细胞进入S期;而处理24小时后,第一组3T3-L1前脂肪细胞的细胞周期仍停滞于G0/G1期,第二组的3T3-L1前脂肪细胞有35.47%进入G2/M期,第三组有10.17%的3T3-L1前脂肪细胞进入G2/M期,第四组的3T3-L1前脂肪细胞仅有4.84%进入G2/M期。由图7结果显示DMI诱导剂会诱发3T3-L1前脂肪细胞的细胞扩增(mitoticclonalexpansion),而羟基多甲氧基黄酮类化合物可延缓经DMI诱导剂所诱发的细胞扩增现象,使细胞周期停滞在G0/G1期,影响3T3-L1前脂肪细胞分化而抑制脂肪生成。实例7:制备肥胖小鼠动物模式取预定数量的周龄4周C57BL/6雄性小黑鼠,分为四组而分别以不同饲养条件对待,其中,第一组为空白组,仅喂食饲料及水,第二组喂食膏油脂饲料及水,第三组喂食高油脂饲料、水及剂量为每公斤250毫克的羟基多甲氧基黄酮类化合物,第四组喂食高油脂饲料、水及剂量为每公斤10克的羟基多甲氧基黄酮类化合物。各组小鼠饲养10周,每周分别测量各组小鼠的重量,如图8所示,而各组小鼠的摄食量经统计如图9所示,并且于第十周时拍摄各组小鼠的外观,分别如图10A至图10D所示。由图8至图10的结果可知于第0周至第10周的饲养过程中,各组小鼠所摄取的饲料量差异性不大;而于体重变化方面,第一组小鼠体重由20.27克增加至23.91克,增加15.18克,第二组小鼠体重由19.93克增加至35.11克,增加15.18克,第三组小鼠体重由19.15克增加至27.18克,增加8.03克,第四组小鼠体重由19.32克增加至27.18克,增加7.86克;而经由10周饲养,第二组的小鼠外观相较于第一组的小鼠外观明显变大,第三组及第四组的小鼠外观分别较第二组小的鼠外观变小,且第四组的小鼠外观更相近第一组的小鼠外观。据此,由上述结果显示喂食高油脂饲料确实可制备肥胖小鼠,而通过喂食羟基多甲氧基黄酮类化合物,可抑制肥胖小鼠的体重增加。换言之,羟基多甲氧基黄酮类化合物具有抑制体重增加的功效。实例8:各组小鼠的各脏器重量分析将实例7的各组小鼠予以牺牲,并分别将各组小鼠的肝脏、肾脏、脾脏称重后纪录结果如下表二所示。表二:各组小鼠的脏器重量脏器第一组第二组第三组第四组肝脏1.14±0.171.47±0.07#1.30±0.161.23±0.08*肾脏0.45±0.020.54±0.05#0.44±0.05*0.40±0.03脾脏0.06±0.010.07±0.010.07±0.020.07±0.01由表二的结果可知相较于第一组小鼠,第二组小鼠的肝脏及肾脏重量分别增加0.33克及0.06克,显示多余脂肪累积于脏器内而使脏器重量增加,而相较于第二组小鼠,第三组小鼠的肝脏及肾脏重量分别减少0.17克及0.10克,第四组小鼠的肝脏及肾脏重量分别减少0.24克及0.14克,显示喂食羟基多甲氧基黄酮类化合物具有抑制脂质累积于肝脏及肾脏等脏器的功效,并且随着喂食剂量增加,其效果更为显著。再者,由于第一组至第四组的小鼠脾脏重量均无显著差异性存在,显示羟基多甲氧基黄酮类化合物不具有毒性。实例9:各组小鼠体内脂肪分析将实例7的各组小鼠予以牺牲后,分别取各组小鼠的性腺、腹部、肠道的白色脂肪组织而观察各该部位的脂肪组织外观,结果如图11及图12所示,其中,图11A至图11D依序分别为第一组至第四组小鼠的性腺脂肪外观,图12A至图12D依序分别为第一组至第四组小鼠的腹部脂肪外观。再者,将各组小鼠的性腺、腹部、肠道的脂肪予以称重,结果如下:第一组小鼠性腺、腹部、肠道的脂肪重量分别为0.60g、0.06g、0.34g;第二组小鼠性腺、腹部、肠道的脂肪重量分别为1.65g、0.56g、0.67g;第三组小鼠性腺、腹部、肠道的脂肪重量分别为0.79g、0.21g、0.39g;第四组小鼠性腺、腹部、肠道的脂肪重量分别为0.42g、0.06g、0.27g,并将称重结果经统计后如图13至图15所示,其中图13为各组小鼠性腺脂肪重量的称重结果,图14为各组小鼠腹部脂肪重量的称重结果,图15为各组小鼠肠道脂肪重量的称重结果。由图11至图12的结果可知相较于第一组的性腺及腹部脂肪外观,第二组的性腺及腹部脂肪外观明显变大;然相较于第二组的性腺及腹部脂肪外观,第三组及第四组的性腺及腹部脂肪外观则分别明显变小。再者,由图13至图14的结果可知相较于第一组小鼠性腺、腹部、肠道的脂肪重量,第二组小鼠性腺、腹部、肠道的脂肪重量分别增加1.05克、0.50克、0.33克;而相较于第二组小鼠性腺、腹部、肠道的脂肪重量,第三组小鼠性腺、腹部、肠道的脂肪重量分别降低0.86克、0.35克、0.26克,第四组小鼠性腺、腹部、肠道的脂肪重量分别降低1.23克、0.50克、0.38克。由图11至图15的结果显示羟基多甲氧基黄酮类化合物具有抑制脂肪组织扩张的功效,并且随着剂量增加而能增加该功效。实例10:各组小鼠的血清生化检测将实例7的各组小鼠予以牺牲后,分别取各组小鼠血液,经离心后而得到血清,用以进行血清中的天门冬酸转胺酵素(GOT)、丙胺酸转胺酵素(GPT)、三酸甘油酯(TG)及总胆固醇(T-cho)等肝脏生化功能指标的分析,结果如下表三所示。表三:各组小鼠的肝脏生化功能指标含量由表三的结果可知第二组小鼠相较于第一组小鼠,其丙胺酸转胺酵素、三酸甘油酯及总胆固醇的浓度分别较为上升,而第三组及第四组小鼠分别相较于第一组小鼠,其天门冬酸转胺酵素、丙胺酸转胺酵素、三酸甘油酯及总胆固醇则均分别减少。因此,由表三的结果显示羟基多甲氧基黄酮类化合物具有降低脂肪肝病变的风险及降低脂肪累积的功效,并且该功效随着喂食剂量增加而提升。实例11:各组小鼠肝脏切片分析将实例7的各组小鼠牺牲后而分别取其肝脏,将各组小鼠的肝脏先以福马林固定,再以石蜡包埋后进行切片。而后将各组小鼠的肝脏切片进行脱蜡后而以苏木精-伊红染剂予以染色,结果如图16所示,其中,图16A至图16D依序分别为第一组至第四组小鼠肝脏切片染色的结果。由图16的结果可知相较于第一组的肝脏细胞来说,第二组的肝脏细胞排列有显著不同,并且其内累积大量油滴而造成肝脏的病变,而喂食低剂量羟基多甲氧基黄酮类化合物的第三组小鼠肝脏切片中所累积的油滴较为减少,喂食高剂量羟基多甲氧基黄酮类化合物的第四组小鼠肝脏切片不仅大幅减少其内所累积的油滴,并且使肝脏细胞的排列趋于正常状态。是以,由图16的结果显示羟基多甲氧基黄酮类化合物具有改善脂肪肝病理状况的功效,并且该功效随着喂食剂量增加而提升。据此,通过本发明所揭羟基多甲氧基黄酮类化合物具有抑制脂肪分化、抑制脂肪成熟、改善脂肪肝、降低脂肪堆积的能力,能够作为一药物的有效成分,达到抑制肥胖或治疗脂肪肝的目的,此外,基于该羟基多甲氧基黄酮类化合物来自于天然植物,对于细胞无毒性,降低了对个体的副作用,另也能作为食品组成成分而制备成为日常保健食品,达到预防肥胖及改善脂肪肝的目的。以上仅是通过各该实施例详细说明本发明,熟知该
技术领域:
者于不脱离本发明精神下,而对于说明书中的实施例所做的任何简单修改或是变化,均应为本申请保护范围所涵盖。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1