阿戈美拉汀水溶液及其制备方法和应用与流程
本发明涉及一种阿戈美拉汀制剂技术。
背景技术:
抑郁症是由人格因素、社会心理及慢性疾病等诸多亚健康因素引发的心理疾病,其主要表现为持久的心境低落、情绪消沉、抑郁,甚至产生自杀企图或行为,同时经常伴随有行为、睡眠、中心温度和皮质醇及其他激素的生物周期节律紊乱,从而严重的影响了人的正常工作和生活,为社会带来不良影响。
据世界卫生部门最新发布的统计报告显示,全球的抑郁症患者已超过3.5亿,同时由于治愈率和发病率的差距,导致抑郁症患病人数逐年递增。抑郁症现已成为人类继癌症、卒中、和慢性阻塞性肺病的第四大慢性疾病。
阿戈美拉汀(Agomelatine)作为治疗成人重度抑郁症(major depressive disorder MDD)的药物,是首个褪黑素受体激动剂,也是5-羟色胺2C(5-HT2C)受体拮抗剂。临床研究表明该药具有抗抑郁、抗焦虑、调整睡眠节律及调节生物钟的作用。此外,与选择性5-羟色胺再摄取抑制剂(SSRI)及5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRI)相比,阿戈美拉汀的不良反应显著减少,患者依从性更好。因此,阿戈美拉汀被誉为精神疾病类又一个“重磅炸弹”级的药物。该药是由法国Servier公司首先开发,剂型为普通片剂,于2009年在欧盟获得批准,英文商品名维度新(Valdoxan)。
中文名:阿戈美拉汀,分子式:C15H17NO2,分子量:243.3,结构式:
欧洲药品管理局(EMA)人用医药产品委员会公布的维度新的评估报告(CHMP assessment report for Valdoxan)指出,阿戈美拉汀的首过效应较为明显,维度新在人体内的生物利用度仅为3%-4%,并且个体间的药物代谢与药效差异较大。近年来,研究者们尝试研究阿戈美拉汀的新剂型,以解决以上问题:专利申请US2007/0134331A1提出了阿戈美拉汀口腔分散技术;专利CN103040750B提出了阿戈美拉汀脂质体技术专利,以上专利虽然提供了与原研厂家不同的阿戈美拉汀剂型,但在制剂稳定性、放大生产可 行性、患者依从性上严重影响了其药物制剂开发的可行性。
为了提高阿戈美拉汀的溶出度,专利申请CN102218050A提出了原料为微粉化的阿戈美拉汀的药物组合物。但是在大规模生产中,其工艺生产效率低,成本昂贵,且对微粉化的阿戈美拉汀需要进行严格质量控制。
专利申请CN104523589A提出阿戈美拉汀口服混悬液药物组合物,但与本发明相比,在提高药物生物利用度,增加水中溶解度,及长期稳定性上不具备优势。
另外,也有研究者尝试应用环糊精及其衍生物作为药物载体来提高阿戈美拉汀水溶性。专利申请WO 2014/012571A1和专利申请CN103623423A都以环糊精作为阿戈美拉汀的制剂载体,制备无晶型的阿戈美拉汀-环糊精固体粉末。本发明者重复专利申请WO 2014/012571A1实施例一和例三,发现该阿戈美拉汀-环糊精粉末分别属于《中国药典》规定的在水中“略溶”和“难溶”水平。而通过重复专利申请CN103623423A的实施例一、二、三、十二,其阿戈美拉汀包合物粉末在水中并未达到所述的“溶解”和“极易溶解”的水平。使用上述两个专利的阿戈美拉汀-环糊精包合技术,并不能获得与本发明等同的高水溶性及长期稳定的阿戈美拉汀/环糊精水溶液。
以上专利和专利申请在解决阿戈美拉汀制剂的溶出度、生物利用度、患者依从性,工业生产可行性等问题的尝试均存在一定不足。
技术实现要素:
本发明的目的是提供一种阿戈美拉汀水溶液的制备方法和应用,以克服现有技术存在的缺陷。
所述的阿戈美拉汀水溶液,含有阿戈美拉汀与环糊精,阿戈美拉汀与环糊精的质量比(w/w)为1:1-1:50,优选为1:16-1:40;
以阿戈美拉汀水溶液的总质量计,阿戈美拉汀在所述的环糊精水溶液中的浓度为1-100mg/ml,根据阿戈美拉汀溶解情况和环糊精的临床用量,优选为1-30mg/ml。
所述的阿戈美拉汀包括阿戈美拉汀及其药学上可接受的盐型。
所述的阿戈美拉汀的晶型包括但不限于Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ、A、B、C、D、X、Y,或两种及以上的混合晶型以及其共结晶;
所述环糊精包括α-环糊精、β-环糊精、γ-环糊精、羟丙基-β-环糊精(HP-β-CD)、磺丁基-β-环糊精(SBE-β-CD)、甲基-β-环糊精(RM-β-CD)及其它环糊精衍生物,优选为羟丙基-β-环糊精;
所述羟丙基-β-环糊精的平均取代度(DS)可以是2.0-12.0或其多种取代度的混合物,其中平均取代度优选为3.0-6.0。
阿戈美拉汀(AG)在水中溶解度低,经测试为0.1-0.2mg/ml,同时该溶液不稳定,长期放置后有关物质(如:水解产物)明显增加,极不利于制成澄清透明稳定的液体制剂。为得到溶解度高、稳定性好且加水稀释无AG晶体析出的阿戈美拉汀水溶液,发明者通过大量实验,发现用环糊精的水溶液溶解阿戈美拉汀可以得到澄清透明溶液,且该溶液物理化学稳定性良好。表1列出了阿戈美拉汀在不同溶剂中的最大溶解度,及加水稀释100倍后的稳定性。由表1可见,虽然在有机溶剂(乙醇、丙二醇、聚乙二醇-400)中AG的溶解度(分别为:500mg/ml、140mg/ml、300mg/ml)大于其在HP-β-CD水溶液的溶解度(50mg/ml),但是有机溶剂溶解阿戈美拉汀后加水稀释100倍,析出AG晶体,同时,即使有机溶剂(乙醇、丙二醇、聚乙二醇-400)也溶解50mg/ml,加水稀释100倍后也有AG晶体析出。而阿戈美拉汀虽然在酸性、碱性、表面活性剂溶液中稳定,但AG的溶解度(分别为0.2mg/ml、0.2mg/ml、0.7mg/ml)远低于其在HP-β-CD水溶液的溶解度。可见,环糊精水溶液在增加阿戈美拉汀溶解性、稳定性及安全性比现有的溶剂增溶方法有显著优势。这为开发一种阿戈美拉汀液体制剂和拓展阿戈美拉汀的给药途径提供了可行性。
表1不同溶剂中阿戈美拉汀最大溶解度(AGmax)和加水稀释后溶液外观变化
其方法为:
本发明的阿戈美拉汀水溶液的制备方法,包括如下步骤:
方法1:
(1)将环糊精粉末加入水中,加热使其溶解,获得环糊精水溶液;
(2)将阿戈美拉汀粉末加入步骤(1)的环糊精水溶液中,使用包括但不限于磁力搅拌、超声或研磨等任意一种方式加热溶解,即得澄清稳定的阿戈美拉汀/环糊精水溶液;
方法2:
将环糊精粉末和阿戈美拉汀粉末加入水中,使用包括但不限于磁力搅拌、超声或研磨等任意一种混合方式加热溶解,即得澄清稳定的阿戈美拉汀/环糊精水溶液;
方法3:
(1)将环糊精粉末加入水中,加热使其溶解,获得环糊精水溶液;
(2)将阿戈美拉汀中加入有机溶剂,加热使其溶解,获得阿戈美拉汀有机溶液,所述阿戈美拉汀溶液中,阿戈美拉汀的浓度为50-250mg/ml,优选为100-200mg/ml;
所述的有机溶剂选自甲醇、乙醇、丙酮、丙二醇、正丁醇、乙酸乙酯或乙腈中的一种以上,优选为乙醇;
(3)将步骤(2)的溶液加入步骤(1)的溶液中,使用包括但不限于磁力搅拌、超声或研磨任意一种方式加热溶解;
(4)将步骤(3)所得的溶液用水稀释5-50倍,经旋转蒸发浓缩后,冻干;
(5)用水复溶至配制体积,即得澄清稳定的阿戈美拉汀/环糊精水溶液;
上述方法中:
加热温度为30℃-80℃,优选50℃-70℃;
搅拌速度为100rpm-1200rpm,优选600rpm-1000rpm;
搅拌时间为0.1h-48h,优选为0.5h-5h;
表2列出了在0.2g/ml的羟丙基-β-环糊精水溶液中,阿戈美拉汀晶型Ⅰ、Ⅱ、Ⅲ、Ⅵ通过加热溶解一定时间后的溶解度。同时,将上述溶液加水稀释100倍后溶液仍澄清透明、无AG晶体析出。可见该增加阿戈美拉汀水溶性的方法,适用于不同晶型的阿戈美拉汀。
表2不同晶型阿戈美拉汀在羟丙基-β-环糊精水溶液中的溶解情况及稀释后的稳定性
本研究在相同浓度环糊精水溶液中,投入等量且过量的Ⅱ型阿戈美拉汀,考察不同种类的环糊精水溶液溶解Ⅱ型阿戈美拉汀的最大量。其优选结果见表3,同时考虑到阿戈美拉汀在环糊精水溶液中的增溶量、溶液的稳定性、安全性以及对于粘膜组织的刺激程度,优选为羟丙基-β-环糊精,其平均取代度优选为3.0-6.0。
表3方法1、方法3不同种类环糊精的筛选结果
研究发现,在一定温度和溶解时间下,阿戈美拉汀的溶解量与环糊精水溶液的浓度呈正相关,同时,加水稀释100倍后溶液仍澄清透明、无晶体析出,见表4;
表4不同浓度羟丙基-β-环糊精水溶液中阿戈美拉汀的溶解量
本发明使用了一定量的环糊精,使阿戈美拉汀在水溶液中的溶解度最大可提高250倍。而且阿戈美拉汀/环糊精水溶液稳定性良好,加速实验(40℃,75%RH)8个月有关物质、含量检测合格,能保持在长时间内无AG晶体析出,溶液澄清透明,这为制备阿戈美拉汀液体制剂开创了可行性。该技术可用于制备阿戈美拉汀其它给药途径的制剂,其中包括但不限于静脉注射制剂、肌内注射剂、皮下注射剂、口服液体制剂、鼻腔滴剂、口腔喷剂、舌下喷剂或粉针剂;
本发明还涉及一种组合物,包括治疗有效量的所述的阿戈美拉汀水溶液和医药学上可接受的载体,所述的载体如香料、甜味剂、液体或固体填料或稀释剂等常用载体物质,并采用本领域公知的方法,制成常见的药用制剂,如静脉注射制剂、肌内注射剂、皮下注射剂、口服液体制剂、鼻腔滴剂、口腔喷剂、舌下喷剂或粉针剂,制剂通常含有浓度为1-30mg/ml的的阿戈美拉汀水溶液,较佳重量含量为0.1-2.5%;
本发明的有益效果是:
本发明将阿戈美拉汀与环糊精衍生物按一定比例和特定的制备工艺处理后,制得的 阿戈美拉汀/环糊精水溶液,通过40℃8个月的稳定性数据证明,阿戈美拉汀/环糊精水溶液技术显著提高了阿戈美拉汀在水中的溶解度及稳定性。同时,动物实验证明,该阿戈美拉汀水溶液适合于制备静脉注射制剂、肌内注射剂、皮下注射剂、口服液体制剂、鼻腔滴剂、口腔喷剂、舌下喷剂或粉针剂。其中,在相同给药剂量(32mg/kg)和相同给药方式下(口服灌胃),阿戈美拉汀水溶液的绝对生物利用度是市售阿戈美拉汀固体制剂(维度新)的5倍。
从而更具有极大地开发价值和市场前景。
本发明采用的评价方法及结果如下:
1.差示扫描量热法(DSC法)测定
为适用DSC法鉴定,将方法1和方法3获得的阿戈美拉汀/环糊精水溶液冻干,将得到的冻干粉用DSC法测定。结果:阿戈美拉汀与环糊精的物理混合物中显示阿戈美拉汀的特征熔融峰。阿戈美拉汀/环糊精水溶液冻干粉的DSC图谱中,阿戈美拉汀和环糊精通过一定的相互作用,形成了热稳定性增强的组合物,因此不显示有阿戈美拉汀的特征熔融峰。
2.高效液相色谱法(HPLC法)测定:
配制阿戈美拉汀对照品溶液:称取20mg阿戈美拉汀(晶型Ⅱ)粉末于20mL容量瓶中,用甲醇定容至20ml,振摇溶解,移取1ml该溶液到100ml容量瓶中,用水定容至100ml,振摇混匀,即得0.01mg/ml的阿戈美拉汀对照品溶液。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,柱温30℃,流速1.0ml/min,波长230nm,流动相为10mmol/L磷酸二氢钠(pH3.0)-乙腈(55-45),阿戈美拉汀主峰的理论塔板数不低于2000。
附图说明
图1为羟丙基-β-环糊精的DSC图谱。
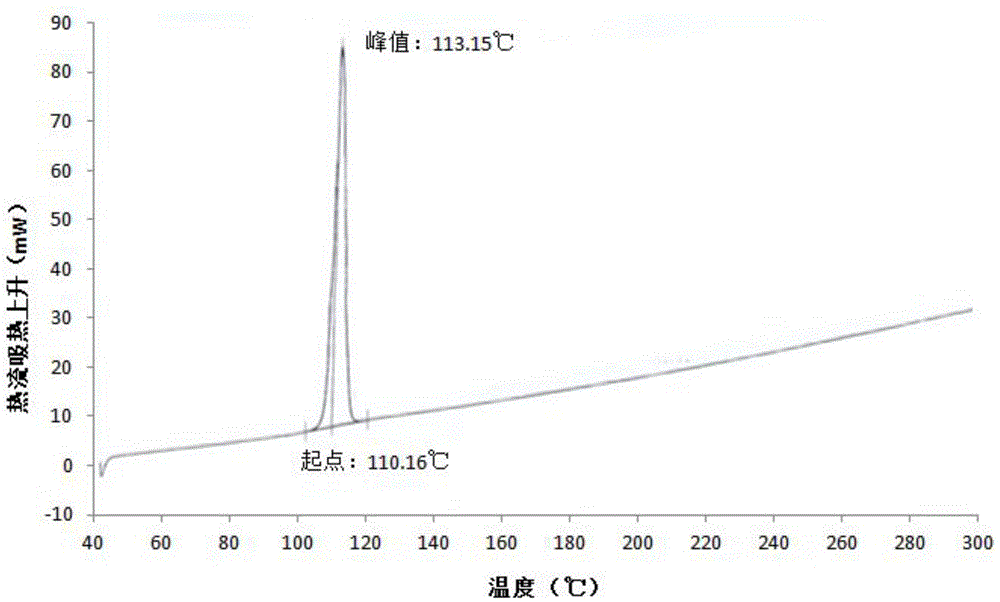
图2为阿戈美拉汀(晶型Ⅱ)的DSC图谱。
图3为阿戈美拉汀与环糊精的物理混合物的DSC图谱。
图4为实施例1制备的阿戈美拉汀与羟丙基-β-环糊精组合物的DSC图谱。
图5为实施例15制备的阿戈美拉汀与羟丙基-β-环糊精组合物的DSC图谱。
图6为阿戈美拉汀水溶液(实施例3)不同给药方式的绝对生物利用度。
图7实施例16样品40℃8月后与现配同浓度样品两个剂量(16mg/kg、32mg/kg) 两种给药方式(腹腔注射i.p、口服灌胃p.o)的最大血药浓度(Cmax)对比。
以下实施例旨在对本发明进一步解释说明,有关技术条件等并不限于本发明的变化范围。
实施例中,羟丙基-β-环糊精的DSC图谱见图1。
阿戈美拉汀(晶型Ⅱ)的DSC图谱见图2。
实施例1
阿戈美拉汀/环糊精水溶液(1):
将200g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.4g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为3.0;
取0.4g/ml羟丙基-β-环糊精溶液100ml,加入阿戈美拉汀(晶型Ⅱ)2.5g,加热至50℃,600rpm搅拌5小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测,有关物质含量均合格。
实施例2
阿戈美拉汀/环糊精水溶液(2):
将200g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.4g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为6.0;
取0.4g/ml羟丙基-β-环糊精溶液100ml,加入阿戈美拉汀(晶型Ⅱ)1.0g,加热至55℃,700rpm搅拌3小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测,有关物质含量均合格。
实施例3
阿戈美拉汀/环糊精水溶液(3):
将250g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.5g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为3.9;
取0.5g/ml羟丙基-β-环糊精溶液100ml,加入3.0g阿戈美拉汀(晶型Ⅰ、Ⅱ混晶),加热至60℃,650rpm搅拌3.5小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
实施例4
阿戈美拉汀/环糊精水溶液(4)
称取25g羟丙基-β-环糊精和1.25g阿戈美拉汀(晶型Ⅱ)共同加入适量水中,使最终体积为100ml,70℃下超声1小时,得澄清溶液。加水稀释100倍,无阿戈美拉汀晶体析出。含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
羟丙基-β-环糊精平均取代度(DS)为5.7。
实施例5
阿戈美拉汀/环糊精水溶液(5):
将75g甲基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.15g/ml的甲基-β-环糊精溶液;
取0.15g/ml甲基-β-环糊精溶液100ml,加入0.5g阿戈美拉汀(晶型Ⅰ),加热至60℃,900rpm搅拌2小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
实施例6
阿戈美拉汀/环糊精水溶液(6):
将50g磺丁基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.1g/ml的磺丁基-β-环糊精溶液;
取0.1g/ml磺丁基-β-环糊精溶液100ml,加入0.25g阿戈美拉汀(晶型Ⅱ),加热至55℃,1000rpm搅拌2小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
实施例7
阿戈美拉汀/环糊精水溶液(7):
将25gβ-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.05g/ml的β-环糊精溶液;
取0.05g/mlβ-环糊精溶液100ml,加入0.1g阿戈美拉汀(晶型Ⅱ),加热至60℃,750rpm搅拌4小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。
实施例8
阿戈美拉汀/环糊精水溶液(8):
将75g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.15g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为4.5。
取0.15g/ml羟丙基-β-环糊精溶液100ml,加入0.5g阿戈美拉汀(晶型Ⅰ),加热至70℃,500rpm搅拌3.5小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
实施例9
阿戈美拉汀/环糊精水溶液(9):
将150g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.3g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为4.2。
取0.3g/ml羟丙基-β-环糊精溶液100ml,加入1.0g阿戈美拉汀(晶型Ⅱ),加热至65℃,800rpm搅拌4小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
实施例10
阿戈美拉汀/环糊精水溶液(10):
将35g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.07g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为3.9。
取0.07g/ml羟丙基-β-环糊精溶液100ml,加入0.2g阿戈美拉汀(晶型Ⅲ),加热至50℃,600rpm搅拌5小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
实施例11
阿戈美拉汀/环糊精水溶液(11):
将175g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.35g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为4.9。
取0.35g/ml羟丙基-β-环糊精溶液100ml,加入1.0g阿戈美拉汀(晶型Ⅵ),加热至60℃,650rpm搅拌5小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
实施例12
阿戈美拉汀盐酸盐水合物/环糊精水溶液(12):
将100g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.2g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为4.0。
取0.2g/ml羟丙基-β-环糊精溶液100ml,加入0.5g阿戈美拉汀盐酸盐水合物(以阿戈美拉汀计),加热至70℃,700rpm搅拌2.5小时,得澄清溶液,用氢氧化钠溶液调pH至中性,加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测有关物质含量合格。
实施例13
阿戈美拉汀/环糊精水溶液(13):
将100g羟丙基-β-环糊精加适量水,加热搅拌溶解,加水并定容至500ml,配得浓度为0.2g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为3.5。
取0.2g/ml羟丙基-β-环糊精溶液10ml,在60℃条件下,边研磨边加入0.1g阿戈美拉汀(晶型Ⅱ),继续保温研磨3h,加水稀释并定容至100ml,即得1mg/ml的阿戈美 拉汀澄清溶液。加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测含量有关物质合格。
实施例14
阿戈美拉汀/环糊精水溶液(14)
称取羟丙基-β-环糊精200g,加适量水,加热到70℃,700rpm搅拌溶解,最后定容至500ml,配得0.4g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为4.0。
称取2.0g阿戈美拉汀(晶型Ⅱ),溶解到无水乙醇中,定容至20ml,得100mg/ml的阿戈美拉汀乙醇溶液。
取0.4g/ml的羟丙基-β-环糊精溶液100ml,加热至70℃,逐滴加入100mg/ml阿戈美拉汀乙醇溶液10ml,继续保温超声1h。稀释5倍,旋转蒸发至一定体积后,分装至冻干瓶内冻干,冻干结束后加水复溶至配制体积,即得澄清溶液。加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测含量有关物质均合格。
实施例15
阿戈美拉汀/环糊精水溶液(15)
取0.6g/ml的羟丙基-β-环糊精溶液100ml,加热至60℃,逐滴加入200mg/ml的阿戈美拉汀乙醇溶液15ml,保温,600rpm搅拌0.5h。放置室温,稀释50倍,旋转蒸发至一定体积后,分装至冻干瓶内冻干,冻干结束后加水复溶至配制体积,即得澄清溶液。羟丙基-β-环糊精平均取代度(DS)为5.0。加水稀释100倍,无阿戈美拉汀晶体析出,含量有关物质检测合格。4℃10天后澄清透明,无阿戈美拉汀晶体析出,60℃10天后检测含量有关物质均合格。
实施例16
阿戈美拉汀/环糊精水溶液(16):
将200g羟丙基-β-环糊精加适量水,加热搅拌溶解,然后加水最后定容至500ml,配得浓度为0.4g/ml的羟丙基-β-环糊精溶液;
羟丙基-β-环糊精平均取代度(DS)为4.6;
取0.4g/ml羟丙基-β-环糊精溶液100ml,加入1.0g阿戈美拉汀(晶型Ⅰ),加热至60℃,650rpm搅拌5小时,得澄清溶液,加水稀释100倍,无阿戈美拉汀晶体析出, 含量有关物质检测合格。4℃8个月后澄清透明,无阿戈美拉汀晶体析出,40℃8个月后检测含量和有关物质仍合格。
实施例17
称取羟丙基-β-环糊精50g,加适量水,加热至55℃,搅拌溶解,最后定容至100ml,配得0.5g/ml的羟丙基-β-环糊精溶液,加入阿戈美拉汀3.0g,约70℃下700rpm水浴搅拌4小时,得澄清溶液。
分别加入0.03g的依地酸二钠、0.005g的苯扎氯铵。
搅拌混匀。加水稀释100倍,无阿戈美拉汀晶体析出。将该样品同时分别置于4℃、室温、40℃、60℃条件下考察稳定性,包括0天、1个月、3个月各条件下及加速实验(40℃、75%RH)8个月的纯度、外观、含量,4℃、室温样品一直保持澄清透明无晶体析出,含量检测合格,其他结果详见于表4。
实施例18
称取羟丙基-β-环糊精15g,加适量水,加热(40℃-50℃)搅拌溶解,最后定容至100ml,配得0.15g/ml的羟丙基-β-环糊精溶液,加入阿戈美拉汀1.0g,约70℃下700rpm水浴搅拌5小时,得澄清溶液。
分别加入0.03g的依地酸二钠、0.005g的苯扎氯铵和0.55g氯化钠。
搅拌混匀。加水稀释100倍,无阿戈美拉汀晶体析出。将样品同时分别置于4℃、室温、40℃、60℃条件下考察稳定性,包括0天、1个月、3个月各条件下及加速实验 (40℃、75%RH)8个月的纯度、外观、含量,4℃、室温样品一直保持澄清透明无晶体析出,含量检测合格,其他结果详见于表4。
实施案例19
称取羟丙基-β-环糊精20g,加适量水,加热(40℃-50℃)搅拌溶解,最后定容至100ml,配得0.2g/ml的羟丙基-β-环糊精溶液。称取1g阿戈美拉汀,溶解到适量无水乙醇中,得200mg/ml的阿戈美拉汀乙醇溶液。
将100ml 0.2g/ml的羟丙基-β-环糊精溶液加热至60-70℃,逐滴加入全部上述阿戈美拉汀乙醇溶液,继续保温600rpm搅拌5h。放置室温,稀释15倍,旋转蒸发至一定体积后,分装至冻干瓶内冻干,冻干结束后加水复溶至配制体积。
分别加入0.03g的依地酸二钠、0.005g的苯扎氯铵和0.45g氯化钠。
搅拌混匀。加水稀释100倍,无阿戈美拉汀晶体析出。将样品同时分别置于4℃、室温、40℃、60℃条件下考察稳定性,包括0天、1个月、3个月各条件下及加速实验(40℃、75%RH)8个月的纯度、外观、含量,4℃、室温样品一直保持澄清透明无晶体析出,含量检测合格,其他结果详见于表4。
实施例20
称取羟丙基-β-环糊精10g,加适量水,加热至50℃搅拌溶解,最后定容至100ml,配得0.1g/ml的羟丙基-β-环糊精溶液。称取0.5g阿戈美拉汀,溶解到适量无水乙醇中,得200mg/ml的阿戈美拉汀乙醇溶液。
将100ml 0.1g/ml的羟丙基-β-环糊精溶液加热至70℃,逐滴加入全部上述阿戈美拉汀乙醇溶液,继续保温650rpm搅拌5h。放置室温,稀释15倍,旋转蒸发至一定体积后,分装至冻干瓶内冻干,冻干结束后加水复溶至配制体积。
分别加入0.03g的依地酸二钠、0.005g的苯扎氯铵和0.67g氯化钠。
搅拌混匀。加水稀释100倍,无阿戈美拉汀晶体析出。将该样品同时分别置于4℃、室温、40℃、60℃条件下考察稳定性,包括0天、1个月、3个月各条件下及加速实验(40℃、75%RH)8个月的纯度、外观、含量,4℃、室温样品一直保持澄清透明无晶体析出,含量检测合格,其他结果详见于表4。
表5实施例17-20样品各条件下稳定性试验结果。
实施例21
将实施例3的样品适当稀释,以三个梯度剂量8mg/kg、16mg/kg、32mg/kg给ICR小鼠滴鼻给药。经HPLC检测,药物的绝对生物利用度(以静脉给药的血浆浓度为100%)如下表所示,可见不同的滴鼻给药剂量下,AG水溶液具有较为相似的生物利用度。
表6 AG水溶液不同给药剂量的绝对生物利用度
实施例22
为了阐述该阿戈美拉汀/环糊精水溶液制剂的优势,本发明考察了在ICR小鼠体内,相同剂量(32mg/kg)阿戈美拉汀/环糊精水溶液在不同给药途径(腹腔注射、肌内注射、皮下注射、灌胃)相对于静脉注射的绝对生物利用度,见图6。阿戈美拉汀/环糊精水溶液其他给药形式的绝对生物利用度均不同程度优于口服灌胃,更特别的是,阿戈美拉汀 水溶液口服灌胃的绝对生物利用度是市售阿戈美拉汀固体制剂(维度新)的5倍。可见,该水溶液适合制备成不同给药途径的液体制剂,其中包括静脉注射制剂、肌内注射剂、皮下注射剂、口服液体制剂、鼻腔滴剂、口腔喷剂、舌下喷剂或粉针剂。
实施例23
为了验证阿戈美拉汀/环糊精水溶液40℃8个月后其最大血药浓度依然与0天配制样品一致,故将实施案例16中40℃8月后的样品与现配的相同处方的阿戈美拉汀/环糊精水溶液样品(AG 10mg/ml,0.4g/ml HP-β-CD)对照给药,以两种给药剂量和给药方式考察ICR小鼠的最大血药浓度,具体结果见附图7。可见,即使经过加速试验(40℃,75%)8月后,本发明AG水溶液样品放置8个月后的最大血药浓度(Cmax)依然与0天现配样品相似,统计结果显示两样品无显著差异,说明该水溶液具有较好的小鼠药物代谢动力学稳定性。
- 还没有人留言评论。精彩留言会获得点赞!