诱导内皮细胞迁移运动的PEG密度梯度表面的制备方法与流程
本发明属于生物医用材料领域,涉及一种peg密度梯度硅表面的制备方法。
背景技术:
由于遗传、疾病、事故等原因所导致的组织和器官缺损或功能障碍极其常见,已经严重威胁到人类的生命和健康。因此,众多临床医生和各相关领域的专家通力合作,探究新途径,组织工程就在这样的背景下诞生并发展。
组织工程在过去的几十年中虽取得了很大发展,但仍存在着许多挑战。其中,最大的障碍就是组织工程产品在植入宿主后微循环血管的形成。组织工程化组织构建物上的血管再生是非常重要的,植入体存活所必备的氧气和养分由新生血管负责输送。体外植入体与其周围组织的微循环系统是否能够有效的整合,即能否形成微循环血管,在很大程度上决定了植入体植入体内能否存活。而血管新生是在原有血管基础上通过血管内皮细胞的迁移和分裂增殖,从原有血管处生成新血管的过程。其原理是,内皮细胞利用自身特异蛋白酶将胞外基质降解掉,之后迁移进入到血管周围进行粘附、增殖、定向排列形成新的血管。所以细胞迁移对于血管生成有重要的影响。
研究表明,细胞所处的环境并非匀质的或方向不同性的,它们常粘附活动在一些存在梯度的外基质中,如细胞在迁移、增殖和分化等行为中就常常伴随体内不同介质的浓度梯度发生,体内的生物分子梯度在调控细胞这些行为中起驱动的作用。梯度生物材料是研究细胞粘附性和迁移性的重要基材,因此,在组织工程的研究中,研究者们在体外通过对生物材料表面的修饰,构建表面梯度材料,模拟体内梯度环境来研究细胞粘附和迁移行为。然而,由于体内环境复杂,影响细胞活动因素过多,所以为了清楚的阐释相关因素对细胞迁移行为的影响和机制,构建简单的梯度材料进行研究才更方便可行。
peg是这一种生物惰性分子,具有很好的生物相容性,被广泛应用于血液接触生物材料。由于短肽、蛋白质、生长因子等天然大分子和细胞相互作用比较复杂,不易作为模型研究细胞行为。因此,本专利提供了一种简单快捷、低耗的peg密度梯度表面构建的方法。通过精确控制gptms自组装的反应时间,制备氨基密度梯度,继而接枝peg,得到peg密度梯度,可诱导内皮细胞的迁移运动。
技术实现要素:
本专利旨在硅片表面构建可以诱导内皮细胞迁移的peg密度梯度。该方法不需要特殊设备,操作简单、成本低廉、可控性强。利用该方法构建的peg密度梯度材料可以很好的诱导内皮细胞的定向迁移,为构建组织工程血管支架和组织再生提供科学依据。
为了实现以上目的,本发明提供下述技术路线:
1.一种诱导内皮细胞迁移运动的peg密度梯度表面的制备方法,包括以下步骤:
a.利用微流泵(注射法)控制gptms与同一硅片表面不同位置的反应时间,制备gptms密度梯度表面;
b.gptms密度梯度表面与aptes充分反应,制备氨基密度梯度表面;c.在氨基密度梯度表面接枝peg分子,制备peg梯度表面。
优选的,所述步骤a是将依次用甲苯、丙酮、乙醇、双蒸水超声清洗15min后清洗干净的10mm×10mm硅片吹干,浸入在水浴锅加热80°c的“piranha”溶液(浓硫酸:30%双氧水(v:v)=7:3)中充分反应2小时,取出并氮气吹干;将硅片垂直固定于小烧杯内,小烧杯放入80°c恒温水浴锅中加热;将gptms溶于无水甲苯中,配成0.1%~0.5%的gptms溶液;将微流泵仪器装好,用10ml注射器(内径15mm)吸取足量的的gptms溶液;设置参数使得gptms溶液以30~70μl/min的均匀速度流入小烧杯中,使反应时间为80min时gptms正好淹没硅片上沿,立即关闭微流泵,并取出硅片,用大量的无水甲苯中清洗掉未反应的gptms,得到gptms密度梯度表面。
更优选的是,所述步骤a将依次用甲苯、丙酮、乙醇、双蒸水超声清洗15min后清洗干净的10mm×10mm硅片吹干,浸入在水浴锅加热80°c的“piranha”溶液(浓硫酸:30%双氧水(v:v)=7:3)中充分反应2小时,取出并氮气吹干;将硅片垂直固定于小烧杯内,小烧杯放入80°c恒温水浴锅中加热;将gptms溶于无水甲苯中,配成0.25%的gptms溶液;将微流泵仪器装好,用10ml注射器(内径15mm)吸取足量的的0.25%gptms溶液;设置参数使得gptms溶液以50μl/min的均匀速度流入小烧杯中,使反应时间为80min时gptms正好淹没硅片上沿,立即关闭微流泵,并取出硅片,用大量的无水甲苯中清洗掉未反应的gptms,得到gptms密度梯度表面。
优选的,所述步骤b将aptes溶于无水甲苯中,配成0.5%~2%的aptes溶液于干净的小试管中,水浴加热到80°c;然后把gptms密度梯度硅片置于aptes溶液中反应1~5h,使材料表面未与gptms反应的羟基充分与aptes反应;取出硅片,放入充足的无水甲苯中清洗掉未反应的aptes,再用无水乙醇、双蒸水分别清洗六次;氮气吹干,放入干净干燥的烧杯中置于40~80°c的烘箱中烘烤4小时,固定材料表面硅烷,得到氨基密度梯度表面。
更优选的是,所述步骤b将aptes溶于无水甲苯中,配成1%的aptes溶液于干净的小试管中,水浴加热到80°c;然后把gptms密度梯度硅片置于1%aptes溶液中反应3h,使材料表面未与gptms反应的羟基充分与aptes反应;取出硅片,放入充足的无水甲苯中清洗掉未反应的aptes,再用无水乙醇、双蒸水分别清洗六次;氮气吹干,放入干净干燥的烧杯中置于60°c的烘箱中烘烤4小时,固定材料表面硅烷,得到氨基密度梯度表面。
优选的,所述步骤c以0.1mpbs(ph=7.4)为溶剂配制的1~3mg/ml的peg溶液,再加入k2so4使之为0.4~0.8m;将氨基密度梯度硅片置于peg溶液中反应10~14h;取出,用双蒸水震荡清洗4小时,去除未反应的peg分子,得到peg密度梯度表面。
更优选的是,所述步骤c以0.1mpbs(ph=7.4)为溶剂配制的2mg/ml的peg溶液,再加入k2so4使之为0.6m;将氨基密度梯度硅片置于peg溶液中反应12h;取出,用双蒸水震荡清洗4小时,去除未反应的peg分子,得到peg密度梯度表面。
附图说明
图1(a)梯度材料制备过程图;(b)氨基梯度表面不同位置的氮碳比;(c)peg梯度表面不同位置的链密度。
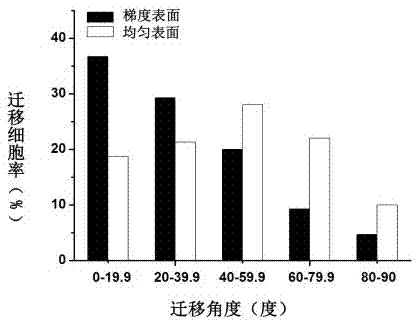
图2peg梯度表面和均匀表面接种内皮细胞培养2天后的迁移角度,n=150。
图3peg梯度表面和均匀表面接种内皮细胞培养12h后的迁移轨迹,n=20,*p<0.05。
图4(a)peg梯度表面和均匀表面接种内皮细胞的迁移净位移(b)peg梯度表面和均匀表面接种内皮细胞的迁移指数,n=20,*p<0.05。
具体实施方式
为了使本研究发明的技术方案以及优点更为清晰,下面将根据附图对本发明的实施方案进行详细描述。
本发明首先利用注射法,借助微流泵将gptms匀速注射到直立的硅片表面,使硅片底部到顶部与gptms的反应时间逐渐减小,接着与aptes反应,从而构建了反向的氨基梯度,随后继续在硅片表面接枝peg,制备出peg密度逐渐变化的梯度材料。在构建流程中,诸多因素会影响peg密度梯度的构建,例如gptms溶液的浓度和gptms与硅片的反应时间会影响peg密度梯度的斜率。本发明主要用注射法制备得到了可控的peg密度梯度。结果显示,通过微流泵将0.25%gptms溶液以50μl/min的均匀速度流入小烧杯中与硅片反应,使反应时间为80min时gptms正好淹没硅片上沿,则可制得peg密度为0.56chains/nm2到0.75chains/nm2梯度材料。且peg梯度可以有效诱导内皮细胞进行迁移运动。
实施例1.peg密度梯度表面的制备
a.gptms密度梯度表面的制备:将依次用甲苯、丙酮、乙醇、双蒸水超声清洗15min后清洗干净的10mm×10mm硅片吹干,浸入在水浴锅加热80°c的“piranha”溶液(浓硫酸:30%双氧水(v:v)=7:3)中充分反应2小时,取出并氮气吹干;将硅片垂直固定于小烧杯内,小烧杯放入80°c恒温水浴锅中加热;将gptms溶于无水甲苯中,配成0.25%的gptms溶液;将微流泵仪器装好,用10ml注射器(内径15mm)吸取足量的的0.25%gptms溶液;设置参数使得gptms溶液以50μl/min的均匀速度流入小烧杯中,使反应时间为80min时gptms正好淹没硅片上沿,立即关闭微流泵,并取出硅片,用大量的无水甲苯中清洗掉未反应的gptms,得到gptms密度梯度表面。
b.氨基密度梯度表面的制备:将aptes溶于无水甲苯中,配成1%aptes溶液于干净的小试管中,水浴加热到80°c;然后把gptms密度梯度硅片置于1%aptes溶液中反应3h,使材料表面未与gptms反应的羟基充分与aptes反应;取出硅片,放入充足的无水甲苯中清洗掉未反应的aptes,再用无水乙醇、双蒸水分别清洗六次;氮气吹干,放入干净干燥的烧杯中置于60°c的烘箱中烘烤4小时,固定材料表面硅烷,得到氨基密度梯度表面。
c.peg密度梯度表面的制备:以0.1mpbs(ph=7.4)为溶剂配制的2mg/ml的peg溶液,再加入k2so4使之为0.6m;将氨基密度梯度硅片置于peg溶液中反应12h;取出,用双蒸水震荡清洗4小时,去除未反应的peg分子,得到peg密度梯度表面。
以上制备过程如图1.a所示。步骤b制备所得的氨基密度梯度表面的xps检测结果如图1.b;可见,在同一硅片上1、3、5、7、9mm处的n/c值越来越大,即氨基的密度越来越大,由此见得在同一硅片表面成功的构建了氨基密度梯度。图1.c为peg密度梯度材料表面不同位置的链密度,可见,在同一硅片上1、3、5、7、9mm处的peg链密度逐渐增大,peg接枝量越来越多,由此可见成功制备得到peg密度梯度表面。
实验例2.peg密度梯度对细胞迁移运动方向的影响
本研究探究构建的peg密度梯度材料对内皮细胞迁移活动方向的影响。
我们将内皮细胞以低密度(5×103cells/cm2)接种于peg密度梯度表面培养;随后4%多聚甲醛,4°c下固定细胞20min,预冷的pbs溶液,清洗细胞;加入配好的0.2%的triton-x100溶液,4°c下孵育5min,预冷的pbs溶液,清洗细胞;继续加入10μg/mlhochest33258溶液,避光室温下染色5min,加入预冷的pbs溶液,清洗细胞;加入罗丹明-鬼笔环肽(5u/ml)溶液,完全淹没硅片,避光4°c孵育12h,预冷的pbs清洗清洗细胞;用95%的甘油封片,避光保存,以备激光光聚焦荧光显微镜观察其细胞形态。
对细胞与peg梯度方向的夹角进行统计分析,以研究内皮细胞在peg梯度上的极化程度。我们定义沿peg密度梯度减小方向为0°,测试内皮细胞内细胞骨架蛋白纤维丝分布方向与peg密度梯度方向的夹角。从图2中可以发现,约36.7%的细胞沿梯度方向的夹角在20°以内,73.3%的细胞排列方向在40°以内。由此表明,内皮细胞在peg密度梯度上表现出极化现象,peg密度梯度可诱导细胞趋向于peg梯度的方向迁移。
实验例3.peg密度梯度材料诱导内皮细胞的迁移
我们将内皮细胞以低密度(5×103cells/cm2)接种于peg密度梯度表面,37℃、5%co2培养孵箱中培养12h后取出,用37°c温热的pbs溶液清洗细胞,更换培养基;置于活细胞显微镜的培养体系(37°c和5%的co2饱和湿度)中在线观察;每隔15min就拍照记录下给个细胞所在位置,历时7h,共得到28张图片;利用图像分析软件imageproplus标记每张照片上单个细胞的中心位置,通过一系列图片重建细胞的迁移轨迹;根据细胞的迁移轨迹计算净位移和趋化指数。
通过分析连续的细胞位置图片重建细胞迁移轨迹图,如图3所示,x轴表示peg密度梯度方向,y轴表示与peg密度梯度方向垂直的方向。在均匀的peg表面,无论peg接枝密度的高低(图3abc),内皮细胞均无方向性的随意运动,毫无规律。相反,在peg密度梯度表面(高、中和低密度),大部分细胞趋向于x轴的方向迁移,x负轴表示peg浓度减小的方向,所以细胞是向低密度peg方向迁移的(图3def)。表明内皮细胞在peg密度梯度表面有趋向性。
随后计算了细胞运动性相关参数,净位移和趋化指数(ci)。如图4.a所示,接种在peg低密度和中密度梯度材料表面的内皮细胞的净位移平均值显著高于接种在peg均匀密度表面的内皮细胞净位移(p<0.05)。但是,在高密度peg梯度表面没有显著性差异。如图4.b所示,接种于peg梯度密度材料表面的内皮细胞表现出了更高的趋化指数平均值。且接种于peg梯度密度表面中间密度区域和低密度区域的细胞分别对于其相应的peg均匀密度表面的材料,趋化指数有显著性差异(p<0.05)。然而,高密度区域内皮细胞的趋化指数无显著性差异。趋化指数的结论与上述细胞净位移的结论是一致的,且都表明了peg梯度材料可以诱导内皮细胞的迁移运动。
因此,本研究为了诱导内皮细胞的迁移,利用微流泵注射法,可控地构建了peg密度逐渐变化的梯度材料,可为组织工程材料的设计提供参考和依据。
最后说明的是,以上实施例仅用于说明本发明的技术方案,并不构成对本发明内容的限制。尽管通过上述实施例已经对本发明做了较为详细的例举,但本领域技术人员仍然可以根据发明内容部分和实施例部分所描述的技术内容,在形式上和细节上对其作出各种各样的改变,而不偏离所附权利要求书所限定的本发明的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!