用于治疗非小细胞肺癌的抗‑B7‑H1和抗‑CTLA‑4抗体的制作方法
本申请要求于2014年5月13日提交的美国临时专利申请序列号61/992,658、于2015年1月21日提交的美国临时专利申请序列号62/105,992、以及于2015年2月10日提交的美国临时专利申请序列号62/114,336的优先权和权益。每一个这些申请的全部内容通过在此引用特此结合。
背景
癌症继续是主要的全球健康负担。尽管在癌症的治疗方面有所进展,但一直存在对更有效且毒性更小的疗法的未满足的医疗需要,尤其对于患有对现有治疗剂有抗性的晚期疾病或癌症的那些患者。
免疫系统,特别是T细胞介导的细胞毒性,在肿瘤控制中的作用是公认的。有越来越多的证据表明T细胞在癌症患者中控制肿瘤生长和存活,无论是在该疾病的早期和晚期阶段。然而,肿瘤特异性T细胞应答很难在癌症患者中装配和维持。
迄今为止收到显著关注的两个T细胞通路通过毒性T淋巴细胞抗原-4(CTLA-4,CD152)和程序性死亡配体1(PD-L1,也被称为B7-H1或CD274)发信号。
CTLA4在活化的T细胞上表达,并随着CD28介导的T细胞激活作为共抑制剂以抑制T细胞应答。CTLA4被认为在TCR接合之后调节幼稚和记忆性T细胞的早期激活幅度,并且是影响抗肿瘤免疫和自身免疫两者的中央抑制途径的一部分。CTLA4专门在T细胞中表达,并且其配体CD80(B7.1)和CD86(B7.2)的表达主要限于抗原提呈细胞、T细胞、和其他免疫介导的细胞。已经报道了阻断CTLA4信号通路的拮抗性抗CTLA4抗体增强T细胞激活。一个这样的抗体易普利姆玛在2011年被FDA批准用于转移性黑色素瘤的治疗。另一个抗CTLA4抗体曲美木单抗,在III期临床试验中测试了对于晚期黑色素瘤的治疗,但相比当时的标准治疗(替莫唑胺或达卡巴嗪)没有显著增加患者的整体存活率。
PD-L1也是涉及控制T-细胞激活的受体和配体的复杂系统的一部分。在正常组织中,PD-L1在T细胞、B细胞、树突状细胞、巨噬细胞、间充质干细胞、骨髓源性肥大细胞以及不同非造血细胞上表达。它的正常功能是通过与它的两个受体程序性死亡1(又称为PD-1或CD279)和CD80(又称为B7-1或B7.1)的相互作用来调节T-细胞激活与耐受之间的平衡。PD-L1还通过肿瘤来表达并且在多个部位上起作用以帮助肿瘤避开由宿主免疫系统进行的检测和消除。PD-L1在宽范围的癌症中高频率地表达。在一些癌症中,PD-L1的表达与存活降低和不利预后相关联。阻断B7-H1与它的受体之间的相互作用的抗体能够在体外解除PD-L1依赖性免疫抑制作用并且增强抗肿瘤T细胞的细胞毒性活性。MEDI4736是针对人PD-L1的能够阻断PD-L1与PD-1和CD80受体两者的结合的人单克隆抗体。
尽管在过去十年在开发用于对抗癌症和其他疾病的策略中做出了显著的进步,但是患有晚期、难治性和转移性疾病的患者具有有限的临床选择。化疗、放射、和高剂量化疗已成为剂量限制。仍然存在对新的毒性更少的方法和具有更好的治疗效果、更长的临床益处、和改进的安全性特性的治疗剂的大量未满足的需要,特别是对于那些患有对现有的治疗剂耐药的晚期疾病或癌症的患者。
简要概述
本发明提供一种在人类患者中治疗非小细胞肺癌(NSCLC)的方法,该方法包括向患者给予1mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予3mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予10mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予15mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予10mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予15mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予20mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予15mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予20mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予20mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予10mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予3mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予3mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予1mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括向患者给予1mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
本发明还提供一种治疗的方法,包括将MEDI4736或其抗原结合片段(例如,以1mg/kg、3mg/kg、10mg/kg、15mg/kg、或20mg/kg)和曲美木单抗或其抗原结合片段(例如,以1mg/kg、3mg/kg、10mg/kg)给予至被鉴定为患有PD-L1-或PD-L1+NSCLC的患者。
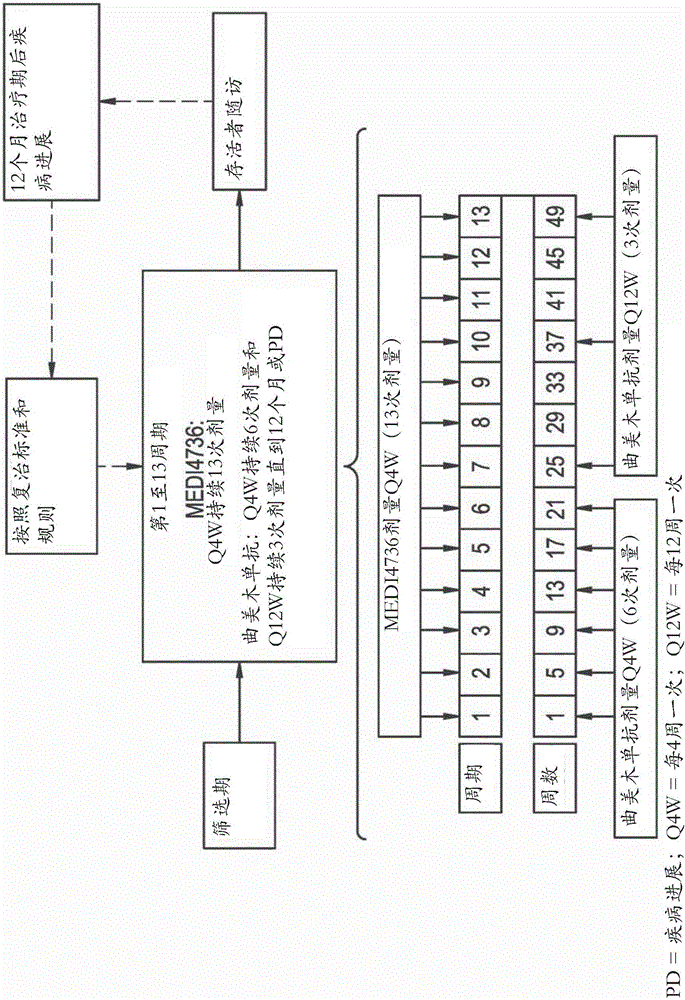
在任何上述方法的具体实施例中,MEDI4736是每4周一次给予的。在一个具体实施例中,MEDI4736每4周一次给予了49周。在任何上述方法的具体实施例中,MEDI4736是每2周一次给予的。在另一个实施例中,给予了总共13个剂量的MEDI4736。
在上述方面的具体实施例中,对于前21周曲美木单抗是每4周一次给予的。在上述方面的其他实施例中,从第25至49周曲美木单抗是每12周一次给予的。在上述方面的其他实施例中,给予了总共9个剂量的曲美木单抗。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括将10mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段给予患者,其中MEDI4736是每2周一次给予的。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括将10mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段给予患者,其中MEDI4736是每2周一次给予的。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括将10mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段给予患者,其中MEDI4736是每2周一次给予的。
在上述方面的具体实施例中,对于前25周曲美木单抗是每4周一次给予的。在上述方面的其他实施例中,从第25至49周曲美木单抗是每12周一次给予的。在上述方面的其他实施例中,给予了总共9个剂量的曲美木单抗。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括将MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段给予患者,其中这些给予导致了肿瘤反应。
在本发明的方法中,相比于给予单独的MEDI4736或其抗原结合片段抑或单独的曲美木单抗或其抗原结合片段,这些给予导致肿瘤反应增加。
在一些实施例中,肿瘤反应可以在第2、4、6、8、或10周检测到。在其他实施例中,肿瘤反应可以在第33周检测到。在其他实施例中,肿瘤反应可以在第50周检测到。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括将MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段给予患者,其中这些给予增加了无进展存活期。在一些实施例中,相比于给予单独的MEDI4736或其抗原结合片段或者单独的曲美木单抗或其抗原结合片段,这些给予导致无进展存活期的增加。
本发明还提供一种在人类患者中治疗NSCLC的方法,该方法包括将MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段给予患者,其中这些给予增加了总存活期。在一些实施例中,相比于给予单独的MEDI4736或其抗原结合片段或者单独的曲美木单抗或其抗原结合片段,这些给予导致总存活期的增加。
在本发明的方法的一些实施例中,这些给予导致肿瘤反应。在一些实施例中,相比于给予单独的MEDI4736或其抗原结合片段或者单独的曲美木单抗或其抗原结合片段,这些给予导致肿瘤反应的增加。在一些实施例中,肿瘤反应可以在第8周检测到。在一些实施例中,肿瘤反应可以在第33周检测到。
在本发明的方法的一些实施例中,这些给予增加无进展存活期。在一些实施例中,相比于给予单独的MEDI4736或其抗原结合片段或者单独的曲美木单抗或其抗原结合片段,这些给予导致无进展存活期的增加。
在本发明的方法的一些实施例中,这些给予增加总存活期。在一些实施例中,相比于给予单独的MEDI4736或其抗原结合片段或者单独的曲美木单抗或其抗原结合片段,这些给予导致总存活期的增加。
在任何上述方法的具体实施例中,MEDI4736是每4周一次给予的。在一个具体实施例中,MEDI4736每4周一次给予了49周。在另一个实施例中,给予了总共13个剂量的MEDI4736。
在上述方面的具体实施例中,对于前21周曲美木单抗是每4周一次给予的。在上述方面的其他实施例中,从第25至49周或最前6个剂量之后曲美木单抗是每12周一次给予的。在上述方面的其他实施例中,给予了总共9个剂量的曲美木单抗。
在本发明的方法的一些实施例中,曲美木单抗或其抗原结合片段每4周一次给予了7次,然后每12周一次给予。
在本发明的方法的一些实施例中,这些给予减少了可溶性PD-L1。在一些实施例中,可溶性PD-L1减少了至少约65%、80%、90%、95%或99%。
在本发明的方法的一些实施例中,该肿瘤对于至少一种化学治疗剂是难治性的。这样的化学治疗剂可包括但不限于威罗菲尼、埃罗替尼、阿法替尼、西妥昔单抗、卡铂、贝伐单抗、埃罗替尼、吉非替尼或培美曲塞。
在本发明的方法的一些实施例中,该患者具有0-1的东部肿瘤协作组(ECOG)行为状态。
在本发明的方法的一些实施例中,在给予MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段之前,该患者是免疫疗法初治的。
在本发明的方法的一些实施例中,在给予MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段之前,该患者已接受肿瘤疗法。
在本发明的方法的一些实施例中,MEDI4736或其抗原结合片段的给予是通过静脉输注。
在本发明的方法的一些实施例中,曲美木单抗或其抗原结合片段的给予是通过静脉输注。
在本发明的方法的具体实施例中,这些给予减少肿瘤大小至少相对于基线约10%、25%、50%、75%或100%。
在本发明的方法的具体实施例中,人类患者患有局部晚期不可切除或转移的NSCLC。在本发明的方法的具体实施例中,该NSCLC是鳞状的或非鳞状的。在本发明的方法的其他实施例中,该NSCLC包括KRAS突变或EGFR突变。
在本发明的方法的一些实施例中,该MEDI4736或其抗原结合片段是MEDI4736,并且其中该曲美木单抗或其抗原结合片段是曲美木单抗。
在另一个方面,本发明为治疗癌症的方法提供与曲美木单抗或曲美木单抗的抗原结合片段组合的MEDI4736或MEDI4736的抗原结合片段。在本发明的一些实施例中,该癌症是选自前列腺癌、乳腺癌、三阴性乳腺癌、结肠癌、肺癌、非小细胞肺癌、头颈部癌、黑色素瘤、胃癌、胰腺癌、卵巢癌、肾细胞癌、和肝癌。
附图/图简要说明
图1显示了治疗计划。MTD=最大耐受剂量。
图2显示了剂量递增和剂量扩张计划。
图3显示了剂量递增研究设计。DLT=剂量限制性毒性。
图4提供了显示MEDI4736的药代动力学(PK)曲线的图和表格。Q4W=每4周一次。LLOQ=定量下限。AUC=曲线下面积。
图5提供了显示曲美木单抗的药代动力学(PK)曲线的图和表格。
图6是显示可溶性PD-L1的绝对浓度曲线(sPD-L1)的图。
图7是显示可溶性PD-L1的抑制百分比的图。
图8是显示在个体患者中MEDI4736的药代动力学(PK)参数的图。
图9是显示在个体患者中曲美木单抗的药代动力学(PK)参数的图。
图10A和10B是显示MEDI4736和曲美木单抗由于1级或2级毒性(10A)和3级或4级毒性(10B)的剂量改变的表格。
图11是显示研究标准的表格。
图12显示了研究登记。
图13显示了对于给药的患者的相关不良事件(AE)。
图14显示了在最前4个组群中肿瘤大小从基线的变化。
图15显示了研究的MEDI4736和曲美木单抗剂量和计划。
图16显示了在接受MEDI4736和曲美木单抗的组合的个体患者中sPD-L1的抑制。
图17显示了在接受MEDI4736和曲美木单抗的组合的通过组群分组的个体患者中sPD-L1的抑制。
图18显示了相比于在接受单独的MEDI4736的那些受试者中的增加,在接受MEDI4736和曲美木单抗的受试者中CD4 Ki67+和CD8 Ki67增生细胞从基线的增加。CD4 Ki67+和CD8 Ki67增生细胞从基线的增加与增加的曲美木单抗剂量相关。
图19显示了相比于在接受单独的MEDI4736的那些受试者中的增加,在接受MEDI4736和曲美木单抗的受试者中CD4 ICOS+和CD4 HLADR+细胞从基线的增加。CD4 ICOS+和CD4 HLADR+细胞从基线的增加与增加的曲美木单抗剂量相关。
图20显示了相比于在接受单独的MEDI4736的那些受试者中的增加,在接受MEDI4736和曲美木单抗的受试者中CD4+T效应细胞从基线的增加。CD4+T效应细胞从基线的增加与增加的曲美木单抗剂量相关。
图21显示了相比于在接受单独的MEDI4736的那些受试者中的增加,在接受MEDI4736和曲美木单抗的受试者中Treg细胞从基线的增加。Treg细胞从基线的增加与增加的曲美木单抗剂量相关。
图22是显示与MEDI4736单药疗法相比MEDI4736与曲美木单抗组合的疗法的临床活性的表格。
图23是显示在由曲美木单抗剂量锚定的组群中肿瘤大小从基线的变化的蜘蛛图:1mg/kg(左上小图);10mg/kg(右上小图);以及3mg/kg(下部小图)。
图24是显示与MEDI4736单药疗法相比,在由曲美木单抗剂量(1mg/kg;10mg/kg;和3mg/kg)锚定的组合组群中相关的≥3级不良事件(AE)开始的时间的图。
图25是显示在由MEDI4736剂量锚定的组群中肿瘤大小从基线的变化的蜘蛛图:10mg/kg Q4W(左上小图);15mg/kg Q4W(右上小图);20mg/kg Q4W(左下小图);以及10mg/kg Q2W(右下小图)。
图26是显示与MEDI4736单药疗法相比,在由MEDI4736剂量(1mg/kg;10mg/kg;和3mg/kg)锚定的组合组群中相关的≥3级不良事件(AE)开始的时间的图。
图27是显示与接受单独的MEDI4736(10mg/kg Q4W)的那些(右小图)相比,在接受MEDI4736和曲美木单抗的NSCLC患者(左小图)的选择性组群中肿瘤大小从基线的变化的蜘蛛图。
图28是显示与MEDI4736单药疗法(左小图)相比,在选择性组合组群(左和右小图)中相关的≥3级不良事件(AE)开始的时间的图。
图29是显示在接受MEDI4736和曲美木单抗的患有NSCLC的患者的所有研究组群中肿瘤大小从基线的变化的蜘蛛图。
图30是显示与接受单独的MEDI4736(10mg/kg;CP1108)的那些(右小图)相比,在接受MEDI4736和曲美木单抗的PD-L1阴性NSCLC患者(左小图)的选择性组群中肿瘤大小从基线的变化的蜘蛛图。
图31是显示与接受单独的MEDI4736(10mg/kg;CP1108)的那些(右小图)相比,在接受MEDI4736和曲美木单抗的PD-L1阳性NSCLC患者(左小图)的选择性组群中肿瘤大小从基线的变化的蜘蛛图。
图32是由曲美木单抗剂量锚定的蜘蛛图(1mg/kg(左小图),3mg/kg(中小图),和10mg/kg(右小图)),该蜘蛛图显示了在接受MEDI4736和曲美木单抗的PD-L1阴性NSCLC患者的选择性组群中肿瘤大小从基线的变化。
图33是由MEDI4736剂量锚定的蜘蛛图(10mg/kg Q4W(左上小图),15mg/kg(右上小图),和20mg/kg(左下小图)),该蜘蛛图显示了在接受MEDI4736和曲美木单抗的PD-L1阴性NSCLC患者的选择性组群中肿瘤大小从基线的变化。
图34A-34D是显示在根据NSCLC PD-L1状态分组的在图29中接受MEDI4736和曲美木单抗的NSCLC患者中肿瘤大小从基线的变化的蜘蛛图:所有NSCLC患者(34A);被鉴定为患有PD-L1-NSCLC的患者(34B);被鉴定为患有PD-L1+NSCLC的患者(34C);以及NSCLC PD-L1状态未知的患者(34D)。
图35是显示在接受MEDI4736和曲美木单抗的NSCLC患者中肿瘤大小从基线的最好变化的瀑布图。
图36是显示在根据NSCLC的PD-L1状态鉴定的在图35中接受MEDI4736和曲美木单抗的NSCLC患者中肿瘤大小从基线的最好变化的瀑布图。
图37是显示在接受MEDI4736和曲美木单抗的NSCLC患者中随访的持续时间的泳道图。
详细说明
应当指出的是,术语“一个/种(a或an)”实体是指一个/种或多个/种该实体;例如,“一个/种抗体”应理解为代表一个/种或多个/种抗体。因此,术语“一个”(或“一种”)、“一个或多个(一种或多种)”、以及“至少一个(至少一种)”在此可以互换地使用。
在此提供的是使用MEDI4736和曲美木单抗治疗非小细胞肺癌(NSCLC)的方法。有三个主要的NSCLC亚型:鳞状细胞癌、腺癌和大细胞(未分化)癌。其他亚型包括腺鳞癌和肉瘤样癌。NSCLC可以包括在KRAS或表皮生长因子受体中的突变。这类突变在本领域是已知的并且描述于,例如,赖利(Riley)等人,美国胸腔学会会议录(Proc Am Thorac Soc.)2009年04月15日;6(2):201-5,其通过引用结合在此。
此外,本文提供的是使用MEDI4736和曲美木单抗治疗癌症或肿瘤增殖的方法。本文所用的“癌症”是指由异常细胞不受控制的分裂引起的疾病。癌症的实例包括前列腺癌、乳腺癌、三阴性乳腺癌、结肠癌、肺癌、非小细胞肺癌、头颈部癌、黑色素瘤、胃癌、胰腺癌、卵巢癌、肾细胞癌、和肝癌。
所提供的这些方法包括给予有效量的MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段。
“MEDI4736”意指选择性地结合PD-L1多肽的抗体或其抗原结合片段,并包含轻链可变区的至少一部分和/或重链可变区的至少一部分,该轻链可变区包含SEQ ID NO:1的氨基酸序列,该重链可变区包含SEQ ID NO:2的氨基酸序列。
关于用于在此提供的方法中的MEDI4736(或其抗原结合片段)的信息可以见于美国专利号8,779,108,其披露内容通过引用以其全文结合在此。MEDI4736的片段可结晶(Fc)结构域在IgG1重链的恒定结构域中含有三重突变,该三重突变使与负责介导抗体依赖性细胞介导的细胞毒性(ADCC)的补体组分C1q和Fcγ受体的结合减少。MEDI4736对PD-L1有选择性并且阻断了PD-L1与PD-1和CD80受体的结合。MEDI4736可以在体外解除PD-L1介导的对人T-细胞激活的抑制,并且通过T-细胞依赖性机制在异种移植物模型中抑制肿瘤生长。
用于在此提供的这些方法中的MEDI4736包含重链和轻链或重链可变区和轻链可变区。在一个特定方面,用于在此提供的这些方法中的MEDI4736或其抗原结合片段包含轻链可变区和重链可变区,该轻链可变区包含SEQ ID NO:1的氨基酸序列,该重链可变区包含SEQ ID NO:2的氨基酸序列。在一个特定方面,用于在此提供的这些方法中的MEDI4736或其抗原结合片段包含重链可变区和轻链可变区,其中该重链可变区包含SEQ ID NO:3-5的卡巴特(Kabat)定义的CDR1、CDR2和CDR3序列,并且其中该轻链可变区包含SEQ ID NO:6-8的卡巴特定义的CDR1、CDR2和CDR3序列。本领域技术人员将能够容易地鉴定对于本领域技术人员而言已知的乔西亚(Chothia)定义、Abm定义或其他CDR定义。在一个特定方面,用于在此提供的这些方法中的MEDI4736或其抗原结合片段包含如在美国专利号8,779,108中所披露的2.14H9OPT抗体的可变重链和可变轻链CDR序列,该专利通过引用以其全文结合在此。
“曲美木单抗”意指选择性地结合CTLA4多肽的抗体或其抗原结合片段,并包含轻链可变区的至少一部分和/或重链可变区的至少一部分,该轻链可变区包含SEQ ID NO:9的氨基酸序列,该重链可变区包含SEQ ID NO:10的氨基酸序列。示例性的抗CTLA4抗体描述于例如美国专利号6,682,736;7,109,003;7,123,281;7,411,057;7,824,679;8,143,379;7,807,797;和8,491,895中(其中,曲美木单抗是11.2.1),这些专利通过引用结合在此。曲美木单抗是示例性抗CTLA4抗体。在下面的序列表中提供了曲美木单抗序列。
关于用于在此提供的方法中的曲美木单抗(或其抗原结合片段)的信息可以见于US 6,682,736(其中它被称为11.2.1),该专利的披露内容通过引用以其全文结合在此。曲美木单抗(也称为CP-675,206、CP-675、CP-675206、和ticilimumab)是一种人类IgG2单克隆抗体,该单克隆抗体对于CTLA4有高度选择性并阻断了CTLA4与CD80(B7.1)和CD86(B7.2)的结合。它已被证明导致体外免疫激活,并且用曲美木单抗治疗的一些患者已表现出肿瘤消退。
用于在此提供的这些方法中的曲美木单抗和其抗原结合片段包含重链和轻链或重链可变区和轻链可变区。在一个特定方面,用于在此提供的这些方法中的曲美木单抗或其抗原结合片段包含轻链可变区和重链可变区,该轻链可变区包含SEQ ID NO:9的氨基酸序列,该重链可变区包含SEQ ID NO:10的氨基酸序列。在一个特定方面,用于在此提供的这些方法中的曲美木单抗或其抗原结合片段包含重链可变区和轻链可变区,其中该重链可变区包含SEQ ID NO:11-13的卡巴特(Kabat)定义的CDR1、CDR2和CDR3序列,并且其中该轻链可变区包含SEQ ID NO:14-16的卡巴特定义的CDR1、CDR2和CDR3序列。本领域技术人员将能够容易地鉴定对于本领域技术人员而言已知的乔西亚(Chothia)定义、Abm定义或其他CDR定义。在一个特定方面,用于在此提供的方法中的曲美木单抗或其抗原结合片段包括如在U.S.6,682,736中所披露的11.2.1抗体的可变重链和可变轻链CDR序列,该专利通过引用以其全文结合在此。
术语“抗原结合片段”是指完整抗体的一部分和/或是指完整抗体的抗原决定可变区。已知的是,抗体的抗原结合功能可以由全长抗体的片段来执行。抗体片段的实例包括但不限于:Fab、Fab′、F(ab′)2、以及Fv片段、线性抗体、单链抗体、双抗体(diabodies)、以及由抗体片段形成的多特异性抗体。
在某些方面中,呈现具有NSCLC的患者被给予MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段。MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段可以仅被给予一次或偶尔给予,而仍然为该患者提供益处。在另外的方面中,该患者被给予另外的后继剂量。可以取决于该患者的年龄、体重、临床评价、肿瘤负荷和/或其他因素(包括主治医生的判断),在不同时间间隔下给予后续剂量。
MEDI4736或其抗原结合片段的剂量之间的间隔可以是每4周一次。曲美木单抗或其抗原结合片段的剂量之间的间隔可以是每4周一次。曲美木单抗或其抗原结合片段的剂量之间的间隔可以是每12周一次。曲美木单抗或其抗原结合片段的剂量之间的间隔可以是每4周一次持续6个周期,然后每12周一次。
在某些方面,MEDI4736或其抗原结合片段是与曲美木单抗或其抗原结合片段大约一样的频率给予的。在某些方面,MEDI4736或其抗原结合片段是与曲美木单抗或其抗原结合片段大约3倍的频率给予的。
在一些实施例中,向该患者给予至少两个剂量的MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段。在一些实施例中,可以向该患者给予至少三个剂量、至少四个剂量、至少五个剂量、至少六个剂量、至少七个剂量、至少八个剂量、至少九个剂量、至少十个剂量或至少十五个剂量或更多。在一些实施例中,在四周治疗周期内、在八周治疗周期内、在十六周治疗周期内、在二十周治疗周期内、在二十四周治疗周期内或在一年或更长治疗周期内给予MEDI4736或其抗原结合片段。在一些实施例中,在四周治疗周期内、在八周治疗周期内、在十二周治疗周期内、在十六周治疗周期内、在十二周治疗周期内、在二十四周治疗周期内、在三十六周治疗周期内、在四十八周治疗周期内、或在一年或更长治疗周期内给予曲美木单抗或其抗原结合片段。
在一些实施例中,MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段是在同一天被给予的。在一些实施例中,MEDI4736或其抗原结合片段与曲美木单抗或其抗原结合片段同时被给予。在其他实施例中,MEDI4736或其抗原结合片段在曲美木单抗或其抗原结合片段给予后约1小时被给予。
有待向该患者给予的MEDI4736或其抗原结合片段的量和曲美木单抗或其抗原结合片段的量将取决于不同参数,如该患者的年龄、体重、临床评价、肿瘤负荷和/或其他因素,包括主治医生的判断。
在某些方面中,该患者被给予一个或多个剂量的MEDI4736或其抗原结合片段,其中该剂量是约1mg/kg。在某些方面中,该患者被给予一个或多个剂量的MEDI4736或其抗原结合片段,其中该剂量是约3mg/kg。在某些方面中,该患者被给予一个或多个剂量的MEDI4736或其抗原结合片段,其中该剂量是约10mg/kg。在某些方面中,该患者被给予一个或多个剂量的MEDI4736或其抗原结合片段,其中该剂量是约15mg/kg。在某些方面中,该患者被给予一个或多个剂量的MEDI4736或其抗原结合片段,其中该剂量是约20mg/kg。
在某些方面中,该患者被给予至少两个剂量的MEDI4736或其抗原结合片段,其中该剂量是约1mg/kg。在某些方面中,该患者被给予至少两个剂量的MEDI4736或其抗原结合片段,其中该剂量是约3mg/kg。在某些方面中,该患者被给予至少两个剂量的MEDI4736或其抗原结合片段,其中该剂量是约10mg/kg。在某些方面中,该患者被给予至少两个剂量的MEDI4736或其抗原结合片段,其中该剂量是约15mg/kg。在某些方面中,该患者被给予至少两个剂量的MEDI4736或其抗原结合片段,其中该剂量是约20mg/kg。在一些实施例中,相隔约四周给予该至少两个剂量。
在某些方面中,该患者被给予至少三个剂量的MEDI4736或其抗原结合片段,其中该剂量是约1mg/kg。在某些方面中,该患者被给予至少三个剂量的MEDI4736或其抗原结合片段,其中该剂量是约3mg/kg。在某些方面中,该患者被给予至少三个剂量的MEDI4736或其抗原结合片段,其中该剂量是约10mg/kg。在某些方面中,该患者被给予至少三个剂量的MEDI4736或其抗原结合片段,其中该剂量是约15mg/kg。在某些方面中,该患者被给予至少三个剂量的MEDI4736或其抗原结合片段,其中该剂量是约20mg/kg。在一些实施例中,相隔约四周给予该至少三个剂量。
在某些方面中,该患者被给予一个或多个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约1mg/kg。在某些方面中,该患者被给予一个或多个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约3mg/kg。在某些方面中,该患者被给予一个或多个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约10mg/kg。
在某些方面中,该患者被给予至少两个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约1mg/kg。在某些方面中,该患者被给予至少两个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约3mg/kg。在某些方面中,该患者被给予至少两个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约10mg/kg。在一些实施例中,相隔约四周给予该至少两个剂量。在一些实施例中,相隔约十二周给予该至少两个剂量。
在某些方面中,该患者被给予至少三个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约1mg/kg。在某些方面中,该患者被给予至少三个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约3mg/kg。在某些方面中,该患者被给予至少三个剂量的曲美木单抗或其抗原结合片段,其中该剂量是约10mg/kg。在一些实施例中,相隔约四周给予该至少三个剂量。在一些实施例中,相隔约十二周给予该至少三个剂量。
在某些方面中,根据在此提供的这些方法给予MEDI4736或其抗原结合片段和/或曲美木单抗或其抗原结合片段是通过肠胃外给予的。例如,可以通过静脉内输注或通过皮下注射来给予MEDI4736或其抗原结合片段和/或曲美木单抗或其抗原结合片段。在一些实施例中,该给予是通过静脉内输注。
在某些方面,向患者给予1mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予1mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予1mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
在某些方面,向患者给予3mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予3mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予3mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
在某些方面,向患者给予10mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予10mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予10mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
在某些方面,向患者给予15mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予15mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予15mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
在某些方面,向患者给予20mg/kg的MEDI4736或其抗原结合片段和1mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予20mg/kg的MEDI4736或其抗原结合片段和3mg/kg的曲美木单抗或其抗原结合片段。在某些方面,向患者给予20mg/kg的MEDI4736或其抗原结合片段和10mg/kg的曲美木单抗或其抗原结合片段。
在此提供的这些方法可以减弱、延迟或稳定肿瘤生长。在一些方面中,该减小或延迟可以是统计学上显著的。可以通过与基线处的患者肿瘤的生长、针对预期的肿瘤生长、针对基于大的患者群体的预期的肿瘤生长或针对对照群体的肿瘤生长进行比较来测量肿瘤生长的减少。在某些方面,肿瘤反应使用实体瘤反应评价标准(RECIST)来进行测量。
在某些方面,肿瘤反应在第8周是可检测的。在某些方面,肿瘤反应在第33周是可检测的。在某些方面,肿瘤反应在第50周是可检测的。
在某些方面中,在给予MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段后,肿瘤反应是可检测的。在某些方面中,在给予8次剂量的MEDI4736或其抗原结合片段和7次剂量的曲美木单抗或其抗原结合片段后,肿瘤反应是可检测的。在某些方面中,在给予13次剂量的MEDI4736或其抗原结合片段和9次剂量的曲美木单抗或其抗原结合片段后,肿瘤反应是可检测的。
在某些方面中,患者实现了疾病控制(DC)。疾病控制可以是完全应答(CR)、部分应答(PR)或疾病稳定(SD)。
“完全应答”(CR)、“部分应答”(PR)、和“疾病稳定”(SD)可以如在下面表1中所定义的来确定。
在某些方面中,给予MEDI4736或其抗原结合片段可以使无进展存活期(PFS)增加。
在某些方面中,给予MEDI4736或其抗原结合片段可以使总体存活期(OS)增加。
在一些实施例中,该患者先前已经接受了用至少一种化学治疗剂进行的治疗。在一些实施例中,该患者先前已经接受了用至少两种化学治疗剂进行的治疗。该化学治疗剂可以是例如并且不限于威罗菲尼、埃罗替尼、阿法替尼、西妥昔单抗、卡铂、贝伐单抗、埃罗替尼、吉非替尼、和/或培美曲塞。
在一些实施例中,该NSCLC是至少一种化学治疗剂难治愈的或该NSCLC对至少一种化学治疗剂有抗性。在一些实施例中,该肿瘤是至少两种化学治疗剂难治愈的或该肿瘤对至少两种化学治疗剂有抗性。该肿瘤可能是以下各项中的一种或多种难治愈的或该肿瘤对以下各项中的一种或多种有抗性:例如并且不限于威罗菲尼、埃罗替尼、阿法替尼、西妥昔单抗、卡铂、贝伐单抗、埃罗替尼、吉非替尼、和/或培美曲塞。在一些实施例中,该NSCLC对于PD-L1是阴性的。在一些实施例中,该NSCLC对于PD-L1是阳性的。
在一些实施例中,在给予MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段之前,该患者具有0或1的东部肿瘤协作组(ECOG)(奥肯·MM(Oken MM)等人,美国临床肿瘤学杂志(Am.J.Clin.Oncol.),5:649-55(1982))行为状态。
根据在此提供的这些方法,如在一些早期数据中所示,给予MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段可导致理想的药代动力学参数。可以使用“曲线下面积”(AUC)来评估总药物暴露。“AUC(τ)”是指从时间0至时间τ的给药间隔的AUC,而“AUC(∞)”是指直到无穷时间的AUC。给药可产生MEDI4736或其抗原结合片段的约600至约3,000μg/mL*天的AUC(τ)和曲美木单抗或其抗原结合片段的约250至约350μg/mL*天的AUC(τ)。给药可产生约60至约300μg/mLMEDI4736或其抗原结合片段和约25至约35μg/mL曲美木单抗或其抗原结合片段的最大观察浓度(Cmax)。给药可产生约5至约40μg/mL MEDI4736或其抗原结合片段和约4至约6μg/mL曲美木单抗或其抗原结合片段的C最低值(最小血药浓度)。
如在此所提供,MEDI4736或其抗原结合片段还可以使游离(可溶的)PD-L1水平降低。游离(可溶的)PD-L1是指没有结合的PD-L1(例如,通过MEDI4736)。在一些实施例中,PD-L1水平被降低至少65%。在一些实施例中,PD-L1水平被降低至少80%。在一些实施例中,PD-L1水平被降低至少90%。在一些实施例中,PD-L1水平被降低至少95%。在一些实施例中,PD-L1水平被降低至少99%。在一些实施例中,在给予MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段之后,PD-L1水平是不可检测的。
在一些实施例中,在给予MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少65%。在一些实施例中,在单次给予MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少80%。在一些实施例中,在单次给予MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少90%。在一些实施例中,在单次给予MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少95%。在一些实施例中,在单次给予MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少99%。在一些实施例中,在单次给予MEDI4736或其抗原结合片段之后,PD-L1水平是不可检测的。
在一些实施例中,在给予两次剂量的MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少65%。在一些实施例中,在给予两次剂量的MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少80%。在一些实施例中,在给予两次剂量的MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少90%。在一些实施例中,在给予两次剂量的MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少95%。在一些实施例中,在给予两次剂量的MEDI4736或其抗原结合片段之后,PD-L1水平被降低至少99%。在一些实施例中,在给予两次剂量的MEDI4736或其抗原结合片段之后,PD-L1水平是不可检测的。
使用MEDI4736或其抗原结合片段和曲美木单抗或其抗原结合片段两者(即,组合疗法)来治疗患有实体瘤的患者可导致协同效应。本文所用的术语“协同”是指组合疗法(例如,MEDI4736或其抗原结合片段与曲美木单抗或其抗原结合片段组合)比单药疗法的加和效应更加有效。
组合疗法(例如,MEDI4736或其抗原结合片段与曲美木单抗或其抗原结合片段组合)的协同效应允许向患有实体瘤的患者使用一种或多种这些治疗剂的更低剂量和/或向患有实体瘤的患者以更少的频率给予所述治疗剂。利用治疗剂的更低剂量和/或以更少频率给予所述疗法的能力减少与向受试者给予所述疗法相关的毒性而不降低所述疗法在实体瘤的治疗中的疗效。此外,协同效应可以导致治疗剂在实体瘤的管理、治疗或改善中的功效增加。治疗剂的组合的协同效应可避免或减少与使用任一单一疗法相关的不良或不需要的副作用。
在组合疗法中,MEDI4736或其抗原结合片段可以任选地被包括在与曲美木单抗或其抗原结合片段相同的药物组合物中,或者可以被包括在单独的药物组合物中。在后一种情况下,包括MEDI4736或其抗原结合片段的药物组合物适合在给予包含曲美木单抗或其抗原结合片段的药物组合物之前、同时或之后给予。在某些情况下,将MEDI4736或其抗原结合片段在与单独的组合物中的曲美木单抗或其抗原结合片段重叠的时期给予。
患有肺癌(例如,非小细胞肺癌)的受试者可以在选择治疗方法的过程中对PD-L1多核苷酸或多肽表达进行测试。被鉴定为具有对PD-L1是阴性的肿瘤的患者(例如,如通过Ct或IHC-M的分数定义的)或由具有相对于参考水平减少的或不可检测的PD-L1水平鉴定的患者被鉴定为响应抗PD-L1抗体和曲美木单抗的组合治疗。向这样的患者给予MEDI4736或其抗原结合片段与曲美木单抗或其抗原结合片段的组合。
实例
实例1:患者与方法
(a)受试者
这项研究中的受试者被要求年龄为18岁或以上并具有组织学或细胞学证实的非小细胞肺癌(NSCLC;鳞状和非鳞状),根据实体瘤反应评价标准(RECIST)准则v1.1,该非小细胞肺癌具有至少一个可测量的病灶,该RECIST准则v1.1通过引用以其全文结合在此。
对于剂量递增和剂量扩张两个阶段,组群特定的免疫治疗前的要求如下:a)免疫治疗初治的组群:必须没有事先暴露于免疫治疗,例如但不限于,排除疫苗的其他抗CTLA-4、抗PD-1、或抗PD-L1的抗体;和b)免疫治疗预处理组群:在MEDI4736和曲美木单抗首次剂量之前必须有事先暴露于免疫治疗大于28天,这些免疫治疗是,例如但不限于,排除疫苗的其他抗-CTLA-4、抗PD-1、或抗PD-L1抗体。
受试者还被要求未能响应标准治疗、标准治疗后已复发、已拒绝标准治疗、或尚不符合标准治疗。受试者具有0-1的东部肿瘤协作组(ECOG)行为状态。
具有中枢神经系统(CNS)转移的受试者在研究的第1天必须是无症状的。此外,在第1天,必须有至少28周没有CNS转移的进展,如在使用辐射治疗的最后一天之后和从皮质类固醇的末次剂量的至少14天之后通过磁共振成像(MRI)/计算机断层扫描(CT)所证明。
受试者还被要求有足够的器官(肝和肾)和造血功能。足够的器官和造血功能被定义为:血红蛋白≥为9g/dL;绝对嗜中性粒细胞计数≥1500个/mm3;血小板计数≥100,000个/mm3;总胆红素≤1.5×正常值的上限(ULN),除非与吉尔伯特综合征或肝转移相关联(对于这些受试者,基线总胆红素必须≤3.0mg/dL);丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)必须≤2.5×ULN,除非与肝转移相关联(对于这些受试者,ALT和AST必须≤5×ULN);以及血清肌酐≤2.0mg/dL。
如果受试者正在进行任何同步化疗、免疫治疗、生物或激素疗法用于癌症治疗,则他们不能参加。如果受试者在MEDI4736和曲美木单抗的首次剂量之前的28天内已经承受任何试验性抗癌治疗,则他们不能参加。如果受试者在接受免疫治疗(包括抗CTLA-4治疗)时有任何事先≥3级免疫相关不良事件(irAE)或任何未解决的irAE>1级,则他们不能参加。如果受试者在MEDI4736和曲美木单抗的第一剂量之前的28天之内经历了重大外科手术(如研究者所定义的)或如果他们仍正在从之前的手术恢复,则他们也不能参加。除了纳入标准中列出的脱发和实验室值之外,如果受试者具有来自以前的抗癌治疗的未解决的毒性,该毒性被定义为未解决至美国国立癌症研究所不良事件通用术语标准(NCI CTCAE)V4.03的0级或1级。具有合理地预期不被MEDI4736和曲美木单抗加剧的不可逆的毒性的受试者可以被包括在内。除了不超过10mg/天的强的松或等效物的在生理剂量的鼻内和吸入的糖皮质激素或全身皮质类固醇激素之外,如果受试者目前正在使用免疫抑制药物或在MEDI4736和曲美木单抗首次剂量前14天内已经使用免疫抑制药物,他们也被排除。
除了不需要系统治疗的白癜风、斑秃、格雷夫斯病或银屑病(在过去的3年之内)之外,如果受试者在过去3年之内具有活性的或之前的自身免疫性疾病,包括炎性肠病、憩室炎、肠易激病、乳糜泻、韦格纳综合征和桥本综合征,则他们不能参加。如果受试者有原发性免疫缺陷或结核病的历史,如果受试者具有已知的活性或慢性病毒性肝炎A、B、或C;如果受试者有人类免疫缺陷病毒(HIV);其他活性严重疾病或不受控制的间发性疾病;在MEDI4736和曲美木单抗首次剂量之前28天内已接受活的减毒疫苗;5年之内具有其他侵入性恶性肿瘤;或对研究药物配制品的已知的过敏或过敏症,则他们也不能参加。
如果受试者具有晚期NSCLC,该NSCLC具有容纳间变性淋巴瘤受体酪氨酸激酶(ALK)基因重排或表皮生长因子受体(EGFR)敏化突变的肿瘤,并没有接受合适的酪氨酸激酶抑制剂(TKI)治疗,则他们也不能参加。这些受试者可以在用文件证明进展或不能耐受合适的TKI后进行登记。
(b)研究设计
这项研究是MEDI4736和曲美木单抗组合的开放开放性1b期研究(图1)。对于组群的重点研究标准显示在图11中。这项研究将在剂量递增阶段和剂量扩张阶段纳入约36名受试者,并且在免疫治疗初治和免疫治疗预处理组群中各纳入至少20名受试者。在剂量递增阶段为免疫治疗初治组群确定的最大耐受剂量(MTD)或对于每个药剂没有超过MTD的最高协议定义的剂量将作为在免疫治疗预处理组群纳入的受试者作为剂量递增阶段的部分的起始剂量。对于免疫治疗预处理组群的剂量探索将与免疫治疗初治组群的剂量扩张阶段平行进行。
剂量递增阶段
免疫疗法初治组群
在研究的剂量递增阶段,MEDI4736和曲美木单抗最初将在3-6名免疫治疗初治受试者的连续组群中给予,每个受试者经由静脉输注接受曲美木单抗Q4W持续6次剂量和每12周一次(Q12W)持续3次剂量(即,曲美木单抗剂量7是在剂量6的4周后给予并且剂量8是在剂量7的12周后给予)和MEDI4736 Q4W持续13次剂量,共计1年(图2)。按照标准的3+3设计和改进的基于区域的设计,每个组群将纳入至少3个受试者。在第一组群(组群1)中的受试者将接受3mg/kg MED4736和1mg/kg曲美木单抗的剂量。如果在在第一剂量组群中观察到≥2的剂量限制毒性(DLT),起始剂量将按照图1逐步减量。如果在给定的剂量组群中6名受试者中不超过1名经历了DLT,剂量递增将继续。
随后的组群将接受曲美木单抗(Q4W给予6次剂量接着Q12W给予3次剂量)和MEDI4736(Q4W给予13次剂量),直到MTD或对于每个药剂没有超过MTD的最高协议定义的剂量被鉴定。
一旦在剂量递增阶段在免疫治疗初治受试者中确定了MTD或对于每个药剂没有超过MTD的最高协议定义的剂量,免疫治疗初治组群(见图1)的扩张阶段将开始。基于从剂量扩张阶段在免疫治疗初治组群中对PK和药效学、安全性和效力参数的评估,可以在扩张阶段评估来自一个或多个中间基于区域的组群的没有超过MTD的一个或多个另外的剂量。
免疫治疗预处理组群
在剂量递增阶段为免疫治疗初治组群(见图1)确定的MTD或对于每个药剂没有超过MTD的最高协议定义的剂量将作为在免疫治疗预处理组群纳入的受试者作为剂量递增阶段的部分的起始剂量。对于使用3+3设计的免疫治疗预处理组群的剂量探索将与免疫治疗初治组群的剂量扩张阶段平行进行。一旦在剂量递增阶段在免疫治疗预处理受试者中确定了MTD或对于每个药剂没有超过MTD的最高协议定义的剂量,免疫治疗预处理组群的剂量扩张阶段可开始。基于从剂量扩张阶段在免疫治疗预处理组群中对PK和药效学、安全性和效力参数的评估,可以在剂量扩张阶段评估来自一个或多个中间基于区域的组群的没有超过MTD的一个或多个另外的剂量。
剂量扩张阶段
两个剂量扩张组群将被使用:免疫初治和免疫预处理(惨见图1)。在剂量递增阶段中鉴定的MTD或对于每个药剂没有超过MTD的最高协议定义的剂量将被用于在剂量扩张阶段的两个组群。另外,基于形成的受试者数据,包括安全性、PK、药效学、生物标志物、以及来自仍在进行的试验的反应连同数据,不超过MTD的来自一个或多个中间基于区域的组群的一个或多个剂量可以包括作为在剂量扩张阶段用于免疫治疗预处理和免疫治疗初治组群的一个或多个另外的剂量。
最初,在每个免疫治疗初治组群和免疫治疗预处理组群中大约20名NSCLC受试者将被纳入。依赖于形成的受试者数据,包括安全性、PK、药效学、生物标志物、以及来自仍在进行的试验的反应和数据,在剂量扩张阶段可以对免疫治疗初治组群每个纳入另外的受试者,多达总共60名受试者。
治疗方案
受试者将在研究的剂量递增或剂量扩张阶段中进行治疗。在研究的剂量递增和剂量扩张阶段,曲美木单抗将每四周一次(Q4W)被给予6次剂量,接着每十二周一次(Q12W)给予3次剂量,其中剂量7是在剂量6的4周后给予,剂量8是在剂量7的12周后给予。MEDI4736将Q4W被给予13次剂量。两种药剂将通过IV输注给予总共1年(图2)。
曲美木单抗将在250mL的0.9%的氯化钠中通过静脉内被给予。MEDI4736将在250mL的0.9%的氯化钠中通过静脉内被给予。曲美木单抗将首先被给予。曲美木单抗输注结束后约1小时将开始MEDI4736输注。在组群1中,曲美木单抗的第一IV输注将持续大约1小时和MEDI4736的第一IV输注将持续大约为4小时;对于在这个组群中的受试者的后续输注和对于剩余组群的所有输注将持续大约1小时。
直到12个月MEDI4736和曲美木单抗治疗期结束时,实现和保持疾病控制(DC)(即完全缓解(CR)、部分缓解(PR)、或疾病稳定(SD))的受试者将进入随访。根据在随访期间疾病进展(PD)的证据,如果受试者还没有接受针对他们的疾病的其他治疗并仍然满足研究协议的纳入和排除标准,则在最初12月期间可用相同的治疗指南向受试者重新给予MEDI4736和曲美木单抗最多另外12个月。只允许有一轮使用MEDI4736和曲美木单抗的复治。
该研究利用3+3剂量递增阶段并将遵循图3中所示的方案。在各个剂量组群中将纳入至少3个受试者。如果在一个剂量组群中的3名患者中没有患者具有剂量限制性毒性(DLT),下一个剂量递增组群将被启动。如果在一个剂量组群中的3名患者中1名患者具有DLT,另外的3名患者将被纳入相同的组群中。如果6名受试者中不超过1名经历DLT,下一个剂量递增组群将被启动。如果在评价期间在一个剂量组群中有2名或更多名患者经历DLT,则没有另外的受试者将被纳入那个剂量组群中。
最大耐受剂量(MTD)被定义为在6名患者中不超过1名患者经历DLT的组群中曲美木单抗或MEDI4736的最高剂量。这在剂量递增阶段中对免疫治疗初治和预处理组群都进行确定。在扩张阶段(免疫治疗初治和免疫治疗预处理组群)中的患者将以在剂量递增阶段中确定的MTD水平进行治疗。
由于如在图10A和10B中所描述的毒性,MEDI4736和曲美木单抗给予可以被改变或被停止。对于不明显归因于MEDI4736或曲美木单抗的不良事件(AE)(例如,意外事件)或对于被认为不具有临床意义的实验室异常情况,剂量改变不是必需的。
(c)药代动力学、抗肿瘤、生物标志物、可溶性因子、和安全性评估
在血清中MEDI4736和曲美木单抗浓度的测定将使用经过验证的免疫测定来进行。
用于药代动力学评估的血液样品将在剂量递增阶段的以下天数收集:第1天(给药前和输注结束),第8天(±1天),第15天(±1天),第29天(给药前和输注结束;±3天),第57天(给药前和输注结束;±3天),第85天(给药前和输注结束;±3天),第113天(给药前和输注结束;±3天),第141天(给药前和输注结束;±3天),第169天(给药前和输注结束;±3天),第197天(给药前和输注结束;±3天;仅MEDI4736),第225天(给药前和输注结束;±3天;仅MEDI4736),第253天(给药前和输注结束;±3天),第281天(给药前和输注结束;±3天;仅MEDI4736),第309天(给药前和输注结束;±3天),第337天(给药前和输注结束;±3天),在治疗结束时,治疗结束后60天,和治疗结束后90天。
用于药代动力学评估的血液样品将在剂量扩张阶段的以下天数收集:第1天(给药前和输注结束)、第29天(±3天)、第57天(±3天)、第85天(±3天)、第113天(±3天)、第141天(±3天)、第169天(±3天)、第197天(±3天;仅MEDI4736)、第225天(±3天;仅MEDI4736)、第253天(±3天)、第281天(±3天;仅MEDI4736)、第309天(±3天;仅MEDI4736)、第337天(±3天)、在治疗结束时、治疗结束后60天、和治疗结束后90天。
抗药物抗体(ADA)的存在将在以下天数进行评估:第1天和第29天(±3天)、第85天(±3天)、第141天(±3天)、第169天(±3天)、第253天(±3天)、和第337天(±3天)、在治疗结束时、治疗结束后60天、和治疗结束后90天。使用中尺度发现平台的验证电化学发光测定法将用于人血清中抗MEDI4736抗体的确定和用于人血清中抗曲美木单抗抗体的确定。
血液样品将被收集用于循环可溶性因子(包括可溶性PD-L1(sPD-L1))的分析。在剂量递增阶段中,sPD-L1的水平将在以下天数进行评估:第1天、第8天(±1天)、第15天(±1天)、第29天(±3天)、第57天(±3天)、第85天(±3天)、第113天(±3天)、第141天(±3天)、第169天(±3天)、第197天(±3天)、第225天(±3天)、第253天(±3天)、第281天(±3天)、第309天(±3天)、第337天(±3天)、在治疗结束时、治疗结束后60天、和治疗结束后90天。在剂量扩张阶段中,sPD-L1的水平将在以下天数进行评估:第1天、第29天(±3天)、第57天(±3天)、第85天(±3天)、第113天(±3天)、第141天(±3天)、第169天(±3天)、第197天(±3天)、第225天(±3天)、第253天(±3天)、第281天(±3天)、第309天(±3天)、第337天(±3天)、在治疗结束时、治疗结束后60天、和治疗结束后90天。
在筛选过程中(第-28天至第-1天)、在第8周(第50天±3天)、在第33周(第225天±3天)、在剂量递增阶段中将进行肿瘤的评估。肿瘤评价将基于修改过的RECIST准则v1.1,并包括以下评估:体格检查(如果适用的话使用皮肤病灶的照片和测量值),胸、腹和骨盆的CT或MRI扫描,以及大脑的CT或MRI扫描。仅在筛选时进行大脑的计算机断层摄影术或MRI扫描。
抗肿瘤活性的评价是基于肿瘤病灶的测量、靶病灶的评估、非靶病灶的评估、和新病灶的出现。
靶病灶评估
对于靶病灶的评估,完全缓解被定义为所有靶病灶的消失。任何病理性淋巴结(无论是靶或非靶)必须在短轴减少至<10mm(如果有靶节点,总和可能不是“0”)。
对于靶病灶的评估,部分缓解被定义为在靶病灶的直径总和减少至少30%,以基线总和直径作为参考。
对于靶病灶的评估,疾病进展被定义为在靶病灶的直径总和增加至少20%,以研究上的最小总和作为参考(这包括基线总和,如果它是研究上的最小总和)。除了20%的相对增加,总和也必须表现出至少5mm的绝对增加。一个或多个新病灶的出现也被认为是进展。
对于靶病灶的评估,病情稳定(SD)既不是足够的收缩以符合PR,也不是足够的增加以符合PD,在研究上以直径最小的总和作为参考。
非靶病灶评估
对于非靶病灶的评估,完全缓解(CR)被定义为所有非靶病灶的消失。所有的淋巴结必须在短轴上<10mm。
对于非靶病灶的评估,非完全缓解/非疾病进展被定义为一个或多个非靶病灶的持续和/或肿瘤标志物水平保持在正常范围以上。
对于非靶病灶的评估,疾病进展被定义为非靶疾病大量恶化的总体水平,使得即使在靶疾病中存在SD或PR,整体肿瘤负荷已经增加到足以值得停止治疗。在不存在可测量的疾病时,非可测量的疾病的变化幅度与将对可测量的疾病需要声明PD的增加大致相当。
新病灶
根据RECIST准则v1.1,新病灶的出现被考虑为PD。考虑到对于免疫疗法已观察到独特的反应动力学,新病灶可能不代表真实的疾病进展。在没有快速临床恶化时,受试者可继续接受使用MEDI4736和曲美木单抗的治疗。
总体反应
可以通过自第一次记载之日起不少于四周的重复连续评价来要求CR、PR、连同PD的确认。如在下面的表1中的,确定了基于靶病灶、非靶病灶、和新病灶的评估的总体反应的评估。
表1:总体反应的评估
a被定义为在基线的非靶病灶。
b不可评估的被定义为在评价中没有病灶测量或只有病灶的小部分测量被进行。
在给予MEDI4736之后监测不良事件。其他评价包括体格检查、生命体征监测和实验室测量。
实例2:结果
(a)登记和随访
以每3名受试者一个组群对12名受试者进行治疗:组群1a(1mg/kg曲美木单抗和3mg/kg MEDI4736)、组群2a(1mg/kg曲美木单抗和10mg/kg MEDI4736)、组群3a(1mg/kg曲美木单抗和15mg/kg MEDI4736)、和组群3b(3mg/kg曲美木单抗和10mg/kg MEDI4736)。组群1a中的2名受试者(1名受试者在两个药剂的2次剂量后撤回了同意)完成了大约115天的随访;组群2a中的受试者完成了大约56天的随访;并且组群3a和组群3b中的受试者完成了28天的随访(图12)。
(b)药物代谢动力学
由以3mg/kg和10mg/kg给予MEDI4736(与1mg/kg曲美木单抗组合)得到的药物代谢动力学数据被概述于图4中。由给予MEDI4736得到的单个PK参数被显示于图8中。在由第一剂量得到的这个早期数据中,对于接受3mg/kg MEDI4736的受试者的平均Cmax为67.36μg/ml。对于接受3mg/kg MEDI4736的受试者的平均AUCτ为625.3μg/ml*天。对于接受3mg/kg MEDI4736的受试者的平均C最低值(Ctrough)为8.85μg/ml。对于接受10mg/kg MEDI4736的受试者的平均Cmax为266.7μg/ml。对于接受10mg/kg MEDI4736的受试者的平均AUCτ为2860μg/ml*天。对于接受10mg/kg MEDI4736的受试者的平均C最低值(Ctrough)为35.65μg/ml。MEDI4736显示了表示非线性PK的超过与剂量成比例的AUC的增加。参见图4。
由以1mg/kg给予曲美木单抗(与3mg/kg MEDI4736或10mg/kg MEDI4736组合)得到的药物代谢动力学数据被概述于图5中。由给予曲美木单抗得到的单个PK参数被显示于图9中。
对于接受1mg/kg曲美木单抗与3mg/kg MEDI4736组合的受试者的平均Cmax为27.07μg/ml。对于接受1mg/kg曲美木单抗与10mg/kg MEDI4736组合的受试者的平均Cmax为30.40μg/ml。
对于接受1mg/kg曲美木单抗与3mg/kg MEDI4736组合的受试者的平均AUCτ为262.2μg/ml*天。对于接受1mg/kg曲美木单抗与10mg/kg MEDI4736组合的受试者的平均AUCτ为338.8μg/ml*天。
对于接受1mg/kg曲美木单抗与3mg/kg MEDI4736组合的受试者的平均C最低值(Ctrough)为4.21μg/ml。对于接受1mg/kg曲美木单抗与10mg/kg MEDI4736组合的受试者的平均C最低值为5.33μg/ml。
(c)可溶性PD-L1评价
由给予3mg/kg和10mg/kg MEDI4736和1mg/kg曲美木单抗得到的sPD-L1数据被显示于图6(绝对浓度)、图7和图8(抑制,基线的%)中。MEDI4736给药后,在6名受试者的5名中观察到完全sPD-L1抑制。在1名受试者中,在MEDI4736的第二次剂量观察到大约65%的sPD-L1抑制。
(d)安全性
在12名受试者中的10名报道了治疗突发性不良事件(TEAE)。最频繁报道的TEAE是疲乏(41.7%;5名受试者)、增加的淀粉酶(25.0%;3名受试者)、瘙痒和上呼吸道感染(16.7%;各2名受试者)没有受试者经历了剂量限制性毒性。经历了TEAE的10名受试者中的9名具有严重度为1级或2级的事件。1名受试者(组群2a)经历了3级增加的天冬氨酸转移酶(AST)和增加的丙氨酸氨基转移酶(ALT)和致命性(5级)重症肌无力。12名受试者中2名经历了治疗突发性严重不良事件(SAE)。2名受试者由于TEAE停止了治疗。图13显示了相关的不良事件。
显示肿瘤大小从基线的变化的早期结果被显示于图14中。肿瘤大小的降低可见于1mg/kg(T)+10mg/kg(M)、1mg/kg(T)+15mg/kg(M)和3mg/kg(T)+10mg/kg(M)组的患者中。
这项研究说明MEDI4736和曲美木单抗具有良好的药代动力学特性并且药剂的组合抑制sPD-L1。此外,在目前正在治疗的大多数受试者中很好地耐受了MEDI4736。
实例3:在患有晚期NSCLC的患者中MEDI4736与曲美木单抗组合的1b期开放性研究
抑制性PD-L1和CTLA-4通路在控制的T细胞激活中起到了主要的作用。MEDI4736(M)是阻断PD-L1与PD-1和CD-80结合的人类IgG1单克隆抗体。曲美木单抗(T)是靶向CTLA-4的人类IgG2单克隆抗体。作为单剂,MEDI4736和曲美木单抗都显示了令人鼓舞的安全概况和有前景的临床活性;因为他们阻止促进免疫抑制不同的相互作用,MEDI4736+曲美木单抗组合疗法可在患有晚期非小细胞肺癌的患者(pts)中提供与单独的任何一个药剂相比更高的抗肿瘤活性。
这项1期研究正在患有晚期NSCLC的患者中评价MEDI4736+曲美木单抗组合疗法的安全性/耐受性、抗肿瘤活性、药代动力学(PK)和免疫原性。该研究具有剂量递增和扩张阶段。
结果:截至2014年12月4日,已治疗61名患者(表2)。
表2
MEDI4736(M)+曲美木单抗(T)
Q4W=每4周一次;Q2W=每2周一次
总体而言,最常见的药物相关的所有等级的不良事件(之10%的患者)是腹泻、疲乏、瘙痒、增加的丙氨酸转氨酶(ALT)和淀粉酶;它们使用标准治疗指南包括类固醇是可管理的。所有患者中最常见的≥3级药物相关的AE(≥5%)是结肠炎、腹泻、增加的天冬氨酸转氨酶(AST)和ALT。导致停药的药物相关的AE是结肠炎(6.6%)、腹泻(3.3%)、肺炎(3.3%)、增加的AST(3.3%)和ALT(1.6%)、咳嗽(1.6%)和呼吸困难(1.6%);在10mg/kg M q4w+1mg/kg T组群中有1例治疗相关的死亡(多肌炎)。经过至少一个8周扫描的31名受试者中,在8例患者(26%)中报道了最好的总体反应;在11例患者(36%)中报道了疾病稳定。
这些有前景的结果表明,该MEDI4736+曲美木单抗组合具有可管理的安全性和早期临床活性。
结果:截至2015年1月27日,已治疗10个组群中的74名患者(表3)。
对组合给予的MEDI4736和曲美木单抗的各种剂量和时间表进行了检查(图15)。MEDI4736剂量和时间表包括3mg/kg、10mg/kg、15mg/kg、和20mg/kg每4周一次(q4w),和10mg/kg每2周一次(q2w)。曲美木单抗剂量和时间表包括1mg/kg、3mg/kg、和10mg/kg每4周一次(q4w x 6次剂量)和每12周一次(q12w x 3次剂量)。
观察到在剂量≥15mg/kg Q4W MEDI4736的完全sPD-L1抑制(图16)。在10mg/kg Q4W和15mg/kg Q4W的各一名受试者在一些诊治中显示了部分sPD-L1,接着在重复剂量后显示了完全抑制。一名受试者在15mg/kg Q4W之后在第29天没有被抑制。相比之下,使用以剂量>3mg/kg Q2W的单一药剂MEDI4736(研究1108)观察到了完全抑制。当单个sPD-L1概况通过组群被检查时,在>95%的受试者中在给予10mg/kg Q2W剂量后观察到完全sPD-L1抑制(图17)。
当MEDI4736和曲美木单抗组合给予时,也观察到T细胞增加的增殖(图18)。通过对标记CD4和CD8与Ki67(细胞增殖的标记)的组合的FACS分析,对细胞进行了分选。当增加曲美木单抗剂量,观察到CD4+Ki67+细胞峰值单调递增,其比当使用单独的MEDI4736时CD4+Ki67+细胞峰值的增加更大。使用MEDI4736与曲美木单抗的组合比使用单独的MEDI4736的CD8+增殖反应更大。
相比单独的MEDI4736,在接受MEDI4736和曲美木单抗的受试者中观察到CD4 ICOS+和CD4 HLADR+细胞的增加(图19)。使用单独的MEDI4736观察到CD4+ICOS+细胞和CD4+HLADR+细胞中的最小变化,所有测试的组合剂量都具有与MEDI4736可区别的模式。使用10mg/kg曲美木单抗剂量观察到在CD4+ICOS+细胞和CD4+HLADR+细胞的最大增加。相比单独的MEDI4736,在接受MEDI4736和曲美木单抗的受试者中观察到CD4+T效应细胞和调节性T细胞(CD25hi Cd127lo表型也可以包括一些激活的T细胞)的增加(图20和21)。
相比于用MEDI4736单药疗法(10mg/kg Q2W)的治疗,用MEDI4736和曲美木单抗(所有剂量)的治疗时观察到在NSCLC中的临床活性,该用MEDI4736和曲美木单抗(所有剂量)的治疗显示了总体反应率增加(图22)。在有可测量疾病的治疗患者中在基线+≥1随访扫描(包括在第一次随访扫描之前由于疾病进展或死亡的的停药)反应是可评估的。对于MEDI4736 NSCLC(CP1 108),只有具有≥12周随访的患者被包括在内。总体反应率(ORR)包括确认的和未确认的完全缓解(CR)或部分缓解(PR)。对于MEDI4736 NSCLC单药治疗(CP1108,10mg/kg Q2W),呈现了具有最少12周持续时间的疾病稳定(SD)的最佳总体反应(BOR)。对于MEDI4736和曲美木单抗的组合,呈现了具有最少7周持续时间的SD的BOR。
在给予了MEDI4736和曲美木单抗(曲美木单抗的剂量为1mg/kg;3mg/kg;和10mg/kg)的大多数NSCLC患者中可见肿瘤大小的减小和稳定(图23)。3级不良事件的发生表明,增加曲美木单抗的剂量也减少不良事件发生的时间(图24)。在给予了MEDI4736和曲美木单抗(MEDI4736的剂量为10mg/kg;315mg/kg;和20mg/kg(Q4W)或10mg/kg(Q2W))的大多数NSCLC患者中可见肿瘤大小的减小和稳定(图25)。3级不良事件的发生表明,比起增加MEDI4736的剂量,增加曲美木单抗的剂量影响了不良事件发生的时间(图26)。因此,MEDI4736和曲美木单抗剂量的选择将考虑到功效和安全性。
在癌症治疗中的单一药剂曲美木单抗的暴露数据已经支持了需要更高的暴露(>30mg/mL)以最大化功效。平均而言,这些水平在剂量>3mg/kg被获得。基于单一药剂暴露-安全性关系的分析,在给予1mg/kg的曲美木单抗之后实现的暴露比3mg/kg预期产生更少的毒性。不受限于具体的理论,1mg/kg的曲美木单抗部分地抑制CTLA4,因为在1mg/kg下仍观察到免疫介导的不良反应(尽管在较低的发病率)。如果观察到协同效应并且安全性特征相对于更高的曲美木单抗剂量提高了,1mg/kg的曲美木单抗与MEDI4736组合可能是最佳的。
在一项研究中,在剂量≥3mg/kg Q2W MEDI4736时观察到在血清中PD-L1下降和sPD-L1的完全抑制。基于在大多数受试者中实现>99%的下降饱和度,使用在小鼠模型中产生最大肿瘤生长抑制(TGI)的药物水平(100mg/mL被鉴定为最小靶最低浓度),选择10mg/kg Q2W的剂量用作单一药剂。在10mg/kg Q4W与曲美木单抗组合后,在一些受试者中观察到sPD-L1的抑制。使用MEDI4736 Q2W的剂量密度更高且使用Q4W的Cmax更高。使用Q4W的计划可以提供更大的便利。在其他受试者中观察到不完全抑制,可能是由于PD-L1的上调和在此剂量水平实现的次优的最低水平。在10mg/kg Q4W的MEDI4736,与曲美木单抗组合评估,产生低于100mg/mL目标的最低浓度。然而,使用在15mg/kg和20mg/kg Q4W的MEDI4736实现了目标水平,并且更高剂量的MEDI4736在迄今为止评估的所有受试者中保持了sPD-L1抑制。如果观察到协同效应并且提高了安全性特征,在10mg/kg或更高的MEDI4736与曲美木单抗组合可能是最佳的。
总体而言,相比于MEDI4736单药治疗,MEDI4736和曲美木单抗的组合的趋势是减少或稳定疾病,并且在测试的最高剂量的MEDI4736和曲美木单抗与不良事件增加的发生率相关(图27-29)。这些结果表明,MEDI4736和曲美木单抗的组合耐受性良好并具有成为针对NSCLC的有效疗法的潜力。
实例4:使用MED14736和曲美木单抗治疗在NSCLC中的PD-L1阴性肿瘤。
以每3名受试者一个组群对12名受试者进行治疗:组群1a(1mg/kg曲美木单抗和3mg/kg MEDI4736)、组群2a(1mg/kg曲美木单抗和10mg/kg MEDI4736)、组群3a(1mg/kg曲美木单抗和15mg/kg MEDI4736)、和组群3b(3mg/kg曲美木单抗和10mg/kg MEDI4736)。组群1a中的2名受试者(1名受试者在两个药剂的2次剂量后撤回了同意)完成了大约115天的随访;组群2a中的受试者完成了大约56天的随访;并且组群3a和组群3b中的受试者完成了28天的随访。
将在研究中对于7名受试者的PD-L1肿瘤表达数据的基线水平提供在表4(以下)中。将其他信息提供在表5中。
通过在福尔马林固定和石蜡包埋的组织样品中的免疫组织化学来表征NSCLC患者的受试者组织的PD-L1表达。如果样品含有25%或更多的具有PD-L1膜染色的肿瘤细胞,则样品被确定为“PD-L1阳性”。这被表示为免疫组织化学膜(M)-评分。对于PD-L1表达所有样品均被评分为“负数”。肿瘤评价可7例患者的6例中可获得。对3例患者使用曲美木单抗和MEDI4736的组合来治疗。
两例患者被鉴定为未确认的部分缓解(PR),2例具有疾病稳定(SD),以及2例具有疾病进展(PD)。在所有6例患者中,在对PD-L1表达分析前>6个月收集肿瘤样品,并且6个活检样品中的3个在分析前2年以上被收集。这些数据表明,基于存储的组织样本在PD-L1阴性NSCLC中,MEDI4736和曲美木单抗的组合是有活性的。
相比MEDI4736单药治疗(CP1108,10mg/kg Q2W),当给予MEDI4736和曲美木单抗时,具有PD-L1阴性NSCLC的大多数患者响应组合疗法,并表现出肿瘤大小的降低或稳定(图30)。相比MEDI4736单药治疗,具有PD-L1阳性NSCLC的患者还响应MEDI4736和曲美木单抗的组合,并表现出肿瘤大小的降低或稳定(图31)。当通过曲美木单抗的剂量对具有PD-L1阴性NSCLC的患者的结果进行分组时,1mg/kg曲美木单抗或3mg/kg曲美木单抗与在10mg/kg Q4W或15mg/kg Q4W的MEDI4736组合给予在控制或减少疾病方面是有效的(图32)。当通过MEDI4736的剂量对结果分组时,结果还表明,1mg/kg至3mg/kg的曲美木单抗与在10mg/kg Q4W或15mg/kg Q4W的MEDI4736组合给予在控制或减少疾病方面是有效的(图33)。接受MEDI4736和曲美木单抗的所有NSCLC患者的分析表明,PD-L1-和PD-L1+NSCLC患者对治疗有反应(图34A-34D和图35-37;表6-9)。
本领域技术人员仅仅使用常规实验即可识别出或能够确定在此描述的本披露内容的特定方面的许多等效物。此类等效物意图由以下权利要求书涵盖。
在此引用不同的公开,这些公开的披露内容通过引用以其全文结合。
尽管出于清晰理解的目的已经借助于说明和实例相当详细地描述了前述发明,但显而易见可以在所附权利要求书的范围内实践某些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!