使用耐灭菌剂调节物的生物灭菌指示器的制作方法
本申请要求提交于2014年10月10日的美国临时专利申请62/062,285的优先权,该临时专利申请的公开内容全文以引用方式并入本文。
背景技术:
灭菌指示器(也称为生物灭菌指示器)提供了用于确定灭菌机器(诸如,用于对医院中的外科手术器械进行灭菌的那些)是否适当地发挥功能以及是否在灭菌工序期间杀灭存在于灭菌室中的微生物的装置。
在本领域中公认灭菌指示器,包括独立成套的灭菌指示器,能提供用于测试灭菌工序的有效性的准确且精确的装置。常规灭菌指示器通过监测包含在灭菌指示器内的测试微生物的存活来度量灭菌工序的效果,该测试微生物对灭菌过程的耐性比将通常由天然污染提供的大多数微生物高数倍。使灭菌指示器经受灭菌周期并且随后在将促进任何存活的测试微生物的生长的条件下进行温育。如果灭菌周期失效,则该灭菌指示器生成表明生物标本存活的可检测信号。可检测信号常常为如下指示,诸如颜色变化或者发出冷光或荧光信号。
一种熟知类型的独立成套的灭菌指示器采用得自细菌或真菌的孢子(其对灭菌极其耐受)来测试灭菌工序的有效性。典型的独立成套的灭菌指示器具有外部容器和密封的内部容器。外部容器上的细菌不可透过、透气的覆盖物允许灭菌剂在灭菌工序期间进入外部容器。在载体上的活孢子位于外部容器和内部容器的壁之间。内部容器包含刺激活孢子的生长的生长培养基。在灭菌工序期间,灭菌剂通过盖进入外部容器并且接触载体内的孢子。在灭菌工序之后,压碎内部容器,由此释放生长培养基并且使其接触孢子。然后在刺激孢子生长的条件下来温育指示器。如果灭菌工序无效,则存活孢子将生长并且引起生长培养基中的pH指示剂改变颜色,由此指示出灭菌周期不能杀灭微生物测试群并且可能已不能杀灭存在于灭菌器载液中的污染微生物。尽管依赖于孢子生长的灭菌指示器为准确的,但它们为缓慢的,通常需要1至7天才能提供最终结果。
相比于测量仅孢子生长的灭菌指示器,酶指示器提供快速应答(通常在大约几小时内)。这种指示器通过测量酶的活性来测量灭菌工序的有效性,该酶的活性与污染微生物在灭菌工序期间的变性相关联。如果灭菌工序适当地起作用,则酶在该工序期间被灭活并且在温育之后不存在可检测的变化。然而,如果灭菌工序无效,则酶未被灭活并且将与底物反应以形成可检测的产物。酶-底物产物可被检测为颜色变化或者荧光或冷光信号。
双作用快速读出式指示器为通过测量经受灭菌工序之后的酶活性和孢子生长两者来测试灭菌工序的有效性的独立成套的灭菌指示器。酶体系给出灭菌周期的有效性的快速指示,这随后通过在较长时间段上测量孢子生长进行确认。在双作用快速读出式指示器中,在指示器的孢子生长部分中利用的活孢子也可充当分析的酶活性部分所用的活性酶源。快速酶测试测量与孢子相关联的酶的活性,并且随后温育孢子自身以促使在灭菌工序中存活的任何孢子的生长。得自美国明尼苏达州圣保罗3M公司(3M Company,St.Paul,MN)的3M ATTESTTM1291和1292快速读出式生物指示器为双作用快速读出式指示器,该双作用快速读出式指示器通过测量在指示器中与嗜热脂肪土芽孢杆菌(Geobacillus stearothermophilus)(以前称为嗜热脂肪芽孢杆菌(Bacillus stearothermophilis))孢子相关联的酶的活性和孢子自身的存活这两者而测试灭菌周期有效性。
技术实现要素:
本公开提供了用于确定灭菌工序的功效的制品以及方法。制品包括干涂层,该干涂层包含i)能够用于检测对氧化性灭菌剂的暴露的多种活的测试微生物,和ii)有效量的耐灭菌剂调节物。有效量的耐灭菌剂调节物使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性增加。有利地,本公开的耐灭菌剂调节物能够降低生物指示器对氧化性灭菌剂的耐性,而不对与测试微生物相关联的酶活性的快速检测具有显著的负面影响(例如,耐灭菌剂调节物不导致检测酶活性的能力的显著迟滞)。
有利地,调节物提供调节生物指示器对氧化性灭菌剂的耐性的能力。
在一个方面,本公开提供了独立成套的生物灭菌指示器。独立成套的生物灭菌指示器可包括具有液体不可透过的壁和内部体积的外部容器;封闭预定体积的含水介质的密封的、可打开的、液体不可透过的内部容器;干涂层,该干涂层包含i)能够用于检测对氧化性灭菌剂的暴露的多种活的测试微生物和ii)有效量的耐灭菌剂调节物;以及允许内部体积和外部容器外的大气环境之间蒸气连通的路径。有效量使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性增加。
在另一个方面,本公开提供了生物灭菌指示器。生物灭菌指示器可包括载体和其上设置的干涂层。干涂层包含i)能够用于检测对氧化性灭菌剂的暴露的多种活的测试微生物,和ii)有效量的耐灭菌剂调节物。有效量使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性增加。
在任何上述实施方案中,耐灭菌剂调节物可选自由L-高半胱氨酸、L-精氨酸以及L-组氨酸组成的组。在任何上述实施方案中,耐灭菌剂调节物调节生物指示器对包括过氧化氢、过乙酸、臭氧、二氧化氯或它们的组合的氧化性灭菌剂或消毒剂的耐性。
在另一个方面,本公开提供了用于确定灭菌处理的功效的方法。该方法可包括提供根据上述实施方案中任一项所述的生物灭菌指示器;使生物灭菌指示器暴露于灭菌工艺中的灭菌剂,其中灭菌剂是氧化性灭菌剂;以及检测多种测试微生物中的至少一种是否存活于灭菌处理的指示。
在另一个方面,本公开提供了用于确定灭菌处理的功效的方法。该方法可包括提供根据上述实施方案中任一项所述的独立成套的生物灭菌指示器;使独立成套的生物灭菌指示器暴露于灭菌工艺中的灭菌剂,其中灭菌剂是氧化性灭菌剂;以及检测多种测试微生物中的至少一种是否存活于灭菌工艺的指示。
在该方法的任何上述实施方案中,检测多种测试微生物中的至少一种微生物是否存活于灭菌处理的指示可包括检测测试微生物的生长。在该方法的任何上述实施方案中,检测多种测试微生物中的至少一种微生物是否存活于灭菌处理的指示可包括检测与测试微生物相关联的预定的酶活性。
本文中,术语“生物灭菌指示器”是指其上涂覆包含预定量的测试微生物的液体体积并且随后干燥(例如脱水)至基本上无水的状态的基底(例如,载体或容器的壁)。短语“基本上无水的”指这样的涂层,一旦已允许该涂层与周围环境平衡,它就具有不大于脱水涂层的大致含水量的含水量。
本文中,术语“独立成套的生物灭菌指示器”是指包括一起包装在容器中的测试微生物源(例如生物灭菌指示器)、培养基和用于形成对灭菌工序失效的可检测指示的装置的设备,该容器允许测试微生物源、培养基和用于形成对灭菌工序的失效的可检测指示的装置合并在一起,而不将设备的内容物暴露于非灭菌环境。
在本文中,“多孔”载体是指灭菌剂可在正常灭菌条件(这些条件由特定灭菌工序来限定)下穿过载体。
在本文中,“由载体支撑”是指测试微生物可设置在载体的表面上(具体地讲,如果其并非为多孔的)或者可分布在多孔载体内。
在本文中,“分布在多孔载体内”是指测试微生物可均匀地或不均匀地贯穿分布在多孔载体的体积的至少一部分中(即,并非仅在其表面上)。“分布在…内”包括贯穿分布(以及均匀地贯穿分布)在多孔载体的整个体积中。
本文中,“测试微生物”是指通常用于监测灭菌工序有效性的微生物,例如嗜热脂肪土芽孢杆菌。
在本文中,就制备载体的材料而言,术语“亲水性”是指具有零接触角(即,被水润湿)。此疏水性材料可为无机物、有机物、或它们的组合。
词语“优选的”和“优选地”是指在某些情况下可提供某些有益效果的本发明实施方案。然而,在相同的情况或其它情况下,其它实施方案也可为优选的。此外,对一个或多个优选实施方案的表述并不暗示其它实施方案是不可用的,且并非旨在将其它实施方案排除在本发明范围之外。
术语“包括”及其变型形式在说明书和权利要求中出现这些术语的地方不具有限制的含义。
本申请所用的“一种(个)”、“所述(该)”、“至少一种(个)”以及“一种或多种(一个或多个)”可互换使用。因此,例如,“一种”测试微生物可解释为意指“一种或多种”测试微生物。
术语“和/或”意指所列要素中的一个或全部,或者所列要素中的任何两个或更多个的组合。
另外,在本文中,通过端点表述的数值范围包括该范围内所含的所有数值(例如,1至5包括1、1.5、2、2.75、3、3.80、4、5等)。
本发明的上述发明内容并非旨在描述本发明的每个公开的实施方案或每种实施方式。以下描述更具体地举例说明示例性实施方案。在本申请的全文的若干处,通过示例列表提供了指导,这些示例可以各种组合使用。在每种情况下,所引用的列表都只用作代表性的组,并且不应当理解为排它性列表。
下面将结合附图和描述介绍上述及其它实施方案的更多细节。通过具体实施方式、附图和权利要求书,其它特征、对象和优点将变得显而易见。
附图说明
图1是根据本公开的独立成套的生物灭菌指示器的一个实施方案的分解图。
图2是图1中所示设备的剖视图。
图3是根据本公开的独立成套的灭菌指示器的另选实施方案的分解图。
图4是图3中所示设备的剖视图。
图5是根据本公开的生物灭菌指示器的一个实施方案的透视图。
图6是图5中所示设备的分解图。
图7是根据本公开的独立成套的生物灭菌指示器的另选实施方案的透视图。
图8是图7的设备的分解图。
具体实施方式
在详细解释本公开的任何实施方案之前,应当理解,本发明在其应用中不仅限于下文描述内容中提及或下文附图中示出的构造细节和部件布置方式。本发明能够具有其它实施方案,也能够以各种方式实施或执行。另外,应当理解,本文使用的措词和术语是用于说明目的而不应被视为限制性的。本文使用的“包括”、“包含”或“具有”及其变型形式意在涵盖其后列出的项目及其等同形式以及附加的项目。应当理解,可采用其它的实施方案,并且可以在不偏离本发明范围的情况下作出结构变化或逻辑变化。
本公开总体涉及用于测试灭菌处理的有效性的设备和方法。具体地,本公开涉及包括涂层的设备,该涂层包含多种测试微生物和耐灭菌剂调节物,该耐灭菌剂调节物用来降低生物指示器对氧化性灭菌剂的耐性。
提供了用于测试灭菌工序的有效性的生物灭菌指示器,包括独立成套的生物灭菌指示器,其中生物灭菌指示器包括能够用于检测对氧化性灭菌剂的暴露、浸染有一种或多种耐灭菌剂调节物的多种基本上干燥的活的测试微生物,其中耐灭菌剂调节物包含氨基酸。
先前已经使用生物灭菌指示器来监测灭菌系统的功效。生物灭菌指示器通常包括具有干燥至载体上的预定浓度的活测试微生物的微生物源。将微生物浸渍的载体放置在装载的灭菌系统中并且进行完全灭菌处理。此后,使载体与无菌培养基接触,并且在适当温度下与用于指示活的微生物存在或不存在的装置(例如pH指示剂或与酶反应以形成可检测的产物的酶底物)一起温育预定时间。在温育期结束时,检查培养基以确定是否有任何测试微生物存活于灭菌处理。微生物存活意味着灭菌处理是无效的。
独立成套的生物灭菌指示器包括以一种方式包装在一起的微生物源、培养基和用于指示活的微生物的存在或不存在的装置,该方式允许测试微生物、培养基和用于指示活的微生物的存在或不存在的装置合并在一起,而不将任何前述组件暴露于非灭菌环境。独立成套的生物灭菌指示器的示例由Falkowski等人(美国专利5,801,010)和Smith(美国专利5,552,320)公开。当微生物处于活性状态时,微生物源可产生与所述微生物相关联的可检测(活性)酶。相反地,当微生物已暴露于足以使微生物不能存活的灭菌处理时,酶可以是无活性的。
通常,本文中,用于测试灭菌工序的有效性的独立成套的生物灭菌指示器包括:具有至少一个路径(例如开口)的容器(例如管、套筒或安瓿)以允许灭菌剂在灭菌工序期间进入容器;包含在容器内的任选载体;测试微生物(例如由任选载体支撑),测试微生物是通常用于监测灭菌工序的有效性的微生物;以及用于形成对灭菌工序的失效的可检测指示的装置。可使用本公开的测试微生物和对应的耐灭菌剂调节物的独立成套的生物灭菌指示器的示例包括国际公布WO 2012/061227(Chandrapati等人)或WO 2012/061226(Smith等人)中描述的那些。
本公开的生物灭菌指示器可用于测量经受灭菌工序之后的仅孢子生长、仅酶活性、或者酶活性和孢子生长这两者。优选的生物灭菌指示器测量活性酶的活性,活性酶的活性与测试微生物的存活相关。
选择由载体支撑的测试微生物以使其因致死测试微生物的灭菌工序而灭活(例如,杀灭),但其中测试微生物不因亚致死测试微生物的灭菌工序而灭活。因此,测试微生物由于有效的灭菌工序而灭活。相反地,未被灭菌工序灭活的测试微生物由于无效灭菌工序而提供可检测的指示。可检测的指示可涉及由测试微生物产生的酶,该酶具有与至少一种测试微生物的存活相关的酶活性。活性酶因致死测试微生物的灭菌工序而灭活。相反地,酶因亚致死测试微生物的灭菌工序而未灭活。
可用于孢子生长指示器中的测试微生物包括孢子或繁殖体状态的细菌或真菌。对于包括快速的基于酶的读出的生物灭菌指示器,测试微生物包括微生物固有的或通过遗传工程添加到微生物的活性酶来源。在本公开的生物灭菌指示器中,选择测试微生物以使其因致死测试微生物的灭菌工序而灭活,但其中测试微生物可不会因亚致死测试微生物的灭菌工序而灭活。
如果存在,用于测试微生物的载体可由疏水性或亲水性的材料制成。这些材料可为无机物、有机物、或它们的组合。包含疏水性材料(或由其制备)的载体可用于任何指示器,而包含亲水性材料(或由其制备)的载体优选地用于监测使用过氧化氢蒸气相的灭菌工序。合适的疏水性材料的示例包括聚丙烯、聚乙烯、PET、聚氨酯、尼龙、含有这些聚合物中的一种或多种(例如,与其它疏水性聚合物一起)的聚合物共混物,或它们的组合。合适的亲水性材料的示例包括玻璃。用作载体的其它合适的材料包括基本上不与灭菌剂反应的玻璃纤维和金属(例如不锈钢片)。
本公开的生物灭菌指示器(包括独立成套的生物灭菌指示器)可合适地用于监测使用过氧化氢蒸气相(可能包括或可能不包括过氧化氢等离子体)的灭菌工序的有效性。例如,本公开的生物灭菌指示器可用于监测本领域中已知的任何过氧化氢等离子体灭菌工序的有效性,包括例如美国专利4,643,876(Jacobs等人)和美国专利4,756,882(Jacobs等人)中描述的工序。优选地,生物灭菌指示器可用于监测过氧化氢蒸气相灭菌工序的有效性。
虽然含水过氧化氢(H2O2)作为灭菌剂具有长期的使用史,但近来已形成了蒸气相过氧化氢(VPHP)灭菌的概念。此过程为杀灭宽泛范围的微生物的低温灭菌工序,该微生物包括常用作挑战性(challenge)有机物以评价和验证医院中的灭菌周期的有效性的产细菌内生袍子的细菌。过氧化氢的主要优点是对过氧化氢需要相对短(几分钟)的暴露以便对对象灭菌。此外,在过氧化氢灭菌工艺结束时,仅空气和水保留在室中。显然,本文所述的生物灭菌指示器的新型特征促进了快速读出式过氧化氢生物灭菌指示器的开发。
在根据本公开的生物灭菌指示器或独立成套的生物灭菌指示器的任何实施方案中,一种或多种耐灭菌剂调节物接近测试微生物设置(例如在载体上)。
耐灭菌剂调节物的合适示例包括氨基酸,诸如L-高半胱氨酸、L-精氨酸、L-组氨酸以及任何两种或更多种上述氨基酸的混合物。
一种或多种此类耐灭菌剂调节物可与测试微生物或生物灭菌指示器的组件一起设置,由此使得在工艺的灭菌阶段期间测试微生物和耐灭菌剂调节物两者暴露于灭菌剂。
在某些实施方案中,本公开提供了用于测试灭菌工序的有效性的独立成套的生物灭菌指示器,该指示器包括:具有液体不可透过的壁和内部体积的外部容器;被包含在外部容器内的:封闭预定体积的含水介质的密封的、可打开的、液体不可透过的内部容器,以及基本上干的涂层,该涂层包含i)能够用于检测对氧化性灭菌剂的暴露的多种活的测试微生物和ii)有效量的耐灭菌剂调节物,该有效量使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性增加,以及允许内部体积和外部容器外的大气环境之间蒸气连通的路径;其中调节物包含氨基酸。
在任何实施方案中,根据本公开的独立成套的生物灭菌指示器包括用于形成对灭菌工序的失效的可检测指示的装置。用于形成可检测指示的示例性装置描述于本文中。在任何实施方案中,测试微生物可分布在载体上和/或内(优选均匀地)。
在本公开的灭菌指示器(包括独立成套的生物灭菌指示器)中,载体可包含片状形式的材料,而不管其是多孔的还是无孔的。在任何实施方案中,测试微生物可分布在三维多孔载体内。在上下文中,“分布在三维多孔载体内”是指测试微生物可均匀地或不均匀地贯穿分布在三维多孔载体的体积的至少一部分中(与仅在其表面上相反)。在任何实施方案中,测试微生物贯穿三维多孔载体的整个体积的分布(更优选均匀分布)。这可通过共混(例如,在实验室共混机中)片状材料(例如)以形成三维多孔构型并且在共混之前、期间或之后混合测试微生物而实现。
通常,当与设置在常规二维和/或无孔载体上的一定量的测试微生物相比时,相同量的测试微生物分布在本公开的三维多孔载体内。这可实现测试微生物(例如,孢子)的较均匀分布,从而相比于位于常规载体上的较致密堆积和聚簇的测试微生物,允许灭菌剂较彻底地渗透到三维多孔载体内并且与测试微生物具有较均匀的接触。
多孔载体可以多种方式制备并浸染有测试微生物,其中一些描述于国际公布WO 2012/088064中,该国际公布全文以引用方式并入本文。在一个示例性方法中,通过在实验室共混机中共混以获得体积更大的结构(例如,三维结构,类似于棉球的结构)而将非织造片状材料转化成三维结构。另选地,可使用制备非织造材料所用的标准技术对其进行短切、熔喷或制备。然后将此三维多孔载体从共混机中移除,并将所需的测试微生物(例如孢子)施加至多孔载体上。
本公开的独立成套的生物灭菌指示器包括用于形成对灭菌工序失效的可检测指示的装置。例如,本公开的独立成套的生物灭菌指示器可包括用于形成提供灭菌工序失效的可检测指示的酶改性产物(例如,由酶底物和与测试微生物相关联的活性酶的反应形成)的装置。这通常称为酶活性测试。灭菌工序失效的这种可检测指示优选地包括可检测的荧光、冷光和/或显色指示。这些指示优选地用于在快速读出式生物灭菌指示器中的快速酶响应。在此上下文中,“快速读出式”是指在小于24小时并且优选在8小时或更短的时间内形成可检测的信号。
在任何实施方案中,本公开的独立成套的生物灭菌指示器可包括用于形成可检测指示的装置,其中可检测指示与微生物代谢的副产物相关联。在这些实施方案(例如,双作用读出式生物灭菌指示器和仅基于孢子生长的生物灭菌指示器)中,灭菌工序失效的可检测指示可包括例如可检测的pH指示。所使用的pH指示通常在孢子生长24小时之后并且常在7天之后出现。在双作用读出式生物灭菌指示器中,这提供了用于验证快速读出的可靠性的机制。一般来讲,pH指示剂为适于辨识酸形成的物质,例如像溴甲酚紫。这为得自荧光、冷光和/或显色指示(用于快速酶应答)的读出特性的稳定性和/或可靠性提供证据。这称为孢子生长测试。
在评估孢子生长(例如,在孢子生长指示器中)的此类实施方案中,在灭菌工序之后,使孢子与生长培养基(例如,任选地具有pH指示剂的大豆酪蛋白消化物)接触。例如,通过压缩外部容器来压碎包含生长培养基的密封的、可打开的、液体不可透过的内部容器,由此释放出生长培养基并使其与外部容器中的测试微生物(任选地,由载体支撑)进行接触。然后将独立成套的生物灭菌指示器在刺激测试微生物生长的条件下温育。如果灭菌工序是无效的,则存活的测试微生物将生长并且它们的代谢活性可使得在生长培养基中的pH指示剂改变颜色(例如,因为由生长的测试微生物形成的酸性副产物而改变颜色)。这表明灭菌周期不能杀灭微生物测试群并且可已不能杀灭存在于灭菌器载液中的污染微生物。尽管依赖于测试微生物(例如孢子)生长的独立成套的生物灭菌指示器为准确的,但它们为缓慢的,通常需要1到7天才能提供最终结果。
在制备以上讨论的独立成套的生物灭菌指示器的方法的任何实施方案中,将用于形成对灭菌工序失效的可检测指示的一个或多个部件放置在外部容器中的步骤可包括放置包含有助于活测试微生物(例如孢子)生长的生长培养基和pH指示剂的内部容器。
在上述制备独立成套的生物灭菌指示器的方法的某些实施方案中,将用于形成对灭菌工序失效的可检测指示的一个或多个部件放置在外部容器中的步骤包括放置包含酶底物的内部容器,该酶底物和与测试微生物相关联的活性酶反应以形成可检测的酶-底物产物。
在任何实施方案中,本公开的独立成套的生物灭菌指示器包括:具有至少一个液体不可透过的壁和内部体积的外部容器;封闭预定体积的含水介质的密封的、可打开的、液体不可透过的内部容器;基本上干的涂层,其中干涂层包含i)能够用于检测对氧化性灭菌剂的暴露的多种活的测试微生物和ii)有效量的耐灭菌剂调节物;以及允许内部体积和外部容器外的大气环境之间蒸气连通的路径;其中内部容器和干涂层设置在内部体积中;其中调节物包含氨基酸;其中有效量使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性增加。
在任何实施方案中,可打开的内部容器(例如管、套筒或安瓿)在灭菌工序中使用的条件下,是不可透过灭菌剂(例如蒸气相过氧化氢和/或等离子体相过氧化氢)的。在任何实施方案中,其中,在经受灭菌处理之后针对存活的测试微生物的生长评估测试微生物的存活,内部容器包括有助于活的测试微生物生长的生长培养基。内部容器适于(例如使用易碎材料制造)使得它可打开以允许生长培养基和测试微生物之间的接触。
在任何实施方案中,其中,在经受灭菌处理之后,通过针对活性酶(例如由活的测试微生物合成的酶)的存在分析测试微生物来确定测试微生物的存活。例如,在这些实施方案中,内部容器包括与活性酶反应的底物。在这些实施方案中,独立成套的生物灭菌指示器的内部容器适于(例如使用易碎材料制造)使得它可破碎以允许酶底物与活性酶反应以形成酶改性产物,该酶改性产物提供对灭菌工序的失效的可检测指示。
在本公开的独立成套的生物灭菌指示器的任何实施方案中,优选的是外部容器是可压缩的并且内部容器适于使得它可通过压缩外部容器来破碎。另选地,外部容器可为或可不为可压缩的并且内部容器适于使得它可通过如下方式来破碎:下压盖以将内部容器压缩到具有尖头的元件(例如,套筒)上,以使得内部容器在压入尖头内时破碎。
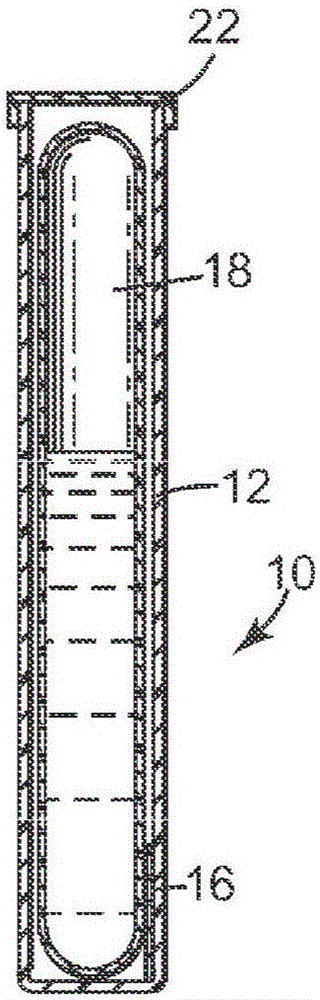
本公开的示例性独立成套的生物灭菌指示器的一个实施方案在图1和图2中示出。独立成套的生物灭菌指示器10包括嵌套式容器,这些嵌套式容器使系统的各个部件在灭菌周期完成之前彼此保持分离。独立成套的灭菌指示器10包括外部容器12(此处以具有开口端14的管的形式示出,但可使用如本领域的技术人员所理解的其它类型的容器)、密封的内部容器18(此处以密封的管或安瓿的形式示出,但可使用如本领域的技术人员所理解的其它类型的密封容器)以及通气盖26。外部容器12限定内部体积,并且优选地由塑料材料(例如,聚乙烯、聚丙烯)制成。内部容器18由玻璃或一些其它液体不可透过的易碎材料制成。任选的闭合构件22优选地为细菌不可透过、透蒸气屏蔽件,该屏蔽件安装在外部容器12的开口端14上方。
任选的载体16包括(即,支撑)基本上无水的干涂层(未示出),该干涂层包括多种测试微生物和根据本公开的一种或多种耐灭菌剂调节物。载体16设置在外部容器12的内部体积中(例如在内部容器18和外部容器12之间的空间中)。在图1和图2中,载体16是材料条带(例如由聚合物膜制成的平坦的载体条带)。在用于形成对灭菌工序的失效的可检测指示的装置包括酶底物的任何实施方案中,内部容器18可含有酶底物,该酶底物在灭菌工序无效的情况下和与测试微生物相关联的活性酶反应以产生可检测信号。在用于形成对灭菌工序的失效的可检测指示的装置包括用于检测微生物生长的指示剂的任何实施方案中,内部容器18还包括由载体16支撑的存活的测试微生物的生长培养基,其中如果灭菌工序无效,则孢子生长物产生可检测的信号(例如浊度、pH变化)。
图3和图4示出了另选实施方案,其中独立成套的生物灭菌指示器30包括位于外部容器12的内部体积中的靠近容器封闭端的载体36,并且屏蔽件38位于载体36和内部容器18之间。
在图3和图4中,载体36是材料条带(例如聚合物膜)。如图1和图2的实施方案中所述,在用于形成对灭菌工序的失效的可检测指示的装置包括酶底物的任何实施方案中,内部容器18可含有酶底物,该酶底物在灭菌工序无效的情况下和与测试微生物相关联的活性酶反应以产生可检测信号。此外,在用于形成对灭菌工序的失效的可检测指示的装置包括用于检测微生物生长的指示剂的任何实施方案中,内部容器18还包括由载体16支撑的存活的测试微生物的生长培养基,其中如果灭菌工序无效,则孢子生长物产生可检测的信号(例如浊度、pH变化)。
另选地,在任何实施方案中,可有利地在不存在屏蔽件的情况下使用本文所述的载体。例如,包含疏水性材料的载体(例如疏水性聚合物膜或非织造幅材)可起到载体和屏蔽件这两种作用。
屏蔽件38用于将载体36与内部容器18隔离。屏蔽件38优选由疏水性材料制成,使得活性酶(由测试微生物产生)和对应的酶底物之间的反应产物例如集中在多孔载体附近,并且不迅速地扩散遍及外部容器12的整个内部体积。活性酶产物在独立成套的生物灭菌指示器的下部中保持较高浓度使得该产物(无论其为发冷光的还是着色的)能够例如在比假如使得产物扩散遍及外部容器12的整个内部体积的情况更短的温育期之后被检测到。组装了屏蔽件38的优选的设备在约10分钟内提供关于灭菌功效的可靠信息。
在图3和图4中示出的具有屏蔽件38的独立成套的生物灭菌指示器构型通常用于过氧化氢蒸气灭菌工序中。屏蔽件38优选地为重量为200克/平方米的聚丙烯吹塑微纤维材料的圆盘,它作为“THINSULATE 200-B brand Thermal Insulation”从美国明尼苏达州圣保罗的3M公司商购获得。此外,然而,如果载体为如本文所述的疏水性材料,则不需要该屏蔽件,即便在过氧化氢灭菌工序中也是如此。另外,当使用独立成套的生物灭菌指示器来监测过氧化氢工序时(无论是使用图1和图2中所示的实施方案还是使用图3和图4中所示的实施方案),封闭构件22优选地由高密度纤维材料(例如可从美国特拉华州威尔明顿的杜邦公司(E.I.duPont de NeMours and Co.,Wilmington,DE)商购获得的TYVEK高密度聚乙烯纤维材料)制成。
重新参见图1和图2的独立成套的生物灭菌指示器,在典型的灭菌工序中,灭菌剂通过盖26(126)上的通气孔28进入外部容器12并且与由载体16支撑的测试微生物(未示出)接触,但是不与密封的内部容器18中的内容物(例如,酶底物溶液和/或生长培养基)接触。因此,通气孔28形成允许内部体积和外部容器12外的大气环境之间的蒸气连通的路径。
在本公开的任何实施方案的独立成套的生物灭菌指示器经受灭菌处理之后,可压缩外部容器12的侧面,使内部容器18破碎并使内部容器18的内容物与由载体16支撑的测试微生物彼此接触。然后将独立成套的生物灭菌指示器温育足够的时间段以允许任何存活的测试微生物形成可检测指示。例如,如果测试微生物产生活性酶,则使温育发生足够长的时间,以允许活性酶与酶底物反应形成产物,该产物生成可检测信号,诸如冷光、荧光或颜色改变,从而表明灭菌工序可能已失效。
在本公开的生物灭菌指示器10的优选实施方案中,由载体16支撑的测试微生物为活性酶源。优选地,活性酶源为活的测试微生物,诸如细菌或真菌孢子。在最优选的实施方案中,孢子为活性酶源,并且生物灭菌指示器10为双作用快速读出式指示器,该双作用快速读出式指示器通过测量酶活性和测试微生物生长这两者而监测灭菌工序的有效性。在此实施方案中,内部容器18包含营养培养基以有助于测试微生物和酶底物的生长。在独立成套的生物灭菌指示器经受灭菌处理之后,内部容器18破碎;从而使载体16(及其上的测试微生物)与其内容物接触;并且将独立成套的生物灭菌指示器温育一段时间。酶反应的产物(如果在温育后存在)在几小时内产生可观察到的(例如可见的)结果,并且测试微生物的生长通常在7天内是可观察到的。
酶指示器操作的基本理论为酶的灭活将与生物灭菌指示器中的测试微生物的死亡相关联。选择用于生物灭菌指示器中的酶对于灭菌工序必须具有至少与可能存在为污染物的微生物相同的耐性,并且优选具有比这些微生物高的耐性。在灭菌周期不能杀灭污染微生物之后,则酶也不因杀灭污染微生物的灭菌周期而灭活,酶应当保持足够的活性以与对应的酶底物反应形成可检测的产物。
适用于本公开的生物灭菌指示器中的酶在美国专利5,252,484(Matner等人)和美国专利5,073,488(Matner等人)中有所描述。合适的酶包括衍生自产孢子微生物的酶,这些产孢子微生物诸如嗜热脂肪土芽孢杆菌和萎缩芽孢杆菌(Bacillus atrophaeus)(以前称为枯草芽孢杆菌(Bacillus subtilis))。可用于本发明的生物灭菌指示器的得自产孢子微生物的酶类包括衍生自产孢子微生物的β-D-葡萄糖苷酶、α-D-葡萄糖苷酶、碱性磷酸酶、酸性磷酸酶、丁酸酯酶、辛酸酯酶脂肪酶、肉豆蔻酸脂肪酶、亮氨酸氨基肽酶、缬氨酸氨基肽酶、胰凝乳蛋白酶、磷酸水解酶、α-D-半乳糖苷酶、β-D-半乳糖苷酶、酪氨酸氨基肽酶、苯丙氨酸氨基肽酶、β-D-葡萄糖醛酸酶、α-L-阿拉伯呋喃糖苷酶、N-乙酰-B-氨基葡萄糖苷酶、β-D-纤维二糖糖苷酶、丙氨酸氨基肽酶、脯氨酸氨基肽酶以及脂肪酸酯酶。
当将测试微生物用作活性酶源时,本公开的方法可包括在灭菌周期完成之后利用水性营养培养基来温育保持活性的微生物中的任何一种的步骤。添加此步骤以通过常规技术来确认灭菌条件是否已足以杀灭指示器中的全部微生物,由此指示出灭菌条件是否已足以对灭菌器中的所有物品灭菌。如果以常规方式使用微生物的生长来确认酶测试的结果,则该微生物应为常规用于监测灭菌条件的微生物。这些常规使用的微生物对所采用的灭菌工序的耐性通常比在天然污染物中遇到的大多数有机体高数倍。
可用作测试微生物的优选微生物是处于孢子或营养体状态的细菌或真菌。细菌孢子被公认为是具有最高耐性的微生物生命形式。它是在用于确定设备、化学品和工艺的灭菌功效的所有测试中所选择的生命形态。尤其优选的测试微生物包括芽孢杆菌属(Bacillus)、梭状芽孢杆菌属(Clostridium)、脉孢菌属(Neurospora)以及假丝酵母(Candida)属微生物。源自芽孢杆菌属和梭状芽孢杆菌属的孢子最常用于监测采用饱和蒸汽、干热、γ射线照射以及环氧乙烷的灭菌工序。
常用于监测灭菌条件的尤其优选的微生物包括嗜热脂肪土芽孢杆菌和萎缩芽孢杆菌。嗜热脂肪土芽孢杆菌尤其可用于监测蒸汽灭菌条件下的灭菌和使用氧化性灭菌剂的灭菌。α-D-葡萄糖苷酶已在嗜热脂肪土芽孢杆菌的孢子中鉴定,这些脂肪嗜热芽孢杆菌是诸如可以“ATCC7953”从马里兰州洛克维尔的美国典型培养物保藏中心(American Type Culture Collection,Rockville,MD)商购获得的那些。萎缩芽孢杆菌尤其可用于监测气体灭菌和干热灭菌的条件。已在萎缩芽孢杆菌(例如,可以“ATCC 9372”从美国典型培养物保藏中心商购获得)中发现β-D-葡萄糖苷酶。
在使用双作用快速读出式指示器的情况下,这些微生物既可充当快速酶测试中的活性酶源,又可充当微生物生长测试的测试微生物。嗜热脂肪土芽孢杆菌尤其优选用于监测蒸汽和过氧化氢等离子体灭菌工序。萎缩芽孢杆菌尤其优选用于监测环氧乙烷灭菌工序并且可用于监测过氧化氢等离子体灭菌工序。
尽管本公开主要以单一测试微生物菌种进行描述,但本公开应当理解为也涉及使用多种测试微生物菌种。例如,单个无菌指示器可包含两种或更多种菌种的测试微生物;一种抗氧化性灭菌剂蒸气的菌种,以及选自由耐热菌种、耐气态灭菌培养基菌种和耐辐射菌种组成的组中的至少一种菌种。
适用于本公开的生物灭菌指示器的酶底物在美国专利5,252,484(Matner等人)和美国专利5,073,488(Matner等人)中有所描述。能与酶反应形成可检测的产物且适用于本公开的生物灭菌指示器的发色底物和荧光底物为本领域熟知的。这些底物根据它们产生视觉上可检测的信号的方式可分为两类。第一类底物与酶反应形成本身发色或发荧光的酶改性产物。第二类底物所形成的酶改性产物必须再与另一种化合物反应才能生成颜色或荧光信号。
本公开也提供了使用独立成套的生物灭菌指示器的方法。一般来讲,本公开提供了用于测试灭菌工序的有效性的方法,该方法包括:提供根据本公开的独立成套的生物灭菌指示器的任何实施方案;使包含测试微生物的独立成套的生物灭菌指示器经受灭菌工序;在灭菌后,使独立成套的生物灭菌指示器经受开发的工序以确定可检测指示是存在还是不存在;以及将可检测指示的存在与灭菌工序的失效相关联并且将可检测指示的不存在与灭菌工序的成功相关联。
使用示例性独立成套的孢子生长生物灭菌指示器,用于测试灭菌工序的有效性的方法包括:提供生物灭菌指示器,该生物灭菌指示器包括:具有至少一个液体不可透过的壁和内部体积的外部容器;封闭预定体积的含水介质的密封的、可打开的、液体不可透过的内部容器;干涂层,该干涂层包含i)能够用于检测暴露于氧化性灭菌剂的多种活的测试微生物和ii)有效量的耐灭菌剂调节物;以及允许内部体积和外部容器外的大气环境之间蒸气连通的路径;其中内部容器和干涂层设置在内部体积中;其中调节物包含氨基酸;其中有效量使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性增加。该方法还包括使生物灭菌指示器经受灭菌工序;在使生物灭菌指示器经受灭菌工序后,使测试微生物与用于形成对灭菌工序的失效的可检测指示的装置接触;在有助于测试微生物的生长的条件下,将测试微生物与用于形成可检测指示的装置的混合物温育;观察可检测指示的存在或不存在;以及将可检测指示的存在与灭菌工序的失效相关联或者将可检测指示的不存在与灭菌工序的成功相关联。
在尤其优选的实施方案中,生物灭菌指示器为双作用快速读出式指示器,并且测试微生物既充当用于酶活性测试的活性酶源,又充当用于微生物生长测试的测试微生物。合适的微生物包括嗜热脂肪土芽孢杆菌和萎缩芽孢杆菌。在最优选的实施方案中,将嗜热脂肪土芽孢杆菌孢子用于生物灭菌指示器中。
参见图1和图2,在其中测试微生物包括孢子的示例性应用中,将独立成套的生物灭菌指示器10放置在灭菌室中并且使其经受过氧化氢蒸气灭菌工序。灭菌剂通过通气孔28和封闭构件22进入独立成套的生物灭菌指示器10,并且接触由载体16支撑的测试微生物。在工序完成之后,从灭菌室中移出独立成套的生物灭菌指示器10并且压缩外部容器12的侧面,由此使易碎的内部容器18破碎并且释放出包含pH指示剂的营养培养基以使该培养基可接触由载体16支撑的测试微生物。然后将独立成套的生物灭菌指示器10温育足够长的时间段(例如在合适的温度下(例如55℃-60℃),以允许保留在指示器中的任何存活测试微生物生长并且引起pH指示剂的颜色变化,该颜色变化提供灭菌工序失效的可检测指示。如果灭菌工序有效并且所有的孢子均已灭活,则在温育期后观察到没有颜色变化。
参见图1和图2,在测试微生物产生活性酶的示例性应用中,将独立成套的生物灭菌指示器10放置在灭菌室中并且使其经受过氧化氢蒸气灭菌工序。灭菌剂通过通气孔28和封闭构件22进入指示器10,并且接触由载体16支撑的测试微生物源。在工序完成之后,从灭菌室中移出独立成套的生物灭菌指示器10并且压缩外部容器12的侧面,由此使易碎的内部容器18破碎并且释放出酶底物,以使该酶底物可接触由测试微生物产生的活性酶。然后将独立成套的生物灭菌指示器10温育足够长的一段时间,以便测试微生物产生的任何活性酶与底物反应并形成可检测产物,该可检测产物提供了对灭菌工序失效的可检测指示。例如,可检测产物可通过其特征性荧光、冷光光或其吸收光谱(例如颜色)来检测。如果灭菌工序有效并且所有的测试微生物均已灭活,则在温育期后不生成可观察到的可检测信号。
本公开的另一个示例性的独立成套的生物灭菌指示器示于图3-图4中。独立成套的生物灭菌指示器200包括壳体202,该壳体包括第一部分204(例如,中空管)和第二部分206(例如,盖),该第一部分和该第二部分联接在一起,从而得到独立成套的生物灭菌指示器。盖可以由聚丙烯模制而成,其大致尺寸为大约21mm长×14mm直径。第一部分204(中空管)可由聚碳酸酯片模制而成,其顶部的大致尺寸为约52mm长×12mm直径,形状在图3-图4中示出。第一部分204(例如,中空管)的总体积为例如大约3mL。
壳体202可由至少一个液体不可透过的壁限定,诸如第一部分204的壁208和/或第二部分206的壁210。应当理解,在不脱离本发明的实质和范围的前提下,也可采用一件式一体壳体202,或者第一部分204和第二部分206可具有其它形状、尺寸或相关结构。壳体202(例如,壁208和壁210)的合适材料可以包括(但不限于)玻璃、金属(例如,箔)、聚合物(如,聚碳酸酯(PC)、聚丙烯(PP)、聚苯醚(PPE)、聚乙烯(polythyene)、聚苯乙烯(PS)、聚酯(例如,聚对苯二甲酸乙二醇酯(PET))、聚甲基丙烯酸甲酯(PMMA或丙烯酸类树脂)、丙烯腈-丁二烯-苯乙烯(ABS)、环状烯烃聚合物(COP)、环状烯烃共聚物(COC)、聚砜(PSU)、聚醚砜(PES)、聚醚酰亚胺(PEI)、聚对苯二甲酸丁二酯(PBT))、陶、瓷或者它们的组合。
在任何实施方案中,壳体202的第二部分(盖)206可包括一个或多个孔口或开口207,该一个或多个孔口或开口207提供壳体202的内部(例如,贮存室203)和环境之间的流体连通。在任何实施方案中,壳体202的第二部分206可包括多个(例如六个)开口207。用作微生物屏蔽件的滤纸材料(未示出)被定位在灭菌剂路径中,该灭菌剂路径在开口207上方并且被压敏粘合剂背衬的纸标签保持在适当位置。滤纸材料与目前可用的用于蒸汽灭菌器的3M ATTEST 1291快速读出式生物指示器(得自美国明尼苏达州圣保罗的3M公司)的盖中存在的材料相同。
独立成套的生物灭菌指示器200还包括包含液体营养培养基222的易碎容器220。易碎容器220由硼硅酸盐玻璃制成并包含例如有助于孢子的生长的培养基。该培养基由改良的胰酶大豆肉汤(TSB)组成,该胰酶大豆肉汤包含pH指示剂、溴甲酚紫和荧光酶底物4-甲基伞形酮酰-α-D-葡糖苷。安瓿为例如大约40mm长×约4mm直径,并容纳例如大约500μL的液体营养培养基。合适的液体营养培养基222的示例为目前用于蒸汽灭菌器的以3M ATTEST1292快速读出式生物指示器得自3M公司的产品中所使用的培养基。
液体培养基容器220可通过插件230保持在独立成套的生物灭菌指示器200内的合适位置。插件(也称为破碎器)230的功能为将容器220保持在合适位置并且还有助于容器220的受控破碎。在独立成套的生物灭菌指示器的激活步骤过程中,当第二部分(盖)206被向下(即,朝向壳体的第一部分204)推动以破碎容器220时,发生受控破碎。插件230可为模制的聚碳酸酯结构,例如大致尺寸为22mm长×9mm宽。
第二部分206具有密封件,该密封件被定位成在第一部分204的开口上端处接触第一部分204的第一末端201,以便在激活之后封闭或密封(例如,气密地密封)独立成套的生物灭菌指示器200。
独立成套的生物灭菌指示器200还包括干涂层292,该干涂层292包含合适的耐灭菌剂孢子诸如嗜热脂肪土芽孢杆菌孢子(ATCC 7953)和根据本公开的有效量的耐灭菌剂调节物,干涂层292被定位成与第一部分204流体连通。图3-图4的所示实施方案的干涂层392沉积在载体116上。
壳体202包括下部214(其至少部分地限定第一室209)和上部216(其至少部分地限定第二室211),它们被部分内壁或突架218部分地分开,在其中形成提供第一室209与第二室211之间的流体连通的开口217。第二室211适于容纳载体116。第一室209适于容纳易碎容器220,特别是在激活之前。壁218相对于壳体202的纵向DL以非零角度和非直角成角度或倾斜。
也可称为“测试微生物生长室”或“检测室”的第二室211包括有待检查测试微生物活性以确定灭菌处理功效的空间。
液体培养基容器220通过插件230定位并保持在第一室209中的合适位置。包含测试微生物和耐灭菌剂调节物的干涂层292被定位在载体116上并容纳在第二室211中,并且在灭菌期间与环境流体连通。在灭菌期间,灭菌剂(例如,经由第一室209)移动到第二室211中。在经受灭菌处理之后,独立成套的生物灭菌指示器被有意激活,并且当容器220破碎并且将液体培养基222释放到壳体202的内部内时,液体培养基222移动到第二室211内(例如,从第一室209)。
第一室209具有例如约2800微升的体积(清空所有内部部件)。第一室209在壁218正上方的横截面积例如为大约50mm2。第二室211具有例如约210微升的体积。第二室211在壁218正下方的横截面积例如为大约20mm2。
壳体202是锥形的(参见,例如,锥形部分246),使得在壳体202中的横截面积通常从第一部分204的第一末端201至壳体202的封闭端205沿纵向DL减小。
在另一个方面,本公开提供了生物灭菌指示器。图4和图5示出了根据本公开的生物灭菌指示器300的一个实施方案的两个视图。生物灭菌指示器300包括载体390,该载体390具有设置于其上的干涂层392。
载体390可由疏水性或亲水性的材料制成。这些材料可为无机物、有机物、或它们的组合。包含疏水性材料(或由其制备)的载体可用于任何指示器,而包含亲水性材料(或由其制备)的载体优选地用于监测使用过氧化氢蒸气相的灭菌工序。合适的疏水性材料的示例包括聚丙烯、聚乙烯、PET、聚氨酯、尼龙、含有这些聚合物中的一种或多种(例如,与其它疏水性聚合物一起)的聚合物共混物,或它们的组合。合适的亲水性材料的示例包括玻璃。用作载体的其它合适的材料包括基本上不与灭菌剂反应的玻璃纤维和金属(例如不锈钢片)。
载体390可以多种形状和大小被提供。由相对薄的柔性片状材料(例如聚合物膜)制成的载体是特别合适的,但是也可使用金属、玻璃或陶瓷片。在任何实施方案中,载体390可以基本上透射可见光波长和/或紫外线波长的电磁辐射(例如,载体可以是透明或半透明的)。另选地或除此之外,载体的部分(或全部)可基本上不透射可见光波长和/或紫外波长的电磁辐射(例如不透明)。在任何实施方案中,载体可以基本上反射可见光波长和/或紫外线波长的电磁辐射。
返回到图5和图6,涂层392设置在载体390上。涂层392是干的(即基本上无水的,如本文所定义)。在任何实施方案中,涂层392包含多种测试微生物。测试微生物是通常用于监测灭菌工序的有效性的微生物。在任何实施方案中,测试微生物可产生(例如在孢子形成和/或生长期间)活性酶,该活性酶的活性与测试微生物暴露于灭菌处理中的灭菌剂后的存活相关。
选择由载体390支撑的测试微生物以使其因致死测试微生物的灭菌工序而灭活(例如杀灭)。相比之下,其中测试微生物因亚致死测试微生物的灭菌工序而未灭活,测试微生物提供了作为无效灭菌工序的结果的可检测指示(例如生长)。优选地,对于基于酶的检测,测试微生物产生活性酶,该酶具有与至少一种测试微生物的存活相关的酶活性。因此,活性酶因致死测试微生物的灭菌工序而灭活,但活性酶不因亚致死测试微生物的灭菌工序而灭活。
用于本公开的生物灭菌指示器的合适的测试微生物包括例如来自芽孢杆菌属、土芽孢杆菌属、梭状芽孢杆菌属、脉孢菌属以及假丝酵母属的微生物菌种。已知来自前述菌种的生物体产生活性酶,该活性酶可用于在暴露于灭菌处理中的灭菌剂后检测测试微生物的存活。
在任何实施方案中,干涂层392包含预定量的活的测试微生物。该量通常使用本领域熟知的平板计数法定量为菌落形成单位数(CFU)。在任何实施方案中,干涂层包含约102个活的测试微生物至约109个活的测试微生物。在任何实施方案中,干涂层包含约103个活的测试微生物至约108个活的测试微生物。在任何实施方案中,干涂层包含约104个活的测试微生物至约107个活的测试微生物。在任何实施方案中,干涂层包含约105个活的测试微生物至约107个活的测试微生物。
干涂层392还包含有效量的耐灭菌剂调节物。干涂层392中的耐灭菌剂调节物的有效量使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂(例如蒸气相过氧化氢)的敏感性增加。耐灭菌剂调节物包含氨基酸。在任何实施方案中,氨基酸选自由L-高半胱氨酸、L-精氨酸、L-组氨酸或上述氨基酸中任何两种或更多种的组合组成的组。
在任何实施方案中,干涂层392包含预定量的耐灭菌剂调节物。预定量是有效增加生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性的量。生物指示器对氧化性灭菌剂的敏感性以及调节物对生物指示器对灭菌剂的敏感性的影响可以容易地如实施例中所述测定。如实施例所证实的那样,对灭菌剂的敏感性可通过测试微生物在暴露于灭菌剂后的生长和/或通过在微生物暴露于灭菌剂之后检测与测试微生物相关联的酶活性来测量。
当干涂层392包含约106个测试微生物时,耐灭菌剂调节物的有效量为约2微克至约20微克(例如约11.5纳摩尔至约150纳摩尔)。耐灭菌剂调节物的有效量也可根据耐灭菌剂调节物质量/个活测试微生物来表示。在任何实施方案中,耐灭菌剂调节物的有效量为约0.1飞摩尔(femtomole)/个活的测试微生物至约1.5飞摩尔/个活的测试微生物。
本公开也提供了使用生物灭菌指示器的方法。一般来讲,本公开提供了用于测试灭菌工序的有效性的方法,该方法包括:提供根据本公开的生物灭菌指示器的任何实施方案;使包含测试微生物的生物灭菌指示器经受灭菌工序;在灭菌后,使生物灭菌指示器经受开发的工序以确定可检测指示是存在还是不存在;以及将可检测指示的存在与灭菌工序的失效相关联并且将可检测指示的不存在与灭菌工序的成功相关联。
使用示例性孢子生长生物灭菌指示器,用于测试灭菌工序的有效性的方法包括:提供生物灭菌指示器的任何实施方案,该生物灭菌指示器包括载体,该载体具有设置于其上的干涂层,该干涂层包含i)能够用于检测对氧化性灭菌剂的暴露的多种活的测试微生物和ii)如本文所述的有效量的耐灭菌剂调节物。该方法还包括使生物灭菌指示器经受灭菌工序;在使生物灭菌指示器经受灭菌工序后,使测试微生物与用于形成对灭菌工序的失效的可检测指示的装置接触;在有助于测试微生物的生长的条件下,将测试微生物与用于形成可检测指示的装置的混合物温育;观察可检测指示的存在或不存在;以及将可检测指示的存在与灭菌工序的失效相关联或者将可检测指示的不存在与灭菌工序的成功相关联。
在任何实施方案中,将测试微生物与用于形成对灭菌工序的失效的可检测指示的装置接触可包括例如使生物灭菌指示器与营养培养基接触(即,通过将载体置于肉汤培养基管中)。如果载体上的测试微生物存活于灭菌工序,则它可在营养培养基中生长,其中生长可以通过浊度和/或通过可检测的pH变化来检测。另选地或除此之外,载体可置于包含酶底物的培养基中,该酶底物在与由存活的测试微生物产生的酶反应后可产生可检测的产物,如本文以上所述。
本公开的生物灭菌指示器中的任何一个均可用作测试包的一部分。在本公开的一个实施方案中,本公开的非挑战性测试包并不提供超过单独生物灭菌指示器耐性的另外灭菌工序耐性。非挑战性测试包相比于不使用测试包的指示器的优势在于它将生物灭菌指示器在灭菌工序期间牢固地保持在单一位置。因此,该非挑战性测试包缓解了当通常较小且易于滚动的生物灭菌指示器在灭菌工序期间在负载材料中移位或错位时出现的问题。
称为管腔挑战性测试包的另选测试包相比于生物灭菌指示器提供另外的耐性,其在放置于具有限定横截面积和长度的管腔内时将经受与指示器相同的耐性。管腔挑战性测试包提供了确定灭菌工序在杀灭可能位于管状仪器内部深处的微生物方面是否有效的准确方法。示例性的非挑战性和管腔挑战性灭菌测试包在美国专利6,897,059(Foltz等人)中有所描述。
本公开的方法、组合物、制品和试剂盒的某些实施方案在以下实施方案列表中列出。
示例性实施方案
实施方案A是一种独立成套的生物灭菌指示器,该独立成套的生物灭菌指示器包括:
外部容器,该外部容器具有液体不可透过的壁和内部体积;
密封的、可打开的、液体不可透过的内部容器,该内部容器封闭预定体积的含水介质;
干涂层,该干涂层包含i)能够用于检测对氧化性灭菌剂的暴露的多种活的测试微生物,和ii)有效量的耐灭菌剂调节物;以及
路径,该路径允许内部体积和外部容器外的大气环境之间的蒸气连通;
其中内部容器和干涂层设置在内部体积中;
其中调节物包含氨基酸;
其中有效量使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性增加。
实施方案B是根据实施方案A所述的独立成套的生物灭菌指示器,其中外部容器包括至少一个壁,其中干涂层的至少一部分在至少一个壁上设置在内部体积中。
实施方案C是根据实施方案A所述的独立成套的生物灭菌指示器,还包括载体,其中干涂层的至少一部分设置在载体上。
实施方案D是根据实施方案C所述的独立成套的生物灭菌指示器;其中载体包括玻璃、金属、非纤维素聚合物或它们的组合。
实施方案E是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中干涂层设置成与容器外的大气环境蒸气连通。
实施方案F是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,还包括用于形成对灭菌工序的失效的可检测指示的装置。
实施方案G是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中调节物选自由L-高半胱氨酸、L-精氨酸以及L-组氨酸组成的组。
实施方案H是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中干涂层包含约103个活的测试微生物至约108个活的测试微生物。
实施方案I是根据实施方案G所述的独立成套的生物灭菌指示器,其中干涂层包含约104个活的测试微生物至约107个活的测试微生物。
实施方案J是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中有效量为约2微克至约20微克。
实施方案K是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中有效量为约11.5纳摩尔至约150纳摩尔。
实施方案L是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中有效量为约0.02纳克/个活的测试微生物至约0.2纳克/个活的测试微生物。
实施方案M是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中有效量为约0.1飞摩尔/个活的测试微生物至约1.5飞摩尔/个活的测试微生物。
实施方案N是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中测试微生物是孢子。
实施方案O是根据实施方案N所述的独立成套的生物灭菌指示器,其中孢子是嗜热脂肪土芽孢杆菌孢子。
实施方案P是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中耐灭菌剂调节物调节测试生物体对包括过氧化氢、过乙酸、臭氧或二氧化氯的氧化性灭菌剂或消毒剂的耐性。
实施方案Q是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中路径构造成用于阻碍微生物通过该路径的通道。
实施方案R是根据前述实施方案中任一项所述的独立成套的生物灭菌指示器,其中路径构造成用于阻碍微生物通过该路径的通道。
实施方案S是一种生物灭菌指示器,包括:
载体;以及
设置在载体上的干涂层;
其中干涂层包含i)能够用于检测对氧化性灭菌剂的暴露的多种活的测试微生物,和ii)有效量的耐灭菌剂调节物;
其中有效量使得生物指示器相对于缺乏该有效量的其它相同的干涂层而言对氧化性灭菌剂的敏感性增加。
实施方案T是根据实施方案S所述的生物灭菌指示器,其中调节物选自由L-高半胱氨酸、L-精氨酸、L-组氨酸以及它们的混合物组成的组。
实施方案U是根据实施方案S或实施方案T所述的生物灭菌指示器,其中有效量为约2微克至约20微克。
实施方案V是根据实施方案S至U中任一项所述的生物灭菌指示器,其中有效量为约11.5纳摩尔至约150纳摩尔。
实施方案W是根据实施方案S至V中任一项所述的生物灭菌指示器,其中有效量为约0.02纳克/个活的测试微生物至约0.2纳克/个活的测试微生物。
实施方案X是根据实施方案S至W中任一项所述的独立成套的生物灭菌指示器,其中有效量为约0.1飞摩尔/个活的测试微生物至约1.5飞摩尔/个活的测试微生物。
实施方案Y是根据实施方案S至X中任一项所述的生物灭菌指示器,其中测试微生物是孢子。
实施方案Z是根据实施方案Y所述的生物灭菌指示器,其中孢子是嗜热脂肪土芽孢杆菌孢子。
实施方案AA是根据实施方案S至Z中任一项所述的生物灭菌指示器,其中耐灭菌剂调节物调节测试生物体对包括过氧化氢、过乙酸、臭氧、二氧化氯或上述氧化性灭菌剂中的任何两种或更多种的组合的氧化性灭菌剂或消毒剂的耐性。
实施方案AB是根据实施方案S至AA中任一项所述的生物灭菌指示器;其中载体包括玻璃、金属、非纤维素聚合物或其组合。
实施方案AC是一种方法,包括:
提供根据实施方案A至R中任一项所述的独立成套的生物灭菌指示器;
在灭菌处理中使独立成套的生物灭菌指示器暴露于灭菌剂,其中灭菌剂是氧化性灭菌剂;以及
检测多种测试微生物中的至少一种微生物是否存活于灭菌处理的指示。
实施方案AD是一种方法,包括:
提供根据实施方案S至AB中任一项所述的生物灭菌指示器;
在灭菌处理中使独立成套的生物灭菌指示器或生物灭菌指示器暴露于灭菌剂,其中灭菌剂是氧化性灭菌剂;以及
检测多种测试微生物中的至少一种微生物是否存活于灭菌处理的指示。
实施方案AE是根据实施方案AC或实施方案AD所述的方法,其中检测多种测试微生物中的至少一种是否存活于灭菌处理的指示包括检测测试微生物的生长。
实施方案AF是根据实施方案AC或实施方案AD所述的方法,其中检测多种测试微生物中的至少一种是否存活于灭菌处理的指示包括检测与测试微生物相关联的预定的酶活性。
通过下面的实施例进一步说明了本发明的目的和优点,但这些实施例中列举的具体材料及其量以及其它条件和细节不应被理解为是对本发明的不当限制。
实施例
材料
表1.实施例中使用的材料列表。
灭菌器系统和灭菌处理参数。
使以下实施例中描述的独立成套的生物指示器(BI)经受灭菌处理,该灭菌处理使用了具有灭菌器(购自加利福尼亚州尔湾(Irvine,CA)的高级灭菌产品公司(Advanced Sterilization Products)(ASP))的过氧化氢灭菌。暴露时间是标准的或变化的,如下面实施例中更详细描述的。每种灭菌处理的详细说明在表2中示出。
表2.灭菌处理参数。
实施例1
L-高半胱氨酸对于孢子对过氧化氢灭菌处理的耐性的调节。
使用了管形的孢子载体(聚丙烯),类似于在国际公布WO2014/189716中描述的那些,不同之处是它们未涂覆有胶态纳米粒子。将液体培养的嗜热脂肪土芽孢杆菌孢子(>106)悬浮于无菌水中。将大约10μL的孢子悬浮液沉积到孢子载体上并且在室温下干燥。将L-高半胱氨酸的0.5M无菌溶液的等分试样(分别为0μL、5μL或10μL)沉积到干燥的孢子涂覆的管形孢子载体中。将高半胱氨酸涂覆管在室温下干燥。因此,载体上最终干燥的涂层包括分别具有0、2.5或5微摩尔的L-高半胱氨酸的至少106个孢子。
类似于图1和图2中示出的那些装配独立成套的生物指示器,不同之处是将管形孢子载体放置在外部容器12的底部,然后将内部容器18放置在外部容器中,并且通气盖26具有位于盖的顶部(平坦)表面上的单个圆形开口(2.3mm直径),而不是图1中的盖26的弯曲平面上显示的矩形开口28。外部容器12获自3M ATTEST 1292快速生物指示器(购自明尼苏达州圣保罗的3M公司)。盖获自3M ATTEST 1261生物指示器(3M公司)。营养培养基来自添加有甲硫氨酸的3M ATTEST 1292安瓿(5g/L)。将培养基在密封的玻璃安瓿中灭菌,将该密封的玻璃安瓿放置在外部容器中,如图2所示。在STERRAD NX灭菌器中,将5个单独的独立成套的生物指示器暴露于不同浓度(表3中列出)的过氧化氢2分钟。在使它们经受灭菌处理之后,通过压碎外部容器内的安瓿来激活所有的独立成套的生物指示器。将独立成套的生物指示器在56℃下温育至多7天,并观察培养基中的pH指示剂以确定任何孢子是否存活于灭菌处理。结果在表3中示出。所有阳性对照显示生长的指示(数据未示出)。
在温育24小时内,所有未暴露的独立成套的BI阳性对照是生长阳性的。相比于使用0微摩尔的L-高半胱氨酸的那些,使用2.5微摩尔的L-高半胱氨酸制备的独立成套的生物指示器显示孢子的耐性降低,如通过在分别使用0.6ml和0.8ml的59%H2O2的情况下生长阳性BI数量减少所见。5.0微摩尔量的L-高半胱氨酸显著减小了孢子的耐性,如通过在使用0.4ml的59%H2O2的情况下的全部杀灭所见。
实施例2
L-精氨酸和L-组氨酸对于孢子对过氧化氢灭菌处理的耐性的调节。
独立成套的生物指示器的制备。
使PET膜(.09mm厚)涂覆有胶态二氧化硅,如国际公布WO2014/189716中所述那样,该国际公布全文以引用方式并入本文。将嗜热脂肪土芽孢杆菌的液体培养的孢子收获物在无菌蒸馏水中洗涤并在无菌水中悬浮至一定浓度,使得孢子悬浮液的1:1000稀释液(在水中)具有37%的光学透射率(625nm波长)。如实施例1所述那样制备单独的水性孢子涂料溶液,其中涂料溶液中存在表4所示的氨基酸。将各自的孢子涂料溶液的两微升等分试样(含有至少106个孢子)沉积在二氧化硅涂覆的PET膜上,从而在膜上形成一系列空间上隔开的点。将孢子涂覆的膜在60℃培养箱中干燥12分钟。冲压出PET膜的圆形盘(以下称为“涂覆的载体”),每个盘包括一个干燥点,并且将这些圆形盘用于类似于国际公开WO2014/189716的图1中示出的那样装配的独立成套的生物指示器(BI)。将上述涂覆的载体放置在国际公布WO2014/189716的图1中示出的“孢子载体135”中。每个独立成套的BI包括聚碳酸酯外部容器、破碎器、盖和盖过滤器。设置在外部容器内的是涂覆的载体连同安瓿培养基,该安瓿培养基包含来自3M ATTEST 1292快速读出式生物指示器的营养培养基加上5g/L甲硫氨酸(如实施例1所述的那样)。
过氧化氢灭菌
使具有不同浓度添加剂(表4)的独立成套的生物指示器经受STERRAD NX灭菌器中的过氧化氢灭菌。除非另外指明,否则灭菌处理通过手动注射1.0ml的59%过氧化氢/次负载来运行。改变暴露时间以测定使用不同添加剂配方的独立成套的BI的耐性曲线。通过按下盖以破碎培养基安瓿来激活BI。将激活的BI放置在台式荧光计(明尼苏达州圣保罗的3M公司)中以检测荧光。
针对存活的孢子监测独立成套的生物指示器
未完全灭活的独立成套的BI(即,并非所有孢子被灭菌处理杀灭)将在激活BI后恢复细胞功能。存活孢子对葡萄糖苷酶的产生是至少一个孢子未被灭菌处理灭活(杀灭)的指示。葡萄糖苷酶裂解4-甲基伞形基葡萄糖苷(MUG),从而释放荧光甲基伞形酮,该荧光甲基伞形酮可使用台式荧光计被检测。独立成套的生物指示器中孢子的生长和增殖也可通过pH变化来检测,pH变化可通过生长培养基中pH指示剂的颜色变化来检测。
不同添加剂对于生物指示器对过氧化氢灭菌的耐性的影响。
如此实施例中以上所述制备独立成套的生物指示器(使用表4中列出的不同添加剂)。对于测试的每种添加剂,使用较低范围和较高范围作为初步筛选以鉴定调节孢子对灭菌剂的耐性的添加剂。使代表每种条件的五个独立成套的BI经受STERRAD NX灭菌器中的过氧化氢灭菌。灭菌处理使用恒定注射体积(1.0ml的59%过氧化氢)和暴露于过氧化氢的各种时间(例如20秒至7分钟)。独立成套的BI在经受灭菌处理之后被激活,并且针对荧光(使用台式荧光计)和基于pH的颜色变化(可视地)进行监测。荧光和生长读出结果在表4中示出。
比较例1
L-脯氨酸对于孢子对过氧化氢灭菌处理的耐性缺乏调节。
制备具有L-脯氨酸的独立成套的生物指示器,在灭菌器中处理并且进行分析,如实施例2中所述。独立成套的BI在经受灭菌处理之后被激活,并且针对荧光(使用台式荧光计)和基于pH的颜色变化(可视地)进行监测。荧光和生长读出结果在表4中示出。
数据表明相对于无添加剂的对照,孢子涂料溶液中L-精氨酸和L-组氨酸的存在使得生物指示器对灭菌处理的影响的敏感性增加(耐性降低)。相比之下,相对于无添加剂的对照,L-脯氨酸的存在未使得生物指示器对灭菌处理的影响的敏感性增加。
实施例3
L-精氨酸和L-组氨酸对于孢子对过氧化氢灭菌处理的耐性的调节。
如实施例2中所述,制备独立成套的生物指示器(具有表5中列出的各种添加剂)。使独立成套的生物指示器暴露于STERRAD NX灭菌器中的过氧化氢,如实施例2中所述。独立成套的BI在经受灭菌处理之后被激活,并且针对荧光(使用台式荧光计)和基于pH的颜色变化(可视地)进行监测。荧光和生长读出结果在表5中示出。
数据表明相对于无添加剂的对照,孢子涂料溶液中L-精氨酸和L-组氨酸的存在使得孢子对灭菌处理的损伤/致死影响的敏感性增加。
本文引用的所有专利、专利申请和专利公开的全部公开内容以及可供使用的电子版材料均以引用方式并入。在本申请的公开内容和以引用方式并入本文的任何文献的公开内容之间存在任何矛盾的情况下,应以本申请的公开内容为准。上述具体实施方式和实施例仅为清楚理解本发明而给出。这些具体实施方式和实施例不应被理解为不必要的限制。本发明不限于示出的和描述的具体细节,对本领域的技术人员而言显而易见的变型形式将包括在由权利要求书所限定的本发明中。
所有的标题是为了阅读者方便,而不应该用于限制该标题后面的正文的含义,除非如此规定。
在不脱离本发明的实质和范围的前提下,可进行各种修改。这些以及其它实施方案均在如下权利要求的范围以内。
- 还没有人留言评论。精彩留言会获得点赞!