使用离子电渗法进行生物活性分子的眼内递送的制作方法
本申请要求2014年12月19日提交的美国专利申请序列号62/094,663的优先权,其全部内容通过引用全文并入本文。
背景技术:
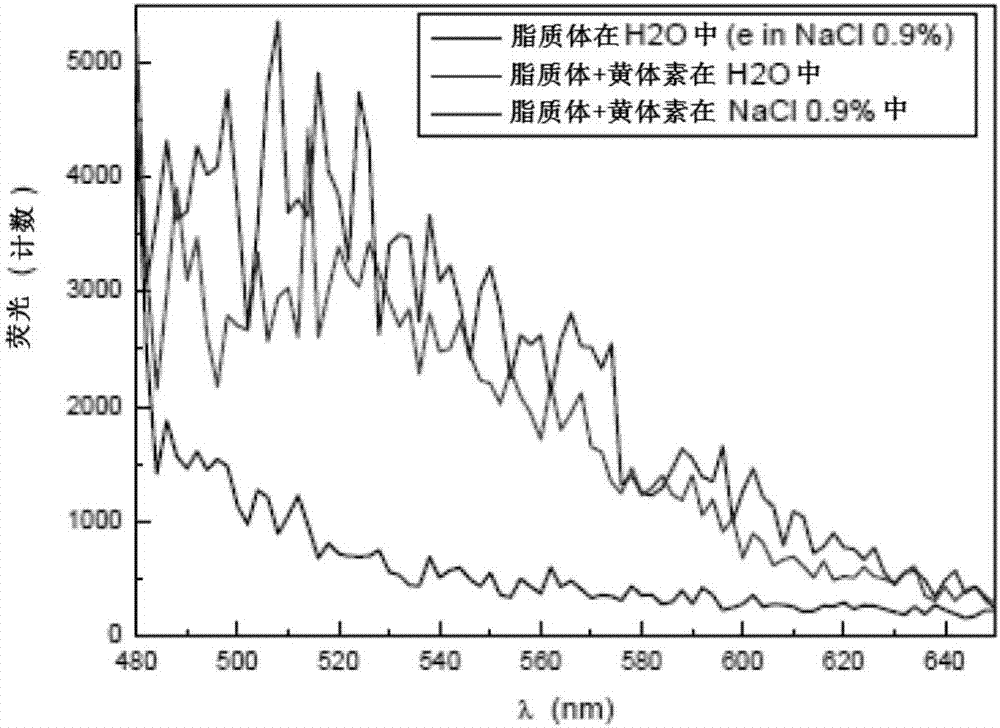
:本发明一般涉及生物活性分子在眼组织中的用途,更具体地涉及使用离子电渗法(iontophoresis)将黄体素(lutein)递送至黄斑。由于其抗氧化和光保护作用以及其在眼黄斑中的独有分布,黄体素(和玉米黄质(zeaxanthin))与降低发生年龄相关性黄斑变性(amd)和白内障摘除的风险相关1。年龄是amd最主要的风险因素之一,通常影响50岁以上的个体2-4。amd有两种类型,“干性amd”和“湿性amd”。当黄斑细胞由于被称为“玻璃疣”(drusen)的废物积累而受损时,会发生干性amd。这是amd最常见且最不严重的类型。出现干性amd症状的患者预计很大数量将会发展为湿性amd,当黄斑下方的异常血管生长并导致不可逆的细胞损伤时发展为湿性amd2-4。黄体素通过口服补充被广泛使用,原理为全身循环可以通过黄体素结合蛋白(xanthophyll-bindingprotein)将黄体素带入脉络膜循环以摄入黄斑5。然而,有几个报告表明,只有很小百分比的黄体素到达黄斑6-8。此外,由于眼屏障的限制,后眼部的治疗处理困难。由于眼睛受到泪膜、角膜、玻璃体、血液视网膜和血液-水屏障的保护,所以非常难以足够的浓度和最小的副作用将药物递送到眼,特别是视网膜9,10。已经使用原位施用(in-situapplication)来克服这个问题;然而缓慢递送系统(如植入物)是非常具有侵入性且昂贵的。在过去几年中,许多研究的结果强调了这些治疗的风险11,12。最近,玻璃体内注射黄体素已被用于在手术期间染色特定的视网膜前膜和其他眼结构13-16。这是将黄体素向黄斑原位递送的第一组数据,其利用了黄体素的内在染色效果。黄体素延迟amd发展的潜力和不同试验中显示的推定的神经保护作用尚未通过眼内递送后的原位施用证实。用于预防目的的玻璃体内注射黄体素作为将黄体素递送到黄斑的策略可能太具侵入性,其缺点在于患者接受度差。眼离子电渗法是一种通过电力驱使高浓度的靶分子跨巩膜和/或跨角膜的微创方法。它使用小电流施加到包含感兴趣的分子和载体的离子电渗室(iontophoreticchamber)17。几个报告显示,在人眼黄斑中发现的高浓度黄体素除了具有潜在的神经保护作用外还有延迟amd发展的潜力18-20。在这里,我们报告了一种向视网膜递送黄体素的新方法,所以它在旁中心凹(parafovea)黄斑区域的存在能够被显著增强并从而延缓amd的发展并保护视网膜内皮细胞。用于眼科用途的不同离子电渗法递送系统已经被创建,并已被用于安全且有效地将药物递送到人眼的前部和后部21。通过这种技术,使跨角膜和巩膜递送大量生物活性分子(包括大分子)成为可能。在本报道的研究中,黄体素乳状液通过离子电渗法扩散递送到黄斑中22-23。理念是开发一种通过离子电渗法驱使高浓度的带电黄体素跨巩膜和/或跨角膜的微创方法。巩膜和角膜离子电渗施用后,我们已经使用双光子显微镜、拉曼光谱和hplc来评估不同眼组织中黄体素的分布和浓度。这种方法的主要优点是使用更加安全并且更容易获得患者依从性的医疗装置,避免频繁和高剂量注射或手术植入的并发症。该程序可以在正常眼保健约见期间在医生办公室中快速进行而不需要手术环境。发明概述离子电渗法,一种使用低电流来增强电离的化合物进入组织的穿透性的微创方法,发现其对黄体素的眼内递送是有效的。将14只着色的兔子通过在角膜和巩膜施用充满黄体素乳状液的离子电渗储器(分别具有或不含电流(分别为20.0和0.0ma))进行治疗。离子电渗法后,收集来自两只眼睛的眼组织(试验和对照),并通过视觉比较评估经治疗的眼睛和未经治疗的对侧的眼睛的黄体素递送。跨角膜和跨巩膜离子电渗法施用导致在所有经治疗的眼睛中将黄体素递送到兔角膜(时间0h)。黄体素的施用还在巩膜缘产生了橙色痕迹,并在眼结膜中形成了轻微的橙色着色,证明乳状液也转移到这些组织中。在这项研究中,我们首次显示离子电渗法是黄体素眼内递送的一种有效技术。在本发明中,评估离子电渗法后眼中黄体素分布,以确定通过该技术将大量黄体素递送到后视网膜。结果表明,离子电渗法是一种有效的将带正电荷的黄体素脂质体乳状液递送到兔眼中的方法。此外,使用优化的黄体素乳状液的制剂和替代的离子电渗原型(prototype)进行实验以评价不同眼组织中的黄体素分布。还进行了用人类尸体的眼睛进行试验,向眼睛施用低电流来评价通过角膜和巩膜的黄体素递送。收集来自经治疗和未经治疗的眼睛的角膜、巩膜、脉络膜、外周和中央视网膜,并通过双光子显微镜分析以观察含黄体素的脂质体的分布。跨巩膜离子电渗施用导致黄体素主要递送到后视网膜区域,揭示离子电渗法后黄体素的途径通过睫状体/平坦部、随后被动扩散直到到达后视网膜发生。在脉络膜中黄体素的不存在可以通过着色的视网膜上皮的紧密连接的狭窄尺寸来解释,这使得较大脂质体囊泡难以通过,从而将黄体素限制在视网膜内层中。通过这项工作,我们首次通过一种新颖的微创方法,将黄体素原位递送到后眼部分。结果表明,巩膜的黄体素离子电渗法是将黄体素递送给黄斑的有效策略,其代表了用于延迟后眼部分疾病(如amd)的当前方法的替代方法。离子电渗法具有作为微创方法的优点,因此比化合物眼内递送的其他方法(即植入物和眼内注射)更安全。因此,离子电渗法将具有更高的患者依从性,因为它避免了手术植入或频繁和高剂量玻璃体内注射的并发症。另一个优点是这种技术比那些方法更便宜,并且可以在正常的眼保健约见期间在医生办公室中快速执行而不需要手术环境。附图简要说明该专利或申请文件包含至少一个以色彩描绘的附图。本专利或专利申请公开文本的彩色附图的副本将由美国专利商标局(theoffice)在请求并支付必要的费用后提供。图1是1:50稀释于0.9%nacl(蓝色)或蒸馏水(红色)的lipo+吸收光谱(300至750nm)的图表;示出了对照光谱(不含黄体素的脂质体溶液)。图2是1:50稀释于0.9%nacl(蓝色)或蒸馏水(红色)的lipo+荧光光谱(480至650nm)的图表;示出了对照光谱(不含黄体素的脂质体溶液)。图3是动态光散射和电泳迁移率的图表,用于估计lipo+溶液的粒度分布和lipo+溶液的电荷:测试在蒸馏水中1:50的稀释(红色),并将在水中的1:50脂质体稀释(不含黄体素)作为对照。图4是离子电渗法施用后黄体素轨迹的示意图;巩膜施用将黄体素沉积到眼睛后部,而角膜施用则将黄体素置于角膜上皮细胞的上部(橙色斑点);箭头表示离子电渗施用后黄体素的入口。具体实施方式术语“施用(administration)”或“施用(administering)”化合物应被理解为是指可以以治疗有用的形式和治疗有效量被引入个体体内的形式向需要治疗的该个体提供本发明化合物,该形式包括但不限于:口服剂型,例如片剂、胶囊剂、糖浆剂、悬浮剂等;可注射剂型,例如iv、im或ip等;经皮剂型,包括乳膏剂(cream)、胶冻剂(jelly)、粉剂或贴剂;口颊剂型;吸入粉末、喷雾剂、悬浮液等;和直肠栓剂。本文所用的术语“有效量”是指引发期望的生物学反应所必需的量。如本领域普通技术人员将理解的,复合物或生物活性剂的有效量可以根据如期望的生物学终点(biologicalendpoint)、待递送的生物活性剂、包被基质的组成、靶组织等而变化。如本文所用,术语“提取物”是指通过萃取制备的产物。提取物可以是在溶剂中的溶液形式,或者提取物可以是不含或基本上不含溶剂的浓缩物或精华。术语提取物可以是从特定提取步骤或一系列提取步骤获得的单一提取物,或者提取物也可以是从单独的提取步骤获得的提取物的组合。例如,可以通过在水中用酒精提取蔓越莓来获得“a”,而通过超临界二氧化碳提取蔓越莓可以获得提取物“b”。提取物a和b然后可以组合以形成提取物“c”。因此,这样的组合提取物也被术语“提取物”所涵盖。如本文所用,术语“级分”(fraction)是指包含由特定物理、化学性质或物理或化学性质表征的特定组的化学化合物的提取物。术语“预防”,当其使用涉及如癌症、感染性疾病或其他医学疾病或病症的病症时,在本领域中是熟知的,并且包括与不接受组合物的对象相比,施用组合物在对象中降低频率或延迟医疗病症的发生、症状。因此,预防癌症包括例如相对于未经治疗的对照群体减少接受预防性治疗的患者群体中可检测到的癌性生长的数量,和/或与未经治疗控制群体相比延迟经治疗的群体中可检测到的癌性生长的出现,例如,统计学和/或临床上显著的量。预防感染包括例如与未经治疗的对照群体相比减少经治疗的群体中的诊断出感染的次数,和/或与未经处理的对照群体相比延迟经治疗的群体中的感染症状的发生。“药学上可接受的”是指载体、稀释剂或赋形剂必须与制剂的其它成分相容,对其接受者无害。术语“协同”在本领域中是熟知的,并且是指两个或更多个成分共同作用使得总效应大于成分的总和。术语“治疗”在本领域中是熟知的,并且是指治疗以及改善任何病症或障碍(disorder)的至少一种症状。术语“预防性或治疗性”治疗在本领域中是熟知的,并且包括向宿主施用一或多种主题组合物。如果在临床表现不期望的病症(例如宿主动物的疾病或其他不期望的状态)之前进行施用,则治疗是预防性的,即其保护宿主免于发展不期望的病症,而如果在表现不期望的病症后施用,治疗是治疗性的(即,旨在减轻、改善或稳定现有的不期望的病症或其副作用)。本发明的化合物可以以将提供最佳药物功效的剂量施用于需要这种治疗的对象(人和动物,包括伴侣动物,如狗、猫和马)。应当理解,在任何特定施用中使用的所需剂量将随患者而变化,不仅随所选择的特定化合物或组合物变化,而且随施用途径、待治疗病症的性质、患者的年龄和病症、患者随后遵循的并用药物或特殊饮食,以及本领域技术人员将认识到的其他因素变化,适当的剂量最终由服务医师酌情决定。实施例1–兔眼中的黄体素的眼内递送材料和方法配制工作。在目前用于提高化合物稳定性的不同递送系统中,脂质体由于其生物相容性、持续释放潜能和携带疏水性和亲水性化合物的能力而具有优势16。在这项工作中,使用磷脂90h(lipoidgmbh,批次529400-2120046-12-112、cas308068-11-3)和十八胺(sigma-aldrich批次bcbk6340v、cas124-30-1))将结晶黄体素(keminfoods,crystallinelutein批次1401103302)包被在脂质体中。使用溶解在chcl3/meoh(2:1)(sigma-aldrich,批次shbc4982v,cas67-66-3或sigma-aldrich,批次szbc237bv,cas67-56-1)中的90h磷脂、十八胺和黄体素制备脂膜。通过旋转蒸发在真空下除去溶剂;通过heidolph旋转蒸发器在40℃下真空干燥溶液,调节旋转蒸发器的速度以减少可能导致产物损失的气泡的形成和飞溅,并在1-2小时后获得干燥的薄膜。为了除去任何痕量的溶剂,将所述薄膜在室温下真空放置至少16小时。通过在40-45℃下将蒸馏水(waterultrapure-milliq-aquamax-电导率0.054μs/cm)加入到脂膜中以水合脂质并形成大的脂质体囊泡进行脂膜水合。使用ikaworksultra-turraxt25数字均质器(staufen,德国)实现大脂质体囊泡的均质化,并且通过使用大规模高流体处理器m-110eh的挤出在50-60℃和1200巴下进行将脂质体囊泡减小到纳米尺寸范围。该过程重复5次。乳状液的灭菌在121℃1大气压下进行20分钟。表1显示了脂质体乳状液组合物。灭菌后分析终产品的尺寸分布、ζ电位、渗透压和ph值,并且总结于表2中。表1.黄体素脂质体乳状液组合物。组合物%w/w90h磷脂1.000十八胺0.005黄体素晶体0.050蒸馏水至100g表2.灭菌后的脂质体特征。眼离子电渗装置。离子电渗装置由两个一次性组件组成:眼睛施药器(applicator)和返回电极。这两个组件被连接到可重复使用的发电机。所述眼睛施药器由聚碳酸酯储存器(直径9mm、高度4.5mm、体积0.5ml)和通过导线连接到所述发电机(阳极-正电极)的不锈钢电极(aisi304)组成。所述返回电极是一个25g的皮内针,被插入颈部(前侧)并与鳄鱼夹连接并通向发电机(阴极)。所述发电机(eyegatecci发电机6121-eye,eyegatepharma,法国巴黎)为恒定电流型,设定范围为电流0.25ma-2.5ma(10个0.25ma的增量),以及时间为0.5min-5min(10个0.5分钟的增量)。在使用万用表进行研究期间测量产生的施用的电压。动物。在本研究中使用了14种着色的兔子品种hy79b(繁育者:“hypharm”-fr-49450roussay)。所有动物在夹杂物检测(inclusionexamination)后使用耳标和使用耳朵中的标记物分别被鉴定。动物在到达后3天内进行观察,每天观察疾病迹象特别注意眼睛。在相同的环境条件下,将动物单独饲养在标准笼中。温度保持在15-21℃,相对湿度为55±10%。房间连续通风(每小时≥15空气体积)。连续控制和记录温度和相对湿度。将动物常规暴露(笼内)在10-200lx光的12小时光照(从上午7:00至晚上7:00)和12小时黑暗的控制循环中。在整个研究中,动物可以自由获取食物和水。他们被喂以标准干颗粒饮食(150克/天),-14h(lasvendigmbh,soest德国)。可以从塑料瓶中随意获得定期分析的自来水。本研究计划中描述的所有标准操作程序和计划均已经经过认证的道德委员会审查。所有动物均按照欧洲保护用于实验17和其他科学目的的脊椎动物保护公约2010/63/ue指令(directive2010/63/ueeuropeanconventionfortheprotectionofvertebrateanimalsusedforexperimentalandotherscientificpurposes)和视力与眼科研究协会(arvo)的动物在眼科和眼科视力研究的使用声明(statementfortheuseofanimalsinophthalmicandvisionresearch)18进行处理。实验程序。将来自hy79品系的14只有色兔随机分为两组:对照组(被动施用:无电流;动物编号9-14)和试验组(离子电渗施用:有电流;动物编号1-8)。这两组被细分为两个时间点(0和2小时)。表3总结了研究设计。表3.研究设计。在施用前约10分钟,通过离子电渗法向麻醉动物(肌内注射混合物甲苯噻嗪/氯胺酮)施用黄体素乳状液,用开睑器和局部麻醉(1滴0.4%thea,批次f6757))辅助。将动物通过向右眼角膜和巩膜施用装满黄体素的9mm离子电渗法施药器10分钟进行治疗。取决于组,每只眼睛施用0.0ma或20.0ma的电荷(参见表3)。恰好在给药之前,用0.5ml的黄体素脂质体乳剂浸渍所述离子电渗施药器;装置的电极被黄体素乳状液覆盖。所有施用后均采用平衡盐溶液(bss)洗涤。动物在离子电渗施用在右眼后立即或施用后2小时(见表3)之后通过静脉内施用过量的戊巴比妥来安乐死,这是欧洲官方推荐的方法之一17。对来自双眼的角膜(c)、房水(ah)、睫状体(cb)、视网膜(r)、玻璃体(v)和巩膜(sc)进行取样并称重。在将它们存储在-80℃以用于将来的hplc(高效液相色谱)分析之前进行样品着色的视觉评估。结果有色兔中黄体素乳状液的眼部离子电渗递送。为了评估通过离子电渗法递送黄体素的能力,我们生产了携带黄体素(带正电荷)的脂质体,并将该乳状液以2.0ma10分钟施加入有色兔的角膜/巩膜中。通过对收集的组织进行视觉评估来评价通过离子电渗法进行递送的功效。表4总结了有无电流施用黄体素乳状液后的结果。表4.离子电渗施用后的着色。注意:c=角膜;sc=巩膜;cj=结膜离子电渗施用之后,用20.0ma电流(时间0h)治疗的所有眼睛都显示角膜中呈圆形橙色,其显示组织中黄体素乳状液的存在。黄体素的施用还来自两只眼睛(编号2和编号3),巩膜角膜缘带上有橙色痕迹和眼结膜有轻微的橙色着色。治疗2小时后,只有一半的经治疗的眼睛在角膜(编号5和编号8)中显示出这种着色,这一事件可能表明施用之后,乳状液扩散到眼睛中。在没有电流的情况下没有观察到递送入不同的眼组织中。讨论世界上约10%65岁以上的人患有amd疾病19。不同的试验已经表明黄体素是潜在的amd发展延迟剂,也是潜在的神经保护分子13,20-22。此外,黄体素是眼睛的天然成分,具有固有的黄斑向性,特异性先天性地保留在旁中央凹的(para-foveal)区域中1。这些特征对于用于控制amd的当前产品可能是一个优势。该病理学可用的治疗涉及具有副作用的对患者麻烦且昂贵的眼内注射,所以开发更安全和有效的治疗是至关重要的。在过去几年中,许多研究的结果已经强调了玻璃体内注射的风险。通过玻璃体内注射频繁施用药物的需要可导致视网膜脱离、眼内炎和升高的眼内压。据报道,非传染性和感染性炎症都是玻璃体内注射的并发症。随着批准使用后玻璃体内注射频率的增加,已经广泛研究了传染性眼内炎的发病率23,24。在这项工作中,我们首次测试了一种原位递送黄体素微创技术。离子电渗法具有微创方法的优点,并且因此更安全和更容易从而改善患者的依从性,因此避免了手术植入术或频繁高剂量玻璃体内注射的并发症12。事实上,不同的临床前和临床研究报道了重复眼部离子电渗法施用的安全性14,25,26。另一个优点是该方法较便宜,并且可以在正常的眼保健约见期间在医生办公室中快速进行而不需要手术环境。不同的研究建立了离子电渗法用于治疗人类眼睛疾病的用途,例如控制活跃性角膜移植物排斥反应27、治疗干眼症14,28、非感染性前葡萄膜炎15和圆锥角膜疾病29。在这项调查中,我们使用了离子电渗法,其涉及在10分钟内施用弱直流电驱动带电分子穿过眼组织。离子电渗施用导致携带黄体素(电离的药物)的脂质体乳状液穿过眼睛的角膜段。本研究是一种有效的概念证明,其清楚地显示了通过离子电渗技术黄体素乳状液的眼内递送。实施例2-在尸体眼睛中的黄体素眼内递送材料和方法配制工作。由于较高的穿透入眼组织中,已经证明对于离子电渗施用带正电荷的颗粒比带负电荷的颗粒作为药物载体是更适合的候选物38。此外,电场迫使正电荷分子移动到眼膜(带负电)39。在这项工作中,我们利用了在生理ph值下存在于人眼中的膜是带负电荷的事实,并且用于开发通过离子电渗施用的携带待递送黄体素的带正电荷的乳状液。由于黄体素是具有大分子量、亲脂性和不溶于水的分子的事实,这种类胡萝卜素不经修饰通过离子电渗法的递送几乎是不可能的1。为了克服这一点,制备了带有带正电荷的脂质体囊泡作为黄体素分子载体的制剂(lipo+)。使用磷脂90h(lipoidgmbh,lot529400-2120046-12-112,cas308068-11-3)、十八胺(sigma-aldrichlotbcbk6340v,cas124-30-1)结晶黄体素(keminhealth,结晶黄体素1401103302)制备脂膜。为了制备4-5l,将化合物溶于500-800ml的chcl3/meoh(1:1v/v)(sigma-aldrich,批号shbc4982v,cas67-66-3/sigma-aldrich,批号szbc237bv,cas67-56-1)在30-35℃加热。请参见表5中的制剂组成。通过旋转蒸发在真空下除去溶剂。该溶液在40℃下通过heidolph旋转蒸发器在真空下干燥,1-2小时后得到干燥的薄膜。将所述薄膜在室温下真空放置至少16小时,以确保完全除去任何痕量的溶剂。通过气相色谱(gc)分析有机溶剂的含量,并保证小于25ppm。通过在65℃下向脂膜中加入蒸馏水(waterultrapure-milliq-byaquamax-电导率0.054μs/cm)进行脂膜水合以形成大的脂质体囊泡。使用ikaworksultra-turraxt25数字匀浆器(staufen,德国)以2000-4000rpm实现这些大脂质体泡囊的均质化,并且通过使用大规模高流处理器m-110eh在50-60℃和1200巴下挤出将脂质体囊泡减小至纳米尺寸范围。该过程重复5次。乳状液的灭菌在121℃下在1大气压下进行20分钟。在所述灭菌过程之后,记录脂质体制剂的特征:ph(使用mettlertoledos20仪器)、渗透压(使用osmomat3000)、粒度和ζ电位(使用动态光散射(dls),也称为光子相关光谱学技术-nicomp380dls)。表5.黄体素脂质体乳状液组合物。组合物%w/w90h磷脂2.000十八胺0.007黄体素晶体0.100蒸馏水至100g制剂的分光光度测定。使用分光光度法测定lipo+溶液的吸光度和荧光性质(1:50稀释在水或0.9%nacl中)。使用仅包含脂质体(不含黄体素)的溶液作为对照。每个样品追踪300和750nm之间的吸光度光谱,以及在480nm和650nm之间的荧光光谱,在370nm处激发(选自吸光度光谱结果)。粒度和ζ电位。动态光散射用于评估lipo+溶液中组分尺寸的分布。进行电泳以评估溶液的ζ电位。眼部离子电渗法装置。眼部离子电渗法的原理是将电场施用到含有至少一种产物的电解物质中,以通过眼睛的生物膜将产物递送到待治疗的身体或器官中12。典型的离子电渗设置由两个部件组成:眼部施药器和连接到发电机(generator)的返回电极。在该实验中,所述眼部施药器包括2个电极,分别触及角膜和巩膜组织。所述眼部施药器(opiatechnologiessas,巴黎,法国)由聚氨酯树脂制成,并且包括2个储存器:中央圆形储存器(直径8mm、高度4.5mm、体积1ml)和施用在角膜上被环形储器(内径12.5mm、外径18mm、高4.5mm、体积1ml)包围的不锈钢电极和施用在巩膜上(角膜缘周围的平坦部区域)的不锈钢电极。每个不锈钢电极与引线相连到不同的恒流发电机(阳极-正极)。将返回电极分配给每个发电机并分别接触视神经(对于角膜电极)和巩膜的赤道区域(对于巩膜电极),单独闭合每个电路。所述发电机(iono-25,iacersrl,意大利)是恒定电流型,电流设定范围为0.25ma-2.5ma(0.5ma增量为5)和时间自动调节以递送20ma.分钟的总输出量。在研究期间针对每个电路使用2个万用表测量施用的所得电压。尸体眼睛。来自不同健康供体的六只人类尸体眼球从威尼托眼库基金会(venetoeyebankfoundation)(veneziazelarino,意大利)获得。根据“赫尔辛基宣言”的指导原则使用人眼进行涉及使用人体组织的研究,并在死亡后3至16小时后移出,并立即在4℃下保存在富含6%葡聚糖的角膜储存培养基中。平均供体年龄为63.6±5.9岁。平均内皮细胞密度为2125±389个/mm2。淹没在富含葡聚糖的溶液中的每个眼球都在5天内运送到实验室。四只眼球经过角膜-巩膜离子电渗法将0.1%的黄体素眼科溶液输送到视网膜组织。使用两只眼球作为对照:在不存在制剂的情况下进行离子电渗法。准备眼睛。每只眼球都轻轻地安装在特别设计的支架上,朝上。巩膜和角膜的被动电极分别施用于视神经和巩膜。眼睛通过填充有0.9%氯化钠溶液的管与柱压力计连接,以便在实验过程中将眼睛内部的压力保持在15mm汞柱。首先对眼球进行15至42mm汞柱之间的三个预处理循环,以稳定实验期间的眼组织和结构。这个预处理确保在每个实验开始时获得独特的参考状态,并将角膜和巩膜厚度恢复到生理水平。预处理后,使用超声角膜测厚计(pachmate,dgh,exton,usa)测量中心角膜厚度(cct)。在这些样品中,平均cct为558±19μm。用溶液浸渍。将塑料浴中的活性电极(阴极)施用到角膜和巩膜表面。塑料管填充泡沫,用lipo+浸泡20分钟。在这种预浸泡处理之后,将管轻轻地施用到眼球的前表面,并再次用2mllipo+溶液填充。将电流密度设定为2.5ma,并且用连接到角膜和巩膜的两个发电机递送5分钟。经角膜-巩膜离子电渗法后,将眼球保持在眼保持器上,朝上,眼睛内部的压力为15mm汞柱,持续80分钟。这个时期允许通过跨巩膜离子电渗法到达视网膜的黄体素被动地通过视网膜组织扩散到黄斑,特别是中央凹周围的区域。将本研究中使用的6只眼睛中的两只用作对照,因此不用所述制剂进行浸渍。组织评估。80分钟后,分离出视网膜组织,而不引起可能损害其用于高分辨率双光子成像的严重的损伤。使用标准化方案进行视网膜、脉络膜、角膜和巩膜组织的解剖47。使用双光子显微镜用于评估视网膜的黄斑区域黄体素的穿透。在开始对眼组织进行图像采集之前,获取lipo+溶液(0.005%、0.002%和0.001%稀释在0.9%氯化钠中)的几个叠层(stack)以了解施用和增强黄体素发出双光子荧光(tpf)信号的最佳滤波器。滤波器550/80nm(semrock)是黄体素研究中最合适的(基于分光光度学研究),但是发现滤波器525/20nm(semrock)在信噪比(snr)方面给出了良好的结果。因此,用于眼组织评估的激发为835nm,并且对于反射光反射通过非退扫描检测器(non-descanneddetector)(ndd1)反向收集由眼组织成分发出的tpf光。共振拉曼光谱:共振拉曼散射用于评估离子电渗法递送黄体素至尸体眼中的人视网膜的功效。将以473.5nm波长为中心的单模激光源(50mw功率)作为激发源进行共振拉曼光谱测量。通过镜片和显微镜物镜(na=0.25)的组合将激光束聚焦在眼组织上,使得被照射的视网膜区域的直径为1mm;使用中性密度滤光片在视网膜平面上将激光功率降低至1mw。拉曼散射光由光电倍增管(pmt)收集,光谱分辨率为10cm-1并且具有平均80次暗计数速率。拉曼信号强度记录为每秒光子计数(cps)。在三个视网膜区域进行测量:离子电渗递送部位的内部巩膜(即面向睫状体的周边巩膜);视网膜中-边缘,其包括围绕血管弓的视网膜区域和视神经头;和黄斑。在每个区域的四个范围进行测量,以收集足够的数据以正确估计研究和对照眼睛的数据。在实验前,为了找到拉曼读数与眼组织的实际黄体素含量之间的相关性,使用装有不同浓度黄体素的薄的石英比色杯进行校准实验。结果lipo+光谱特征。lipo+溶液的吸光度和荧光光谱首先在本研究中提出以确定双光子激发波长。吸收光谱在300和750nm之间进行跟踪,如图1所示。lipo+溶液在370nm处显示吸收峰,并将其用作激发波长以追踪480nm与650nm之间的lipo+荧光光谱(图2)。lipo+显示两个荧光带峰:500-530nm和540-570nm。基于这些结果,为双光子实验选择的滤波器(filter)为550/88。lipo+物理特性。在离子电渗测试之前还测定了粒径和ζ电位以确定lipo+正电荷和大小。这些测定针对在蒸馏水中1:50lipo+稀释液分别通过动态光散射和电泳进行,并与不含黄体素的脂质体溶液(作为对照)进行比较。根据图3,lipo+聚集峰在3.5μm(平均),并且在300nm(平均)也观察到较小的峰,表示各个脂质体。此外,ζ电位测定显示针对lipo+溶液的+5mv电荷。离子电渗施用后尸体眼中黄体素分布。虽然为双光子实验选择的滤波器是550/88(基于以前的荧光实验),黄体素脂质体制剂的初步分析显示525/20滤波器在snr方面给出了更好的结果。在这种初始校准(0.005、0.002和0.001%的lipo+稀释在0.9%nacl中),观察到脂质体为球形囊泡,并且显微镜被正确校准(数据未显示)。这是一个非常重要的对照,因为视网膜色素细胞充满了黑色素(一种以与黄体素相同的波长激发的色素)。此外,通过这种对照,我们能够区分黄体素脂质体和色素。为了评估在离子电渗施用后在人眼中携带黄体素的脂质体的分布,将五只尸体眼睛暴露于角膜/巩膜中2.5ma的电流5分钟,静置80分钟(控制眼内压为15mm汞柱),并且收集眼睛的不同结构:角膜、巩膜、脉络膜、外周和中央视网膜。通过双光子显微镜(在835nm激发)评价脂质体的分布。使用第六只尸体眼睛作为对照:所述眼睛从未与脂质体制剂接触。在这种情况下,当835nm激光打开时,没有检测到脂质体,表明信号对于外源黄体素是特异性的(数据未显示)。收集的不同眼睛组织的分析显示,组合的角膜-巩膜离子电渗法后,黄体素在视网膜中丰富,而所有经测试的眼睛的脉络膜组织中均未发现富含黄体素的脂质体。此外,根据视网膜的检查,lipo+溶液不能穿过视网膜血管壁,因为脂质体仅在血管周围的组织中发现。对于前段(anteriorsegment)测定(巩膜和角膜),没有发现富含黄体素的脂质体,既不在角膜基质中也不在巩膜组织中,但在角膜上皮细胞中发现。在视网膜中,还可以观察到靠近感光体的外部部分中的黄体素比视网膜内部的神经节细胞更多。由于脉络膜分析显示在目前施用后该区域不存在脂质体,这些结果表明通过睫状体/平坦部(parsplana)进行离子电渗经巩膜施用黄体素后,黄体素脂质体通过眼膜被动扩散,直至到达靠近中央凹的后视网膜。图4显示了眼睛内黄体素途径的示意图。角膜离子电渗施用后角膜组织的分析显示脂质体位于该组织的上皮细胞之上。还进行了不同眼组织的共振拉曼光谱分析。拉曼信号叠加在可能源自内在类胡萝卜素荧光素和脂褐素荧光的荧光背景上。为了获得没有背景信号的拉曼峰高的准确读数,我们通过对于每个测量光谱的测量的拉曼线形状的多项式拟合(高达5阶)减去了光谱中可能重叠的噪声尖峰的影响。选择1530cm-1处c=c双键信号的最终峰高作为黄体素存在的标志。在内部巩膜中,在受治疗的眼睛中测量的1530cm-1处的拉曼峰值比对照眼睛大7倍,提供离子电渗法通过完整巩膜将黄体素递送至眼睛的功效的证据。在视网膜的中边缘,在受治疗的眼睛中测量的1530cm-1处的拉曼峰值比对照眼睛大1.7倍,这表明在离子电渗治疗结束时大量的黄体素到达视网膜的后极。在黄斑中,在受处理的眼睛中测量的1530cm-1处的拉曼峰值比对照中的大1.3倍,表明离子电渗法在黄斑中递送黄体素是有效的。讨论年龄相关性黄斑变性(amd)是发达国家50岁以上人群不可逆转失明的主要原因40,41。有超过800万美国人患有amd,预计在2020年该疾病的总发病率将增加超过50%37。几个流行病学研究强调,黄体素补充导致早期amd患者的黄斑色素光密度(mpod)水平升高,其与保护免得黄斑病相关42,21。事实上,黄体素天然集中在视网膜中,在那里其与玉米黄质一起形成黄斑色素。作为蓝光过滤器,黄体素可以保护黄斑中心的底层光感受器免受光化学损伤43。黄体素的抗氧化性质还可以保护黄斑免受氧化应激44。缓慢amd进展的可用解决方案是基于眼内注射或手术,其包括已被证实的副作用和可能的并发症,如视网膜脱离、眼内压增加以及非传染性和传染性炎症23,33。在这项工作中,我们使用黄体素的微创原位递送到人眼的后段。离子电渗法具有更安全和更简单方法的优势,使患者依从并促进高浓度的感兴趣的产品通过不同眼睛层直到其到达视网膜。不同的报告已经确定了使用眼部离子电渗法治疗不同疾病(如干眼症、非感染性葡萄膜炎和圆锥角膜)的重复治疗的安全性14,15,25,26,28,29。在这里,使用尸体眼睛作为临床前模型,我们施用弱电流推动黄体素进入眼睛,没有副作用。我们观察到黄体素脂质体主要沉积在中央凹附近的外周和中央视网膜中,但在脉络膜区域不存在。通过这种观察,可以在通过睫状体/平坦部、随后被动扩散通过眼膜直至到达后视网膜区域的经巩膜施用之后外推黄体素的途径(图4)。我们首次证明经巩膜的离子电渗法是将黄体素置入人眼视网膜的有效途径,为加强黄斑色素提供了新的途径。沉积在后部区域时,假定黄体素能够通过被动扩散/蛋白质梯度到达感光体存在的视网膜的外部部分。可以认为在脉络膜中没有观察到黄体素的原因是由于神经视网膜屏障,其网眼大小为80-90nm45(脂质体尺寸为341nm,有时可形成2-3μm的簇,表明黄体素脂质体保持被限制在视网膜中)(图4)。重要的是,共振拉曼光谱分析显示离子电渗后黄斑中的黄体素浓度增加。这一观察清楚地表明经巩膜的离子电渗法是一种有效的将黄体素递送到黄斑的方法,并且是一种用于预防amd发病、阻止其发展和/或治疗已形成的疾病的当前方法的有效替代方法。在施用角膜离子电渗法后,角膜基质中不存在脂质体。这个事实可以被解释为因为黄体素是疏水性的,基质的70%是由水组成,因此非常亲水46,这使得黄体素不可能穿透入该组织。前面的描述和附图包括本发明的说明性实施例。前述实施例和本文描述的方法可以基于本领域技术人员的能力、经验和偏好而变化。仅以一定顺序列举方法的步骤不构成对该方法的步骤的顺序的任何限制。前面的描述和附图仅仅解释和说明本发明,并且本发明不限于此,除非权利要求如此限制。本领域技术人员获得其前面的公开内容将能够在不脱离本发明的范围的情况下进行修改和变化。参考文献1.kijlstraa.,tiany.,kellye.r.,berendschott.t.2012.lutein:morethanjustafilterforbluelight.progretineyeres.31:303-315.2.yemelyanova.y.,katzn.b.,bernsteinp.s.2001.ligand-bindingcharacterizationofxanthophyllcarotenoidstosolubilizedmembraneproteinsderivedfromhumanretina.expeyeres.72:381-392.3.boner.a.,landrumj.t.,guerral.h.,ruizc.a.2003.luteinandzeaxanthindietarysupplementsraisemacularpigmentdensityandserumconcentrationsofthesecarotenoidsinhumans.jnutr.133:992-998.4.landrumj.t.,boner.a.,joah.,kilburnm.d.,moorel.l.,spraguek.e.1997.aoneyearstudyofthemacularpigment:theeffectof140daysofaluteinsupplement.expeyeres.65:57-62.5.mal.,linx.m.2010.effectsofluteinandzeaxanthinonaspectsofeyehealth.jscifoodagric.90:2-12.6.bararj.,javadzadeha.r.,omidiy.2008.ocularnoveldrugdelivery:impactsofmembranesandbarriers.expertopindrugdeliv.5:567-581.7.delafuentem.,ravinam.,paolicellip.,sancheza.,seijob.,alonsom.j.2010.chitosan-basednanostructures:adeliveryplatformforoculartherapeutics.advdrugdelivrev.62:100-117.8.sousa-martinsd.,maiam.,moraesm.,lima-filhoa.a.,rodriguese.b.,chenj.,farahm.e.,santosl.b.,belfortr.,jr.2012.useofluteinandzeaxanthinaloneorcombinedwithbrilliantbluetoidentifyintraocularstructuresintraoperatively.retina.32:1328-1336.9.rodriguese.b.,costae.f.,penhaf.m.,melog.b.,bottosj.,dibe.,furlanib.,limav.c.,maiam.,meyerc.h.,hofling-limaa.l.,farahm.e.2009.theuseofvitaldyesinocularsurgery.survophthalmol.54:576-617.10.maiam.,furlanib.a.,souza-limaa.a.,martinsd.s.,navarror.m.,belfortr.,jr.2014.lutein:anewdyeforchromovitrectomy.retina.34:262-272.11.badaroe.,furlanib.,prazeresj.,maiam.,limaa.a.,souza-martinsd.,mucciolic.,lucattol.f.,belfortr.,jr.2014.solubleluteinincombinationwithbrilliantblueasanewdyeforchromovitrectomy.graefesarchclinexpophthalmol.252:1071-1078.12.eljarrat-binstocke.,domba.j.2006.iontophoresis:anon-invasiveoculardrugdelivery.jcontrolrelease.110:479-489.13.izumi-nagaik.,nagain.,ohgamik.,satofukas.,ozaway.,tsubotak.,umezawak.,ohnos.,oikey.,ishidas.2007.macularpigmentluteinisantiinflammatoryinpreventingchoroidalneovascularization.arteriosclerthrombvascbiol.27:2555-2562.14.patanem.a.,cohena.,froms.,torkildseng.,welchd.,ouslerg.w.,3rd.2011.oculariontophoresisofegp-437(dexamethasonephosphate)indryeyepatients:resultsofarandomizedclinicaltrial.clinophthalmol.5:633-643.15.cohena.e.,assangc.,patanem.a.,froms.,korenfeldm.,avionstudyi.2012.evaluationofdexamethasonephosphatedeliveredbyoculariontophoresisfortreatingnoninfectiousanterioruveitis.ophthalmology.119:66-73.16.tanc.,xias.,xuej.,xiej.,fengb.,zhangx.2013.liposomesasvehiclesforlutein:preparation,stability,liposomalmembranedynamics,andstructure.jagricfoodchem.61:8175-8184.17.frenchdecreen°2013-118.2013europeandirective2010/63/ue.j.offic.rep.frtext24outof130.18.associationforresearchinvisionandophthalmology(arvo).1995.statementfortheuseofanimalsinophthalmicandvisionresearch.19.ratnapriyar.,chewe.y.2013.age-relatedmaculardegeneration-clinicalreviewandgeneticsupdate.clingenet.84:160-166.20.age-relatedeyediseasestudy2researchg.2013.lutein+zeaxanthinandomega-3fattyacidsforage-relatedmaculardegeneration:theage-relatedeyediseasestudy2(areds2)randomizedclinicaltrial.jama.309:2005-2015.21.richers.,stilesw.,statkutel.,pulidoj.,frankowskij.,rudyd.,peik.,tsipurskym.,nylandj.2004.double-masked,placebo-controlled,randomizedtrialofluteinandantioxidantsupplementationintheinterventionofatrophicage-relatedmaculardegeneration:theveteranslaststudy(luteinantioxidantsupplementationtrial).optometry.75:216-230.22.zhaol.,sweetb.v.2008.luteinandzeaxanthinformaculardegeneration.amjhealthsystpharm.65:1232-1238.23.simunovicm.p.,rushr.b.,hunyora.p.,changa.a.2012.endophthalmitisfollowingintravitrealinjectionversusendophthalmitisfollowingcataractsurgery:clinicalfeatures,causativeorganismsandpost-treatmentoutcomes.brjophthalmol.96:862-866.24.irigoyenc.,ziahosseinik.,morphisg.,stapplert.,heimannh.2012.endophthalmitisfollowingintravitrealinjections.graefesarchclinexpophthalmol.250:499-505.25.patanem.a.,schubertw.,sanfordt.,geer.,burgosm.,isomw.p.,ruiz-perezb.2013.evaluationofocularandgeneralsafetyfollowingrepeateddosingofdexamethasonephosphatedeliveredbytransscleraliontophoresisinrabbits.joculpharmacolther.29:760-769.26.patanem.a.,cohena.,assangc.,froms.2010.randomized,double-maskedstudyofegp-437insubjectswithnon-infectiousanteriorsegmentuveitis.posterpresentedat:americanacademyofophthalmologyannualmeeting.27.halhalm.,renardg.,courtoisy.,benezrad.,behar-cohenf.2004.iontophoresis:fromthelabtothebedside.expeyeres.78:751-757.28.horwath-winterj.,schmuto.,haller-schobere.m.,grubera.,riegerg.2005.iodideiontophoresisasatreatmentfordryeyesyndrome.brjophthalmol.89:40-44.29.arboledaa.,kowalczukl.,savoldellim.,kleinc.,ladraas.,naudm.c.,aguilarm.c.,parelj.m.,behar-cohenf.2014.evaluatinginvivodeliveryofriboflavinwithcoulomb-controllediontophoresisforcornealcollagencross-linking:apilotstudy.investophthalmolvissci.55:2731-2738.30.liml.s.,mitchellp.,seddonj.m.,holzf.g.,wongt.y.age-relatedmaculardegeneration.thelancet.379:1728-1738.31.dejongp.t.v.m.2006.age-relatedmaculardegeneration.newenglandjournalofmedicine.355:1474-1485.32.jagerr.d.,mielerw.f.,millerj.w.2008.age-relatedmaculardegeneration.newenglandjournalofmedicine.358:2606-2617.33.irigoyenc.,ziahosseinik.,morphisg.,stapplert.,heimannh.2012.endophthalmitisfollowingintravitrealinjections.graefesarchclinexpophthalmol.250:499-505.34.ozaway.,sasakim.,takahashin.,kamoshitam.,miyakes.,tsubotak.2012.neuroprotectiveeffectsofluteinintheretina.currpharmdes.18:51-56.35.sasakim.,ozaway.,kuriharat.,nodak.,imamuray.,kobayashis.,ishidas.,tsubotak.2009.neuroprotectiveeffectofanantioxidant,lutein,duringretinalinflammation.investophthalmolvissci.50:1433-1439.36.woot.t.,lis.y.,laiw.w.,wongd.,loa.c.2013.neuroprotectiveeffectsofluteininaratmodelofretinaldetachment.graefesarchclinexpophthalmol.251:41-51.37.friedmand.s.,o′colmainb.j.,munozb.,tomanys.c.,mccartyc.,dejongp.t.,nemesureb.,mitchellp.,kempenj.,eyediseasesprevalenceresearchg.2004.prevalenceofage-relatedmaculardegenerationintheunitedstates.archophthalmol.122:564-572.38.eljarrat-binstocke.,orucovf.,aldoubyy.,frucht-peryj.,domba.j.2008.chargednanoparticlesdeliverytotheeyeusinghydrogeliontophoresis.jcontrolrelease.126:156-161.39.gungors.,delgado-charrom.b.,ruiz-perezb.,schubertw.,isomp.,moslemyp.,patanem.a.,guyr.h.2010.trans-scleraliontophoreticdeliveryoflowmolecularweighttherapeutics.jcontrolrelease.147:225-231.40.pascolinid.,mariottis.p.,pokharelg.p.,pararajasegaramr.,etya′aled.,negrela.d.,resnikoffs.2004.2002globalupdateofavailabledataonvisualimpairment:acompilationofpopulation-basedprevalencestudies.ophthalmicepidemiol.11:67-115.41.congdonn.,o′colmainb.,klaverc.c.,kleinr.,munozb.,friedmand.s.,kempenj.,taylorh.r.,mitchellp.,eyediseasesprevalenceresearchg.2004.causesandprevalenceofvisualimpairmentamongadultsintheunitedstates.archophthalmol.122:477-485.42.seddonj.m.,ajaniu.a.,sperdutor.d.,hillerr.,blairn.,burtont.c.,farberm.d.,gragoudase.s.,hallerj.,millerd.t.,etal.1994.dietarycarotenoids,vitaminsa,c,ande,andadvancedage-relatedmaculardegeneration.eyediseasecase-controlstudygroup.jama.272:1413-1420.43.vandekraatsj.,kanism.j.,genderss.w.,vannorrend.2008.luteinandzeaxanthinmeasuredseparatelyinthelivinghumanretinawithfundusreflectometry.investophthalmolvissci.49:5568-5573.44.barkerf.m.,2nd,snodderlyd.m.,johnsone.j.,schalchw.,koepckew.,gerssj.,neuringerm.2011.nutritionalmanipulationofprimateretinas,v:effectsoflutein,zeaxanthin,andn-3fattyacidsonretinalsensitivitytoblue-light-induceddamage.investophthalmolvissci.52:3934-3942.45.cunha-vazj.,bernardesr.,loboc.2011.blood-retinalbarrier.eurjophthalmol.21suppl6:s3-9.46.prausnitzm.r.,noonanj.s.1998.permeabilityofcornea,sclera,andconjunctiva:aliteratureanalysisfordrugdeliverytotheeye.jpharmsci.87:1479-1488.47.www.jove.com/video/3765权利要求书(按照条约第19条的修改)1.一种在眼组织中沉积生物活性分子的方法,包括以下步骤:配制含有所述生物活性分子的脂质体,向离子电渗法装置加载含有所述生物活性分子的脂质体的组合物,将所述离子电渗法装置施加于对象的眼睛,以及操作所述离子电渗法装置。2.权利要求1所述的方法,其中所述生物活性分子选自类胡萝卜素组成的组。3.权利要求2所述的方法,其中所述类胡萝卜素选自黄体素和玉米黄质组成的组。4.权利要求1所述的方法,其中所述脂质体具有正ζ电位。5.一种治疗、改善或预防眼部疾病或功能障碍的方法,包括以下步骤:配制含有生物活性分子的脂质体,向离子电渗法装置加载含有所述生物活性分子的脂质体的组合物,将所述离子电渗法装置施加于对象的眼睛,以及操作所述离子电渗法装置。6.权利要求5所述的方法,其中治疗、改善或预防眼部疾病或功能障碍是延迟年龄相关性黄斑变性的发作。7.权利要求5所述的方法,其中所述眼部疾病或功能障碍是年龄相关性黄斑变性。8.权利要求5所述的方法,其中所述改善或预防眼部疾病或功能障碍包括在健康对象中执行所述方法。9.权利要求5所述的方法,其中所述生物活性分子选自类胡萝卜素组成的组。10.权利要求9所述的方法,其中所述类胡萝卜素选自黄体素和玉米黄质组成的组。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1