基于转录因子ZEB1在制备促进乳腺癌化疗敏感性的药物中的应用的制作方法
本发明涉及转录因子ZEB1的新用途以及提高化疗敏感性的相关基因,特别涉及基于转录因子ZEB1提高乳腺癌化疗敏感性药物制备中的应用,属于肿瘤药物制备的技术领域。
背景技术:
乳腺癌(Breast Cancer)已成为世界范围内女性最常见的恶性肿瘤之一,也是全球女性因肿瘤相关疾病死亡的首要原因。尽管由于乳腺外科技术、新辅助治疗和靶向药物等综合治疗技术的发展,目前早期乳腺癌5年生存率在一些发达国家已提高至85%以上,但晚期乳腺癌或复发转移性乳腺癌五年生存率仅有23%。而乳腺癌化疗耐药的发生则成为导致这一严酷事实的主要原因之一。
DNA损伤类药物,例如,表柔比星、依托泊苷等,主要是通过造成DNA双链损伤来杀伤肿瘤细胞。但因其毒副作用大,并且容易出现化疗耐药,使其临床应用受到了很大的制约。因此,揭开乳腺癌化疗耐药的分子机制,寻找和发现参与乳腺癌化疗耐药的关键靶点,降低其毒副作用,就成为提高化疗敏感性的重要手段。
技术实现要素:
本发明目的在于提供基于转录因子ZEB1在制备促进乳腺癌化疗敏感性的药物中的应用,抑制ZEB1表达可提高乳腺癌化疗疗效,为有效提高乳腺癌的临床疗效提供新的药物靶标选择。
ZEB1是调控上皮-间质转化过程的重要转录因子,ZEB1已被证实在多种实体肿瘤中高表达,对肿瘤的发生、发展和远处转移具有显著影响,因此ZEB1可作为肿瘤防治特别是肿瘤个体化治疗的关键靶点。
本发明首先提供了转录因子ZEB1在制备抗乳腺癌的药物及其逆转乳腺癌化疗耐药的应用。所述转录因子ZEB1通过转录激活作用,增加ATM在乳腺癌中的激活。转录因子ZEB1通过对转录激活因子P300、PCAF的招募,激活ATM在乳腺癌中的表达。
所述的药物为Le-shZEB1以及与化疗药物联合使用的药物。
本发明所述的基于转录因子ZEB1在制备促进乳腺癌化疗敏感性的药物中的应用,通过以下步骤实现:
1.ZEB1高表达与乳腺癌化疗耐药相关性的探讨
(1)免疫组织化学方法检测ZEB1在化疗耐药的人乳腺癌组织和非耐药的乳腺癌组织中的表达情况。一共检测233例人乳腺癌组织,其中耐药病例69例(评价标准按WHO肿瘤化疗疗效评价标准执行),非耐药病例164例(评价标准同前)。经统计,ZEB1在化疗耐药的乳腺癌组织中的表达显著高于其在非耐药组织中的表达,差异具有统计学意义(P=0.006);
(2)免疫组织化学方法检测ZEB1与经典化疗耐药分子Bcl-xl、CyclinD1的相关性。通过对139例原发性乳腺病例进行免疫组织化学染色,确定ZEB1与抗凋亡蛋白Bcl-xl(P=0.01,r=0.343)及细胞周期蛋白CyclinD1(P<0.01,r=0.432)呈正相关的关系。进一步明确ZEB1在乳腺癌化疗耐药过程中的作用;
2.转录因子ZEB1在制备增加乳腺癌对化疗药物敏感性的药物中的应用。
(1)Le-shZEB1的制备及鉴定,并且通过体外的CCK-8实验证实Le-shZEB1可增加化疗药物表柔比星(Epirubicin)和依托泊苷(Etoposide)对乳腺癌细胞MDA-MB-231生长的抑制作用;
(2)通过Western blot和细胞免疫荧光(Immunofluorescence)证明Le-shZEB1可以促进DNA损伤标记物γH2AX的产生。
3.转录因子ZEB1下游靶基因的确定。
(1)通过Chip-seq方法,初步筛选出147个ZEB1候选靶基因;
(2)通过文献检索从147个候选基因中找到9个与化疗耐药相关的靶基因(ATM,NLGN1,CLASP1,CD4,RPS6KB1,BIRC3,PIM3,KIF2C,SLC3A2);
(3)利用TCGAdata base分析ZEB1与上述9个候选靶基因的相关性,明确ZEB1和ATM具有显著的正相关关系(P<0.01,r=0.484)。
(4)利用QPCR方法在mRNA水平进一步确定ZEB1与上述9个候选靶基因的关系,证实ZEB1与ATM的正向调控作用。
4.转录因子ZEB1对ATM的转录调控,增加ATM在乳腺癌中的激活。
(1)对ATM启动子进行分析,确定在ATM启动子距离转录起始位点(TSS)-849bp的位置,存在一个潜在的ZEB1结合元件E2-box序列(GAGGTG);
(2)通过分子生物学方法设计并克隆ATM启动子的不同长度的截短序列以及E2-box位点的突变序列,利用双荧光素酶报告系统确定ZEB1结合到ATM启动子的E2-box,并且转录激活ATM;
(3)通过免疫染色质免疫共沉淀技术(Chromatin immunoprecipitation,ChIP),验证ZEB1通过结合ATM启动子的E2-box,转录激活ATM;
(4)通过免疫共沉淀技术(Co-Immunoprecipitation,Co-IP),确定ZEB1/P300/PCAF复合物的存在,并进一步通过ChIP确定ZEB1与P300、PCAF形成复合物后,与ATM启动子的E2-box结合,从而发挥了相应的调控作用;
(5)利用Western blot、免疫组织化学以及QPCR等方法,分别从蛋白水平和mRNA水平确定,ZEB1对ATM的正向调控作用。
5.ZEB1调控ATM介导乳腺癌化疗耐药的探讨
(1)构建ZEB1过表达乳腺癌细胞系中沉默ATM的稳定细胞系;
(2)CCK-8方法证明ATM沉默对ZEB1介导的表柔比星化疗耐药具有逆转作用;
(3)Western blot和免疫荧光方法证明ATM沉默可增加表柔比星诱导的肿瘤细胞的DNA损伤;
(4)利用ATM特异的小分子抑制剂(KU55933,10μM),重复上述研究,再次确定ZEB1介导的乳腺癌细胞对表柔比星的耐受是通过调控ATM实现的。
6.转录因子ZEB1通过对转录激活因子P300、PCAF的招募,激活ATM在癌中的表达。
7.ZEB1对ATM的调控机制在制备抗乳腺癌药物中的应用。
(1)Le-shATM的制备及鉴定,并且通过体外的CCK-8实验证实Le-shATM可增加化疗药物表柔比星(Epirubicin)和依托泊苷(Etoposide)对乳腺癌细胞MDA-MB-231生长的抑制作用;
(2)通过Western blot和细胞免疫荧光(Immunofluorescence)证明Le-shATM可以促进DNA损伤标记物γH2AX的产生。
8.ZEB1调控ATM介导乳腺癌化疗耐药的体内研究
(1)选择4-6周龄的雌性裸鼠,每组5只。以1.5×106/只的数量,分别接种野生型人乳腺癌细胞MDA-MB-231及ZEB1过表达细胞系MDA-MB-231/ZEB1;
(2)待肿瘤生长至体积为100mm3时,采用隔天腹腔给药的方式,给予表柔比星化疗(5mg/kg);
(3)每隔三天用游标卡尺测量肿瘤的长径和短径,以绘制生长曲线;
(4)接种4周后,处死裸鼠,测量肿瘤的瘤重及体积;
(5)将取下的瘤体标记,4%多聚甲醛固定,脱水、石蜡包埋、切片并进行病理染色,检测不同处理组中ZEB1及ATM的表达情况。
本发明的优点和积极效果:ZEB1/P300/PCAF复合物对ATM的转录激活作用,提供了促进乳腺癌化疗敏感性的新应用。利用这一机理,可以设计特定的靶向治疗方案,并可以应用于相关药物的制备(Le-shZEB1,Le-shATM),对患者实施精准的个体化治疗。通过将化疗药物和ZEB1抑制剂联合应用,可以解决乳腺癌的化疗耐药问题。
附图说明
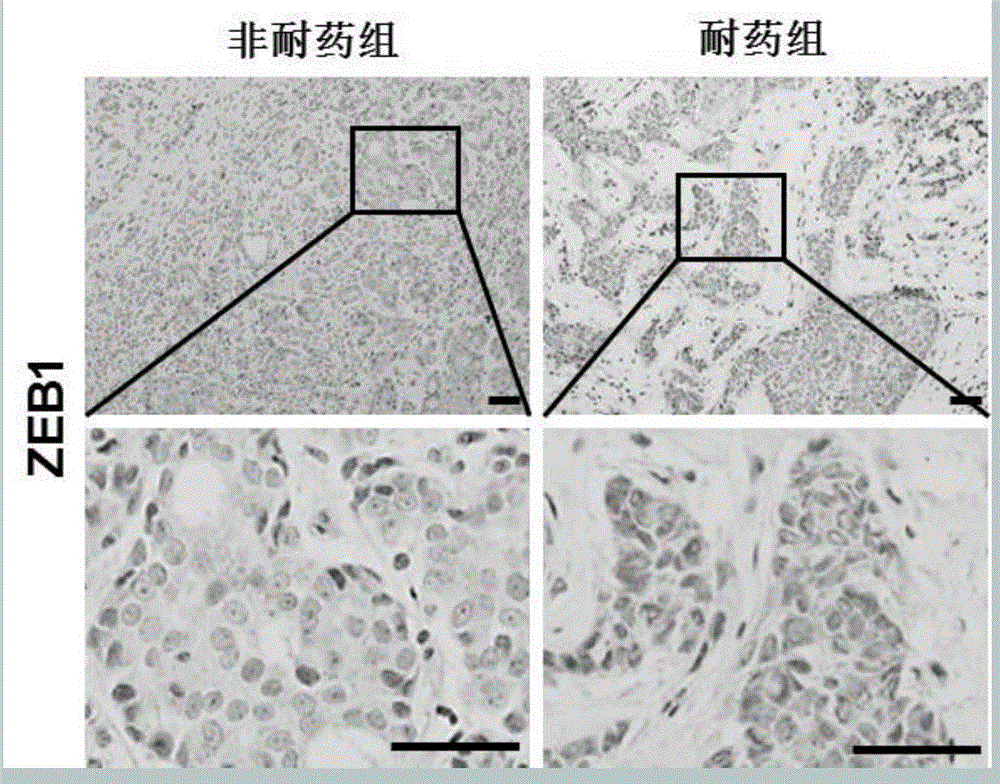
图1ZEB1在乳腺癌耐药组织和非耐药组织中的表达;
图2ZEB1过表达稳定细胞系的构建;
图3ZEB1过表达降低了化疗药物对乳腺癌细胞的损伤;
图4ZEB1过表达减弱了乳腺癌细胞对化疗药物的敏感性;图中,A表柔比星组(EPI),B依托泊苷组(ETOP);
图5Le-shZEB1处理后对乳腺癌细胞ZEB1表达的影响;
图6Le-shZEB1增加了乳腺癌细胞对化疗药物的敏感性;图中,A表柔比星组(EPI),B依托泊苷组(ETOP);
图7ZEB1转录调控ATM的模式图;
图8ZEB1与P300、PCAF形成复合物的关系图;
图9Le-shATM的构建及验证;
图10Le-shATM增加乳腺癌细胞对表柔比星的化疗敏感性;
图11转录因子ZEB1在制备促进乳腺癌化疗敏感性的药物中的应用的模式图。
具体实施方式
实施例1
ZEB1与乳腺癌化疗耐药密切相关
(1)收集接受标准新辅助化疗的乳腺癌病例的组织样本,共233例,采用WHO化疗疗效评价标准进行化疗疗效评估,其中,耐药病例69例,非耐药病例164例并进行免疫组织化学染色;
(2)烘片:先将组织切片置于65℃烘箱烘烤2h,取出后冷却至室温;
(3)在通风橱中准备好脱蜡所需试剂,将组织切片依次放于二甲苯I10min,二甲苯II 10min,无水乙醇I 5min,无水乙醇II 5min,95%乙醇10min,80%乙醇10min,然后在摇床上用TBST洗,5min,2次,100rpm;
(4)抗原修复并以3%H2O2去除内源性过氧化氢;
(5)5%山羊血清室温封闭组织1h;
(6)孵育ZEB1一抗,4℃过夜;
(7)将组织切片从冰箱中取出放置至室温,用TBST洗,10min,3次,100rpm,滴加配好的二抗至覆盖全部组织,室温孵育2h;
(8)将组织用TBST洗,10min,3次,100rpm,将HRP-生物素偶联的三抗滴加到组织上至覆盖全部组织,室温孵育1h;
(9)DAB显色,苏木素染核;
(10)将组织从自来水中取出,在通风橱中依次放入80%乙醇5min,95%乙醇5min,无水乙醇I 5min,无水乙醇II 5min,二甲苯I 5min,二甲苯II 5min,封片观察。
按照ZEB1着色强度,对其进行评分,比较耐药组和非耐药组中ZEB1的表达差异,结果如图1所示,ZEB1在化疗耐药的乳腺癌组织中的表达要显著高于其在非耐药组织中的表达。
实施例2
ZEB1过表达乳腺癌稳定细胞系的构建
(1)通过分子生物学的方法克隆人ZEB1基因CDS全长;
(2)PCR扩增并回收克隆产物;
(3)将回收产物连接至载体质粒pLV-EF1-MCS-IRES-Bsd,双酶切鉴定,并测序,以保证所构建的目的载体的正确;
(4)将上述构建成功的目的质粒,利用Letivirus系统进行病毒包装,并测定病毒滴度;
(5)用包装好的病毒转染人乳腺癌细胞MDA-MB-231,转染48h后,加入10μM的BSD进行稳定株筛选,最终筛选得到ZEB1过表达的稳定细胞系。
ZEB1过表达效率通过Western blot方法进行验证(图2),该稳定细胞系的成功构建,为进一步机理的探讨提供了重要的工具。同时,ZEB1过表达后,化疗药物对乳腺癌细胞造成的损伤减弱,乳腺癌细胞对化疗药物敏感性降低(图3,图4)
实施例3
Le-shZEB1的制备
(1)在线设计并合成ZEB1shRNA序列;
(2)将ZEB1shRNA序列退火后(95℃,5分钟)连接至载体质粒pLV-H1-EF1α-puro上,双酶切鉴定(BamH1,Sac1)目的质粒是否构建成功;
(3)将上述构建成功的目的质粒,利用Letivirus系统进行病毒包装,并测定病毒滴度,构建Le-shZEB1:
a.将293T细胞以每孔1.0×106个细胞的量铺于6孔板中,待细胞密度达到90%左右时,转染细胞;
b.取一无菌的1.5ml离心管,向其中加入7.5μl Lipofectamine2000和250μl Opti-MEM,温和混匀,室温静置5min;
c.取另一无菌的1.5ml离心管,向其中加入1.5μg构建pLV载体(目的质粒),1.5μg包装质粒(每个包装质粒0.5μg,Gag-pol+Rev+VSV-G)和250μl Opti-MEM,震荡混匀;
d.将Lipo2000组分和质粒组分混合,温和混匀,室温静置20min;
e.移去六孔板内的旧培养基,小心加入1ml新鲜的全培养基,并将上述混合液加入到六孔板中,常规培养12-16小时后换液,每孔加入3ml全培养基;
f.换液24小时后收上清并测定滴度,既为Le-shZEB1。
如图5所示,Le-shZEB1处理乳腺癌细胞MDA-MB-231后,ZEB1的表达明显降低。并且,Le-shZEB1处理后可以增加乳腺癌细胞对化疗药物的敏感性(图6)。
实施例4
ATM启动子截短和E2-box突变体的构建及ZEB1对ATM的转录激活作用
(1)确定ATM启动子序列并进行分析,发现ATM启动子距离转录起始位点(Tss)-849bp的位置,存在一个ZEB1可能结合的E2-box序列(GAGGTG);
(2)分别克隆ATM启动子不同的截短序列(1.5kb,0.9kb,0.4kb),以及ATM启动子E2-box区突变的突变体(CAGGTG突变为CATATG);
(3)将上述构建成功的截短及突变和ZEB1表达质粒同时瞬时转染至人乳腺癌细胞MDA-MB-231,应用双荧光素酶报告分析系统,检测ZEB1对ATM的转录激活作用。
如图7所示,ZEB1可以转录激活ATM,并且ZEB1是通过与ATM启动子的E2-box结合,进而发挥了对ATM的激活作用。
实施例5
ZEB1/P300/PCAF复合物的确定
实施例4中已证明ZEB1可以结合ATM启动子的E2-box并激活ATM。通过免疫共沉淀技术(Co-Immunoprecipitation,CoIP)进一步确定两个共激活因子,P300和PCAF可以与ZEB1形成复合物,共同激活ATM,结果见图8,图11。
(1)收获细胞后提取蛋白并定量;
(2)取1mg蛋白至EP管,用RIPA将蛋白体积补加到600-800μl,留取部分蛋白溶液作为Input;
(3)取10μl重悬的ProteinA/G和2μg与目的抗体同种属来源的IgG加到EP管中;将EP管置于微型漩涡混合仪上,4℃旋转1h;
(4)将EP管置于磁力架上,将上清转移至新的EP管中并加入2μg目的一抗(ZEB1,P300,PCAF),置于4℃旋转2h,然后加入20μl ProteinA/G旋转过夜;
(5)将上述步骤中的磁珠用PBS轻轻洗涤三次,加入10μl 1×SDS PAGE Loading Buffer,于99℃金属浴10min;
(6)第二天,弃上清,将磁珠用1ml PBS洗涤三次,加入20μl 1×SDS PAGE Loading Buffer,于99℃金属浴10min;
(7)Western blot验证。
实施例6
基于ZEB1对ATM的调控机制制备Le-shATM
在实施例3中构建的稳定细胞系的基础上,应用shRNA基因沉默技术使ATM表达沉默,并利用CCK8的方法检测ATM沉默后对ZEB1介导的化疗耐药的逆转作用。如图10所示,ZEB1过表达可以显著降低表柔比星对乳腺癌细胞MDA-MB-231的抑制率,而在此基础上联合应用Le-shATM后,表柔比星对MDA-MB-231的抑制率增加,细胞对化疗药物的敏感性增加。具体步骤如下:
(1)在线设计并合成ATM shRNA序列;
(2)将ATM shRNA序列退火后(95℃,5分钟)连接至载体质粒pLV-H1-EF1α-puro上,双酶切鉴定(BamH1,Sac1)目的质粒是否构建成功;
(3)将上述构建成功的目的质粒,利用Letivirus系统进行病毒包装,并测定病毒滴度,构建Le-shATM:
a.将293T细胞以每孔1.0×106个细胞的量铺于6孔板中,待细胞密度达到90%左右时,转染细胞;
b.取一无菌的1.5ml离心管,向其中加入7.5μl Lipofectamine2000和250μl Opti-MEM,温和混匀,室温静置5min;
c.取另一无菌的1.5ml离心管,向其中加入1.5μg构建pLV载体(目的质粒),1.5μg包装质粒(每个包装质粒0.5μg,Gag-pol+Rev+VSV-G)和250μl Opti-MEM,震荡混匀;
d.将Lipo2000组分和质粒组分混合,温和混匀,室温静置20min;
e.移去六孔板内的旧培养基,小心加入1ml新鲜的全培养基,并将上述混合液加入到六孔板中,常规培养12-16小时后换液,每孔加入3ml全培养基;
f.换液24小时后收上清并测定滴度,既为Le-shATM。
(4)用上述病毒感染实施例2中构建的细胞系,并用嘌呤霉素进行筛选,获得在ZEB1过表达基础上ATM表达沉默的稳定细胞系(图9);
(5)CCK8方法检测,ATM表达沉默后表柔比星对乳腺癌细胞的抑制作用,联合应用Le-shATM后,表柔比星对MDA-MB-231的抑制率增加(图10)。
- 还没有人留言评论。精彩留言会获得点赞!