一种替格瑞洛复方口服固体制剂的制备方法与流程
本发明属于制药工业领域,具体涉及一种替格瑞洛复方口服固体制剂的制备方法,具体地,为分别制备替格瑞洛颗粒或微丸或片,以及阿司匹林或其药学上可接受的盐或酯的肠溶颗粒、肠溶微丸或肠溶片,按比例混合装袋、或装胶囊或压片以达到替格瑞洛和阿司匹林或其药学上可接受的盐或酯在复方制剂产品中不直接接触而增加稳定性的目的。
背景技术:
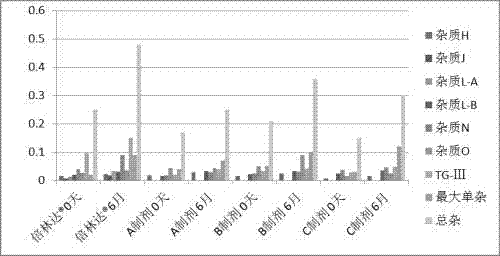
:急性冠状动脉(冠脉)综合征(acutecoronarysyndrome,acs)是临床上常见的心血管急症之一,病死率和发病率极高,临床上已经将抗血小板聚集的药物列为治疗acs的常规用药。替格瑞洛(ticagrelor)又名替卡格雷,是一种选择性p2y12受体抑制剂,通过抑制新血凝块的形成,帮助患者降低动脉粥样化血栓形成事件的发生。替格瑞洛的化学名称为(1s,2s,3r,5s)-3-[7-{[(1r,2s)-2-(3,4-二氟苯)环丙基]氨基}-5-(丙基硫氧嘧啶)-3h-[1,2,3]-三唑磷[4,5-d]嘧啶-3-基]-5-(2-羟乙基)环戊烷-1,2-二醇,分子式:c23h28f2n6o4s,分子量:522.57,分子结构式为:替格瑞洛为结晶性粉末,在水中不溶,室温下水中的溶解度为10~20μg/ml,低溶低渗,bcs中被列为第四类;熔点为140~142℃,具有多晶型,根据专利保护中的晶型熔点,判断为晶型iv;2010年12月获得欧盟批准,用于成年急性冠状动脉综合征(acs)患者动脉粥样硬化血栓形成事件预防。2011年1月替格瑞洛正式在欧盟所有成员国销售,商品名为brilique,其规格是90mg/片,60片装。2011年7月20日,阿斯利康宣布fda已批准替格瑞洛用于减少急性冠脉综合征(acs)患者的心血管死亡和心脏病发作。加上这次获得fda的批准,替格瑞洛如今已在41个国家获准上市,并纳入了其中7个国家(如英国)的医疗补偿范围。替卡格雷(替格瑞洛)是化学结构为环戊三唑磷嘧啶的第一个口服、作用可逆的adp受体拮抗剂,可直接作用于p2y12受体,无需代谢激活。研究显示,替卡格雷与氯吡格雷相比,能明显降低患者心梗、卒中或心血管死亡等首要终点事件,而严重出血并发症没有增加.替卡格雷为非前体药,无须经肝脏代谢激活即可直接起效,与p2y12adp受体可逆性结合。plato研究结果显示,替卡格雷治疗12个月在不增加主要出血的情况下,较氯吡格雷进一步显著降低acs患者的心血管死亡/心肌梗死/卒中复合终点事件风险达16%,同时显著降低心血管死亡达21%。替卡格雷和氯吡格雷的作用方式不同,氯吡格雷对血小板造成不可逆转影响,血小板在一周内都维持原状,但停止替卡格雷治疗后,该作用被很快减弱或逆转,两天内血小板会上升。这种差异对手术中病人过量出血是非常重要的。快速逆转后更适合冠状动脉搭桥手术用药,或拥有多支血管病变并可能会接受旁路手术患者。替格瑞洛是一种口服抗血小板药物,具有良好的临床疗效和安全性,对acs患者抗血小板治疗十分有益。因此,美国心脏病学会基金会和美国心脏协会经皮冠状动脉介入治疗指南推荐替格瑞洛可作为拟行经皮冠状动脉介入治疗患者的抗血小板治疗选择(推荐级别ib)。2012年美国心脏病学会基金会和美国心脏协会不稳定型心绞痛和非st段抬高型心肌梗死治疗指南推荐替格瑞洛可作为氯吡格雷的替代药物(推荐级别ib)。阿司匹林(aspirin)也叫乙酰水杨酸,化学名称为:2-(乙酰氧基)苯甲酸,分子化学式为:c9h8o4,分子量为:180.16,分子结构式为:阿司匹林是一种白色结晶或结晶性粉末;无臭或微带醋酸臭味,味微酸;微溶于水,溶于乙醇、乙醚、氯仿,也溶于氢氧化碱溶液或碳酸溶液,同时分解。阿司匹林的稳定性较差,高湿条件下易水解成水杨酸和乙酸。分子结构中含有酯键,易水解成水杨酸,酸碱均能催化水解反应。阿司匹林为非甾体抗血小板治疗中最常用的药物之一,已经被确立为治疗急性心肌梗死(ami),不稳定心绞痛及心肌梗死(mi)二期预防的经典用药,可抑制血小板凝集,有效阻止血栓形成。其作用机制主要通过选择性抑制环氧化酶1(cox-1),从而阻止血栓素a2的形成,进而阻止血小板聚集和释放反应。欧洲心脏病学会(esc)2012年关于高急性心肌梗死(stemi)诊断指南中i类推荐a级证据表明:接受pci治疗的患者,推荐使用阿司匹林与替格瑞洛联合或阿司匹林与普拉格雷联合的dapt治疗,其疗效优于阿司匹林与氯吡格雷联合。临床研究也表明,替格瑞洛联合阿司匹林治疗能够显著降低acs患者的发病率和病死率,减少心血管疾病的发生。在pegasus-timi54研究共纳入了21162例心梗发病在1~3年内的患者。全部患者接受低剂量(75~150mg)阿司匹林治疗,并按1:1:1比例随机分配使用替格瑞洛90mg、替格瑞洛60mg和安慰剂,2次/天。主要疗效终点是心血管死亡、心梗或卒中的复合终点。主要安全终点是timi大出血事件。平均随访33个月。数据显示,3年时替格瑞洛90mg组的主要疗效终点事件发生率为7.85%,替格瑞洛60mg组为7.77%,安慰剂组9.04%。与安慰剂组相比,替格瑞洛90mg组(hr=0.85;95%ci,0.75~0.96)与60mg组(hr=0.84;95%ci,0.74~0.95)的主要疗效终点发生风险较低。加用替格瑞洛后,终点事件曲线在早期开始分离,随着时间推移继续分离,进一步表明阿司匹林与替格瑞洛联用长期双抗治疗能够使心梗患者获益的观点是正确的。国内临床研究结果[中国医药导报,2014;16(8):1243-1246]也提示,与单独使用阿司匹林相比较,替格瑞洛联合阿司匹林组治疗后临床疗效总有效率和心电图改善均显著高于单独阿司匹林组,差异有统计学意义(p<0.05),而两组均未出现严重不良反应,均未中断治疗,说明替格瑞洛联合阿司匹林能够显著改善acs临床疗效和体征,治疗效果显著。在currentoasis7研究中,研究人员纳入超过25000名acs患者,比较低剂量阿司匹林(75~100mg)与高剂量(≥300mg)的疗效,结果表明支架植入后第一个月,两种剂量在缺血性事件和主要出血方面作用相仿,但低剂量组次要出血发生率较低。于是,2013美国st段抬高型心肌梗死(stemi)指南推荐阿司匹林维持剂量为81~325mg,并指出与替格瑞洛联用时,阿司匹林最佳维持剂量为81mg。而2014欧洲心肌血运重建指南明确指出阿司匹林维持剂量为75~100mg。中国专利cn104434931a公开了一种包含替格瑞洛和阿司匹林的复方口服固体剂,每单位制剂中替格瑞洛的含量选自80~180mg,优选80~100mg;每单位制剂中阿司匹林或其药学上可接受的盐或酯的含量选自50~120mg,优选70~100mg。据临床研究报道,替格瑞洛维持治疗acs,患者需每日服用2次,与替格瑞洛联用时,阿司匹林维持剂量大于100mg会降低替格瑞洛减少复合终点事件的临床疗效,故阿司匹林与替格瑞洛联用时,其维持日剂量不能超过100mg。故此专利中所描述的组方在临床应用中,不具合理性。本专利公开了一种含替格瑞洛的复方口服固体制剂,每单位制剂中替格瑞洛的含量选自60~180mg,优选60~90mg;每单位制剂中阿司匹林或其药学上可接受的盐或酯的含量选自选自35~75mg,优选35~50mg。按替格瑞洛片的说明书,替格瑞洛的日维持治疗剂量为180mg或120mg(fda批准用药治疗一年后的维持剂量),每日分两次口服,如服用本专利的复方口服固体制剂,也需服用每日2次,相当于替格瑞洛的日维持治疗剂量为180mg或120mg,与批准的服用剂量一致;同时阿司匹林的日服用剂量则为70~100mg,与2014欧洲心肌血运重建指南明确指出阿司匹林维持剂75~100mg一致。阿司匹林的稳定性较差,高湿条件下易水解成水杨酸和乙酸。分子结构中含有酯键,易水解成水杨酸,酸碱均能催化水解反应。而替格瑞洛是碱性药物(pka=12.94),两者直接接触会导致乙酰水杨酸的降解,出现稳定性降低的问题,从而影响用药有效性和安全性。中国专利cn104434931a公开了一种包含替格瑞洛和阿司匹林的复方口服固体剂制备方法,主要通过包衣、分开制粒或分开混合使得替格瑞洛和阿司匹林在最终固体剂产品中不直接接触。工艺主要为将阿司匹林和适宜的辅料混合,制粒或包衣;再将替格瑞洛和适宜的辅料混合均匀,再将两部分混合制备成成品。但颗粒或包衣并不能完全隔绝两组分的暴露接触,而且颗粒包衣的难度很大,工艺可行性难度较大。本专利公开一种含替格瑞洛的复方口服固体制剂的制备方法为分别制备替格瑞洛颗粒或微丸或片,以及阿司匹林或其药学上可接受的盐或酯的肠溶微丸或肠溶片,按比例混合装袋、或装胶囊或压片,使替格瑞洛和阿司匹林或其药学上可接受的盐或酯在复方制剂产品中充分隔离开,不直接接触从而增加稳定性的目的。由于替格瑞洛在水中不溶,室温下水中的溶解度为10~20μg/ml。属于生物药剂学分类系统(bcs)iv类药物,其溶解度和渗透性都很低,溶出是吸收的限速过程,口服生物利用度低,很可能因血药浓度过低导致给药方案失败。本发明通过万能粉碎机、球磨机、气流粉碎机等粉碎手段将替格瑞洛原料药粉碎至的粒度要求为d90<85μm,优选d90为5~50μm,更优选d90为5~30μm,大大提高了替格瑞洛的溶出速率,提高其口服生物利用度。阿司匹林口服具有胃刺激性,研究显示常规使用时胃肠道副作用的发生率会增加。本发明的复方口服固体制剂将阿司匹林制备成肠溶制剂,大大有助于防止服用乙酰水杨酸治疗的患者发生胃部不适或刺激,减少其不良反应的发生。本发明所述的含替格瑞洛和阿司匹林的复方口服固体制剂可以提高疗效,减少单一药用量过大而引起的药物不良反应,改善患者的服药顺应性,增加用药安全。技术实现要素:本发明的目的在于提供一种含替格瑞洛的复方口服固体制剂,进一步地,本发明的目的还在于提供一种避免替格瑞洛和阿司匹林直接接触而保持固体制剂的稳定性的复方口服固体剂的制备方法。本发明中公开的一种含替格瑞洛的复方口服固体制剂,每单位制剂中替格瑞洛的含量选自60~180mg,优选60~90mg;每单位制剂中阿司匹林或其药学上可接受的盐或酯的含量选自35~75mg,优选35~50mg。本发明进一步公开的一种含替格瑞洛的复方口服固体制剂的制备方法中,替格瑞洛原料药的粒度要求为d90<85μm,优选d90为5~50μm,更优选d90为5~30μm.主要通过万能粉碎机、球磨机、气流粉碎机等粉碎手段以达到要求。本发明进一步公开了一种含替格瑞洛的复方口服固体制剂的制备方法,主要通过分别制备替格瑞洛颗粒或微丸或片,以及阿司匹林或其药学上可接受的盐或酯的肠溶颗粒、肠溶微丸或肠溶片,再按比例混合装袋、或装胶囊或压片,其步骤如下:a.阿司匹林肠溶制剂的制备:将阿司匹林与丸芯材料混匀,使用含药微丸制备方法制备成活性药物丸芯,然后再将活性药物小丸进行薄膜包衣,再进行肠溶包衣,制成阿司匹林肠溶微丸;或将阿司匹林上药到空白丸芯上制成上药层小丸,然后再将上药小丸进行薄膜包衣,再进行肠溶包衣,制成阿司匹林肠溶微丸;或将阿司匹林与适宜的辅料混匀后制粒,压成小片,先包隔离薄膜包衣再包肠溶衣,制成肠溶片;b.替格瑞洛固体制剂的制备:将替格瑞洛与丸芯材料混匀使用含药微丸制备方法,制备成活性药物丸芯,然后再将活性药物小丸进行隔离薄膜包衣,制成替格瑞洛微丸;将替格瑞洛上药到空白丸芯上,再对上药小丸进行隔离薄膜包衣得替格瑞洛微丸;或将替格瑞洛与适宜的辅料混匀后制粒,制成替格瑞洛颗粒;或将替格瑞洛与适宜的辅料混匀后制粒,压成小片,制成替格瑞洛片;c.混合将两者颗粒或微丸按一定比例混匀、再添加外加辅料混匀;d.采用适合的模具制备成品将两者的颗粒或微丸混合物灌装成颗粒剂、胶囊,或压成整片、或双层片或内外核片。或将两者的小片灌装于胶囊中,成胶囊剂;或无需混合步骤,利用全自动胶囊填充机直接将两者微丸或微丸+颗粒灌装胶囊中,成胶囊剂。本发明的步骤a和b的活性药物丸芯或空白丸芯的制备方法为流化床技术、旋转式制丸、离心-流化床包衣、挤出-滚圆法、旋转切割式制粒机制备、液中干燥法、球形结晶技术、振动喷嘴成型技术的任一种方法。本发明的步骤a和步骤b的空白微丸上药方法为粉末上药法、溶液上药法的任一种方法。本发明步骤a和步骤b的包衣制备方法为流化床包衣技术、包衣锅包衣、离心-流化床造粒锅包衣、多孔离心装置包衣、压制包衣的任一种方法,优选为流化床包衣和高效包衣锅包衣。本发明的步骤a的阿司匹林片的制备方法为湿法制粒、干法制粒、直接压片的任一种,优选为干法制粒和直接压片。本发明的步骤b的替格瑞洛颗粒或片的制备方法为湿法制粒、干法制粒、热熔挤出制粒的任一种,优选为湿法制粒。本发明所述丸芯材料包括稀释剂、粘合剂、崩解剂、润湿剂;稀释剂为蔗糖、淀粉、微晶纤维素、乳糖、β-环糊精的一种或一种以上的混合物;粘合剂为所述粘合剂为糖浆、淀粉浆、聚乙烯吡咯烷酮、聚乙烯醇、纤维素衍生物(羟丙甲纤维素、羟丙基纤维素、甲基纤维素、羧甲基纤维素钠)的一种或一种以上的混合物;崩解剂为淀粉、羧甲基淀粉钠、交联羧甲基纤维素钠、低取代羟丙基纤维素、交联聚维酮的一种或一种以上的混合物;润湿剂为水、乙醇的一种或一种以上的混合物;所述薄膜包衣材料为薄膜成膜材料和添加剂,所述薄膜成膜材料为糖类、聚乙二醇、聚乙烯醇、羟丙基纤维素、甲基纤维素、乙基纤维素、羟丙甲纤维素、羧甲基纤维素或欧巴代薄膜衣产品的一种或一种以上的混合物,所述添加剂包括增塑剂、遮光剂、着色剂、抗粘剂、防静电剂;增塑剂为甘油、丙二醇、聚乙二醇、苯二甲酸二甲酯(dmp)、苯二甲酸二乙酯(dep)、苯二甲酸二丁酯(dbp)、葵二酸二丁酯(dbs)、甘油三乙酸酯(gta)、柠檬酸三乙酯(tec)、柠檬酸三丁酯(tbc)、乙酰基柠檬酸三乙酯、乙酰基柠檬酸三丁酯(tbac)、蓖麻油的一种或一种以上的混合物;遮光剂为二氧化钛;着色剂为氧化铁;防粘剂包括硬脂酸镁、滑石粉、单硬脂酸甘油酯的一种或一种以上的混合物;所述肠溶包衣材料包括肠溶衣层聚合物、增塑剂、遮光剂、抗粘剂,所述聚合物包括聚丙烯酸树脂型肠溶材料(尤特奇l30d-55、尤特奇l100-55、尤特奇l100、尤特奇s100、尤特奇ne30d、ⅰ号丙烯酸树脂、ⅱ号丙烯酸树脂、ⅲ号丙烯酸树脂)、邻苯二甲酸羟丙基甲基纤维素酯(hpmcp)、乙酸琥珀酸羟丙基甲基纤维素(hpmcas)、聚乙酸苯二甲酸乙烯酯(pvap)、苯二甲酸醋酸纤维素(cap)、乙酸苯三酸纤维素、羧甲基乙基纤维素、邻苯二甲酸纤维素、虫胶的一种或一种以上的溶液或分散液;所述增塑剂为甘油、丙二醇、聚乙二醇、苯二甲酸二甲酯(dmp)、苯二甲酸二乙酯(dep)、苯二甲酸二丁酯(dbp)、葵二酸二丁酯(dbs)、甘油三乙酸酯(gta)、柠檬酸三乙酯(tec)、柠檬酸三丁酯(tbc)、乙酰基柠檬酸三乙酯、乙酰基柠檬酸三丁酯(tbac)、蓖麻油的一种或一种以上的混合物;所述遮光剂为二氧化钛;着色剂为氧化铁;防粘剂为硬脂酸镁、滑石粉、单硬脂酸甘油酯的一种或一种以上的混合物;所述稀释剂为玉米淀粉、预胶化淀粉、乳糖、微晶纤维素、磷酸氢钙、甘露醇、蔗糖、糊精、硫酸钙、二水硫酸钙、碳酸钙、山梨醇的一种或一种以上的混合物;所述粘合剂为糖浆、淀粉浆、聚乙烯吡咯烷酮、聚乙烯醇、纤维素衍生物(羟丙甲纤维素、羟丙基纤维素、甲基纤维素、羧甲基纤维素钠)、聚乙二醇、预胶化淀粉、明胶、蔗糖的一种或一种以上的混合物;所述崩解剂为淀粉、羧甲基淀粉钠、交联羧甲基纤维素钠、低取代羟丙基纤维素、交联聚维酮的一种或一种以上的混合物;所述润滑剂为硬脂酸镁、硬脂酸、滑石粉、微粉硅胶、硬脂酸富马酸钠、氢化植物油、聚乙二醇类(peg4000、peg6000)、十二烷基硫酸钠一种或一种以上的混合物。本发明提供了一种特别优选的含替格瑞洛的复方口服固体制剂的制备方法,与现有技术相比,其显著优点:1)通过将临床常联用治疗的两单方制成复方,明显提高了患者用药的依从性;2)此复方与之前专利报道的同样复方相比,此复方规格设置更加合理,符合临床用药指导;3)本专利中公开的制备方法更加科学、可行、可靠,且环保。附图说明以下,结合附图来详细说明本发明的实施方案,其中:图1为实施案例的样品与倍林达0天与加速6月的溶出度图。图2为实施案例的样品与倍林达0天与加速6月的有关物质图。图3为实施案例的样品与拜阿司匹林0天与加速6月的溶出度图。图4为实施案例的样品与拜阿司匹林0天与加速6月的有关物质图。具体实施方式下面将通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细具体地说明之用,而不应理解为用于以任何形式限制本发明。实施例1(片剂-制剂a)制备方法:a.阿司匹林肠溶片的制备将阿司匹林与微晶纤维素、预胶化淀粉、硬脂酸混合均匀后直接压片;将欧巴代薄膜包衣粉配制隔离包衣层溶液;将尤特奇l30d-55(30%水分散体)中分别加入单硬脂酸甘油酯、柠檬酸三乙酯搅拌均匀,配制成肠溶层溶液。采用高效包衣锅将素片分别包上隔离包衣和肠溶包衣,40℃烘箱干燥24小时即得。b.替格瑞洛颗粒的制备:将替格瑞洛粉碎至粒度d90<85μm,再与甘露醇、磷酸氢钙、羧甲基淀粉钠混合均匀后,以羟丙基纤维素溶液为粘合剂湿法制粒,干燥,再与外加硬脂酸镁混匀,得替格瑞洛颗粒。c.压片以阿司匹林肠溶片为内核,压制替格瑞洛阿司匹林复合片。实施例2(胶囊剂-制剂b)制备方法:a.阿司匹林肠溶微丸的制备将阿司匹林与微晶纤维素混匀,以羟丙甲纤维素和聚维酮为粘合剂,使用挤出滚圆工艺制备成活性药物丸芯。然后将欧巴代薄膜包衣粉配制成薄膜包衣液;将尤特奇l100-55溶解于95%乙醇中,再加入柠檬酸三乙酯搅拌均匀,再将滑石粉的混悬液倒入l100-55溶液中,配制成肠溶层溶液,然后使用流化床喷雾技术分别将薄膜包衣层和肠溶包衣层喷雾到上药小丸上制成阿司匹林肠溶微丸,40℃烘箱干燥24小时即得。b.替格瑞洛微丸的制备:将替格瑞洛粉碎至粒度d90<85μm,然后与微晶纤维素、羧甲基淀粉钠混匀,以羟丙基纤维素为粘合剂,使用挤出滚圆工艺制备成活性药物丸芯。然后将欧巴代薄膜包衣粉配制成薄膜隔离包衣液;后用流化床喷雾技术将薄膜隔离包衣层溶液喷雾到含药小丸上制成替格瑞洛微丸,40℃烘箱干燥24小时即得。c.将两种微丸混合均匀将两者按一定比例混合均匀,再外加润滑剂混合均匀。d.采用适合的模具制备成品将微丸混合物灌装胶囊。实施例3(片剂-制剂c)制备方法:a.空白丸芯的制备微晶纤维素空白丸芯作为空白微丸丸芯。b.阿司匹林肠溶微丸的制备将阿司匹林溶解于聚维酮的乙醇溶液中,配制成含药层溶液。将尤特奇l30d-55(30%水分散体)、尤特奇ne30d(30%水分散体)按比例混匀,再分别加入单硬脂酸甘油酯、柠檬酸三乙酯搅拌均匀,配制成肠溶层溶液。将欧巴代薄膜包衣粉配制薄膜隔离包衣层溶液。采用流化床喷雾技术将含药层溶液喷雾到空白微丸丸芯上制成上药层小丸。然后将隔离层包衣液喷雾至上药小丸上,再喷雾肠溶包衣层制成阿司匹林肠溶微丸,再将隔离层包衣液喷雾至阿司匹林肠溶小丸上起保护肠溶包衣层作用,40℃烘箱干燥24小时即得。c.替格瑞洛微丸的制备:将替格瑞洛粉碎至粒度d90<85μm,然后搅拌混悬在羟丙基纤维素溶液中,配制成含药混悬溶液。将欧巴代薄膜包衣粉配制隔离包衣层溶液。采用流化床喷雾技术将含药层溶液喷雾到空白微丸丸芯上制成含药层小丸。然后用流化床喷雾技术将隔离包衣层溶液喷雾到含药小丸上制成替格瑞洛微丸,40℃烘箱干燥24小时即得。d.将两种微丸以及外加辅料混合均匀将两种微丸按一定比例混合,再外加微晶纤维素、羧甲基淀粉钠和硬脂酸镁混合均匀。e.采用适合的模具制备成品将混合物压成片剂成型。实施案例4:稳定性(替格瑞洛部分)分别取实施案例的样品及参比制剂(倍林达),按化学药物稳定性研究技术指导原则的加速试验(40℃±2℃/75%rh±5%rh)按市售包装条件下考察6个月,按进口注册质量标准进行溶出度检测,溶出条件为中国药典2015版四部0931溶出与释放度检测法第二法(桨法),0.2%(w/v)聚山梨酯80溶液900ml为溶出介质,转速为每分钟75转,检测时间45分钟。表1实施案例的样品与倍林达0天与加速6月的溶出度数据样品0.2%(w/v)聚山梨酯80溶液45分钟倍林达0天91.20倍林达6月87.56制剂a(%)0天93.71制剂a(%)6月91.03制剂b(%)0天92.04制剂b(%)6月88.65制剂c(%)0天95.71制剂c(%)6月95.24通过表1和说明书附图1的结果显示,实施案例与参比制剂-倍林达(阿斯利康制药有限公司生产)0天和加速6月的样品在0.2%(w/v)聚山梨酯80溶液45分钟的溶出度均满足45分钟内至少释放70%的进口注册质量标准,说明实施案例样品在加速6月条件下溶出均保持稳定。分别取实施案例的样品及参比制剂(倍林达),按化学药物稳定性研究技术指导原则的加速试验(40℃±2℃/75%rh±5%rh)按市售包装条件下考察6个月,按质量标准检测其有关物质的变化。表2实施案例的样品与倍林达0天与加速6月的有关物质数据样品杂质h杂质j杂质l-a杂质l-b杂质n杂质otg-ⅲ最大单杂总杂倍林达0天0.0150.0070.0130.0210.040.0260.0960.020.25倍林达6月0.0220.0170.0330.0310.090.0360.150.090.48制剂a0天0.018000.0150.0180.0450.0190.040.17制剂a6月0.028000.0340.0280.0450.0390.070.25制剂b0天0.015000.0230.0240.050.0320.050.21制剂b6月0.025000.0330.0310.090.0420.10.36制剂c0天0.006000.0250.0380.0150.0280.030.15制剂c6月0.016000.0350.0460.0250.0480.120.30从表2和说明书附图2的结果可知实施案例的样品与参比制剂的杂质谱基本一致,6个月加速试验的杂质增长趋势基本一致,样品的总杂量均低于参比制剂,杂质量均符合单杂小于0.2%,总杂小于0.5%的质量标准的限度。表明实施案例的样品在加速条件下放置6个月替格瑞洛保持稳定。实施案例5:稳定性考察(阿司匹林部分)分别取实施案例的样品及参比制剂(拜阿司匹林),按化学药物稳定性研究技术指导原则的加速试验(40℃±2℃/75%rh±5%rh)按市售包装条件下考察6个月。采用中国药典2015版四部0931溶出与释放度检测法第一法(篮法),检测经过0.1mol/l盐酸两小时酸中溶出量以及之后在缓冲液(ph=6.8)中溶出量。表3实施案例的样品与拜阿司匹林0天与加速6月的溶出度数据样品耐酸2小时ph6.8缓冲液45分钟拜阿司匹林0天1.0198.82拜阿司匹林6月3.4595.23制剂a(%)0天1.199.14制剂a(%)6月3.2195.56制剂b(%)0天1.298.34制剂b(%)6月2.4596.86制剂c(%)0天0.9298.75制剂c(%)6月2.2395.16通过表3和说明书附图3结果显示,实施案例与参比制剂-拜阿司匹林(拜耳医药保健有限公司生产)0天和加速6月的样品经过0.1n盐酸两小时耐酸实验后均满足2小时酸中溶出小于10%的质量标准的限度。在缓冲液(ph=6.8)中,均满足45分钟内至少释放80%水杨酸的质量标准,均保持稳定。分别取实施案例的样品及参比制剂(拜阿司匹林),按化学药物稳定性研究技术指导原则的加速试验(40℃±2℃/75%rh±5%rh)按市售包装条件下考察6个月,按质量标准检测其游离水杨酸的变化。表4实施案例的样品与拜阿司匹林0天与加速6月的有关物质数据样品游离水杨酸拜阿司匹林0天0.11拜阿司匹林6月2.31制剂a0天0.19制剂a6月1.88制剂b0天0.12制剂b6月2.46制剂c0天0.13制剂c6月1.42从表4和说明书附图4的结果可知实施案例的样品与参比制剂6个月加速试验的游离水杨酸的含量增长趋势基本一致,游离水杨酸的含量均小于3%的usp质量标准的限度。表明实施案例的样品在加速条件下放置6个月的阿司匹林保持稳定。实施案例6:溶出曲线(替格瑞洛部分)分别取实施案例的样品及参比制剂(倍林达),进行溶出曲线检测,溶出条件为中国药典2015版四部0931溶出与释放度检测法第二法(桨法),溶出介质:0.2%(w/v)聚山梨酯80溶液900ml、0.2%聚山梨酯80的盐酸溶液(ph1.2)900ml、0.2%聚山梨酯80的磷酸盐缓冲液(ph4.5)、0.2%聚山梨酯80的磷酸盐缓冲液(ph6.8)为溶出介质,转速为每分钟75转,检测时间为5、10、15、30、45、60、90、120分钟。测定方法:hplc评价方法:根据《普通口服固体制剂溶出度试验技术指导原则》中所述“分别取受试(变更后)和参比产品(变更前)各12片(粒),测定其溶出曲线;取两条曲线上各时间点的平均溶出度值,根据公式计算相似因子(f2);f2值越接近100,则认为两条曲线相似。一般情况下,f2值高于50,可认为两条曲线具有相似性,受试(变更后)与参比产品(变更前)具有等效性。。f2=50·log{[1+(1/n)∑nt=1(rt-tt)2]-0.5100}上述公式中n为时间点(n≥3),rt为参比样品(或变更前产品)在t时刻的溶出度值,tt为试验批次(变更后样品)在t时刻的溶出度值。如果药物在15min内溶出均达到85%以上,可以认为产品溶出行为是相似的,不需要通过统计学方法对数据分析判定。表50.2%(w/v)聚山梨酯80水介质中的累积溶出曲线时间(min)5101530456090120f2倍林达(%)61.775.580.988.391.292.994.495.4/制剂a(%)54.069.178.190.493.795.197.496.663制剂b(%)54.272.479.589.79496.6979768制剂c(%)5370.782.390.594.795.796.897.564注:f2取5、10、15、20min等溶出点与市售品比较表60.2%聚山梨酯80的盐酸溶液(ph1.2)的累积溶出曲线时间(min)5101530456090120f2倍林达(%)58.673.279.187.891.192.795.095.7/制剂a(%)63.077.484.792.996.597.697.497.565制剂b(%)63.570.787.093.796.798.597.598.262制剂c(%)60.165.685.394.997.598.698.599.260注:f2取5、10、15、20min等溶出点与市售品比较表70.2%聚山梨酯80的磷酸盐缓冲液(ph4.5)的累积溶出曲线时间(min)5101530456090120f2倍林达(%)59.574.480.788.692.594.495.696.4/制剂a(%)59.376.984.094.798.698.9100.8100.671制剂b(%)62.373.786.795.7100.0101.3102.5103.065制剂c(%)53.167.984.194.497.198.499.299.062注:f2取5、10、15、20min等溶出点与市售品比较表80.2%聚山梨酯80的磷酸盐缓冲液(ph6.8)的累积溶出曲线时间(min)5101530456090120f2倍林达(%)56.771.878.287.390.692.394.295.1/制剂a(%)53.963.181.493.397.598.8100.5100.262制剂b(%)58.178.983.896.098.9100.9102.4102.760制剂c(%)57.177.485.996.9100.1102.4103.2104.458注:f2取5、10、15、20min等溶出点与市售品比较结果显示:实施案例的样品与参比制剂(倍林达)在四种溶出介质中的溶出曲线的相似因子f2值均大于50,两者溶出曲线相似。实施案例7:溶出曲线(阿司匹林部分)分别取实施案例的样品及参比制剂(拜阿司匹林),进行溶出曲线检测,溶出条件为中国药典2015版四部0931溶出与释放度检测法第一法(篮法),溶出介质:检测经过600ml0.1mol/l盐酸两小时酸中溶出量以及之后在缓冲液(ph=6.8)800ml中溶出量。转速为每分钟100转,检测时间为酸中2小时、ph6.8介质中为5、10、15、30、45、60分钟。测定方法:hplc评价方法:根据《普通口服固体制剂溶出度试验技术指导原则》中所述“分别取受试(变更后)和参比产品(变更前)各12片(粒),测定其溶出曲线;取两条曲线上各时间点的平均溶出度值,根据公式计算相似因子(f2);f2值越接近100,则认为两条曲线相似。一般情况下,f2值高于50,可认为两条曲线具有相似性,受试(变更后)与参比产品(变更前)具有等效性。。f2=50·log{[1+(1/n)∑nt=1(rt-tt)2]-0.5100}上述公式中n为时间点(n≥3),rt为参比样品(或变更前产品)在t时刻的溶出度值,tt为试验批次(变更后样品)在t时刻的溶出度值。如果药物在15min内溶出均达到85%以上,可以认为产品溶出行为是相似的,不需要通过统计学方法对数据分析判定。表9在0.1mol/l盐酸释放2小时后在ph6.8磷酸盐缓冲液时间(min)051015304560f2拜阿司匹林(%)1.010.644.513.290.198.8102.3/制剂a(%)1.12.346.5217.493.399.1100.275制剂b(%)1.21.2310.2120.196.098.398.963制剂c(%)0.921.527.1215.996.998.899.870注:f2取5、10、15、20、30、45min等溶出点与市售品比较结果显示,实施案例与参比制剂-拜阿司匹林(拜耳医药保健有限公司生产)经过0.1n盐酸两小时耐酸实验后均满足2小时酸中溶出小于10%的质量标准的限度,而且与参比制剂酸中溶出量相当,均较少(小于2.0%)。在缓冲液(ph=6.8)中,相似因子f2值均大于50,两者溶出曲线相似。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1