抗菌肽与抗生素组合抗菌药物及其使用方法与流程
本发明属于生物医药领域,主要涉及一种抗菌肽与抗生素组合的抗菌药物及其使用方法。
背景技术:
抗生素是用于预防和治疗细菌感染的药物。抗生素的出现,拯救了无数生命,但是细菌对于抗生素产品的耐药性问题也逐年加重,新药研发的速度远跟不上细菌耐药的速度,抗生素耐药性会导致更高的医疗费用,更长的住院时间和更多死亡。抗生素耐药性是指引起感染的普通细菌所出现的对抗生素的耐药性,它在细菌对使用该类药物发生反应并改变时出现,一般是由于耐药基因导致的这种变化。
据世界卫生组织报告,仅在欧盟地区,仅在2014年耐药细菌估计就造成了25000例死亡,每年因此发生的卫生保健支出和生产力损失超过了15亿美元。因此急需改变开处方和使用抗生素的方法。
在常见菌种如金黄色葡萄球菌对于抗生素的耐药性日益严重的当今,生物体产生的抗菌肽类物质因其能够在几千年中仍保有杀菌抗菌作用而被选为抗菌药物的后备军。抗菌肽也称为宿主防御肽,具有广谱高效杀菌活性,对革兰氏阴性菌、革兰氏阳性菌、真菌、病毒及癌细胞等均具有强有力的杀伤作用,其作用机制包括抑制细菌细胞壁的合成、破坏细胞膜,激活自溶酶,抑制dna、rna和蛋白质的合成等。研究表明很少有细菌对抗菌肽有耐药性,现在已经有一些抗菌肽在临床上研究使用。
中国专利申请201410241068.9《抗菌肽抗菌活性预测方法及抗菌肽》中公开了人工设计的dp系列抗菌肽,其序列为v-q-w-r-i-r-x1-x2-v-i-r-x3,其中x1=i或v,x2=a或c,x3=a、r或k;或者:v-q-l-r-i-r-v-x4-v-i-r-x5,其中x4=a或c,x5=r或k。dp系列抗菌肽具有很好的广谱抗菌活性,尤其是氨基酸序列为vqwrirvavirk(seqno.4)的dp7,对革兰氏阳性菌、革兰氏阴性菌、真菌具有很好的抗菌活性,并且对真核细胞具有较低的毒性以及较低的溶血效应。如何能进一步提高dp系列抗菌肽的抗菌活性,尤其是使使细菌更难产生耐药性,以及对耐药细菌具有更好的抗菌作用,是本领域的难题。
技术实现要素:
本发明要解决的技术问题是为本领域的抗感染治疗提供一种新的有效选择。本发明解决上述技术问题的技术方案是提供了一种抗菌药物。该抗菌药物包括抗菌肽与抗生素作为主要活性成分。
其中,上述抗菌药物中所述的抗菌肽具有如下所示的氨基酸序列:
v-q-w-r-i-r-x1-x2-v-i-r-x3,其中x1=i或v,x2=a或c,x3=a、r或k;
或者:
v-q-l-r-i-r-v-x4-v-i-r-x5,其中x4=a或c,x5=r或k;
或者为上述序列多肽的碳末端进行了酰胺化和/或氮末端进行了乙酰化的衍生物中的至少一种。
进一步的,上述抗菌药物中所述的抗菌肽的氨基酸序列选自序列表中seqidno.1~seqidno.16中的至少一条。
其中,上述抗菌药物中所述的抗生素为糖肽类抗生素、氨基苷类抗生素、大环内脂类抗生素、β-内酰胺类抗生素中的至少一种。
其中,上述抗菌药物中所述的β-内酰胺类抗生素为青霉素类抗生素或头孢菌素类抗生素中的至少一种。
进一步的,所述的青霉素类抗生素为青霉素g、青霉素v、氟氯西林、苯唑青霉素、氨苄西林、羧苄西林、匹氨西林、磺苄西林、替卡西林、哌拉西林或阿莫西林中的至少一种。所述的头孢菌素类抗生素为:头孢羟氨苄、头孢氨苄、头孢唑啉、头孢拉啶、头孢丙烯,头孢呋辛脂、头孢克洛、头孢孟多、头孢噻肟、头孢曲松、头孢克肟、头孢地尼、头孢皮罗、头孢吡肟或头孢唑南中的至少一种。
其中,上述抗菌药物中所述的氨基苷类抗生素为链霉素、庆大霉素、卡那霉素、妥布霉素、丁胺卡那霉素、新霉素、西索米星、妥布霉素、阿米卡星、奈替米星、核糖霉素、小诺霉素或阿斯霉素中的至少一种。
其中,上述抗菌药物中所述的多肽类抗生素为万古霉素、去甲万古霉素、多粘菌素b或替考拉宁中的至少一种
其中,上述抗菌药物中所述的大环内脂类抗生素为红霉素、白霉素、无味红霉素、依托红霉素、乙酰螺旋霉素、麦迪霉素、交沙霉素或阿奇霉素中的至少一种。
进一步的,上述抗菌药物的其剂型为注射剂。
其中,上述抗菌药物中所述的抗菌肽与抗生素处于独立的包装中。
进一步的,上述抗菌药物中所述的独立包装的抗菌肽的剂型为注射剂,抗生素的剂型为口服制剂或注射剂。
同时,本发明还提供了一种抗菌方法。该抗菌方法包括以下步骤:对于非生物物体或者带菌生物体施用有效量的抗菌肽与抗生素,进行抗菌处理。
其中,上述的抗菌方法中抗菌肽具有如下所示的氨基酸序列:
v-q-w-r-i-r-x1-x2-v-i-r-x3,其中x1=i或v,x2=a或c,x3=a、r或k;
或者:
v-q-l-r-i-r-v-x4-v-i-r-x5,其中x4=a或c,x5=r或k;
或者;
为对上述氨基酸序列所示多肽的碳末端进行了酰胺化和/或氮末端进行了乙酰化的衍生物中的至少一种。
进一步的,上述方法中所述抗菌肽的氨基酸序列选自序列表中seqidno.1~seqidno.16中的至少一条。
其中,上述的抗菌方法中所述的抗生素为多肽类抗生素、氨基苷类抗生素、大环内脂类抗生素、β-内酰胺类抗生素中的至少一种。进一步的,各类抗生素的具体种类也如前所述。
其中,上述的抗菌方法中所述的抗菌肽和抗生素为同时或者分时施用。
其中,上述的抗菌方法中所述的抗菌肽和抗生素使用相同或不同的给药途径施用。
进一步的,当对生物体施用时,上述抗菌方法中所述抗菌肽和抗生素施用在生物体的体表和/或体内。
当施用在生物体的体表时,上述抗菌方法中可施用抗菌肽和抗生素在生物体的皮肤和/或毛发处,以用于皮肤和毛发的抗菌。
当施用在生物体的体表时,上述抗菌方法中也能施用抗菌肽和抗生素在生物体表的伤口和/或感染处。
上述抗菌方法中,所述的生物为人或非人的脊椎动物。
本发明开展抗菌肽与抗生素类药物的联合使用研究,以期使其达到协同抗菌作用。但是由于不同的药物往往具有不同的抗菌机制,联合用药与单独用药相比虽然可能使细菌更难产生耐药性,但是哪些药物之间有可能产生协同作用是难以预期的。在大量工作的基础上,本发明创造性地发现dp系列的抗菌肽和抗生素类药物之间能较好的配合使用,且能进一步产生协同作用。
本发明的有益效果在于:本发明抗菌肽抗生素组合药能可有效提高抗菌效果,降低药物尤其是抗生素的使用剂量,减少毒副作用;同时本发明抗菌肽抗生素组合药物,将抗菌肽与抗生素联合使用可有效降低菌株的耐药性,对耐药菌的抗菌效果也有明显的提升,试验证明对已有的耐药株也有良好的杀菌效果,为本领域提供了一种新的有效选择。
附图说明
图1、联合用药的药物在96孔板排版布局示意图。其中的blank是仅有培养基的对照,control是加菌液的培养基,未加药物的对照。
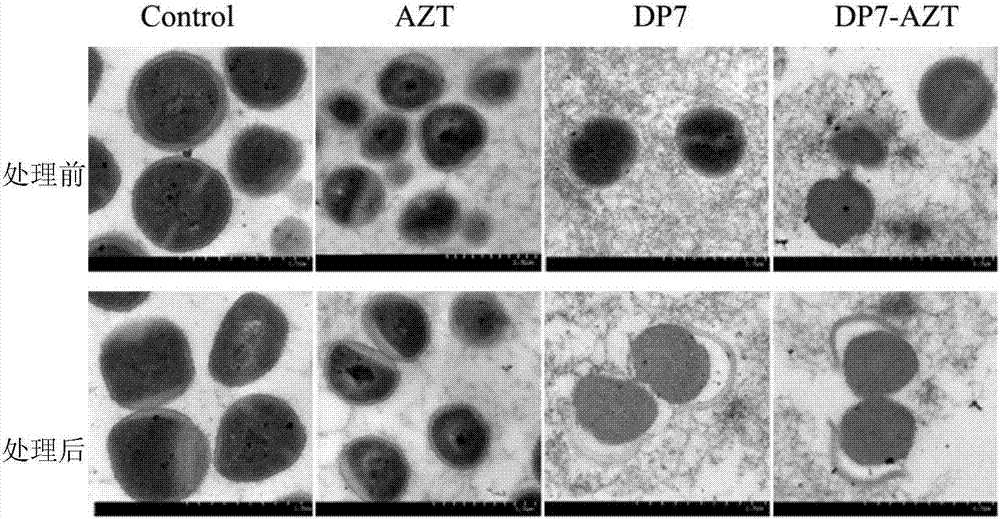
图2、金黄色葡萄球菌耐药株s5375经过不同药物处理后细胞形态的透射电镜图。
具体实施方式
以下将结合附图和实施例详细说明本发明。
实施例1dp7与多种抗生素联用对多种临床分离耐药菌的协同抗菌作用以及与cls001的协同抗菌效果比较:
将抗菌肽dp7(氨基酸序列vqwrirvavirk-nh2,碳末端进行了酰胺化)分别与抗生素药物万古霉素(van)、庆大霉素(gen)、阿奇霉素(azt)和阿莫西林(amo)用棋盘法进行药物联用抑菌实验,并选取了重庆西南医院和四川省疾控中心获得的临床分离耐药金黄色葡萄球菌菌株(sau系列)、临床分离耐药大肠杆菌菌株(eco系列)、临床分离耐药绿脓杆菌菌株(paer系列)和临床分离耐药鲍曼不动杆菌菌株(aba系列)各三株用于联合用药效果测试。同时,本发明选取了目前处于临床iii期评估阶段的抗菌肽药物omiganan(cls001,其氨基酸序列为ilrwpwwpwrrk(seqno.17),并在碳末端进行了酰胺化),代替dp7重复以上的联合用药抗菌实验,以比较cls001和dp7的抗菌效果以及协同抗菌的效果。
1、抗菌肽与抗生素对于临床分离耐药菌的最小抑菌浓度测定
根据临床和实验室标准化协会(clsi)系列文件(m7-a7)指导,使用微量肉汤稀释法测定抗菌药物的最低抑菌浓度(mic)。主要操作方法如下:将细菌涂于mha平板,于37℃培养箱中生长24小时,然后挑取的菌落用mh肉汤系列稀释至1×106cfu/ml,备用;药物用mh肉汤进行等二倍系列稀释,药物浓度范围从512mg/l到0.50mg/l,然后分别加入到96板相应的孔中,每孔加入100μl,每个药物浓度有三个复孔;再向相应板孔中96孔板中加入100μl的5×106cfu/ml细菌;于37℃培养箱中培养20小时后,用酶标仪检测od595波长下的吸光度值,三复孔测得的值取平均值,并计算抑菌率,以抑菌率大于或等于80%的抗菌药物浓度作为其对这种细菌的mic值。抑菌率计算公式如下:
结果见表1,最小抑菌浓度实验表明,大部分实验用的各临床分离耐药菌菌株对庆大霉素和阿莫西林都具有非常严重的耐药性,而阿奇霉素和万古霉素对大部分菌株的抗菌效果也较差,抗菌肽dp7和cls001对所有菌株都有不错的抗菌效果,就整体抗菌效果来说,dp7要稍微优于cls001。
表1.临床分离菌株的mic
(金黄色葡萄球菌菌株、大肠杆菌菌株、绿脓杆菌菌株和鲍曼不动杆菌)
2、抗菌肽与抗生素联用对临床分离耐药菌的协同抗菌作用
抗菌肽与抗生素联合使用的部分抑菌浓度指数(ficis)是通过棋盘肉汤稀释法测定mic后计算得来,可评价两种药物的体外协同抑菌效果。
抗菌肽与抗生素对于临床分离耐药菌的最小抑菌浓度(mic)测定的棋盘法的具体步骤如下:
(1)取需要联用对抗菌药物母液(10mg/ml),然后稀释至4×2倍mic浓度,并配置2倍梯度稀释药液。
(2)按照棋盘法布局混合各个浓度的药液:联合用药孔每孔加每种药物50μl,当药物孔加入药物50μl,培养基50μl,每个药物处理浓度设置二副孔。
(3)除blank孔,每孔加入100μl5×106cfu/ml的待试菌液。每孔的液体体积为200μl,blank孔只含200μl培养基。
(4)将96孔板放置于37℃细菌孵箱培养中,培养20小时后取出用酶标仪测量od595的值,计算各孔的抑菌率。
(5)联合用药的药物在96孔板排版布局如图1所示。
ficis的计算公式如下:
按照棋盘法布局混合各个浓度的药液,取需要联用对抗菌药物母液(10mg/ml),然后稀释至4×2倍mic浓度,并配置2倍梯度稀释药液。联合用药孔每孔加每种药物50μl,单药物孔(对应联用药0×mic)加入药物50μl,培养基50μl,每个药物处理浓度设置二副孔。除blank孔,每孔加入100μl5×106cfu/ml的待试菌液。每孔中液体中体积200μl,blank孔只含200μl培养基。
将96孔板放置于37℃细菌孵箱培养,培养20小时后取出用酶标仪测量od595的值,计算各孔的抑菌率,以抑菌率大于或等于90%的抗菌药物浓度作为其对这种细菌的mic值。
结果见表2,在联合抗菌实验中,dp7与cls001这两种抗菌肽的联用对所有菌株都没有发现协同作用(抑菌浓度指数fici≤0.5表明有协同作用)。抗菌肽dp7与万古霉素联用时,所有菌株中有50%的菌株具协同作用,与庆大霉素、阿奇霉素和阿莫西林联用时有协同作用的菌株比例分别为20%、60%和20%。抗菌肽cls001与万古霉素、庆大霉素、阿奇霉素和阿莫西林联用时有协同作用的菌株比例分别为30%、20%、10%和40%。从整体的协同效果上看,dp7与抗生素联用时的具有协同效果的联合抗菌结果比cls001与抗生素联用时的结果更多。而抗菌肽与抗生素万古霉素和阿奇霉素联用时具有更高的协同抗菌频率。
表2.dp7或cls001与抗生素联用的部分抑菌浓度指数ficis
注:部分抑菌浓度指数fici与协同作用关系:协同作用(fici≤0.5),部分协同作用(0.5<fici<1),无协同作用(1≤fici<4.0),拮抗作用(fici≥4.0)。
实施例2dp7与万古霉素和阿奇霉素联合抗菌的扩大实验
抗菌肽dp7与万古霉素和阿奇霉素联用时,对于金黄色葡萄球菌临床分离耐药菌株和绿脓杆菌临床分离耐药菌株的协同抗菌具有更好的效果,因此我们扩大dp7与万古霉素和阿奇霉素联用抗菌实验的金黄色葡萄球菌临床分离耐药菌和绿脓杆菌临床分离耐药菌的菌株数目以进一步研究协同抗菌效果。
采用实时定量pcr(qpcr)的方法确定临床分离耐药菌菌种的准确性。用dneasyblood&tissuekit(qiagen)提取细菌的总dna,dna浓度用thermoscientificnanodrop2000分光光度仪检测,dna样品的a260吸光度测定的浓度应大于10ng/ml,a260/a280值应大于1.8;用microbialdnaqpcrmulti-assaykits(qiagen)鉴定细菌万古霉素耐药基因和阿奇霉素耐药基因;用qpcr软件计算每个孔的临界循环数(cq值),与阴性对照(ntc)的cq值相比,样品cq值大于ntc-6的结果为阴性,小于ntc-6的结果为阳性。处于阳性和阴性之间的值为没有显著差异。根据cq值,确定临床分离耐药菌,然后进行联合用药实验。
结果见表3,对于金黄色葡萄球菌临床分离耐药菌,抗菌肽dp7与万古霉素联用(dp7–van)有协同作用的占总菌株数量的40%,有部分协同作用的占40%;dp7与阿奇霉素联用(dp7–azt)有协同作用的占总菌株数量的50%。对绿脓杆菌临床分离耐药菌,抗菌肽dp7与万古霉素联用有协同作用的占总菌株数量的50%,有部分协同作用的占20%;然而dp7与阿奇霉素联用有协同作用的只占总菌株数量的10%,有部分协同作用的占30%。
表3.dp7、万古霉素和阿奇霉素对金黄色葡萄球菌临床分离
耐药菌和绿脓杆菌临床分离耐药菌的mic以及联合抗菌效果
实施例3dp7与阿奇霉素的协同作用与阿奇霉素耐药基因之间的联系
综合dp7与阿奇霉素或万古霉素联用时的协同抗菌效果以及各菌株对阿奇霉素或万古霉素的耐药情况,我们采用实时定量pcr(qpcr)的方法,对金黄色葡萄球菌临床分离耐药菌和绿脓杆菌临床分离耐药菌进行了常见的万古霉素耐药基因和阿奇霉素耐药基因的鉴定分析,本实施例涉及到的耐药基因是万古霉素耐药基因(vanb、vanc)和阿奇霉素耐药基因(erma,ermb,ermc,mefa,msra)。
结果见表4和表5、我们从qpcr基因鉴定结果得出,分离得到的金黄色葡萄球菌耐药菌和绿脓杆菌临床分离耐药菌均没有万古霉素耐药基因vanb和vanc(数据没呈现)。针对于阿奇霉素耐药基因,13株金黄色葡萄球菌临床分离耐药菌中有11株携带ermb基因,6株携带ermc基因(同时均携带ermb基因);9株绿脓杆菌临床分离耐药菌中有4株携带erma基因,6株携带ermb基因,6株携带ermc基因;这几种金黄色葡萄球菌临床分离耐药菌和绿脓杆菌临床分离耐药菌均不携带mefa和msra基因。我们对这13株金黄色葡萄球菌临床分离耐药菌和9株绿脓杆菌临床分离耐药菌的耐药性及耐药基因种类数量的统计分析发现,阿奇霉素耐药基因种类越多的菌株,其最低抑菌浓度(mic)越大;然而,绝大多数存在协同作用的耐药菌株都含有两种及以上的耐药基因,阿奇霉素耐药基因种类越多的菌株,其dp7与azt联用的部分抑菌浓度指数(fici)越小,协同作用越好;这些结果表明dp7与阿奇霉素对于金黄色葡萄球菌临床分离耐药菌和绿脓杆菌临床分离耐药菌的协同抗菌作用可能与菌株的耐药基因种类和数量有关。
表4.各个耐药基因菌株在阿奇霉素耐药菌中所占的比例
表5.耐药基因在阿奇霉素耐药菌的分布及dp7与阿奇霉素联用的fici
注:“+”代表cq<ntc-6,鉴定为阳性;“-”代表cq≥ntc-6,鉴定为阴性。
实施例4金黄色葡萄球菌耐药菌s5375被抗菌肽dp7与阿奇霉素处理后的形态学变化
本实例通过对药物处理前后,通过透射电镜来观察细菌形态的变化,说明药物对细菌杀伤的方式。
取对数生长期的金黄色葡萄球菌耐药菌s5375,分组4组(control、dp7、dp7-azt、azt),然后每组用各自药物处理60分钟;900g离心10分钟,获得的沉淀有1m磷酸盐缓冲液洗涤2次;然后2.5%戊二醛/磷酸盐缓冲夜固定细胞,4度过夜;在透射显微镜下拍照。
结果见图2,与control对照组相比,我们发现azt处理后的细胞显示核区颜色变深暗和有清晰的细胞壁,dp7组处理后的细胞的细胞壁发生断裂,dp7-azt组处理后的细胞壁断裂程度比dp7更加严重。这些结果说明了dp7通过破坏细胞壁而杀菌,而azt可能是通过阻断相关蛋白质合成而杀菌。两者通过不同的机理达成了协同的效果。
- 还没有人留言评论。精彩留言会获得点赞!