清热中药组合物联合抗生素在制备抑制炎症因子药物方面的应用的制作方法
本发明涉及医药技术领域,更具体地,涉及一种清热中药组合物联合抗生素在制备抑制炎症因子药物方面的应用。
技术背景
研究发现,感染和炎症发生时,患者体内血浆内毒素、血浆一氧化氮、血浆肿瘤坏死因子大量产生,水平高于正常值。肿瘤坏死因子(TNF-α)是活化单核-巨噬细胞产生的一种重要细胞因子,在感染性疾病和炎症方面,能刺激血管内皮细胞表达黏附分子、刺激单核-巨噬细胞和其他细胞分泌趋化性细胞因子,引起白细胞在炎症部位聚集,促进炎症反应,过度反应的过量TNF-α,则产生剧烈免疫反应,呈现毒性作用,对机体造成损害。一氧化氮(nitricoxide,NO)由巨噬细胞分泌,能和超氧阴离子反应形成过氧亚硝酸阴离子(peroxynitrite,ONOO-),它再分解为毒性更大的OH-和NO2,后者进入靶细胞或邻近细胞,引起细胞毒作用或损伤组织。内毒素(LPS):淋巴细胞作为机体重要的免疫细胞,其可能是通过Toll样受体4(Toll-likereceptor4,TLR4)及核因子κB(NuclearFactorKappaB,NF-κB)途径,合成并释放包括TNF-α及IL-6在内的多种促炎因子,加强炎症反应,使得促炎/抑炎失衡,导致炎症反应扩大化及免疫紊乱。在上述反应途径中,TLR4为内毒素有效成分脂多糖(Lipopolysaccharides,LPS)的特异性配体,可以与LPS结合,启动炎症反应,而NF-κB作为TLR4反应链下游的主要因子,可以与多种促炎因子的基因启动序列相结合,合成和释放相应的炎症因子。
目前未见中药组合物与抗生素联合应用于制备抑制炎症因子的相关技术报道。
技术实现要素:
本发明要解决的技术问题是填补现有中药组合物联合阿奇霉素的应用技术不足,提供一种清热中药组合物联合抗生素在制备抑制炎症因子药物方面的应用。
本发明的目的通过以下技术方案予以实现:
提供清热中药组合物联合抗生素在制备抑制炎症因子药物方面的应用,所述炎症因子包括血浆内毒素、血浆一氧化氮和/或血浆肿瘤坏死因子;所述抗生素为阿奇霉素,所述中药组合物的活性成分由千斤拔、穿心莲、金樱根、功劳木和单面针组成。
优选地,所述清热中药组合物联合阿奇霉素可以很好地应用于制备治疗慢性盆腔炎、子宫炎症和/或卵巢炎症的药物方面。
优选地,所述中药组合物中,穿心莲和单面针的掺入量各为药材总重量的9%;金樱根、功劳木和千斤拔的掺入量各为药材总重量的16%。
优选地,所述应用是将清热中药组合物联合阿奇霉素应用于制备靶向抑制血浆内毒素、血浆一氧化氮和血浆肿瘤坏死因子药物方面。
本发明的有益效果是:
阿奇霉素适用于敏感细菌所引起的感染,包括支气管炎、肺炎等下呼吸道感染,皮肤和软组织感染,急性中耳炎,鼻窦炎、咽炎、扁桃体炎等上呼吸道感染。本发明将其与由千斤拔、穿心莲、金樱根、功劳木和单面针五味药组成的中药组合物联合应用,在抑制炎症因子方面具有良好的应用效果,并通过大量动物实验证明中药组合物和阿奇霉素发挥协同作用,实现靶向治疗感染和炎症,为中药组合物和阿奇霉素的新领域应用提供了有力技术支持。
附图说明
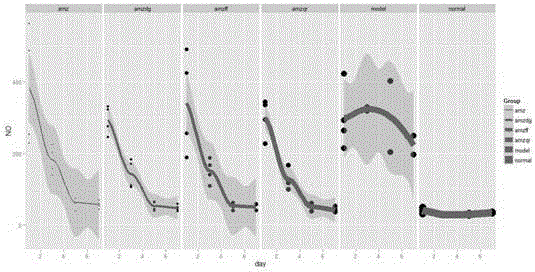
图1药物联合治疗前后血浆内毒素变化情况。
图2药物联合治疗前后血浆一氧化氮变化情况。
图3药物联合治疗前后血浆肿瘤坏死因子变化情况。
图4检测NO用的NaNO2标准液的稀释步骤示意图。
具体实施方式
下面结合具体实施例进一步说明本发明。下述实施例仅用于示例性说明,不能理解为对本发明的限制。除非特别说明,下述实施例中使用的原料为常规市购或商业途径获得的原料,除非特别说明,下述实施例中使用的方法和设备为本领域常规使用的方法和设备。
实施例1
1.实验菌种:金黄色葡萄球菌(ATCC25923),大肠埃希菌(ATCC25922)购买于中国国家菌种库。受试菌株冻干粉用无菌M-H(B)培养基混悬后均匀铺于无菌M-H(A)平板表面,35℃孵育过夜复活,18h后平板表面生长出菌苔,选取其中长势良好的单一菌团,重新涂抹于M-H(A)斜面,相同条件下孵育18h,密封,4℃条件下冷藏保存;试验前一天取斜面菌涂抹于M-H(A)平板,35℃孵育过夜,即可使用。所有操作均在超净工作台完成。
2.菌液制备方法
方法一:(高浓度菌液制备)
挑3~4个单菌落于40毫升的M-H(B)培养基中。受试菌隔夜增菌培养16小时(37℃,水浴摇床振摇16小时),次日取出原菌液用全波长多功能读数议测OD值(细菌生长饱和期);取20mL,分装于离心管中,每管2mL,离心10000~15000rpm/min,10分钟,弃取上清液之中的M-H(B),用2mL生理盐水混匀后,再离心15000rpm/min,10分钟,弃取上清液中的生理盐水,收集细菌细胞菌体2mL。将相同方法培养的金色葡萄球菌和大肠埃希菌按1:1混合即获得4mL混合菌液。将该菌液为100菌液浓度,用生理盐水进行10倍稀释,稀释至0.1×100,0.01×100,备用(共3个剂量)。
方法二:(低浓度菌液制备)
挑单一菌落(包括金色葡萄球菌和大肠埃希菌)于2毫升的生理盐水中,分别配制成为0.5麦氏浓度(约1×108CFU·mL-1)细菌混悬液,将金色葡萄球菌和大肠埃希菌混悬液混合,即得到混合菌液4mL。将该菌液设置成为10A菌液浓度,用生理盐水进行对倍稀释,稀释至0.5×10A,0.25×10A,备用(共3个剂量)。
3.药品与试剂:M-H(A)培养基(OXOID公司,生产批号:CM0337A);M-H(B)培养基(OXOID公司,生产批号:CM0405B);乌拉坦溶液(20%);生理盐水(四川科伦药液股份有限公司,生产批号:M12012004);其他试剂和耗材均由成都雅荣生化设备经营部购买提供。
4.仪器:电热恒温培养箱(上海一恒科技有限公司,BPH-9162);优普系列超纯水机(成都超纯科技有限公司,UpK-1-10T);微量加样器(EppendorfResearch,10、100、100uL);空气浴振荡器(哈尔滨市东联电子技术开发,HZQ-C);自动电热压力蒸汽灭菌锅(上海申安医疗器械厂,LDZX-40BI);全波长多功能读数议(美国Thermo);菌落计数仪。
5.IL-1β(白介素1β)、LPS(内毒素)、TNF-α(肿瘤坏死因子)、NO(一氧化氮)检测方法
参照试剂盒使用说明书,进行相关检测。
(1)IL-1β
1、加样:分别设标准孔、待测样品孔、空白孔。设标准孔7孔,依次加入100μL不同浓度的标准品(见试剂准备2)。空白孔加100μL(见试剂准备第二步最后一管),余孔加待测样品100μL,酶标板加上覆膜,37℃温育2小时。
2、弃去液体,甩干,不用洗涤。
3、每孔加检测溶液A工作液100μL(临用前配制),酶标板加上覆膜,37℃温育1小时。
4、弃去孔内液体,每孔用350μL的洗涤液洗涤,浸泡1~2分钟,吸去(不可触及板壁)或甩掉酶标板内的液体,在实验台上铺垫几层吸水纸,酶标板朝下用力拍几次(也可轻拍将孔内液体拍干),重复洗板3次。最后一次洗涤后,要把孔内的洗涤液完全甩干。自动洗板机亦可。
5、每孔加检测溶液B工作液(临用前配制)100μL,加上覆膜,37℃温育30分钟。
6、弃去孔内液体,甩干,洗板5次,方法同步骤4。
7、每孔加底物溶液90μL,酶标板加上覆膜,37℃避光显色(反应时间控制在15~25分钟,不要超过30分钟。当标准孔的前3~4孔有明显的梯度蓝色,后3~4孔梯度不明显时,即可终止)。
8、每孔加终止溶液50μL,终止反应,此时蓝色立转黄色。终止液的加入顺序应尽量与底物溶液的加入顺序相同。如出现颜色不匀一,请轻轻晃动酶标板以使溶液混合均匀。
9、在确保酶标板底无水滴及孔内无气泡后,立即用酶标仪在450nm波长测量各孔的光密度(O.D.值)。
(2)LPS
1、加样:分别设标准孔、待测样品孔、空白孔。设标准孔5孔,依次加入50μL不同浓度的标准品(见试剂准备2)。空白孔加50μL(见试剂准备第二步最后一管),余孔加待测样品50μL,然后立即每孔加检测溶液A工作液50μL,轻轻振动,混匀,注意不要有气泡,酶标板加上覆膜,37℃温育1小时。
2、弃去孔内液体,每孔用350μL的洗涤液洗涤,浸泡1-2分钟,吸去(不可触及板壁)或甩掉酶标板内的液体,在实验台上铺垫几层吸水纸,酶标板朝下用力拍几次(也可轻拍将孔内液体拍干),重复洗板3次。最后一次洗涤后,要把孔内的洗涤液完全甩干。自动洗板机亦可。
3、每孔加检测溶液B工作液(临用前配制)100μL,加上覆膜,37℃温育30分钟。
4、弃去孔内液体,甩干,洗板5次,方法同步骤2。
5、每孔加底物溶液90μL,酶标板加上覆膜,37℃避光显色(反应时间控制在15-25分钟,不要超过30分钟。当标准孔的后面3孔有明显的梯度蓝色,前3孔梯度不明显时,即可终止)。
6、每孔加终止溶液50μL,终止反应,此时蓝色立转黄色。终止液的加入顺序应尽量与底物溶液的加入顺序相同。如出现颜色不匀一,请轻轻晃动酶标板以使溶液混合均匀。
7、在确保酶标板底无水滴及孔内无气泡后,立即用酶标仪在450nm波长测量各孔的光密度(O.D.值)。
(3)TNF-α
1、加样:分别设标准孔、待测样品孔、空白孔。设标准孔7孔,依次加入100μL不同浓度的标准品(见试剂准备2)。空白孔加100μL(见试剂准备第二步最后一管),余孔加待测样品100μL,酶标板加上覆膜,37℃温育2小时。
2、弃去液体,甩干,不用洗涤。
3、每孔加检测溶液A工作液100μL(临用前配制),酶标板加上覆膜,37℃温育1小时。
4、弃去孔内液体,每孔用350μL的洗涤液洗涤,浸泡1-2分钟,吸去(不可触及板壁)或甩掉酶标板内的液体,在实验台上铺垫几层吸水纸,酶标板朝下用力拍几次(也可轻拍将孔内液体拍干),重复洗板3次。最后一次洗涤后,要把孔内的洗涤液完全甩干。自动洗板机亦可。
5、每孔加检测溶液B工作液(临用前配制)100μL,加上覆膜,37℃温育30分钟。
6、弃去孔内液体,甩干,洗板5次,方法同步骤4。
7、每孔加底物溶液90μL,酶标板加上覆膜,37℃避光显色(反应时间控制在15~25分钟,不要超过30分钟。当标准孔的前3-4孔有明显的梯度蓝色,后3-4孔梯度不明显时,即可终止)。
8、每孔加终止溶液50μL,终止反应,此时蓝色立转黄色。终止液的加入顺序应尽量与底物溶液的加入顺序相同。如出现颜色不匀一,请轻轻晃动酶标板以使溶液混合均匀。
9、在确保酶标板底无水滴及孔内无气泡后,立即用酶标仪在450nm波长测量各孔的光密度(O.D.值)。
(4)NO检测
1、NaNO2标准液的稀释:
取试管7支,依次标号1~7。用滴定管1号依次向2~7号试管加入双蒸水1ml,用滴定管2号向1号试管加入NaNO2标准液2ml,再用滴定管2号从1号试管吸出1ml液体加入2号试管,混匀,再吸出1ml液体加入3号试管,混匀。重复此步骤。当从6号试管吸出1ml液体时弃去。稀释步骤见图4。
2、用滴定管3号依次向1~7号试管加入1%磺胺0.5ml。
3、用滴定管4号依次向1~7号试管加入0.1%N-1-萘基乙二胺盐酸0.5ml。
4、依次混匀1~7号试管内液体,于常温下孵育20分钟。
5、用7号试管内液体作为对照组,用分光光度计分别测定1~6号试管内液体的吸光度值并记录。
6、用滴定管滴加液体时应注意每一只滴定管只能用于每一种试剂,切忌混用。
6.模型制备
具体操作方法:大鼠称重标记,腹部常规消毒,20%乌拉坦0.5mL/100g腹腔注射麻醉,用1mL注射器抽取预先制备的混合菌液,左手持鼠尾提起大鼠,用10mL注射器磨去针头尖,于阴道底部的子宫颈分叉处小心进入一侧宫腔内,针头在宫腔内来回抽拉2次以机械性损伤子宫内膜组织,然后朝卵巢方向推注菌液0.1mL,同样操作步骤将0.1mL菌液注入另一侧子宫,注射完毕后,倒置大鼠5min,以防菌液漏出。分别于24h,48h观察记录各组大鼠感染情况,以大鼠无死亡,于造模后24h、72h、96h后分别阴道刮片,进行菌落培养,选择菌落计数≥30,≤100的感染菌量作为最佳感染菌量。将该菌量作为体内感染的菌量。受试大鼠感染菌量为:
表1
所有实验动物于造模后24h、72h和96h,麻醉,常规消毒腹部,用无菌棉签伸入宫口,来回抽拉2次后,将棉签放入含2mL生理盐水的试管中,获得含测试品混悬液,取出棉签,再用新的无菌棉签充分蘸取混合液均匀涂抹于无菌M-H(A)平板表面,35℃孵育过夜,18h后进行菌落计数。240h牺牲动物,观察子宫感染情况。各组典型鼠感染菌落计数,结果如下表2:
表2 受试大鼠感染菌量
所有实验动物于造模后24h、72h和96h,麻醉,常规消毒腹部,用无菌落计数结果显示,3组鼠所感染菌量符合实验要求。同时,解剖后可见子宫等直观可见炎性充血与炎性水肿。
7.试验过程
模型及分组150只大鼠(雌性SPF级SD大鼠,220g±20g,由四川省医学科学院实验动物研究所购得,实验动物生产许可证号:SCXK(川)2008-24)。16只用于空白,另行饲养。其余均采用造模方法麻醉后注射混合菌液。观察5日,每日均随机抽取6只及空白组2只麻醉后采集阴道分泌物用于细菌涂片。5日后存活大鼠随机分为5组,即model、AZM、AZMQR、AZMDG、AZMFF(分别表示不予治疗的模型组、单独使用阿奇霉素组、阿奇霉素清热合并组、阿奇霉素缺当归合并组、阿奇霉素全方合并组)。
Model:不予治疗的模型组。
AZM:阿奇霉素治疗模型组。
AZMQR:阿奇霉素+以千斤拔、穿心莲、金樱根、功劳木、单面针按照妇科千金片配方中的比例和方法制得组合物联合治疗模型组。
AZMDG:阿奇霉素+以千斤拔、穿心莲、金樱根、功劳木、单面针、鸡血藤、党参按照妇科千金片配方中的比例和方法制得制得组合物联合治疗模型组。
AZMFF:阿奇霉素+妇科千金片(包括千斤拔、穿心莲、金樱根、功劳木、单面针、当归、鸡血藤、党参成分,株洲千金药业股份有限公司出品)联合治疗模型组。
1.受试剂量
(1)AZM剂量:本实施例对阿奇霉素(AZM)的可选受试剂量进行了分析和确定,目的为选择一个试用后作用强度适中、时长适中的受试剂量,同时明确同中药合并用药时的时程长度。预试60、30、20、10mg/kg.d三天,发现原设定剂量过高,最终采用10mg/kg.d。
(2)受试药物剂量:
根据研究结果,原设定中药组合物的剂量为2.058g/kg.d,但预试发现,此剂量采用最大给容积配制的给药液为稀浆状,无法通过灌胃针头。随调整最终全方AZMFF给药剂量为最大给药量1.66g/kg.d,调整缺当归组剂量AMZDG为1.41g/kg.d、清热组剂量AMZQR为1.16g/kg.d。
2.给药时间
除空白和模型外,造模后第六日开始给予相应药物。AZM与各中药分别给予,相差时间约2小时。所有给药组在8点左右均先给予相应剂量的AZM,两个小时后开始给予相应的中药生理盐水水混物。
3.样本收集
第1日给予AZM两小时后,经尾静脉采集各组大鼠末梢静脉血。从第二日始各给药组大鼠每日两次采血,于给予阿奇前和给予中药前各经尾静脉采集一次,每次采集血量约0.3mL,取样时间误差约30min。于给药第2、4、6、8日给予AZM两小时后,各组麻醉后牺牲约2~4只大鼠,采集下腔动脉抗凝全血。
4.送样测试
所有时间点0.3mL及末次全血,取约0.2mL血浆用于末次抗凝全血送检血细胞计数、血流变。末次血浆用于检测LPS、TNF-α、NO。
实验结果见图1至图3所示。附图中,从左至右分别显示为AMZ、AMZDG、AZMFF、AZMQR、Model和正常组normal的指数变化情况。
结果显示,实验动物造模后,3种炎症因子水平与正常组比较均明显升高,给予不同的药物组合治疗后,各系数都降低,趋向于回复正常水平。各治疗组之间的治疗效果比较,血浆内毒素:AZMQR>AZMDG>AZM>AZMFF;血浆一氧化氮:AZMQR AZMDG>AZMFF>AZM,血浆肿瘤坏死因子:AZMFF>AZM>AZMDG>AZMQR。
以上结果表明,表明慢性盆腔炎模型大鼠血浆内毒素、血浆一氧化氮、血浆肿瘤坏死因子由于感染和炎症的发生,导致这三种炎症因子大量产生,使其水平高于正常值;在给予药物治疗后,炎症因子水平均趋于恢复正常水平,四种药物之间的作于强度大致为:AZMQR>AZMDG>AZMFF>AZM。
实施例2应用研究
1.研究对象:选择门诊自愿2014年6月至2015年2月,因月经失调、阴道不规则出血、下腹坠痛或白带增多,经过诊断为盆腔炎患者30例,年龄35~52岁。
2.所有患者在治疗前均常规检查血常规、肝和肾功能,取末次血浆用于检测LPS、TNF-α、NO。LPS、TNF-α、NO明显升高患者给予本发明中药组合物(以千斤拔、穿心莲、金樱根、功劳木和单面针参照株洲千金药业妇科千金片的配方比例和方法制得组合物,汤剂或片剂)和阿奇霉素(参照阿奇霉素规定剂量),阿奇霉素与本发明中药组合物分开服用,相差时间约2小时。连续服药2周。治疗期间每周复诊1次,复查血常规、LPS、TNF-α、NO指标、肝和肾功能,了解用药后不良反应及月经情况。无失访病例。
3.临床症状:有阴道出血者均在用药后3~5天内血止,下腹坠痛或白带增多情况消失或减轻,检测LPS、TNF-α、NO回复正常水平。
统计结果显示,30例中,显效10例,占33.3%;有效17例,56.7%;无效3例,占10%;总有效率为90%。
- 还没有人留言评论。精彩留言会获得点赞!