微结构体的制造方法与流程
本申请要求2015年12月8日提交至韩国知识产权局的申请号为10-2015-0174066的韩国专利申请的权益,其全部公开内容通过参考包括于此。
技术领域
本发明涉及一种使用吹风技术来制造如微针等的微结构体的方法。更具体地,本发明涉及一种在现有微结构体的制造方法中改善用作微结构体形成的基础的底层的形成工序的、使用吹风技术来制造如微针等的微结构体的方法。
背景技术:
虽然已经开发出了用于治疗疾病的各种药物和生理活性物质,但是在将药物和生理活性物质输入人体的过程中,还有些方面需要改进,例如穿过生物障碍(例如,皮肤、口腔黏膜及血脑屏障等)的问题及药物输送效率问题。
一般而言,药物和生理活性物质以药片或胶囊形式口服。然而,由于各种药物都是在胃肠道中被消化或吸收或者由于肝脏的机理而损失,所以这些药物无法仅通过上述口服来被有效地输送。此外,一些药物无法有效地穿过肠粘膜扩散。而且,患者的用药依从性也是个问题(例如,需要以预定间隔服药的患者,或无法服药的重病患者等)。
另一种输送药物或生理活性物质的通用技术是常规的针。这种技术比口服更有效,但是会在注射的区域引起疼痛,对皮肤造成局部伤害、出血,以及在注射的区域感染。
为了解决所述口服和皮下注射的问题,利用了通过贴片的经皮给药方法。使用贴片的经皮给药具有副作用较小、患者的用药依从性高、易于保持恒定的药物血中浓度等优点,反而还具有可透过皮肤的药物有限、药物输送效率较低的缺点。
为了解决这些问题,已经开发出了包括微针的各种微结构体。当前开发的微针已经被用于向生物体输送药物、采集血液以及检测来自人体的分析物等。
微针的特征在于,与常规的针相比,刺入皮肤不会引起疼痛并且没有外部伤害。为了无痛地刺入皮肤,重要的是将微针的顶端直径确定为针的最小尖头。此外,由于微针需要刺穿10至20μm的角质层,角质层是皮肤最有力的屏障,所以微针需要具有足够的物理硬度。此外,还需要考虑合适长度的微针来将微针达到毛细血管,以便提高药物输送的效率。
在提出了面内型(in-plane type)微针(“娃加工的微针”,Journal of microelectrochemical systems 8,1999)之后,开发出来了各种微针。根据使用刻蚀技术来制造面外型(out-of-plane type)固体微针的方法(美国专利公开第2002138049号,发明名称为“Microneedle devices and methods of manufacture and use thereof(微针设备及其制造方法和用法)”),制造的固体硅微针的直径为50至100μm并且长度为500μm。然而,微针无法无痛地的刺入皮肤,并且在向目标区域输送药物和化妆品配料方面存在困难。
同时,普劳斯尼茨(Prausnitz,Georgia University,U.S.A.)提出了一种通过在玻璃上进行刻蚀或光刻法来生产模板以制造可生物降解的聚合物微针的方法(Biodegradable polymer microneedles:Fabrication,mechanics and transdermal drug delivery(可生物降角军的聚合物微针:制造、结构和经皮给药),Journal of Controlled Release l04,2005,5166)。此外,在2006年,提出了一种通过在由光刻法制造的模板的一端装载制成胶囊型的材料来制造可生物降解的固体微针的方法(Polymer Microneedles for Contro11ed-Release Drug Delivery(控释给药的聚合物微针),Pharmaceutical Research 23,2006,1008)。根据上述方法,可以容易地装载能被制成胶囊型的药物,但是当装载大量的这种药物时,微针的硬度降低,因此在应用于需要大剂量派药的药物方面存在限制。
在2005年,Nano Device and Systems公司制造了可吸收的微针(日本专利申请公开第2005154321号;发明名称为“Sugar Micro Needles as Transdermic Drug Delivery System(作为经皮药物输送系统的糖微针)”,Biomedical Microdevices 7,2005,185)。这种可吸收的微针用于药物输送或美容而无需去除插入皮内的微针。根据上述方法,将通过混合麦芽糖和药物而制成的合成物涂布于模板,然后进行固化以便制造微针。所述日本专利公开了制造出用于经皮吸收药物的可吸收微针。然而,经皮输送药物实现起来会产生疼痛。此外,由于在制造模板方面存在限制,所以无法制造出这样一种微针:其尖端具有合适的直径以实现无痛吸收且具有高效输送药物所需的长度,即,1㎜或更大的长度。
通过使用聚二甲基硅氧烷(PDMS)模板并通过将聚乙烯基吡咯烷酮(PVP)和甲基丙烯酸(MAA)混合而制备的材料,制造出了普劳斯尼茨(Prausnitz,Georgia University,U.S.A.)在2008年提出的可生物降解的微针(Minimally Invasive Protein Delivery with Rapidly Dissolving Polymer Microneedles(使用速溶聚合物微针的微创蛋白质输送),Advanced Materials2008,I)。另外,通过将羧甲基纤维素注射到金字塔结构的模板中来制造微针(Dissolving Microneedles for Transdermal Drug Delivery(用于经皮药物输送的溶解微针),Biomaterials 2007,l)。然而,所述使用模板的方法存在的限制是,需要用复杂的过程来制造新模板和模具以调节微针的直径和长度。此外,通过将材料注射到模板中来制造微针的方法很复杂且费时。
在2008年,颁发给Mukai等(日本)的美国专利第20080157421A1号中公开了一种使用针结构来制造皮肤针的方法及设备。这种方法包括在基板的基底上熔化粘性材料,然后利用针的拉力来拉开粘性材料。由于所述方法涉及使用针结构来拉开受热熔化或是粘性的材料,所以还需要根据所需的模式来制造新的针结构的过程,从而导致增加了生产成本,并且,加热过程使得难以装载对热敏感的各种生物制品(激素、疫苗、其他蛋白质药品等)。
另外,皮肤是由从皮肤的外层顺序堆叠的角质层(〈20μm)、表皮(〈100μm)和真皮(300至2,500μm)组成的。因此,为了无痛地将药物和生理活性物质输送到皮肤的特定层,需要将微针制造成顶部直径为大约30μm以内、有效长度为200至2,000μm以及具有足够的硬度以刺穿皮肤,这对于输送药物和化妆品配料也是有效的。此外,为了通过可生物降解的固体微针来输送药物和生理活性物质,必须从制造微针的过程中排除破坏药物和生理活性物质的活性的过程,例如高温处理、用有机溶剂处理等。
现有的固体微针由于制造方法的限制是使用有限的材料制造的,例如,硅、聚合物、金属、玻璃等。利用制模技术的制造方法的使用会造成复杂且费时的过程,存在的缺点是药物变性、微针的硬度不足和药物损失。因此,持续不断地需要一种微针的制造方法,这种微针具有小直径以无痛地刺穿皮肤、具有足够的长度以深入地刺入皮肤、具有不具体限于某种材料的足够的硬度,并且可以使药物的损失最小化。
为了解决上述现有技术的问题,本发明人在韩国专利申请第10-2010-0130169号(发明名称:微结构体的制造方法)中提出了全新的微结构体的制造方法。所述微结构体的制造方法如图1示意性所示。下面,简略地说明一下所述微结构体的制造方法。
首先,在底层形成步骤中,通过将第一粘性材料11涂覆在第一基板10上并且干燥(固化)所述材料来形成底层。此时,朝着基板吹风以便于固化。在此,第一基板10形成为平板形状,并且对材料无特别限制。例如,基板可以由诸如聚合物、有机材料、金属、陶瓷、半导体等的材料制成。然而,在制造医疗专用的微针时,第一基板10优选由对人体无害的材料制成。在通过将第一粘性材料11涂覆在第一基板10上并且固化所述材料来形成底层的步骤(图1的步骤a和步骤b)之后,通过点滴第二粘性材料12来形成基底结构层。在基底结构层的形成中也可以与形成底层时一样通过吹风来进行固化。基底结构层是,当在其上点滴的另一个粘性材料即第三粘性材料13为如医药品等功能材料时,为了精确地调节进入人体的医药品成分量而通过在底层上进行点滴来形成的层,并且根据情况可以省略(图1的步骤c和步骤d)。在形成基底结构层之后,作为刺入人体的微针材料的第三粘性材料13点滴在基底结构层上(图1的步骤e)。当省略基底结构层时,第三粘性材料13可以点滴在底层上。
如图1的步骤f所示,在这种状态下,以相同的方式形成底层的第二基板20在使该底层朝向下方的状态下下降移动,以便与第三粘性材料13接触,然后如图1的步骤g和步骤h所示,通过上升移动来拉伸第三粘性材料13。对所拉伸的第三粘性材料13通过吹风等方式进行固化。此后,如图1的步骤i所示,在第三粘性材料13完全固化的状态下,通过将所拉伸的第三粘性材料切断来产生微针结构体。
根据上述本发明人的现有微结构体的制造方法,不仅可以实现足够的硬度,还可以减少功能材料的损失,因此能够大部分解决上述现有技术的问题。
然而,在如上所述的本发明人的现有微结构体的制造方法中,为了将形成在底层上的微针结构附着到可粘接于皮肤的贴片形式的产品而从第一基板10和第二基板20分离底层的过程中,发生了底层损伤或微针结构损伤的情况。
并且,存在底层难以保持一定厚度的缺点。如果底层的厚度大于预期的厚度,当拉伸到相同的长度时,点滴在底层上而拉伸形成的由第三粘性材料13制成的微针的上下长度会小于预期的上下长度,在这种状态下,微针的上端部无法达到角质层,因此药物输送效率会降低。同时,微针上端部的截面直径会变大(虽然点滴同量的粘性材料,也上下拉伸的长度减少而发生的现象),从而在附着到皮肤时会引起疼痛。与此相反,如果底层的厚度小于预期的厚度,当拉伸到相同的长度时,微针的截面直径会小于预期的截面直径。从而,因上下长度变得大于预期的上下长度而物理硬度会降低,因此,微针不可具有适合透过皮肤的直径和强度,最后导致药物输送效率降低。
而且,底层需要保持均匀的厚度。若底层的厚度不均匀,则微针的截面直径和上下长度根据微针的位置会不同,因此,如上所述物理硬度和上下长度有可能不均匀,最后用户将产品附着到皮肤时会感到痛疼,或药物输送效率会降低。
然而,在本发明人的上述微结构体制造方法中,通过在第一基板10上涂覆第一粘性材料11后固化来形成底层,此后直接在底层上点滴第二粘性材料12和第三粘性材料13,因此,在无法确定底层的厚度是否形成为预期的厚度的状态下就立即进行后续的步骤。因此,当底层的厚度超出预期的厚度范围时也不能判定为不良,且不必要地经过在底层上形成微针结构的步骤之后才能判定为不良。
另一个问题在于工序时间延长。该问题也是与底层的形成有关。通常,干燥粘性材料而形成一层需要最少一小时至数小时以上,因此为形成底层的第一粘性材料11涂覆和通过吹风等的后续固化过程导致生产率降低。
技术实现要素:
发明要解决的问题
本发明的目的在于解决上述现有技术的问题。
更具体地,本发明的目的在于提供一种在从基板分离底层之后无需进行将该底层还附着于涂覆有粘合剂的贴片支撑层上的工序的微结构体的制造方法。
并且,本发明的目的在于提供一种可以将用作微针形成的基础的底层形成为具有一定厚度,且在进行工序之前可以检查该厚度是否均匀的微结构体的制造方法。
而且,本发明的目的在于提供一种可以大幅缩短为制造用作微针形成的基础的底层所需的工序时间的微结构体的制造方法。
用于解决问题的方案
为实现所述目的的本发明的代表性构成如下。
根据本发明的一个实施例的微结构体的制造方法包括以下步骤:提供在上部露出有底层(34)的贴片制造用片材(30);在第一工序基板(50)和第二工序基板(60)上提供所述贴片制造用片材(30);在提供于所述第一工序基板(50)上的贴片制造用片材(30)或在提供于所述第一工序基板(50)和第二工序基板(60)上的贴片制造用片材(30)的底层(34)上都点滴多滴彼此间隔的粘性组合物;将提供于第二工序基板(60)上的所述贴片制造用片材(30)或在提供于第二工序基板(60)上的贴片制造用片材(30)上点滴的所述粘性组合物与在提供于第一工序基板(50)上的贴片制造用片材(30)上点滴的所述粘性组合物接触;通过沿垂直方向相对移动所述第一工序基板(50)与所述第二工序基板(60)以隔开所述第一工序基板(50)与所述第二工序基板(60)之间的距离来拉伸所述粘性组合物,固化所述拉伸的粘性组合物;及切断所述固化的粘性组合物。
在由如上所述的步骤构成的根据本发明的微结构体制造方法中,所述提供在上部露出有底层(34)的贴片制造用片材(30)的步骤包括以下步骤:提供包含支撑层(31)、粘合剂层(32)及剥离膜(33)的贴片制造用片材(30);通过除去所述贴片制造用片材(30)的剥离膜(33)的一部分来露出粘合剂层(32);及将制成具有与所述露出的粘合剂层(32)对应的大小和形状的底层(34)附着于所述露出的粘合剂层(32)上。
另外,在第一工序基板(50)和第二工序基板(60)上提供附着有所述底层(34)的贴片制造用片材(30)的步骤中,可以通过机械手臂真空吸附保管在片材保管基板(40)的附着有所述底层(34)的贴片制造用片材(30)来使附着有所述底层(34)的贴片制造用片材(30)移动到第一工序基板(50)和第二工序基板(60)。
更具体地,在通过机械手臂真空吸附保管中的贴片制造用片材(30)来将其移动到基板上的构成中,在附着有所述底层(34)的贴片制造用片材(30)上形成有孔穴,且附着有所述底层(34)的贴片制造用片材(30)通过使所述孔穴贯通沿垂直方向形成在所述片材保管基板(40)上的杆(41)来可以以层叠方式保管在所述片材保管基板(40)上。在上述保管状态下,在所述机械手臂真空吸附附着有所述底层(34)的贴片制造用片材(30)之后进行垂直移动时,所述杆(41)引导附着有所述底层(34)的贴片制造用片材(30)的垂直移动,从而能够安全精密握持并移动贴片制造用片材(30)。
根据本发明的另一个实施例的微结构体的制造方法包括以下步骤:提供在上部露出有粘合剂层(32)的至少一个贴片制造用片材(30);在第一工序基板(50)和第二工序基板(60)上提供所述贴片制造用片材(30);在提供于所述第一工序基板(50)上及/或第二工序基板(60)上的贴片制造用片材(30)的粘合剂层(32)上都点滴多滴彼此间隔的粘性组合物;将提供于第二工序基板(60)上的所述贴片制造用片材(30)或在提供于第二工序基板(60)上的所述贴片制造用片材(30)的粘合剂层(32)上点滴的所述粘性组合物与在第一工序基板(50)上点滴的所述粘性组合物相接触;相对于所述第一工序基板(50)移动所述第二工序基板(60)以拉伸伸所述粘性组合物,固化所述拉伸的粘性组合物;及切断所述固化的粘性组合物。重要的是,其中构成所述粘合剂层(32)的粘合剂应该是亲水性物质。
在本实施例的步骤中,提供在所述上部露出有多个粘合剂层(32)的贴片制造用片材(30)的步骤包括以下步骤:提供包含支撑层(31)、粘合剂层(32)及剥离膜(33)的贴片制造用片材(30);及通过除去所述贴片制造用片材(30)的剥离膜(33)的一部分来露出粘合剂层(32)。
发明的效果
根据本发明,可以解决在背景技术中说明的现有技术的问题。
更具体地,根据本发明,提供一种在从基板分离底层之后无需另外进行将该底层附着于形成有粘合剂并附着于皮肤的贴片上的工序的微结构体的制造方法。
并且,根据本发明,提供一种可以将用作微针形成的基础的底层形成为具有一定厚度,且在进行工序之前可以检查该厚度是否均匀的微结构体的制造方法。
而且,根据本发明,提供一种可以大幅缩短为制造用作微针形成的基础的底层所需的工序时间的微结构体的制造方法。
附图说明
图1为示出本发明人开发的现有技术的微结构体制造工序的附图。
图2为示出根据本发明的一个实施例的贴片制造用片材的制造工序的附图。
图3为用于说明根据本发明的一个实施例的贴片制造用片材的制造工序中,将底层集体附着于贴片制造用片材的露出的粘合剂层上的方式的附图。
图4为用于说明根据本发明的一个实施例制造的贴片制造用片材在投入微结构体制造工序之前的状态被保管,且投入于所述制造工序的方式的附图。
图5为示出将微结构体形成在根据本发明的一个实施例的贴片制造用片材上的工序的附图。
图6为示出根据本发明的另一个实施例的贴片制造用片材的制造工序的附图。
附图标记说明:
30:贴片制造用片材
31:支撑层
32:粘合剂层
33:剥离膜
34:底层
35:基底结构层
36:功能材料层
40:片材保管基板
41:杆
42:真空吸附部
43:致动器
50:第一工序基板
60:第二工序基板
具体实施方式
参照附图来详细说明实施本发明的特定实施方式。通过这些实施方式,所属领域的技术人员能够充分实施本发明。应理解为,虽然本发明的各种实施方式有所不同,但并非具有排他性。例如,在不超过本发明的精神和范围的基础上,在本说明书中所记载的特定形状、结构及特性可以将一实施方式变更为其他的实施方式来实现。此外,应理解为,每个实施方式的个别构成要素的位置或配置在不脱离本发明的精神和范围的基础上能够进行变更。因此,后述的本发明并非旨在限定,本发明的范围包括权利要求中所要求的范围以及与其等同的所有范围。附图中类似的附图标记在不同侧面表示相同或类似的构成要素。
以下参照附图,详细说明本发明的优选实施方式,以便所属领域的技术人员能够容易地实施本发明。
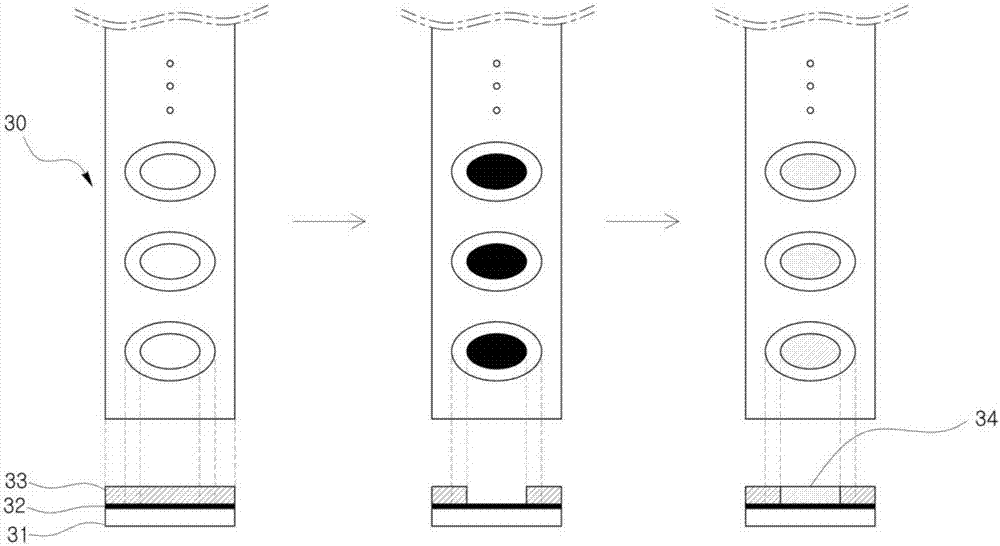
图2中示出在根据本发明的方法中所用的贴片制造用片材30的制造工序。
图2中示出从顶部观察的贴片制造用片材30和贴片制造用片材30的截面图。作为贴片制造用片材30的组成要素提供了支撑层31。支撑层31由药物或生物活性物质不可透过且透湿性和弹性优异的材料制成,例如,可以使用选自纸、无纺布、织造织物、天然或合成橡胶、聚对苯二甲酸乙酯、聚氯乙烯、聚丙烯、聚氨酯、聚苯乙烯、聚碳酸酯、聚对苯二甲酸乙二醇、乙烯-乙烯醇、聚乙烯、聚酯及尼龙中的至少一种材料制成的薄膜。
粘合剂层32位于支撑层31的上面。粘合剂层32中所用的粘合剂由可药用的压敏粘合剂成分构成,且可以使用水性或有机溶剂材料。上述粘合性聚合物材料的例子可以包括如丙烯酸酯聚合物、乙酸乙烯酯-丙烯酸酯共聚物等丙烯酸类树脂、聚异丁烯、聚丁二烯或聚苯乙烯共聚树脂或松香类树脂、多萜树脂、石油类树脂、萜烯酚醛树脂、硅氧烷聚合物、天然或合成橡胶类或其混合物。所述粘合性聚合物材料可以单独使用或组合使用两种以上。
剥离膜33形成在粘合剂层32的上面。如图2所示,在剥离膜33形成有双椭圆状(本发明不限于该形状)切割线的状态下,剥离膜33附着于粘合剂层32上。从而,因形成切割线而能够容易分离与剩余部分可分离的剥离膜33的部分,例如,能够容易分离双椭圆中心侧的小椭圆部分。
当制造工序的第一步骤为提供如上所述的结构的贴片制造用片材30时,第二步骤为利用预先形成的剥离膜33的切割线来除去剥离膜33的中心部分,其相当于图2中从左边起第二个图。如果除去剥离膜33的中心部分,粘合剂层32就处于露出到该除去部分的状态。
其次,露出的粘合剂层32由底层34覆盖。如本文所用的术语“底层34”意味着形成微结构体的底面。底层34与粘合剂层32的粘合剂接触而保持牢固结合的状态。底层34可以为具有亲水性表面的任意薄膜,使得微结构体可以形成在其上。优选地,底层34可以为具有一定且均匀的厚度、在表面上具有亲水基团的任意薄膜。更优选地,底层34可以为具有适当水平的弹性的亲水性聚合物薄膜,以便可紧贴于曲面部分。
本发明的特征之一在于,底层34可以不是如上述现有技术所示通过在微结构体形成工序中的亲水性粘性材料的涂覆工序和后续的干燥工序形成,而是通过与微结构体形成工序不同的另外工序预先制成,而可附着于贴片制造用片材30。
在根据本发明的方法中,各个底层34可以分别结合到形成在贴片制造用片材30的所露出的多个粘合剂层32,但为了缩短工序所需的时间且提高结合正确性,可以通过如图3所示的方法实现底层34与所露出的粘合剂层32之间的结合。
在图3中,底层34形成在制成具有与贴片制造用片材30的大小相同大小的片材上。底层34的形状和大小与所露出的粘合剂层32的形状和大小相对应,且底层34在片材上的位置也与贴片制造用片材30上所露出的粘合剂层32的位置相对应。在这种状态下准备形成有底层34的片材之后,通过将该片材上下反转来使底层34朝向下方,然后使底层34与露出有粘合剂层32的贴片制造用片材30相接触。如上所述,在底层34的形状、大小及位置正确对应的状态下将形成有底层34的片材与贴片制造用片材30接触时,各个底层34与相对应的所露出的粘合剂层32结合,且通过粘合剂层32的粘合结合力牢固保持上述结合状态。此后,当解除形成有底层34的片材与贴片制造用片材30之间的接触时,多个底层34可以同时正确地结合到形成在贴片制造用片材30上的所露出的所有粘合剂层32。
另外,在上述方法中,在通过使形成有多个底层34的片材反转来将其与露出有粘合剂层32的贴片制造用片材30接触之后,使用加压装置对形成有多个所述底层34的片材的反转的片面(与形成有底层的面相反的面)施加压力,从而能够确保接触状态。所述加压装置例如可以为滚柱式或平板式加压装置。通过采用上述加压方式,不仅可以确保确实的接触状态的形成,还可以通过对需要形成均匀厚度的底层34整体施加一定压力来在投入微结构体制造工序之前一定程度改善与贴片制造用片材30结合的底层34的非均匀厚度。
在将底层34提供到如上所述的根据本发明的贴片制造用片材30的制造工序之前,所述底层34可以经过品质管理(QC)过程,所述品质管理(QC)过程检查所述底层34的厚度等是否制成为符合预先决定的标准。从而,可以事前预防由于用作形成微结构体的基础的底层的厚度不满足预先决定的标准而会发生的微结构体的缺陷。
通过制成结合有底层34的多个贴片制造用片材30来可以对微结构体形成工序依次逐一提供贴片制造用片材30或同时提供多个贴片制造用片材30。例如,贴片制造用片材30可以以如图4所示的状态被提供到微结构体形成工序。参照图4,可以在形成有多个贴片的贴片制造用片材30的上下面分别设有一个孔穴,使得在通过贯通各个所述孔穴的杆41正确定位的状态下将多个贴片制造用片材30层叠在片材保管基板40上,从而将该贴片制造用片材30提供到微结构体形成工序。
在这种状态下提供到微结构体形成工序时,作为微结构体形成工序的第一步骤,例如,在包括真空吸附部42的机械手臂下降而真空吸附所保管的贴片制造用片材30的上面之后上升时,各个贴片制造用片材30借助形成在上下面的孔穴沿杆41被引导而上升移动,从而摆脱保管状态。使所述机械手臂进行上下左右移动的致动器43由控制单元控制,从而所述机械手臂能够将贴片制造用片材30传输到微结构体形成工序中的基板的预定位置。另外,本发明应被理解为,除了如上所述将多个贴片制造用片材30层叠的状态下提供到工序之外,可以适用各种形式的工序提供方式。例如,可以将以单层方式保管在片材保管基板40上的贴片制造用片材30提供到工序。
图5中示出在根据本发明的贴片制造用片材30上形成微结构体的工序。
首先,机械手臂接近保管在片材保管基板40上且结合有底层34的贴片制造用片材30后,通过真空吸附部握持贴片制造用片材30(步骤a)。
其次,机械手臂移动到进行微结构体形成工序的位置后,下降以便将结合有底层34的贴片制造用片材30安置在第一工序基板50上(步骤b)。
然后,进行形成基底结构层的步骤。基底结构层是通过将粘性材料点滴在结合有底层34的贴片制造用片材30上而成的。在根据本实施例的用于医疗目的的如微针等微结构体的制造中,粘性材料优选为“可生物相容的或可生物降解的材料”。在此,术语“可生物相容的材料”是指无毒性且在人体中化学不活性的材料。而且,术语“可生物降解的材料”是指能够在生物体内被体液、酶或微生物等降解的材料。
并且,根据本实施例,粘性材料优选在溶解于合适的溶剂中时表现出粘性。即,在粘性材料中,虽然有些材料在受热熔化时是有粘性的,但也可以在溶于溶剂中时有粘性。
粘性材料的例子包括透明质酸和它的盐、聚乙烯基吡咯烷酮、聚乙烯醇、纤维素聚合物、葡聚糖、明胶、甘油、聚乙二醇、聚山梨酸酯、丙二醇、聚维酮、卡波姆、达瓦树胶、瓜耳胶、葡甘露聚糖、葡糖胺、达玛树脂(dammer resin)、酶凝酪素、刺槐豆胶、微纤维化纤维素、亚麻紫车前籽胶、黄原胶、阿拉伯半乳聚糖(arabino galactan)、阿拉伯树胶、藻酸、明胶、吉兰糖胶、角叉菜胶、刺梧桐树胶、凝胶多糖、脱乙酰壳多糖、壳多糖、他拉胶、罗望子胶、黄蓍胶、红藻胶、果胶或支链淀粉等。
优选地,在本发明中所使用的粘性材料为羟丙基甲基纤维素、羟烷基纤维素、乙基羟乙基纤维素、烷基纤维素及羧甲基纤维素,并且更优选为羧甲基纤维素。
并且,用于溶解上述粘性材料的溶剂不受特别限制,而可以为水、具有1至4个碳原子的无水或含水的低乙醇(low alcohol)、丙酮、乙酸乙酯、氯仿、1,3-丁二醇、己烷、乙醚或乙酸丁酯,优选为水或低乙醇,并更优选为水。
在基底结构层形成步骤中,如图5的步骤c和步骤d所示,将用于形成基底结构层35的粘性材料彼此间隔地点滴在包含底层34的贴片制造用片材30的上部所露出的底层34上,固化该粘性材料,从而形成基底结构层35。此时,为了便于固化粘性材料,可以吹风。在图5的步骤d中箭号表示吹风。
用于形成基底结构层35的粘性材料的量越增加,基底结构层35的直径越增大。并且,如下所述,为了在基底结构层35上点滴大量的包含功能材料的粘性组合物,基底结构层35优选具有更大的直径。这是因为,当基底结构层35具有较小的直径且被点滴大量的粘性组合物时,粘性组合物会从基底结构层溢出,从而导致要输送给人体的功能材料的损失。另外,在通过固化粘性材料来形成基底结构层35之后,可以重复进行再次在基底结构层35上点滴用于形成基底结构层35的粘性材料并固化该粘性材料的方法,以形成具有所需高度的基底结构层35。
虽然在图5的实施例中形成基底结构层35之后在其上还点滴粘性组合物来形成功能材料层36,根据情况,可以通过进行双重点滴,使得不是在底层34上同时形成基底结构层35和功能材料层36的两层,而是在底层34上仅形成功能材料层36的单一层。
在粘性组合物中混合有药物的情况下,当省略形成基底结构层35的步骤而仅用功能材料层36形成微针时,药物均匀分布于微针整体。在这种情况下,含有在微针下端的药物不及吸收于皮肤中而残留在底层34上,从而会导致药物剂量减少。因此,为了使药物的吸收率最大化,优选形成基底结构层35。与此相反,当粘性组合物中不含有药物或控制给药量的必要性较低时,为了简化工序和提高效率,可以省略形成基底结构层35的步骤。
在图5的步骤e中,在基底结构层35上点滴包含功能材料的粘性组合物而形成功能材料层36。在此,粘性组合物可以通过将上述粘性材料与功能材料混合来制备。尤其,在本实施例中的微针的情况下,由于粘性组合物刺入皮肤中,因此优选使用具有优异的生物相容性和可生物降解性的粘性材料。在此,功能材料是指在刺入皮肤中之后起到如药理作用等特定功能的材料,例如包括化学药物、蛋白质药品、肽药物、用于基因治疗的核酸分子和纳米级美容化妆品配料(例如,皱纹增强剂、皮肤抗老化剂或皮肤增白剂)等。
在图5的步骤f中使用第二工序基板60和安置在第二工序基板60上的贴片制造用片材30。安置在第二工序基板60上的贴片制造用片材30也以同样的方式预先形成有底层34。
与在第一工序基板50上安置贴片制造用片材30时一样,在第二工序基板60上安置贴片制造用片材30的过程也可以通过机械手臂实现。机械手臂可以通过吸附支撑以层叠方式保管在片材保管基板40上的一个或多个贴片制造用片材30来将所述一个或多个贴片制造用片材30安置在第二工序基板60上的预先决定的正确位置。如图5中的步骤f所示,第二工序基板60和安置在所述第二工序基板60上的贴片制造用片材30上下反转而移动到第一工序基板50和安置在所述第一工序基板50上的贴片制造用片材30上。在如上所述进行上下反转时,第二工序基板60也可以包括真空吸附结构等结构,以便防止贴片制造用片材30的安置位置发生变化。除了真空吸附结构之外,可以保持贴片制造用片材30的安置位置的所有结构应被理解为包括在本发明的范畴。
在图5的步骤g中,第二工序基板60下降使得安置在第二工序基板60上的贴片制造用片材30与点滴在第一工序基板50上的功能材料层36接触。更正确地,安置在第二工序基板60上的贴片制造用片材30的底层34与以在安置于第一工序基板50上的贴片制造用片材30的底层34上形成的基底结构层35为基底的功能材料层36相接触。另外,在本发明中,与安置在第一工序基板50上的贴片制造用片材30的情况相同地,在安置于第二工序基板60上的贴片制造用片材30上也可以点滴粘性组合物。在这种情况下,当第二工序基板60反转而下降时,在提供到第二工序基板60的贴片制造用片材30上点滴的粘性组合物与提供到第一工序基板50的贴片制造用片材30上点滴的粘性组合物,即功能材料层36相接触。
在相当于图5的步骤g和步骤h的拉伸和固化步骤中,通过相对于第一工序基板50移动(或相对于第二工序基板移动第一工序基板)第二工序基板60来拉伸功能材料层36,在此状态下进行固化。在本发明中用作现有技术提及的韩国专利申请第10-2010-0130169(发明名称:微结构体的制造方法)的说明书中详细说明拉伸和固化的条件,而可以以上述韩国专利申请的说明书所记载的条件进行在本发明的相应的步骤中的拉伸和固化。
在拉伸并完全固化功能材料层36之后,如图5的步骤i所示,功能材料层36的最小直径部分被切断。在功能材料层36固化的状态下还进行第一工序基板50和第二工序基板60的相对移动来可以实现上述切断。本发明人通过反复实验结果发现,通过在固化状态下还进行拉伸来能够顺利切断功能材料层36的最小直径部分。从而,微针结构体同时形成于在安置在第一工序基板50上的贴片制造用片材30和安置在第二工序基板60上的贴片制造用片材30。
如图5所示,在结束所说明的工序而从第一工序基板50和第二工序基板60分别除去贴片制造用片材30时,可以提供形成有微结构体(微针)的贴片制造用片材30。
对上述形成有微结构体的贴片制造用片材30上进行用于保护形成在片材上的微结构体的包装处理之后立即可以制成商品化。
根据现有技术,在从基板分离底层的过程中由于底层很薄且在结构上软弱而多发生底层本身的破损或形成在底层上的微结构体的破损。与此相反,在根据本发明的方法中,后来用作贴片产品被使用时,构成贴片产品的主体的多个支撑层31形成在贴片制造用片材30上,且在其上处于预先结合的状态的底层34被提供在微结构体的制造工序中,在其牢固的基础上形成微结构体,因此,在结束微结构体形成工序之后,在从基板的分离过程中似乎没有底层34或微结构体破损的危险。
其次,参照图6说明本发明的另一个实施例。图6的实施例与上述实施例的区别在于不另外形成底层34。
如上所述,底层34为用作形成微结构体的底面的组成要素,且可以为具有亲水性表面的任意薄膜,使得微结构体可以形成在其上。并且,上面所说明的实施例中,沿着形成在贴片制造用片材30的组成要素的剥离膜33上的切割线除去剥离膜33的中心部分,由此露出的粘合剂层32上附着上述底层34。
本实施例的特征在于,不另外形成底层34,而构成粘合剂层32的粘性材料实现为亲水性物质,使得微结构体可以形成在所述粘性材料上。
为了与图2中的实施例进行比较,图6中在上方示出如图2所示的实施例,而在下方示出本实施例。
在图2的实施例中贴片制造用片材30的制造工序由第一步骤即片材的提供、第二步骤即剥离膜33中心部分的除去及第三步骤即底层34的结合构成,与此相反,在图6的实施例中贴片制造用片材30的制造工序仅由第一步骤即片材的提供和第二步骤即剥离膜33中心部分的除去构成。
如上所述,当将形成粘合剂层32的粘性材料实现为能够在粘合剂层32上形成微结构体的亲水性物质时,可以简化贴片制造用片材30的制造工序。
在本实施例中可使用的构成粘合剂层32的亲水性粘性材料为具有亲水基团的粘合性聚合物材料。优选地,在本实施例中可使用的构成粘合剂层32的亲水性粘性材料可以为可药用的具有压敏粘合性的亲水性粘合性聚合物材料。例如,可以使用含有如丙烯酸酯聚合物、乙酸乙烯酯-丙烯酸酯共聚物等丙烯酸类树脂的上市产品。
如上所述,不另外形成底层34的贴片制造用片材30是通过在形成基底结构层35之后其上层叠用作微针的功能材料来,以基底结构层35和功能材料层36的双层可实现的,且在功能上可以省略基底结构层35。
- 还没有人留言评论。精彩留言会获得点赞!