一种抗脑缺血的中药提取物、组合物及其制剂与用途的制作方法
本发明涉及一种以中草药为原料的提取物,特别是一种抗脑缺血组合物及其制剂与用途。
背景技术:
缺血性脑血管疾病是脑血管疾病中最常见的类型(占60-70%),是临床医学亟待解决的难题,近年呈现出明显的年轻化趋势。缺血性脑血管疾病机制目前尚不完全清楚,药物研究者根据现有认识,从抗血小板聚集(阿司匹林等)、溶栓(链激酶、尿激酶等)、抗凝(肝素等)、神经保护(Ca2+通道阻滞剂等)、自由基清除(NXY-059等)等多方面开展工作,取得了很多有益的成果。然而,神经保护剂可能加重脑缺氧、缺血,加重酸中毒;阿司匹林、肝素药物受到质疑;链激酶被叫停;自由基清除药物临床疗效有限。提示当前抗脑缺血药物的基础和临床研究均不尽如人意因此,寻找安全、高效抗脑缺血药物具有重大的临床价值和社会意义。
齿果酸模(Rumex dentatus L.)为蓼科(Polygonaceae)酸模属(Rumex)植物,广泛分布于江苏滩涂。《中华本草》记载其以根或全草入药,具凉血,解毒,通便,杀虫功效,可用于内出血,痢疾,便秘,内痔出血;外用治疥癣,疔疮,神经性皮炎,湿疹。迄今为止,齿果酸模抗脑缺血相关研究尚未见报道,更未见抗脑缺血组合物制备及用途的文献报道。
技术实现要素:
本发明所要解决的技术问题是针对现有技术的不足,提供一种原料简单、效果显著的抗脑缺血的中药提取物。
本发明所要解决的另一个技术问题是提供了上述抗脑缺血的中药提取物的制剂。
本发明所要解决的另一个技术问题是提供了一种抗脑缺血的组合物。
本发明所要解决的另一个技术问题是提供了上述抗脑缺血的组合物的制剂。
本发明所要解决的再一个技术问题是提供了齿果酸模、上述中药提取物、组合物的用途。
本发明所要解决的技术问题是通过以下的技术方案来实现的。本发明是一种抗脑缺血的中药提取物,其特点是,该中药提取物以齿果酸模(Rumex dentatus L.)地下部分为原料,采用水提或者醇提方法提取得到。
本发明所要解决的技术问题还可以通过以下的技术方案来进一步实现。本发明还公开了一种抗脑缺血的组合物,其特点是:该组合物从齿果酸模(Rumex dentatus L.)地下部分提取得到,其提取方法如下:将齿果酸模地下部分清洗,干燥,粉碎后,用水或者醇类溶剂浸提,浸提液合并后低温减压浓缩得浸膏,浸膏经水复溶后,以乙酸乙酯萃取,合并萃取相,得到萃取物;萃取物经MCI柱色谱处理,以乙醇水溶液洗脱,收集75%乙醇洗脱部分,即得到以下述15个单体化合物为主要成份的组合物:
化合物1:酸模素(Nepodin);
化合物2:大黄酚(Chrysophanol);
化合物3:大黄素甲醚(Physcion);
化合物4:槲皮素(Quercetin);
化合物5:大黄素(Emodin);
化合物6:没食子酸甲酯(Methyl gallate);
化合物7:大黄素1,6-二甲醚(1,6-dimethylemodin);
化合物8:大黄酸(Rhein);
化合物9:5-甲氧基酸模素(Torachrysone);
化合物10:大黄素8-O-β-D吡喃葡萄糖苷
(Emodin-8-O-β-D-glucopyranoside);
化合物11:土大黄苷(Rhaponticin);
化合物12:山奈酚(Kaempferol);
化合物13:大黄素甲醚8-O-β-D吡喃葡萄糖苷
(Physcion-8-O-β-D-glucopyranoside);
化合物14:白藜芦醇(Resveratrol);
化合物15:大黄酚8-O-β-D吡喃葡萄糖苷
(Chrysophanol-8-O-β-D-glucopyranoside)。
上述主要化合物结构式如下:式中数字代表化合物编号:
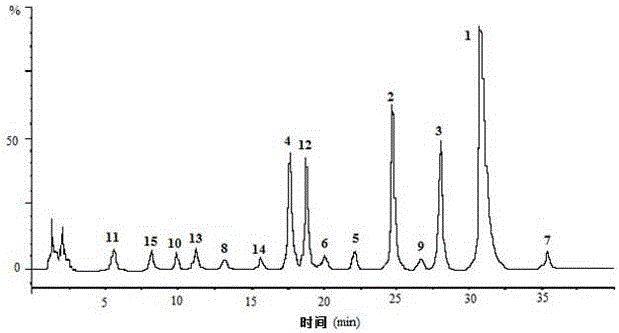
组合物HPLC分析图参见图2,组合物中主要单体化合物重要波谱数据如下:
化合物1
1H NMR(DMSO-d6)
7.20(1H,dd,J=8.0,1.5Hz,H-5),7.27(1H,t,J=8.1,8.1Hz,H-6),7.06(1H,s,H-4),6.89(1H,dd,J=8.0,1.5Hz,H-7),2.55(3H,s,H-12),2.31(3H,s,H-13)
13C NMR(DMSO-d6)
204.5(C-11),153.6(C-1),151.7(C-8),135.3(C-10),132.3(C-3),129.8(C-6),124.7(C-5),117.8(C-4),116.9(C-9),113.1(C-2),111.1(C-7),32..6(C-12),19.9(C-13)
MS(ESI-MS):215(m/z)[M-1]-。
化合物2
1H NMR(CDCl3)
7.88(1H,dd,J=7.5,1.5Hz,H-5),7.71(1H,t,J=8.1,7.5Hz,H-6),7.56(1H,s,H-4),7.36(1H,dd,J=7.5,1.5Hz,H-7),7.21(1H,s,H-2),2.42(3H,s,-CH3)
13C NMR(CDCl3)
189.0(C-9),181.1(C-10),162.7(C-1),161.3(C-8),148.7(C-3),136.9(C-6),123.6(C-2),122.8(C-7),120.6(C-4),119.2(C-5),21.7(-CH3)
MS(ESI-MS):253(m/z)[M-1]-。
化合物3
1H NMR(DMSO-d6)
12.20(1H,s,OH-1),12.01(1H,s,OH-8),7.51(1H,s,H-4),7.34(1H,s,H-5),7.07(1H,s,H-2),6.66(1H,d,J=2.4Hz,H-7),3.87(3H,s,-OCH3),2.34(3H,s,-CH3)
13C NMR(DMSO-d6)
190.9(C-9),181.1(C-10),167.1(C-6),164.7(C-1),162.1(C-8),148.3(C-3),122.1(C-2),108.1(C-5),105.8(C-7),56.1(-OCH3),21.6(-CH3)
MS(ESI-MS):283(m/z)[M-1]-。
化合物4
1H NMR(DMSO-d6)
12.5(1H,s,OH-5),7.61(1H,d,J=2.1Hz,H-2’),7.53(1H,d,J=2.1Hz,H-6’),6.74(1H,d,J=7.7Hz,H-5’),6.56(1H,d,J=2.0 Hz,H-8),6.53(1H,d,J=2.0Hz,H-6)
13C NMR(DMSO-d6)
176.6(C-4),163.8(C-7),161.2(C-9),156.5(C-5),149.0(C-4’),147.3(C-2),145.7(C-3’),136.2(C-3),122.2(C-1’),120.6(C-6’),116.3(C-5’),115.6(C-2’),103.2(C-10),98.8(C-6),93.7(C-8)
MS(ESI-MS):301(m/z)[M-1]-。
化合物5
1H NMR(DMSO-d6)
12.00(1H,s,OH-1),11.84(1H,s,OH-8),11.50(1H,s,OH-6),7.47(1H,s,H-4),7.12(1H,s,H-5),6.98(1H,s,H-2),6.54(1H,d,J=2.4Hz,H-7),2.37(3H,s,-CH3)
13C NMR(DMSO-d6)
190.1(C-9),180.9(C-10),166.0(C-6),164.6(C-1),161.8(C-8),148.3(C-3),123.5(C-2),120.3(C-4),108.6(C-5),107.7(C-7),21.5(-CH3)
MS(ESI-MS):269(m/z)[M-1]-
化合物6
1H NMR(CD3OD)
7.12(2H,s,H-2,6),3.64(3H,s,-CH3)
13C NMR(CD3OD)
168.4(-CO),146.5(C-3,5),139.9(C-4),122.3(C-1),110.1(C-2,6),54.3(-OCH3)
MS(ESI-MS):183(m/z)[M-1]-。
化合物7
1H NMR(DMSO-d6)
12.94(1H,s,OH-8),7.47(1H,s,H-4),7.36(1H,s,H-5),7.06(1H,s,H-2),6.76(1H,d,J=2.3Hz,H-7),3.84(3H,s,OCH3-6),3.68(3H,s,OCH3-1),2.30(3H,s,-CH3)
13C NMR(DMSO-d6)
191.2(C-9),180.7(C-10),166.4(C-6),163.2(C-1),162.7(C-8),147.8(C-3),123.0(C-2),110.1(C-5),105.8(C-7),56.5(OCH3-1),55.8(OCH3-6),21.6(-CH3)
MS(ESI-MS):297(m/z)[M-1]-。
化合物8
1H NMR(DMSO-d6)
7.86(1H,dd,J=7.2,1.4Hz,H-5),7.66(1H,t,J=7.6,4.8Hz,H-6),7.41(1H,s,H-4),7.28(1H,dd,J=7.2,1.4Hz,H-7),7.09(1H,s,H-2)
13C NMR(DMSO-d6)
190.2(C-9),180.7(C-10),168.8(-COOH),162.6(C-1),160.9(C-8),147.8(C-3),136.8(C-6),122.1(C-2),121.6(C-7),120.7(C-4),119.3(C-5)
MS(ESI-MS):283(m/z)[M-1]-。
化合物9
1H NMR(DMSO-d6)
7.33(1H,s,H-5),7.12(1H,s,H-4),6.75(1H,s,H-7),3.94(3H,s,-OCH3),2.55(3H,s,H-12),2.31(3H,s,H-13)
13C NMR(DMSO-d6)
203.9(C-11),167.1(C-6),153.6(C-1),150.6(C-8),135.3(C-10),131.7(C-3),118.2(C-4),117.1(C-9),112.7(C-2),111.7(C-5),109.6(C-7),56.2(-OCH3),33.2(C-12),19.9(C-13)
MS(ESI-MS):229(m/z)[M-1]-。
化合物10
1H NMR(DMSO-d6)
13.33(1H,s,OH-1),12.86(1H,s,OH-6),7.36(1H,s,H-4),7.18(1H,s,H-5),7.04(1H,s,H-2),6.76(1H,s,H-7),4.94(1H,s,H-1’),2.37(3H,s,H-11)
13C NMR(DMSO-d6)
188.9(C-9),181.7(C-10),165.2(C-6),162.1(C-1),161.8(C-8),148.0(C-3),124.2(C-2),120.1(C-4),109.0(C-5),108.5(C-7),21.5(-CH3),101.4(C-1’),78.2(C-2’),76.8(C-3’),74.2(C-4’),71.0(C-5’),61.6(C-6’)
MS(ESI-MS):431(m/z)[M-1]-。
化合物11
1H NMR(DMSO-d6)
9.43(1H,s,OH-4),8.87(1H,s,OH-11),7.00(1H,s,H-10),6.97(1H,d,J=12.4Hz,H-8),6.94(1H,d,J=7.8Hz,H-14),6.84(1H,d,J=7.8Hz,H-13),6.78(1H,d,J=12.4Hz,H-7),6.72(1H,s,H-1),6.61(1H,s,H-5),6.32(1H,s,H-3),4.89(1H,s,H-1’),3.72(3H,s,-OCH3)
13C NMR(DMSO-d6)
158.9(C-2),157.7(C-4),147.2(C-12),146.1(C-11),139.8(C-6),130.0(C-9),129.2(C-8),126.1(C-7),119.0(C-14),114.1(C-10),111.8(C-13),107.5(C-5),105.1(C-1),103.0(C-3),100.4(C-1’),77.2(C-5’),76.8(C-3’),73.2(C-2’),70.0(C-4’),60.6(C-6’),55.5(-OCH3)
MS(ESI-MS):419(m/z)[M-1]-。
化合物12
1H NMR(DMSO-d6)
12.34(1H,s,OH-5),10.81(1H,s,OH-4’),10.35(1H,s,OH-7),9.46(1H,s,OH-3),8.31(2H,d,J=8.5Hz,H-2’,6’),6.72(2H,d,J=8.5Hz,H-3’,5’),6.31(1H,s,H-8),6.22(1H,s,H-6);
13C NMR(DMSO-d6)
93.5(C-8),98.3(C-6),103.0(C-10),115.7(C-5’),129.6(C-6’),129.6(C-2’),135.7(C-3),115.7(C-3’),121.6(C-1’),147.1(C-2),149.4(C-4’),156.2(C-5),160.9(C-9),163.8(C-7),175.7(C-4)
MS(ESI-MS):285(m/z)[M-1]-。
化合物13
1H NMR(DMSO-d6)
13.01(1H,s,OH-1),7.54(1H,d,J=2.8Hz,H-4),7.36(1H,s,H-5),7.17(1H,d,J=2.8Hz,H-2),7.14(1H,s,H-7),5.04(1H,s,H-1’),4.02(3H,s,-OCH3),2.43(3H,s,H-11)
13C NMR(DMSO-d6)
187.3(C-9),181.9(C-10),165.4(C-6),162.1(C-1),161.3(C-8),148.0(C-3),124.6(C-2),120.1(C-4),108.0(C-7),107.5(C-5),56.3(-OCH3),21.7(-CH3),101.4(C-1’),78.2(C-5’),76.8(C-3’),74.2(C-4’),71.0(C-2’),61.6(C-6’)
MS(ESI-MS):445(m/z)[M-1]-。
化合物14
1H NMR(DMSO-d6)
7.31(2H,d,J=7.8Hz,H-2’,6’),7.01(1H,d,J=12.2Hz,H-β),6.89(1H,d,J=12.2Hz,H-α),6.63(2H,d,J=7.8Hz,H-3’,5’),6.44(2H,d,J=2.4Hz,H-2,6),6.14(1H,d,J=2.4Hz,H-4)
13C NMR(DMSO-d6)
159.7(C-3,5),158.2(C-4’),139.2(C-1),130.3(C-1’),129.6(C-β),128.5(C-2’,6’),127.2(C-α),115.1(C-3’,5’),105.0(C-2,6),102.6(C-4)
MS(ESI-MS):227(m/z)[M-1]-。
化合物15
1H NMR(DMSO-d6)
12.93(1H,s,OH-1),7.92(1H,d,J=7.2Hz,H-5),7.83(1H,m,H-6),7.76(1H,d,J=7.2Hz,H-7),7.46(1H,s,H-4),7.12(1H,s,H-2),5.09(1H,s,H-1’),2.41(3H,s,H-11)
13C NMR(DMSO-d6)
188.0(C-9),182.1(C-10),162.0(C-1),158.8(C-8),147.6(C-3),136.1(C-6),123.7(C-2),122.1(C-7),119.8(C-5),118.8(C-4),21.5(-CH3),100.8(C-1’),78.2(C-5’),76.8(C-3’),74.2(C-4’),71.0(C-2’),61.6(C-6’)
MS(ESI-MS):415(m/z)[M-1]-。
本发明所述的一种抗脑缺血的组合物,其进一步优选的技术方案是:所述的醇类溶剂为90%以上的乙醇。
本发明所述的一种抗脑缺血的组合物,其进一步优选的技术方案是:萃取以1-3倍体积的乙酸乙酯进行。
本发明所述的一种抗脑缺血的组合物,其进一步优选的技术方案是:组合物中的主要成份通过以下方法进行分离纯化:利用LH-20色谱柱低速层析处理,根据不同时间段收集部分显色情况进行简单分组,然后利用反相硅胶反复柱层析,并结合必要的半制备高效液相分离制备各单体化合物,利用波谱手段完成所得单体化合物结构解析,再利用HPLC完成所得组合物含量分析。
本发明所要解决的技术问题还可以通过以下的技术方案来进一步实现。本发明是一种抗脑缺血的中药提取物制剂,其特点是,该制剂以以上技术方案所述的抗脑缺血的中药提取物为有效成份,加入药用辅料制成。
本发明所要解决的技术问题还可以通过以下的技术方案来进一步实现。本发明还提供了一种抗脑缺血的组合物制剂,其特点是,该制剂以以上技术方案所述的抗脑缺血的组合物为有效成份,加入药用辅料制成。
本发明所述的抗脑缺血的中药提取物制剂或者抗脑缺血的组合物制剂可以选用现有技术中常规剂型,优选胶囊剂、颗粒剂、片剂、溶液剂、丸剂、输液剂或者为注射剂。
本发明所述的中草药原料齿果酸模、中药提取物、组合物可以用于制备治疗因短暂性脑缺血或梗死导致的脑损伤的药物,也可以用于制备辅助治疗临床脑缺血相关疾病的保健品。
发明人研究表明,齿果酸模地下部分乙醇浸提物,可显著缩小局灶性脑缺血大鼠的脑梗死体积(阳性对照:尼莫地平),且与模型组比较存在显著性差异。进一步研究发现,乙酸乙酯萃取物能降低脑组织含水量、提高脑组织SOD活性(高剂量优于阳性对照)、降低MDA和NO(高剂量优于阳性对照)、保护皮层及海马神经、提高锥体细胞数、降低缺血周边区Bax表达量。该组合物主要包含15个单体化合物,其中化合物1、2、3、4、12为主要成分。
本发明的有益效果和意义在于:利用滩涂地区丰富但尚未被开发利用的齿果酸模资源,研究发现该植物地下部分具有抗脑缺血作用,制备得到抗脑缺血组合物及其制剂,该组合物主要由15个单体化合物组成,该组合物及其制剂主要具有抗脑缺血作用,能有效改善因短暂性脑缺血或梗死导致的脑损伤;临床上能够用于治疗缺血性脑卒中及不同面积的脑梗死,也能用于治疗因脑血栓等导致的脑损伤。本发明有望为临床提供一种治疗脑缺血损伤的植物药制剂。
该组合物及其制剂主要具有抗脑缺血作用,能有效改善因短暂性脑缺血或梗死导致的脑损伤;临床上能够用于治疗缺血性脑卒中及不同面积的脑梗死,也能用于治疗因脑血栓等导致的脑损伤。
附图说明
图1为组合物的制备流程图;
图2为组合物HPLC分析图;
图3-图5为抗脑缺血活性对比实验实结图,其中图3为对脑组织SOD的影响对比图,图4为对脑组织MDA的影响对比图;图5为对脑组织NO的影响对比图。
具体实施方式
以下进一步描述本发明的具体技术方案,以便于本领域的技术人员进一步地理解本发明,而不构成对其权利的限制。
实施例1,一种抗脑缺血的中药提取物,该中药提取物以齿果酸模(Rumex dentatus L.)地下部分为原料,采用水提或者醇提方法提取得到。
实施例2,一种抗脑缺血的组合物,该组合物从齿果酸模(Rumex dentatus L.)地下部分提取得到,其提取方法如下:将齿果酸模地下部分清洗,干燥,粉碎后,用水或者醇类溶剂浸提,浸提液合并后低温减压浓缩得浸膏,浸膏经水复溶后,以乙酸乙酯萃取,合并萃取相,得到萃取物;萃取物经MCI柱色谱处理,以乙醇水溶液洗脱,收集75%乙醇洗脱部分,即得到以下述15个单体化合物为主要成份的组合物:
化合物1:酸模素;
化合物2:大黄酚;
化合物3:大黄素甲醚;
化合物4:槲皮素;
化合物5:大黄素;
化合物6:没食子酸甲酯;
化合物7:大黄素1,6-二甲醚;
化合物8:大黄酸;
化合物9:5-甲氧基酸模素Torachrysone;
化合物10:大黄素8-O-β-D吡喃葡萄糖苷;
化合物11:土大黄苷;
化合物12:山奈酚;
化合物13:大黄素甲醚8-O-β-D吡喃葡萄糖苷;
化合物14:白藜芦醇;
化合物15:大黄酚8-O-β-D吡喃葡萄糖苷。
所述的醇类溶剂为90%以上的乙醇;萃取以2倍体积的乙酸乙酯进行。
组合物中的主要成份通过以下方法进行分离纯化:利用LH-20色谱柱低速层析处理,根据不同时间段收集部分显色情况进行简单分组,然后利用反相硅胶反复柱层析,并结合必要的半制备高效液相分离制备各单体化合物,利用波谱手段完成所得单体化合物结构解析,再利用HPLC完成所得组合物含量分析。
实施例3,一种抗脑缺血的中药提取物制剂,该制剂以实施例1所述的抗脑缺血的中药提取物为有效成份,加入药用辅料制成。所述的制剂剂型为胶囊剂、颗粒剂、片剂、溶液剂、丸剂、输液剂或者为注射剂。
实施例4,一种抗脑缺血的组合物制剂,该制剂以实施例2所述的抗脑缺血的组合物为有效成份,加入药用辅料制成。所述的制剂剂型为胶囊剂、颗粒剂、片剂、溶液剂、丸剂、输液剂或者为注射剂。
实施例3和4所述的制剂可以用于治疗因短暂性脑缺血或梗死导致的脑损伤或者辅助治疗临床脑缺血相关疾病的保健品。
实施例5,抗脑缺血的组合物进行抗脑缺血活性对比实验。
1、实验样品制备:
1kg齿果酸模干燥地下部分粉碎,90%乙醇浸提(3×5d),纱布过滤,低温减压浓缩得浸膏84g,浸膏经水复溶后,以2倍体积乙酸乙酯萃取,合并萃取相,得到萃取物19g。萃取物经MCI柱色谱处理,以乙醇水溶液(5%、75%、100%)洗脱,收集75%乙醇洗脱部分,低温减压得组合物6.4g,组合物超声溶解于生理盐水得3.2mg/mL溶液,经0.22μm滤膜过滤,得实验样品(相当于原生药1.6g/kg)。制备流程参照图1。
2、阳性对照:尼莫地平,剂量:12mg/kg。
3、抗脑缺血实验
SD大鼠(SPF,160±10g,)利用线栓法造局灶性脑缺血模型,造模24h后进行神经功能评分,大鼠出现右眼Horner征、提尾时左前肢内收屈曲、爬行时向左侧倾倒或按逆时针方向转圈标志模型成功,不成功者予以剔除。活性分子群组于造模再灌注时及其后的每隔24h腹腔注射上述实验样品,假手术组和模型组在相同时间腹腔注射等体积生理盐水。
脑梗死体积测定:各组随机取8只造模成功的大鼠,10%水合氯醛腹腔注射麻醉,迅速断头取脑,去除嗅球、小脑、低位脑干。其余脑组织置于-20℃冰箱短暂冷冻,于冰盘上自额极至枕极,以视交叉水平为中心,行冠状等厚(2mm)切片。脑片立即浸泡于2%TTC磷酸缓冲液中,37℃恒温避光孵育30min,用4%多聚甲醛固定24h后,脑片按脑的前后顺序排列,拍照,图像分析系统测量红、白区域面积,计算梗死体积比。
SOD、MDA、NO等测定:各组随机取8只造模成功的大鼠,10%水合氯醛腹腔注射麻醉,迅速断头取脑。取缺血再灌注侧和假手术侧大脑半球中部约200mg脑组织,按1∶9的比例加生理盐水冰浴下匀浆,3000rpm冷冻离心15min(4℃),上清液以考马斯亮兰法测定蛋白含量,黄嘌呤氧化酶法测定SOD活性,硫代巴比妥酸法测定MDA含量,硝酸还原酶法测定NO含量,所有的测定方法均参照试剂盒说明进行。结果,参照图3-5,图中:#P<0.01与假手术组比较,*P<0.01与模型组比较。通过图3-图5可知,齿果酸模提取得到的组合物能有效降低机体中NO、MDA的含量,且结果与模型组相比较具有统计学意义;另外,齿果酸模提取物能有效提高机体中SOD水平,结果也具有统计学意义(与模型组对比)。上述结果说明,齿果酸模提取物能有效降低机体因脑组织脂质过氧化损伤的风险,同时能增加体内清除氧自由基的能力,体现出较好的神经保护作用,提示齿果酸模抗脑缺血可能是基于其神经保护机制。
实施例5,组合物HPLC分析实验:
单体化合物1、2、3、4、12购自中检所,准确称量后甲醇定容于5mL容量瓶,浓度分别为800、1000、1120、1200、1120μg/mL,然后用色谱甲醇依次稀释,得到梯度溶液,最低浓度分别为3.2、2.0、2.2、2.4、2.2μg/mL,以峰面积比为Y轴,样品浓度为X轴,分别得到各成分标准曲线如下:
单体化合物1:Y=62974X-644,r=0.995
单体化合物2:Y=87036X-1326,r=0.992
单体化合物3:Y=93055X-2302,r=0.989
单体化合物4:Y=103682X-5792,r=0.993
单体化合物12:Y=11276X-7493,r=0.989
得到单体化合物1、2、3、4、12在组合物的质量分数分别为22.3%、17.4%、12.6%、16.4%、15.2%,共计83.9%。
HPLC实验条件如下:
Thermo Ultimate 3000,色谱柱:Waters Symmetry300 C18,4.6×250mm,5μm
流速:1.0 mL/min
流动相:甲醇(A)-0.5%甲酸水(B)
实施例6,乙醇浸提物急性毒性研究(MTD)实验
1kg齿果酸模干燥地下部分粉碎,90%乙醇浸提(3×5d),纱布过滤,低温减压浓缩得浸膏84g,浸膏悬浮于0.5%羟甲基纤维素钠溶液,得500、1000、2000mg/mL悬浮液备用。
昆明种小鼠(SPF,23±1g,♀各半)80只,禁食12h后,随机分为4组(20只/组,♀各半),按40mL/kg给药容量分别灌胃给予蒸馏水、试药,连续观察7d,以少动、蜷缩、闭目、震颤作为中毒表现。
给药后高中剂量组小鼠2h内出现少动、毛色不华等现象,4h内出现腹泻现象,高剂量组24h内小鼠死亡3只,48h中剂量组死亡2只,72h后高中剂量组逐渐活动正常,根据给药剂量计算得到醇浸提物小鼠急性毒性MTD值146g kg-1。
- 还没有人留言评论。精彩留言会获得点赞!