一氧化碳释放分子‑2制剂及其在制备抗猪繁殖与呼吸综合征病毒药物上的应用和检测方法与流程
本发明属于抗病毒研究技术领域,具体涉及一氧化碳释放分子-2制剂及其在制备抗猪繁殖与呼吸综合征病毒药物上的应用和检测方法。
背景技术:
猪繁殖与呼吸综合征(Porcine repsoductive and respiratory syndrome,PRRS),又称猪蓝耳病,是一种由猪繁殖与呼吸综合征病毒(Porcine repsoductive and respiratory syndrome virus,PRRSV)引起的,能引起妊娠母猪繁殖障碍(后期出现流产、弱胎、死胎、木乃伊胎等)及各年龄段猪特别是仔猪呼吸道症状(间质性肺炎)和高死亡率为主要特征的猪重要传染病,因此对养猪业危害极大。
猪繁殖与呼吸综合征对整个养猪行业构成严重威胁,由于人们对该病免疫逃逸的分子机制缺乏了解,目前疫苗的使用也不能提供有效且可持续的疾病控制,特备是对那些RNA类病毒更是无能为力;同时基于对健康安全食品的关注和需求,动物抗生素的使用已引起越来越多消费者的反对。因此,开发有效的抗病毒药物及制定新型抗病毒策略仍然极为重要和迫切。
CORM-2(Tricarbonyldichlororuthenium(II)dimer),中文名称是一氧化碳释放分子-2,其结构式如式I所示:
技术实现要素:
本发明的目的在于,提供一氧化碳释放分子-2制剂,以克服现有技术所存在的上述缺点和不足。
本发明的另一个目的是提供一氧化碳释放分子-2制剂在制备抗猪繁殖与呼吸综合征病毒药物上的应用。
本发明的另一个目的是提供一氧化碳释放分子-2制剂的检测方法。
本发明通过体外实验发现CORM-2具有明显抑制猪繁殖与呼吸综合征病毒复制的作用,为通过药物治疗增强对猪繁殖与呼吸综合征病毒的防控提供有力支持。因此,本发明提供一种CORM-2在制备抗猪繁殖与呼吸综合征病毒药物上的应用,同时本发明提供一种CORM-2在制备抗猪繁殖与呼吸综合征病毒复制制剂。
本发明所需要解决的技术问题,可以通过以下技术方案来实现:
本发明通过体外实验发现CORM-2具有明显抑制猪繁殖与呼吸综合征病毒复制的作用,为通过药物治疗增强对猪繁殖与呼吸综合征病毒的防控提供有力支持。因此,本发明提供一种CORM-2在制备抗猪繁殖与呼吸综合征病毒药物上的应用,同时本发明提供一种CORM-2在制备抗猪繁殖与呼吸综合征病毒复制制剂中的应用。
一种抗猪繁殖与呼吸综合征病毒的药物制剂,包括有效量的CORM-2和药学上可接受的辅料。优选地,所述药物制剂为注射制剂或口服制剂。更优选地,所述注射制剂为冻干粉针剂;所述口服制剂为散片剂、胶囊剂或颗粒剂。
本发明首先采用qPCR、western blot、TCID50和间接免疫荧光技术检测CORM-2这种药物对猪繁殖与呼吸综合征病毒在Marc-145细胞中复制的影响。然后再通过qPCR,western blot和TCID50检测CORM-2对猪繁殖与呼吸综合征病毒在PAM细胞复制的影响,在上述结果的基础上对COMR-2的抗病毒效果进行评价。
本发明的有益效果:
1、本发明的CORM-2生产工艺成熟,可以为抗猪繁殖与呼吸综合征病毒的药物制备提供充足的原料。
2、本发明的CORM-2抗猪繁殖与呼吸综合征病毒的效果明显,本发明通过体外实验发现,CORM-2能显著抑制PRRSV在Marc-145细胞和PAM细胞中复制与增殖。
3、本发明使用方便,药品为粉末制剂,2-8℃密封保存即可保存,易于运输,且即溶即用。
附图说明
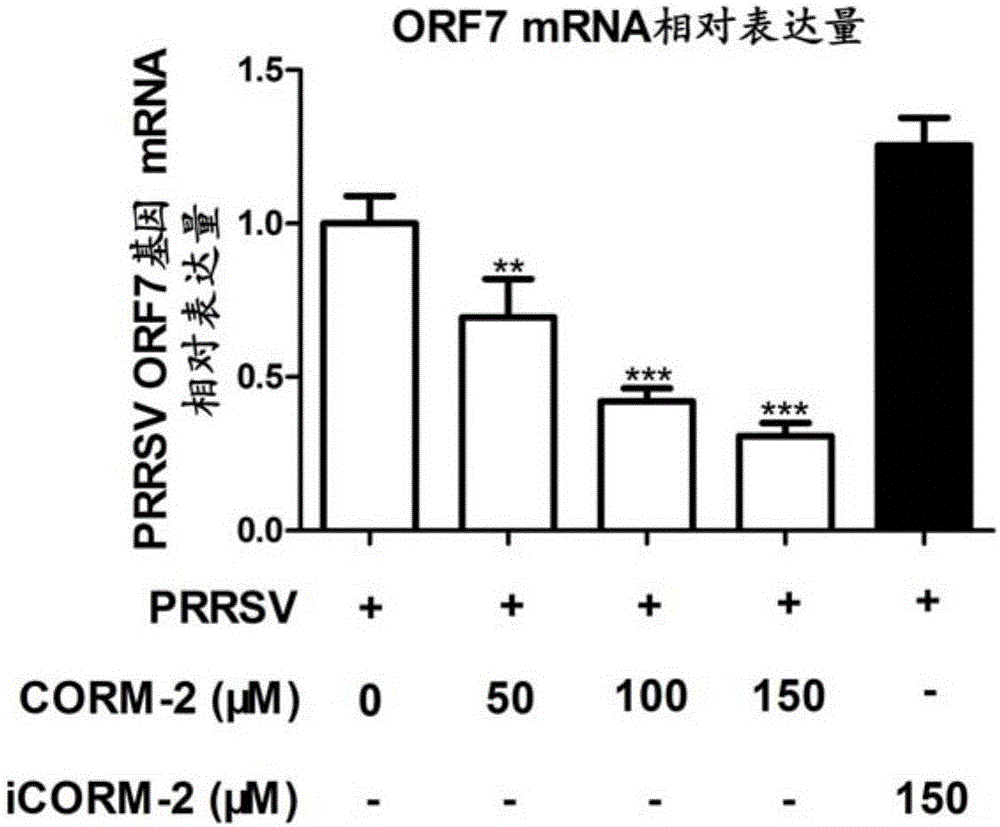
图1是qPCR检测不同浓度CORM-2处理后PRRSV ORF7 mRNA表达。
图2是western blot检测不同浓度CORM-2处理对PRRSV感染Marc-145细胞的影响。
图3是不同浓度CORM-2处理后Marc-145细胞培养上清PRRSV TCID50的测定。
图4间接免疫荧光检测不同浓度CORM-2处理对PRRSV N蛋白表达的影响。图4为合并红光和蓝光的结果,其中,中间的蓝色部分为细胞核部分,由DAPI染色;左侧的红色荧光为标记了TRITC的病毒N蛋白。
图5是qPCR检测不同浓度CORM-2处理后PAM细胞中PRRSV ORF7mRNA表达。
图6是western blot检测不同浓度CORM-2处理对PRRSV感染PAM细胞的影响。
图7是不同浓度CORM-2处理后PAM细胞培养上清PRRSV TCID50的测定。
具体实施方式
以下结合具体实施例,对本发明作进步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
实施例中如无特殊说明,均为本领域常规实验技术。
本发明实施例中选用Marc-145细胞(恒河猴肾细胞MA-104的衍生细胞系)作为PRRSV高致病毒株GD-HD的营养基质,为PRRSV繁殖提供营养,因此选用Marc-145细胞不对本发明的范围做任何限定。
实施例中所用材料来源:
CORM-2购自Sigma公司;DMEM,RPMI1640、胎牛血清(FBS)购自Gibco;GD-HD-PRRSV由西北农林科技大学动物医学院兽医免疫生物学课题组分离;FastStart Universal SYBR Green Master购自Roche公司;Primescript RT reagent Kit购自大连宝生;灭活CORM-2(iCORM-2)的制备如下所述:CORM-2溶于DMSO后,在37℃,5%CO2的潮湿条件下孵育24h,以充分释放一氧化碳。Marc-145细胞(恒河猴肾细胞MA-104的衍生细胞系)登载于中国典型培养物保藏中心(保藏编号GDC041)的目录中,处于公开状态,科学工作者可向该菌种保藏中心索取。猪肺泡巨噬细胞(PAM)来源详见下文所述。针对PRRSV N蛋白的特异性单克隆抗体由西北农林科技大学动物医学院兽医免疫生物学课题组制备。
实施例1 qPCR检测细胞内PRRSV ORF7基因mRNA相对表达量样品的收集
PRRSV接种80%汇合度的Marc-145细胞,37℃孵育1h,吸弃病毒液,细胞用1×PBS洗3次,分别加入含有不同浓度的CORM-2(50μM、100μM、150μM)以及3%胎牛血清的DMEM维持液培养基于37℃,5%CO2的加湿培养箱中培养;同时用不含CORM-2的3%胎牛血清的DMEM维持液培养基及加入含150μM iCORM-2的维持液培养基作为对照,24hpi收集细胞及上清。
细胞样品总RNA提取
(1)每107个/细胞加入1ml Trizol,吹打混匀至无肉眼可见沉淀,室温静止5min。
(2)向上述匀浆裂解液中加入氯仿(1/5Trizol的体积量),盖紧离心管盖,用涡旋振荡仪振荡15s。待溶液充分乳化(无明显分层现象)后,再室温静置5min。
(3)12000g,4℃离心5min。
(4)从离心机中小心取出离心管,此时匀浆分为三层,无色的上清、中间白色蛋白层及带有颜色的下层有机相。小心吸取上清转移至另一新的离心管中(切记勿吸出白色中间层)。
(5)向上清中加入等体积的异丙醇,上下颠倒离心管充分混匀后,室温下静置10min。
(6)12000g 4℃离心10min;离心后,试管底部出现白色沉淀。
(7)RNA沉淀的清洗:小心弃去上清,缓慢地沿离心管壁加入75%乙醇1ml(切勿触及沉淀),轻轻上下颠倒洗涤离心管壁,12000g 4℃离心5min,小心弃去乙醇,应尽量使乙醇挥发干净。
(8)RNA溶解:室温干燥沉淀,加入适量的RNase-free水溶解,待RNA沉淀完全溶解后于-80℃保存待用。
实时荧光定量PCR(qPCR)检测的方法与步骤
(1)总RNA浓度的测定:每个吸取2.0μl总RNA样品,使用BioTek微孔定量方法测定所提取的样品总RNA的浓度(ng/μl);
(2)反应混合液的配制:按下列组份在冰上配制反应混合液qPCR反转录反应体系,如表1所示。
表1
(3)进行反转录反应:反转录条件如下,如表2所示。
表2
qPCR检测引物及检测方法
qPCR检测引物序列,如表3所示。
表3
cDNA样品稀释:将反转录获得的cDNA按照1:10(10μl cDNA+90μl ddH2O)比例进行稀释并充分混匀置于冰上待做进一步检测。
qPCR检测:
qPCR反应混合液配制如下,如表4所示。
表4
将上述各成分依次加入EP管中混合均匀,将混合液转移至qPCR反应八连管中,7.5μl/孔,然后取稀释好的cDNA分别加入八连管中,2.5μl/孔,盖好八连管盖子后,轻弹管壁充分混匀后立即进行qPCR反应。
(4)qPCR反应条件,如表5所示。
表5
从细胞内PRRSV ORF7基因相对定量(图1)检测结果可以看出,随着CORM-2浓度的增加,病毒ORF7基因的表达逐渐降低,且与对照组比较差异显著,而灭活的iCORM-2对PRRSV ORF7基因表达无显著影响。
实施例2Western blot检测CORM-2对PRRSV感染Marc-145细胞的影响
Western blot检测蛋白样品来自实施例1所收集的细胞样品。
(1)准备:用自来水冲洗烧杯、电泳仪及其配件,然后用去离子水冲洗干净,晾干备用。玻璃板和梳子分别冲洗干净后再用去离子水冲洗,晾干备用。
(2)配制12%分离胶先组装好胶板,根据所需要的分离胶浓度按照下表查找每种成分的使用量及比例,如表6所示。
表6 12%分离胶配方
在烧杯中依次加入超纯水、30%丙烯酰胺、1.5M Tris-HCl缓冲液、10%APS在抽气机上将混合液中的空气充分抽干后再加入10%SDS,最后加TEMED。加入TEMED后充分混匀,立即用1ml移液器加入到胶板中。然后,在胶上轻轻加入去离子水封闭,以防蒸发。分离胶室温30min左右即可凝固。然后按照下表配制5%积层胶,如表7所示。
表7 5%的积层胶配方
烧杯中依次加入超纯水、30%丙烯酰胺、1.0M Tris-HCl缓冲液、10%SDS、10%APS、此时,倒掉分离胶上的超纯水,并用滤纸小心吸干残留水分,再将TEMED加入烧杯中,混匀后立即用移液器加入到分离胶上,插入合适的梳子。积层胶20min左右即可完全凝固。
(3)加样:小心拔掉梳子,组装好电泳仪,然后倒入1×Running Buffer,将蛋白Marker和样品依次加入胶孔中,并做好记录。
(4)跑胶:Bio-Rad电泳仪固定在200V跑胶,当溴酚蓝染带刚刚要跑出时停止跑胶。
(5)转膜:PVDF膜的处理:将事先裁好的和胶条一样大小的PVDF膜浸入甲醇中,活化15s,然后将膜直接浸入转膜液中,滤纸则直接浸入转膜液中,使其平衡。转膜:采用Bio-Rad转膜仪,从负极到正极依次为海绵、3层滤纸、胶条、PVDF膜、3层滤纸、海绵。用铲子轻轻赶出滤纸、胶条、膜之间的气泡后,固定好夹子开始用150mA恒定电流在冰水混合物种开始转膜。
(6)免疫反应:
a.转膜完毕后,将PVDF膜小心取出,置于封闭液中室温轻摇孵育1h。
b.弃掉封闭液,用PBS’T在摇床上剧烈摇晃洗膜,5min×4次。
c.加入用封闭液稀释好的针对目的蛋白的一抗,4℃摇床轻摇孵育过夜。
d.弃掉一抗,PBS’T在摇床上剧烈摇晃洗膜,5min×4次。
e.加入HRP-标记的用封闭液稀释好的二抗,室温轻摇孵育1h。
f.弃掉二抗,PBS’T洗膜,5min×4次。
(7)ECL发光试剂盒显色。
从图2可以看出,当CORM-2以浓度梯度依赖性方式抑制PRRSV N蛋白表达,而iCORM-2对N蛋白表达无显著影响。
实施例3不同浓度CORM-2处理后Marc-145细胞培养上清PRRSV TCID50的测定
(1)铺板,将胰酶消化好的Marc145细胞调整密度为1×105个/ml,加到96空细胞培养板中,175μl/well大约24h长成单层。
(2)在96孔细胞培养板中用无血清的DMEM培养基将病毒液(病毒液来自实施例1所收集上清)作连续10倍的梯度稀释,从10-1~10-10。
(3)将稀释好的病毒接种到Marc145单层细胞上,每一稀释度接种一纵排共8孔,每孔接种100μL,正常细胞对照作两纵排,37℃,5%CO2孵育1h后换成3%FBS+DMEM维持液并置于37℃,5%CO2的加湿培养箱中培养。
(4)逐日观察并记录结果,一般需要观察5~7天。
(5)TCID50的计算:Karber法计算如下:lgTCID50=L-D(s-0.5);L:最高稀释度的对数;D:稀释度对数之间的差;S:阳性孔比率总和。
从图3可以看出,随着CORM-2浓度的增加,上清中PRRS病毒的滴度在下降,且呈剂量依赖性。而iCORM-2对上清病毒滴度无显著抑制作用。
实施例4间接免疫荧光法检测不同浓度CORM-2处理对病毒N蛋白表达的影响
(1)铺板:将Marc-145细胞以1×105个细胞/ml的密度加到24孔细胞培养板上,每孔500μl,大约24h达到80%汇合度。
(2)接毒:PRRSV接毒量为0.1MOI,37℃孵育1h,弃掉病毒液,1×PBS洗3次,加入含不同浓度CORM-2的3%FBS+DMEM维持液后继续培养。
(3)固定:培养约24h等细胞稍出现CPE现象,将毒液弃掉,加入400μl/孔的75%乙醇(需事先放在-20℃预冷),4℃固定30min。
(4)洗板:弃掉固定液,在洗板机上震荡洗板,400μl/孔PBS洗5min/次×4次,在生物安全柜中将24孔板吹干。
(5)孵育一抗:每孔加入150μl用PBS稀释好的抗PRRSV N蛋白的单抗6D10(1:300稀释),37℃孵育1h。
(6)洗板:在洗板机上震荡洗板,400μl/孔PBS洗5min/次×4次。
(7)孵育二抗:每孔加入150μl用PBS稀释好的TRITC标记的羊抗鼠IgG荧光二抗(1:300稀释),37℃避光孵育1h。
(8)染细胞核:在荧光二抗孵育将要结束的最后5min,加入100μl/孔的4’,6’-diamidino-2-phenylindole(DAPI)染色细胞核(DAPI用PBS按1:10000比例稀释)。
(9)洗板:在洗板机上震荡洗板,400μl/孔PBS洗5min/次×4次。
(10)观察荧光:去掉水,避光干燥后镜检。或加入100μl PBS后直接镜检。
从图4可以看出,随着CORM-2的增加,标记了TRITC的N蛋白表达(左侧的红色荧光)在减少,且呈剂量依赖性。而不加CORM-2的对照组和iCORM-2处理组N蛋白表达并无显著变化。从而更加确认CORM-2在PRRSV感染Marc-145细胞过程中可以发挥抗病毒作用。
实施例5不同浓度CORM-2处理后PAM细胞中PRRSV ORF7 mRNA表达的检测
PAM细胞的分离
(1)将托盘、废物缸置于生物安全柜中经紫外灯照射进行灭菌。
(2)将从猪体内采集得到的完整的肺脏用含双抗的PBS冲洗干净。
(3)肺脏置于托盘中,用止血钳夹住食管,将肺脏轻轻上提,用剪刀从气管打结点稍下2cm处剪去扎口,用10ml吸管吸取含双抗的PBS从此处灌入肺脏,体积约150ml-250ml,轻轻揉捏拍打肺脏,然后将吸管插入气管中,不断的吸出灌洗液至灭菌蓝口瓶中;如此反复灌洗肺脏2~4次,尽量灌洗出肺泡巨噬细胞。
(4)收集得到的灌洗液用不锈钢筛网过滤至新的无菌蓝口瓶中。
(5)过滤后的灌洗液分装到50ml离心管中,500r/min离心10min。
(6)弃去上清,加入20ml含双抗PBS重悬细胞,500r/min离心10min,洗涤细胞1次。
(7)弃去上清,用10ml 10%FBS的RPMI 1640培养基,将所有管中的PAM重悬并合入一个管中,准备细胞计数。
(8)对获得的PAM细胞稀释后进行计数。
(9)根据计数结果,依照不同试验目的,加入相应体积的10%FBS的RPMI 1640培养基调整细胞密度铺板,多余的PAM细胞进行冻存。
(10)根据细胞数量,按每管1ml,每毫升2×107个细胞密度,计算所需的冻存液体积,依照血清:DMSO=9:1比例配置冻存液。
(11)500r/min离心10min,弃去上清,用冻存液将细胞重悬并分装至冻存管中,按要求标记清楚后装入程序降温盒中于-80℃过夜,次日转入液氮中进行冷冻保存。
样品收集
原代PAM细胞以5×105个细胞/孔的密度铺于24孔细胞培养板中。待细胞贴壁后,吸弃培养上清,加入含PRRSV但不含胎牛血清的RPMI1640培养基,37℃孵育1h,吸弃病毒液,分别加入含有不同浓度CORM-2(50μM、100μM、150μM)的3%胎牛血清的RPMI1640维持液培养基于37℃,5%CO2的加湿培养箱中培养;同时用不含CORM-2的3%胎牛血清的RPMI 1640培养基及加入150μM iCORM-2的维持液培养基作为对照,24hpi收集细胞及上清。
qPCR检测方法同实施例1中所描述的方法。
从PAM细胞内PRRSV ORF7基因qPCR检测结果(图5)可以看出,随着CORM-2浓度的增加,病毒ORF7基因的表达逐渐降低,且与对照组比较差异显著,而灭活的iCORM-2对PRRSV ORF7基因表达无显著影响。
实施例6Western blot检测不同浓度CORM-2对PRRSV感染PAM细胞的影响
Western blot检测样品来自实施例5所收集的细胞样品。
Western blot检测方法同实施例2中所描述的方法。
Western blot检测结果如图6所示,与未经CORM-2处理对照组相比,CORM-2以浓度依赖性方式抑制PRRSV N蛋白表达,而iCORM-2对N蛋白表达无显著影响。
实施例7不同浓度CORM-2处理后PAM细胞培养上清PRRSV TCID50的测定
TCID50测定上清样品来自实施例5所收集的细胞培养上清。
TCID50测定方法同实施例3中所描述的方法。
TCID50测定结果如图7所示,与未经CORM-2处理对照组相比,CORM-2浓度梯度依赖性降低PAM细胞培养上清中子代病毒滴度,而iCORM-2对上清TCID50无显著影响。
以上对本发明的具体实施方式进行了说明,但本发明并不以此为限,只要不脱离本发明的宗旨,本发明还可以有各种变化。
- 还没有人留言评论。精彩留言会获得点赞!