褪黑素在制备治疗松动假体周围慢性炎症和骨质破坏的药物中的用途的制作方法
本发明属于药物新用途
技术领域:
,具体涉及褪黑素在制备治疗松动假体周围慢性炎症和骨质破坏的药物中的用途。
背景技术:
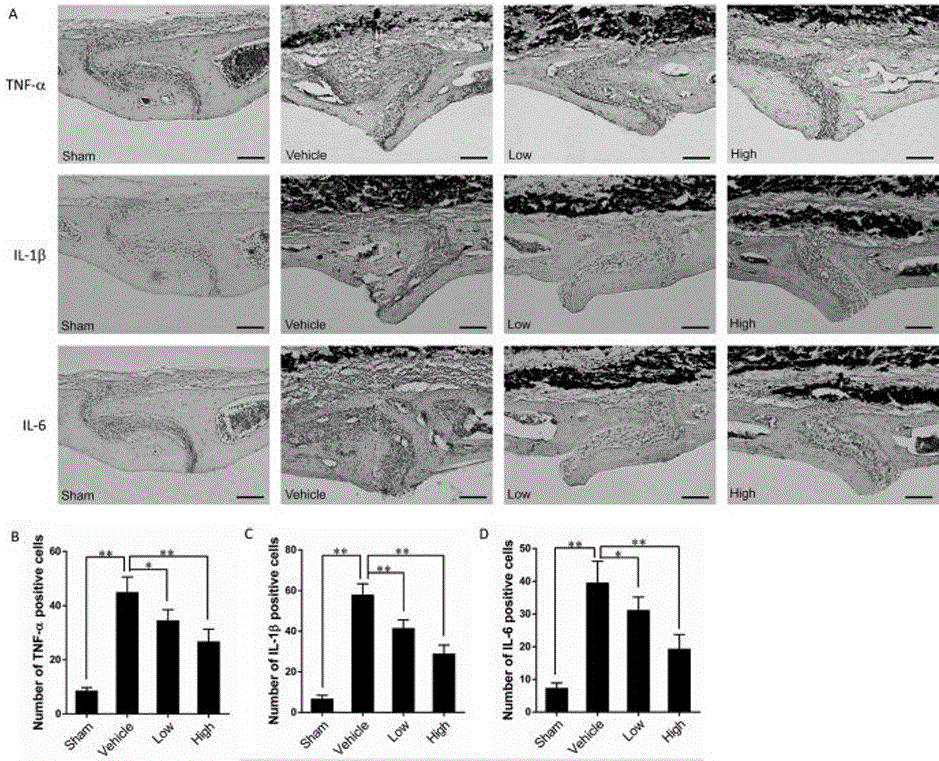
:磨损颗粒引起的假体周围慢性炎症和骨质破坏是引起无菌性松动(asepticloosening,AL)的病理基础,研究发现,人工假体置入后,材料与骨界面间的微动和长期的关节磨损,必然会产生大量的磨损颗粒,包括PMMA、聚乙烯以及金属颗粒等。磨损颗粒积聚在假体周围,一方面加重了局部摩擦,引起磨损颗粒增多,形成溶解-松动-溶解的恶行循环,另一方面磨损颗粒能引起周围结缔组织炎症反应,假体-骨界面的骨组织细胞吞噬磨损颗粒后,以自分泌或旁分泌的方式释放大量细胞因子,从而引起假体周围骨改建紊乱,导致假体松动。为了预防和治疗磨损颗粒诱导骨溶解而导致的人工假体失效,研究人员做了大量的工作,包括设计新型假体、采用耐磨材料,改进手术方法及固定技术等。这些技术以及材料的采用使得假体松动发生率明显降低,但磨损依然存在。除了后期的翻修手术,假体松动尚无有效的预防和治疗手段。但翻修手术对于初次人工关节置换而言手术难度大、效果差、费用高、创伤大,给患者带来巨大痛苦和负担。目前,越来越多的学者将注意力集中在阐释磨损颗粒诱导骨溶解的发生机制,寻求药理学干预措施阻断磨损颗粒诱导的骨质破坏作用。褪黑素(melatonin,Mel),化学名N-乙酰基-5-甲氧基色胺,CASNo:8041-44-9,分子式C13H16N2O2,分子量232.28,结构式如下:。褪黑素是松果体产生的一种吲哚胺类激素,既往研究证实褪黑素具有多种生理功能,包括促进睡眠、调节免疫、抗衰老、抗氧化、抗肿瘤等。美国FDA认为褪黑素可以作为普通的膳食补充剂。到目前为止,我国CFDA已经批准了20多种含有褪黑素的产品作为改善睡眠保健药品。近年来的研究发现,褪黑素在骨髓中也有表达,提示褪黑素可能参与骨发育的调控。最新的研究发现褪黑素能促进骨髓基质干细胞成骨分化,体内研究证实药理剂量的褪黑素能增加小鼠骨密度。但褪黑素对假体松动引起的慢性炎症和骨质破坏的保护作用尚未见有关报道。技术实现要素:要解决的技术问题:为了克服现有技术的不足,开发褪黑素的新用途,且寻找能够防治磨损颗粒引起的假体松动,抑制骨质破坏和炎症反应的有效药物,本发明提供了褪黑素在制备治疗松动假体周围慢性炎症和骨质破坏的药物中的用途。技术方案:褪黑素在制备治疗松动假体周围慢性炎症和骨质破坏的药物中的用途,所述褪黑素的化学结构式如下:,所述的药物包含药学上有效剂量的上述化合物和药学上可接受的载体。所述假体松动为磨损颗粒引起的假体松动。一种治疗松动假体周围慢性炎症和骨质破坏的药物,包含褪黑素。优选的,所述褪黑素在在药物中的质量分数为1-99%,优选10-90%。优选的,所述药物制成适用于胃肠道或非胃肠道给药的药物制剂,优选为常规片剂或胶囊剂或控释、缓释制剂。有益效果:本发明发掘了褪黑素新的药用前景,开拓了一个新的药用领域,其对假体松动疗效确切,具有高效防治磨损颗粒引起的假体松动的用途,同时能够显著降低炎症因子的表达,减轻磨损颗粒引起的炎症反应,抑制破骨细胞活化,促进骨溶解局部新骨形成,减轻磨损颗粒引起的骨质破坏。附图说明:图1为各实验组小鼠颅骨HE染色结果及颅骨骨溶解面积、颅骨厚度检测值。*p<0.05,**p<0.01。图2为免疫组织化学染色检测实验组小鼠颅骨炎症因子TNF-α、IL-1β和IL-6表达及阳性细胞计数结果。*p<0.05,**p<0.01。图3为micro-CT扫描各实验组小鼠颅骨的二维图像及小鼠颅骨陷窝数、骨密度(BMD)、骨体积(BV)及骨体积分数(BV/TV)检测值。*p<0.05,**p<0.01。图4为各实验组小鼠颅骨TRAP染色结果及破骨细胞数量、OCs/BS检测值。*p<0.05,**p<0.01。图5为免疫组织化学染色检测实验组小鼠颅骨局部ALP、Osterix和OCN表达及阳性细胞计数结果。*p<0.05,**p<0.01。图6为免疫组织化学染色检测实验组小鼠颅骨局部RANKL和OPG表达及阳性细胞计数结果。*p<0.05,**p<0.01。图7为免疫组织化学染色检测Wnt/β-catenin信号通路关键调节因子β-catenin和DKK1表达及阳性细胞计数结果。*p<0.05,**p<0.01。具体实施方式实施例11.主要药品及试剂褪黑素(melatonin,Mel),TRAP染色试剂盒,购自Sigma,美国;多聚甲醛、PBS、DAB显色剂、苏木素、伊红、无水乙醇、蒸馏水、10%水合氯醛。钛颗粒购自美国JohnsonMattheychemicals公司(catalog#00681;WardHill,Massachusetts);RANKL、OPG、TNF-α、IL-1β、IL-6酶联免疫吸附试验检测试剂盒,购自Biosource,美国;OPG、RANKL、β-catenin、DKK1、TNF-α、IL-1β、IL-6抗体均购自Abcam,英国。2.主要仪器Micro-CT(SkyScan1176,比利时)、石蜡切片机(Leica2135,德国)、烤片机(Leica1120,德国)、石蜡包埋机(BMJ-Ⅱ,中国,常州)、Axiovert40C光学显微镜(Zeiss,德国)、酶标仪(Biotec,美国)、手术器械一套。3.实验动物健康C57BL/J6小鼠60只,雄性,体重19~22g,8~10周龄,清洁级,由苏州大学动物实验中心提供[动物许可证号:SYXK(苏)2012-0045]。喂养条件如下:五只一笼,室温18~20℃,湿度50~60%,通风良好,自由摄食进水。实验过程中对C57BL/6小鼠的处置方法符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》。4.实验方法(1)钛颗粒(titanium,Ti)的观察及消毒处理Ti颗粒直径为3.32±2.39μm,其中90%的颗粒直径小于3.6μm,50%的颗粒直径小于1.6μm,10%的颗粒直径小于1.0μm。扫描电镜观察结果显示Ti颗粒形状不规则,大小不一。在使用前,Ti颗粒应消毒和去除内毒素。将Ti颗粒置于烘箱内,180℃烘烤6h后,硝酸(1M)浸泡4h,等渗盐水反复冲洗,2000rpm离心5min;后将其浸泡于75%乙醇,室温下振荡1h,重复四次,无水乙醇浸泡过夜,等渗盐水洗涤3次,2000rpm离心5min沉淀Ti颗粒;将Ti颗粒置于超净工作台中,紫外线照射条件下自然干燥后4℃保存备用。(2)实验动物分组雌性C57BL/6小鼠60只,采用随机数字表法分为4组:对照组(Sham),Ti颗粒植入组(Vehicle),Mel低剂量治疗组(Low-Mel)和Mel高剂量治疗组(High-Mel),每组15只小鼠。Sham组仅接受假手术,术后每天经腹腔300μl等渗盐水,6天/周;Vehicle组在小鼠颅骨表面植入Ti颗粒,术后每天经腹腔300μl等渗盐水,6天/周;Low-Mel和High-Mel组,Ti颗粒植入后,术后每天经腹腔5或50mgkg-1d-1Mel,持续2周。(3)小鼠颅骨骨溶解模型的制备采用Greenfield制备的小鼠颅骨骨溶解模型模拟磨损颗粒诱导骨溶解的病理过程。小鼠称重后,以40g/L水合氯醛按40mg/kg腹腔注射麻醉。麻醉成功后,采用小鼠固定板固定小鼠四肢和头部,颅顶局部皮肤去毛后安尔碘消毒。在颅骨表面沿颅骨正中矢状缝的体表投影位置作一长约1cm切口,暴露1cm×1cm的视野,不破坏骨膜。以小鼠颅骨矢状缝和冠状缝交汇处为中心,将消毒后的Ti颗粒50µl(400mg/ml)均匀涂在颅骨表面(20mg/只)。以4-0手术线间断缝合伤口。术后日光灯照射加温复苏小鼠,待小鼠完全苏醒后再放回饲养笼内。术前每只小鼠经皮下注射6-氯-α-甲基咔唑-2-乙酸4mg/kg;术后在饮用水中加入100mg/ml恩诺沙星,持续3天。(4)标本收集给药2周后,使用CO2箱处死小鼠,整体分离小鼠颅骨及颅下脑组织,剔除颅底附着软组织,每组小鼠颅骨平均分为3组:5个颅骨/组置于6孔板中,加入2ml含有1%青-链霉素的无血清DMEM培养基,在细胞培养箱中培养24h,2000rpm离心5min,收集上清,-80℃冻存;保留颅骨用于分子生物学检测。5个颅骨/组10%多聚甲醛固定48h后行micro-CT扫描。5个颅骨/组10%多聚甲醛固定48h后,再以10%EDTA脱钙,进行组织病理学检测。实施例2使用比利时SkyScan公司生产的高分辨显微CTSkyScan1076对小鼠颅骨进行扫描分析。扫描前将标本从固定液中取出,晾干。参照Zhai等的方法,用手术刀片轻轻去除颅骨表面黑色的Ti颗粒,避免扫描时金属伪影干扰。将每个颅骨放置在micro-CT测试试管杯中,每次5只,每个颅骨间用泡沫塑料片隔开;颅骨要摆放整齐,避免碰到试管壁。扫描参数设置为:扫描分辨率18μm,旋转角度180°,旋转角度量增0.9°,电压80kV,电流100μA,曝光时间100ms。扫描结束后,采用SkyScan1076自带软件进行颅骨三维重建。按照Wedemeyer建立的方法,使用CTAnalyzer分析软件(CTAn,SkyScan)在小鼠颅骨表面以冠状缝和矢状缝交汇处为中心选定一圆柱形感兴趣区域(Regionofinterest,ROI;3×3×1mm),分析以下参数:骨密度(Bonemineraldensity,BMD),以mg/cc表示;骨体积(Bonevolume,BV),以mm3表示;骨体积分数(Bonevolumetotissuevolumeratio,BV/TV;%);ROI区域内骨陷窝数(NumberofporeswithintheROI)。实施例31.骨组织染色及形态计量学分析组织标本的处理(1)标本固定:将新鲜的颅骨标本冲洗干净,放置于10%多聚甲醛溶液中浸泡48h;(2)标本脱钙:将固定后的颅骨放入装有10%EDTA脱钙液(pH7.4)的容器内,常温下脱钙3周,每3天换液。判断脱钙成功的方法:注射器针头可无阻力穿过颅骨,即为脱钙成功;(3)标本冲洗:脱钙成功后,将标本置于流水下冲洗2h,以彻底去除脱钙液成分;(4)标本脱水:将冲洗干净后的标本室温下分别通过50%乙醇、60%乙醇、70%乙醇、80%乙醇、90%乙醇、95%乙醇Ⅰ、95%乙醇Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ处理1h进行脱水;(5)透明:室温下将标本分别浸泡于二甲苯无水乙醇混合液(1:1)30min,二甲苯Ⅰ20min,二甲苯Ⅱ20min。在处理过程中应注意观察标本透明程度,待标本完全透明后即可进入下一步;(6)浸蜡:选用无色透明石蜡(Leica),在融蜡箱中融化,保持温度在58-60℃。将标本依次经过纯蜡/二甲苯(1/2),纯蜡/二甲苯(1/1),纯蜡/二甲苯(2/1),石蜡Ⅰ,石蜡Ⅱ,各1.5h;(7)包埋:将融化的石蜡倒入准备好的包埋盒内,将颅骨冠状位切面朝下按于包埋盒底部,待石蜡凝固后推出蜡块,制成固体蜡块;(8)切片、展片、烤片:将蜡块修整成梯形,用石蜡切片机将样品切成厚度约5μm的连续切片,正面放入43±2℃水浴中展片,用经过防脱片处理的载玻片捞片。常温放置24h后,将玻片放入烤箱(60℃)内烘烤4h。2.苏木素-伊红染色(Hematoxylinandeosinstaining,H&E)H&E染色是最常用的染色方法,本研究采用H&E染色观察颅骨表面大体变化,分析炎性细胞浸润及骨质破坏程度。具体操作步骤如下:(1)每个样品选择5张连续切片,放入烤箱(60℃)内烘烤30min;(2)石蜡切片经二甲苯(15min×2次)脱蜡后,依次经过无水乙醇,无水乙醇,95%乙醇,95%乙醇,90%乙醇、80%乙醇、75%乙醇各5min,去离子水冲洗;(3)苏木素染色3-5min,去离子水冲洗;(4)1%盐酸酒精分化20s,1%氨水返蓝30秒,去离子水冲洗;(5)l%伊红溶液复染5min,自来水冲洗5min,去离子水冲洗1min;(6)常规脱水、透明(75%乙醇5min,90%乙醇5min,95%乙醇5min,无水乙醇5min,二甲苯透明10min×2次);(7)用吸水纸擦去样品周围多余的二甲苯,在保持样品湿润的情况下滴加中性树胶,加盖玻片封片;(8)Axioimager.M1正置显微镜(Zeiss,德国)观察颅骨的形态学变化,于10×条件下摄片,颅骨的ROI区域位于拍摄的中央。用显微镜计算机图像分析系统(Image-Proplus6.0),参照Nich和Dempster等报道的方法计算颅骨厚度(Bonethickness,BT;mm)以及骨溶解面积(Boneerodedsurface,BES;mm2)。3.抗酒石酸酸性磷酸酶染色(Tartrate-ResistantAcidPhosphataseStaining,TRAP)抗酒石酸酸性磷酸酶是破骨细胞特有的一种酶,常被用来鉴定成熟的破骨细胞。采用Sigma公司的TRAP染色试剂盒(387A)染色后,成熟的破骨细胞呈紫红色。具体染色方法如下:3.1染色液的配制按照说明书步骤配制TRAP染色液,每次染色时染色液均需新鲜配置。表1:TRAP染色液试剂体积双蒸水(加热至37℃)360mlFastGarnetGBCBase溶液(重氮化的副品红)4mlSodiumNitriteSolution(亚硝酸钠)4mlNaphtholAS-BI磷酸盐溶液4ml醋酸盐溶液16ml酒石酸盐溶液8ml3.2染色步骤(1)每个样品选择5张连续切片,放入烤箱(60℃)内烘烤30min;(2)石蜡切片经二甲苯(15min×2次)脱蜡后,依次经过无水乙醇,无水乙醇,95%乙醇,95%乙醇,90%乙醇、80%乙醇、75%乙醇各5min,双蒸水冲洗;(3)用吸水纸擦干样品周围的水渍,将切片放入丙酮溶液中固定30s;(4)双蒸水冲洗2min;(5)将玻片放入暗盒内,加入新鲜配制的TRAP染液,染液需完全覆盖切片,37℃水浴锅避光孵育1h;(6)双蒸水冲洗2min×3次;(7)苏木素复染2min;(8)自来水冲洗,晾干,中性树胶封片。Axioimager.M1正置显微镜(Zeiss,德国)观察,于20×条件下摄片,颅骨的ROI区域位于拍摄的中央。由于在骨组织中鉴定成熟破骨细胞比较困难,采用Sawyer建立的方法,运用显微镜计算机图像分析系统(Image-Proplus6.0)计算ROI区域内成熟破骨细胞数量及破骨细胞/骨表面积百分比(percentageofosteoclastsurfaceperbonesurface,OcS/BS,%)。4.免疫组织化学染色采用免疫组织化学染色(Immunohistochemistry,IHC)技术检测颅骨ROI区域碱性磷酸酶(alkalinephosphatase,ALP),成骨细胞特异性转录因子Osterix,骨钙蛋白(osteocalcin,OCN),β-连环蛋白(β-catenin),DKK1,核因子-κB受体活化因子配体(receptoractivatorofnuclearfactorkappaBligand,RANKL)以及骨保护素(osteoprotegerin,OPG)的表达变化。具体操作步骤如下:(1)选用Leica公司的防脱玻片,每个样品切5张连续切片,厚5μm;(2)设置烤箱温度在60℃,烤片45min,使切片紧密粘附于玻片上;(3)石蜡切片常规脱蜡至水(二甲苯(15min×2次)脱蜡后,依次经过无水乙醇,无水乙醇,95%乙醇,95%乙醇,90%乙醇、80%乙醇、75%乙醇各5min,双蒸水冲洗);(4)3%的过氧化氢与甲醇按1:50体积比混合,室温浸泡切片15min,灭活内源性过氧化氢酶,双蒸水冲洗5min×3次;(5)配制枸橼酸盐(Sigma)缓冲液,10mmol/L,pH=6.0,煮沸后将切片加入,维持煮沸状态15min×2次;(6)双蒸水冲洗,降至室温;(7)滴加正常马血清封闭30min,保持切片湿润,不必清洗;(8)滴加一抗工作液(ALP,1:500;Osterix,1:100;DKK1:1:500;OCN:1:800;RANKL,1:500;OPG,1:200;TNF-α,1:500;IL-1β,1:500;IL-6,1:600;抗体均购自Abcam公司),4℃孵育过夜,双蒸水冲洗5min×3次;(9)滴加生物素标记的山羊抗兔二抗IgG,室温静置30min,双蒸水冲洗5min×3次;(10)滴加链霉素抗生物素蛋白-过氧化酶,室温静置30min,双蒸水冲洗5min×3次;(11)加入DAB显色液避光显色5min,流水冲洗终止反应;(12)加入IHC专用苏木素染液复染1min,流水冲洗2min;(13)梯度乙醇脱水,二甲苯透明,中性树胶封片;(14)Axioimager.M1正置显微镜(Zeiss,德国)观察,细胞浆或细胞内出现棕(褐)黄色颗粒为阳性细胞,在显微镜下随机选取ROI区域内10个视野进行阳性细胞计数,取平均值。实施例4采用酶联免疫吸附试验(Enzyme-linkedimmunosorbentassay,ELISA)检测外周血中RANKL、OPG、OCN、I型胶原羧基末端肽(C-terminaltelopeptideoftypeIcollagen,CTX)、I型前胶原氨基端肽(N-terminalpropeptideoftypeIprocollagen,P1NP)以及颅骨体外培养上清液中TNF-α、IL-1β和和IL-6的含量。具体操作步骤如下:(1)配制标准品。根据说明书以标准品稀释液稀释标准品,室温放置10min;(2)根据实验设计确定所需板孔数目,并增加1孔作为空白显色液孔;每个样品重复测量2次;(3)取100μl标准品稀释液依次加入标准孔中,1孔加入稀释液作为0孔;(4)取50μl细胞培养上清液加入样品空中,再加入50μl样品稀释液,混匀;(5)在待检测孔中加入50μl生物素结合的抗TNF-α或其它抗体,37℃反应120min;(6)弃反应液体,PBS清洗5次,甩去多余液体;(7)在检测孔中加入100μlStreptavidin-HRP工作液,显色剂空白空除外,37℃孵育30min;(8)弃反应液,PBS清洗4次,甩去多余液体并在吸水纸上拍几下;(9)在每孔中加入100μl显色液,37℃避光孵育30min;(10)在每孔中加入100μl终止液,终止反应;在酶标仪(Bio-Rad)450nm波长处读取每孔的吸光读,根据标准品数据绘制标准曲线,利用曲线拟合计算出待测样品中各因子的含量,每个指标由两名研究者独立重复测量三次,取平均值。应用SPSS11.0统计软件(SPSS,Chicago,IL,USA),数据以均数±标准差()表示,多样本间比较采用单因素方差分析,组间比较采用Tukeypost-hocpairwise分析,统计运算前所有数据均进行方差齐性检验,p<0.05为差异有统计学意义。实施例51.小鼠基本情况各组小鼠均在手术后0.5~1.0h内苏醒,能正常活动、饮水、进食。实验过程中切开无红肿、渗出等改变,均一期愈合。药物治疗组小鼠对Mel耐受性好,体重增加明显;整个实验过程中,无1例小鼠死亡。2.褪黑素抑制钛颗粒引起的炎症反应H&E染色结果显示钛颗粒植入部分可见炎症反应明显,有大量的巨噬样细胞浸润,骨连续性中断,Mel治疗组骨膜内细胞数量减少,炎症反应减轻,骨破坏程度得到改善,且抑制作用呈剂量依赖性(图1)。免疫组织化学染色结果发现TNF-α、IL-1β和IL-6阳性表达定位于胞浆,呈棕黄色,Vehicle组骨溶解处炎症因子TNF-α、IL-1β、IL-6深染区域明显增多。ImagePro-Plus6.0软件计量结果显示Vehicle组TNF-α、IL-1β、IL-6阳性细胞数明显增多,与Sham组比较,差异有统计学意义(*p<0.05,**p<0.01);而经褪黑素治疗后,上述因子的表达明显减少,且抑制作用呈剂量依赖性(图2)。ELISA检测结果显示(表2),颅骨体外24h后,Vehicle组上清液中TNF-α、IL-1β、IL-6的含量分别为241.35±52.36pg/ml、181.45±41.26pg/ml、172.52±15.29ng/ml,与Sham组(113.36±21.08pg/ml、96.45±23.58pg/ml、121.24±18.46ng/ml)比较,差异有统计学意义(p<0.05);Mel治疗组颅骨培养上清液中炎症因子的表达显著减少,与Vehicle组比较,差异有统计学意义(p<0.05)。表2:褪黑素对颅骨体外培养上清液中TNF-α、IL-1β、IL-6表达的影响(,n=5)ShamVehicleLow-MelHigh-MelTNF-α(pg/ml)113.36±21.08241.35±52.36*162.45±24.67*#138.62±19.87#IL-1β(pg/ml)96.45±23.58181.45±41.26*123.50±18.56*#104.23±12.17#IL-6(ng/ml)121.24±18.46172.52±15.29*151.26±14.18*119.25±11.18#注:与Sham组比较,*p<0.05;与Vehicle组比较,#p<0.05。3.褪黑素抑制钛颗粒引起的炎症性骨破坏给药两周后,每组5只小鼠颅骨行micro-CT检测。结果显示钛颗粒植入后小鼠表面虫蚀样破坏明显;经腹腔注射Mel治疗后,颅骨表面的虫蚀样破坏明显减轻,提示Mel能够减轻钛颗粒引起的骨破坏。统计结果表明,Mel治疗后,小鼠颅骨表面骨陷窝数明显减少,骨密度(BMD)、骨体积(BV)和骨体积分数(BV/TV)显著增加,与Vehicle组比较,差异有统计学意义(图3,p<0.05)。4.褪黑素抑制破骨细胞性骨吸收破骨细胞是介导磨损颗粒诱导骨溶解的直接效应细胞。TRAP染色结果发现Sham组仅少量、散在点状阳性改变,钛颗粒植入后颅骨溶解侧可见大片连续的紫红色深染区域;Low-Mel和High-Mel组仅在颅骨溶解边缘有少量阳性区域。骨组织计量学分析结果显示,与Vehicle组比较,Low-Mel和High-Mel组TRAP阳性细胞数分别下降了35.78±6.76%和44.83±10.37%,OCs/BS分别降低了50.14±15.70%和72.76±9.84%,差异有统计学意义(图4,p<0.05)。血清学检测结果显示,Vehicle组骨吸收指标CTX的含量明显增加,与Sham组比较,差异有统计学意义(p<0.05)。Mel治疗后,CTX的表达变化不显著,与Vehicle组比较,差异无统计学意义(表3,p>0.05)。表3:褪黑素对血清中CTX、P1NP、OCN、RANKL、OPG和RANKL/OPG比值的影响(,n=5)ShamVehicleLow-MelHigh-MelCTX35.76±1.9453.58±4.30*51.77±2.9955.15±2.61P1NP35.65±1.7942.58±4.87*54.17±4.31#62.21±2.48#OCN59.93±2.2840.76±4.53*51.66±3.35#63.02±4.03#RANKL157.33±5.47161.12±9.06129.83±12.51#99.17±9.83#OPG2130.33±139.122640.00±247.27*3376.17±208.61#3650.33±193.65#RANKL/OPG0.07±0.010.06±0.01*0.05±0.01#0.03±0.01#注:与Sham组比较,*p<0.05;与Vehicle组比较,#p<0.05。5.褪黑素促进骨溶解局部新骨形成成骨细胞骨形成能力降低是磨损颗粒引起骨溶解的主要病理改变之一。在本研究中,采用免疫组织化学染色的方法发现,在钛颗粒引起的骨溶解局部成骨细胞骨形成相关指标碱性磷酸酶(ALP)、成骨细胞特异性转录因子Osterix和骨钙蛋白(OCN)阳性表达区域有减少;Mel治疗后,ALP、Osterix和OCN阳性细胞数量明显增加,与Vehicle组比较,差异有统计学意义(图5,p<0.05)。进一步检测血清中骨形成指标骨钙蛋白(OCN)和I型前胶原氨基端肽(P1NP)来评价Mel对钛颗粒诱导骨溶解局部新骨形成的影响。结果如表3所示在Vehicle组,血清中OCN的含量为(40.76±4.53)ng/ml,与Control组(59.93±2.28)ng/ml比较,差异有统计学意义(p<0.01);而P1NP在两组中的含量差异无统计学意义(p>0.05)。经Mel治疗后,P1NP和OCN的含量均显著增加,与Vehicle组比较,H-Mel组(50mg/kg/d)P1NP增加了46.1%,OCN增加了54.6%,差异有统计学意义(p<0.01)。6.褪黑素对RANKL/OPG表达的影响RANKL/OPG是调控磨损颗粒诱导骨溶解的关键信号通路。进一步探讨Mel干预对RANKL和OPG在骨溶解局部及外周血中表达的影响。ELISA结果显示,与Sham组比较,Vehicle组血清中OPG的含量增加了23.9%,差异有统计学意义(p<0.05),而RANKL的含量增加不显著,差异无统计学意义(p>0.05)。经Mel治疗2周后,血清中OPG的含量显著上升,与Vehicle组比较,OPG的含量在Low-Mel和High-Mel组分别增加了27.9%和38.3%,差异有统计学意义(p<0.05)。与此相反,Mel治疗后,RANKL的含量显著减少,与Vehicle组比较,Low-Mel和High-Mel组RANKL的含量分别减少了19.4%和38.4%,差异有统计学意义(p<0.05)。Vehicle组RANKL/OPG比值为0.06±0.01,与Sham组(0.07±0.01)比较,差异有统计学意义(p<0.05);而Low-Mel和High-Mel组RANKL/OPG比值分别为0.05±0.01和0.03±0.01,与Vehicle组比较显著降低,差异有统计学意义(表3;p<0.05)。采用免疫组织化学染色的方法检测RANKL和OPG在钛颗粒诱导骨溶解局部的表达,结果表明Vehicle组RANKL棕黄色深染区域明显增多,显微镜下计数结果显示RANKL阳性细胞数比Sham组增加了3.7倍,差异有统计学意义(p<0.01);OPG阳性细胞数在Vehicle组仅略有增加,与Sham组比较,差异无统计学意义(p>0.05)。Mel治疗组RANKL和OPG的表达均受影响,染色结果表明Low-Mel和High-Mel组RANKL阳性细胞明显减少,与Vehicle组比较,差异有统计学意义(p<0.05);而OPG的表达显著增多,与Vehicle组比较,Low-Mel和High-Mel组OPG阳性细胞数分别增加了12.6%和52.4%,差异有统计学意义(图6;p<0.05)。7.褪黑素调控β-catenin和DKK1的表达Wnt/β-catenin是调控骨形成的关键信号通路,采用免疫组织化学染色的方法发现,钛颗粒植入后,小鼠颅骨局部仅有较弱的β-catenin阳性的免疫反应,而Wnt/β-catenin信号通路的抑制因子DKK1的表达明显增强,提示骨溶解局部Wnt/β-catenin信号通路的活性被抑制。Mel治疗后,β-catenin深染区域明显增多,而DKK1阳性细胞数减少,与Vehicle组比较,差异有统计学意义(图7;p<0.05)。综上实验表明,褪黑素能够抑制炎症因子表达,减轻磨损颗粒引起的炎症反应;调控RANKL/OPG,抑制破骨细胞性骨吸收,减轻磨损颗粒引起的骨质破坏;活化骨溶解局部Wnt/β-catenin信号通路,促进骨溶解局部新骨形成。褪黑素在假体松动及其它骨溶解性疾病的治疗中具有较好的应用前景。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1