胆管癌治疗剂的制作方法
本发明涉及胆管癌治疗剂,该治疗剂包含具有fgfr抑制性活性的单环吡啶衍生物或其药理学上可接受的盐。
背景技术:
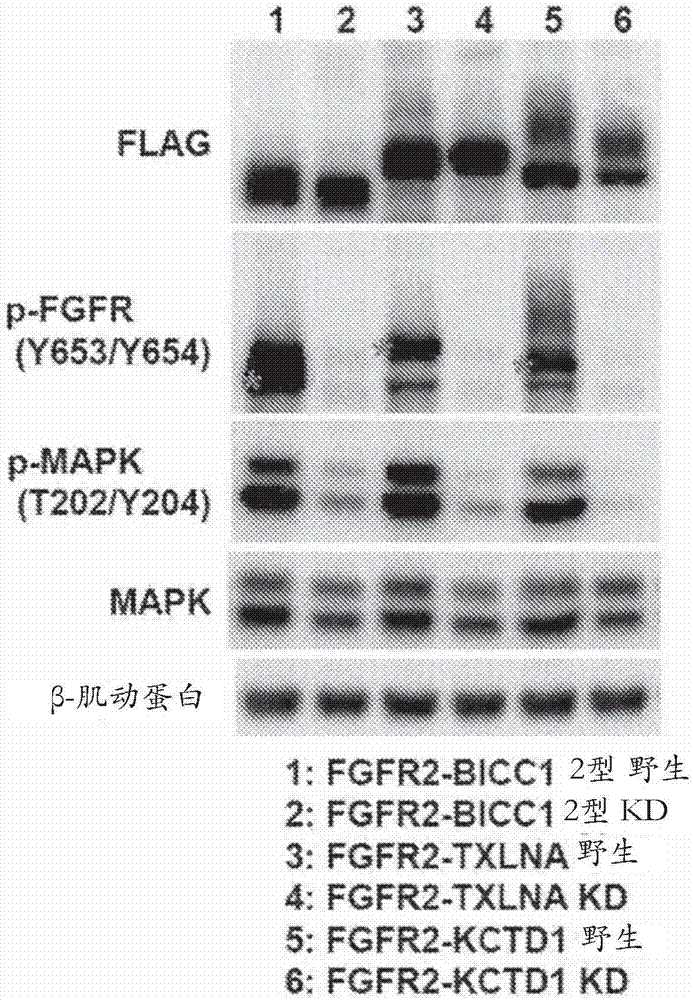
:该化学式(i)所代表的化合物被认为是5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺。据报道,该化学式(i)所代表的化合物对于成纤维细胞增长因子(fibroblastgrowthfactorreceptors,fgfr)1、2和3具有抑制性活性,并且在胃癌、肺癌、膀胱癌和子宫内膜癌中具有抑制细胞生长的活性(专利文献1)。[化学式1]胆管癌发病率低,但被认为是具有不良预后的肿瘤。对于这类胆管癌,主要的治疗方法是胆管的手术切除,但在很多病例中癌细胞不能被完全清除。在这样的病例中,在该手术后实施吉西他滨和顺铂的组合给药(非专利文献1)。引用清单专利文献专利文献1:us2014-235614非专利文献非专利文献1:celinaang,"roleofthefibroblastgrowthfactorreceptoraxisincholangiocarcinoma"[成纤维细胞生长因子受体轴在胆管癌中的作用],journalofgastroenterologyandhepatology[胃肠病学与肝病学杂志],vol.30,p.1116-1122,2015。技术实现要素:技术问题然而,足够的治疗活性尚不能从目前报道的胆管癌治疗剂中获得。问题解决方案鉴于这种情况,诸位发明人进行了深入研究,并且结果是找到了这种化学式(i)所代表的化合物对于胆管癌的治疗是有效的,且完成了本发明。即,本发明提供了以下[1]至[12]:[1]一种胆管癌治疗剂,其包含5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺(由化学式(i)所示)或其药学上可接受的盐。[化学式2][2]根据[1]所述的治疗剂,其中该胆管癌是肝内胆管癌。[3]一种用于胆管癌的治疗的药物组合物,其包含5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺(由化学式(i)所示)或其药学上可接受的盐作为活性成分。[4]根据[3]所述的药物组合物,其中该胆管癌是肝内胆管癌。[5]一种治疗胆管癌的方法,包括向患者给予药理学有效量的5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺(由化学式(i)所示)或其药学上可接受的盐。[6]根据[5]所述的方法,其中该患者在给药前已被证实具有编码fgfr2-融合蛋白的基因。[7]根据[6]所述的方法,其中编码fgfr2-融合蛋白的基因是fgfr2-ahcyl1、fgfr2-bicc11型、fgfr2-bicc12型、fgfr2-txlna或fgfr2-kctd1。[8]根据[5]到[7]中任一项所述的方法,其中该胆管癌是肝内胆管癌。[9]5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺(由化学式(i)所示)或其药学上可接受的盐,用于胆管癌的治疗。[10]根据[9]所述的化合物或其药学上可接受的盐,其中该胆管癌是肝内胆管癌。[11]5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺(由化学式(i)所示)或其药学上可接受的盐用于制备胆管癌治疗剂的用途。[12]根据[11]所述的用途,其中该胆管癌是肝内胆管癌。发明的有利效果根据本发明,可以提供对于胆管癌的治疗有效的治疗剂。附图说明[图1]图1是展示fgfr2-bicc11型和2型基因结构的示意图。[图2]图2是显示蛋白印迹分析结果的图,该分析中的蛋白通过培育转染了不同fgfr2融合基因的小鼠成纤维细胞系nih3t3获得。[图3]图3是显示蛋白印迹分析结果的图,该分析中的蛋白通过培育转染了fgfr2融合基因的nih3t3细胞系获得。[图4]图4是显示蛋白分析结果的图,该分析中的蛋白通过培育转染了不同fgfr2融合基因的nih3t3细胞系获得。[图5]图5是显示fgfr抑制剂活性的图,该抑制剂作用于转染了fgfr2融合基因的nih3t3细胞系的生长能力。[图6]图6是显示fgfr抑制剂活性的图,该抑制剂作用于转染了fgfr2融合基因的nih3t3细胞系的生长能力。[图7]图7是显示fgfr抑制剂活性的图,该抑制剂作用于转染了fgfr2融合基因的nih3t3细胞系的生长能力。具体实施方式本发明的一个实施方案是包含5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺(由化学式(i)所示)或其药学上可接受的盐的胆管癌治疗剂。[化学式3]在本说明书中,药理学上可接受的盐的实例可包括无机酸的盐、有机酸的盐或酸性氨基酸的盐。无机酸的盐的适当实例包括盐酸、氢溴酸、硫酸、硝酸和磷酸的盐。有机酸的盐的适当实例包括羧酸(例如乙酸、琥珀酸、富马酸、马来酸、酒石酸、柠檬酸、乳酸、硬脂酸和苯甲酸)的盐和磺酸(例如甲磺酸、乙磺酸和对甲苯磺酸)的盐。酸性氨基酸的盐的适当实例包括天冬氨酸的盐和谷氨酸的盐。优选的药理学上可接受的盐是琥珀酸盐或马来酸盐,并且更优选的盐是琥珀酸盐。作为这种药理学上可接受的盐,以质量计超出该化学式(i)所代表的化合物1.5倍的含琥珀酸的盐(1.5琥珀酸盐)是特别优选的。根据本发明的由化学式(i)表示的化合物或其药理学上可接受的盐可以通过专利文献1中描述的程序来生产。在本说明书中,术语“胆管”与“胆道”同义地使用。即,胆管癌指肝内胆管癌、肝外胆管癌、胆囊管癌、胆囊癌或十二指肠乳头癌。这种胆管癌也包括这些转移到胆管以外部位的恶性肿瘤。本发明的胆管癌治疗剂对肝内胆管癌特别有效。本发明的胆管癌治疗剂可以处于口服给药的制剂形式,例如固体制剂(如片剂、颗粒、微粒、散剂或胶囊)或溶液、冻胶或糖浆。本发明的胆管癌治疗剂也可以处于非消化道给药的制剂形式,例如注射液、栓剂、软膏或糊剂。当制备口服给药的制剂时,可适当地向由化学式(i)表示的化合物或其药学上可接受的盐添加药学上可接受的载体,例如赋形剂、粘合剂、分解剂、润滑剂和着色剂。制剂(如片剂、颗粒、散剂或胶囊)也可适当地进行包衣。当制备注射液(例如用于静脉给药、肌肉给药、皮下给药或腹膜内给药)时,可适当地向由化学式(i)表示的化合物或其药学上可接受的盐添加药学上可接受的载体(例如ph调节剂、缓冲剂、助悬剂、增溶剂、抗氧化剂、保鲜剂(防腐剂)或等渗剂),并且然后该注射液可通过传统方法进行制备。该注射液也可以冻干以提供使用前溶解的冻干制剂。当制备外用制剂时,可将基础材料添加至由化学式(i)所代表的化合物或其药学上可接受的盐,然后可将上述药学上可接受的载体(例如保鲜剂、稳定剂、ph调节剂、抗氧化剂或着色剂)向其中适当地添加,并且随后,例如透皮制剂(如软膏或贴片)、滴眼剂、鼻用制剂或栓剂可通过传统方法进行制备。可用的基础材料的实例包括常用于药物、类药品、化妆品等的各种材料。本发明的胆管癌治疗剂可用由化学式(i)代表的化合物或其药理学上可接受的盐制备,依据japanesepharmacopoeia16thedition[《日本药典》第16版]中描述的方法。本发明的胆管癌治疗剂中由化学式(i)代表的化合物或其药理学上可接受的盐的剂量可以根据症状的严重程度、年龄、性别、体重、以及患者敏感性的差异、给药方式、给药时间、给药间隔、药物制剂类型等进行适宜地选择。本发明的胆管癌治疗剂,当口服给药时,可以如下给予:对于成人(体重:60kg)而言,由化学式(i)代表的化合物或其药理学上可接受的盐的剂量是每天100μg到10g,优选每天500μg到10g,更优选每天1mg到5g。本发明的胆管癌治疗剂能够每天分成1到3部分进行给药。根据本发明,能够提供治疗胆管癌的方法,该方法包括向患者给予由化学式(i)代表的化合物或其药学上可接受的盐。给药的受试者优选地是胆管癌患者,该受试者更优选地是肝内胆管癌患者,且特别优选地是该受试者是具有编码fgfr2-融合蛋白的基因(fgfr融合基因)的胆管癌患者。fgfr2融合基因是指融合了fgfr2和特定的其他基因的基因,fgfr2融合基因的实例包括fgfr2-bicc11型、fgfr2-bicc12型(seqidno:5)、fgfr2-txlna(seqidno:1)、fgfr2-ahcyl1、fgfr2-ccdc6、fgfr2-kctd1(seqidno:3)、fgfr2-mgea5、fgfr2-tacc3、fgfr2-pphln1、fgfr2-kiaa1598、fgfr2-ccar1、fgfr2-nol4和fgfr2-park2。此处,如图1中所示,fgfr2-bicc11型是指具有与bicc1基因的khkh序列的5’末端位点融合的fgfr2的基因,而fgfr2-bicc12型是指具有与bicc1基因的sam区(不育α基序(sterilemotif))的5’末端位点融合的fgfr2的基因。fgfr2-bicc11型编码由1574个氨基酸组成的多肽,而fgfr2-bicc12型编码由835个氨基酸组成的多肽(seqidno:6)。bicc11型在bicc12型被发现之前也指bicc1。作为胆管癌患者,具有fgfr2-ahcyl1、fgfr2-bicc11型、fgfr2-bicc12型、fgfr2-txlna或fgfr2-kctd1的患者是优选的,具有fgfr2-bicc12型、fgfr2-txlna或fgfr2-kctd1的患者是更加优选的,且具有fgfr2-bicc12型的患者是特别优选的。在给予本发明的胆管癌治疗剂之前,可诊断受到给药的受试者是否具有fgfr2融合基因。诊断fgfr2融合基因的存在与缺失的方法可以是常用的基因诊断法。实例本发明将通过以下实例更详细地进行描述。生产实例1:5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺1.5琥珀酸盐(下文中也称作化合物a)的制备[化学式4]称取2.93g5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺置于茄型烧瓶中,向其中添加60ml乙醇,并且将反应混合物加热至70℃同时在油浴中搅拌至溶解。添加琥珀酸(1.23g),然后停止对该油浴的加热,并且将该反应混合物缓慢冷却。将该反应混合物在室温下搅拌约2小时,并且在5℃下进一步搅拌一小时。所得固体通过过滤收集以得到化合物a(3.70g)。1h-nmr谱(600mhz,cd3od)δ(ppm):1.96-2.10(4h,m),2.52(6h,s),2.93(1h,m),2.96(3h,s),3.01(2h,m),3.16(2h,t,j=5.4hz),3.22(3h,s),3.56(2h,t,j=4.7hz),3.61(2h,m),3.87(2h,t,j=5.4hz),4.14(2h,t,j=4.6hz),6.61(1h,d,j=3.6hz),6.68(1h,dd,j=5.8,2.3hz),7.37(1h,s),7.42(2h,d,j=8.3hz),7.58(1h,d,j=3.6hz),7.73(1h,d,j=2.2hz),7.88(2h,d,j=8.3hz),8.08(1h,s),8.15(1h,d,j=5.8hz)。13c-nmr谱(100mhz,固体状态)δ(ppm):27.1,28.3,29.7,34.8,38.0,41.3,54.0,57.3,59.7,60.9,72.1,72.5,103.3,104.2,108.5,116.9,126.9,128.6,134.5,136.7,140.7,149.4,151.3,155.1,169.5,170.1,175.6,179.9,183.7。fgfr2融合基因的构建fgfr2融合基因的三种cdna类型(fgfr2-bicc12型(seqidno:5)、fgfr2-txlna(seqidno:1)、fgfr2-kctd1(seqidno:3))分别制备自胆道癌患者的癌组织。将编码flag表位标记的核苷酸序列根据翻译阅读框与所得的每个fgfr2融合基因的cdna的n-末端进行连接,并且在pmxs逆转录病毒载体中克隆以构建逆转录病毒。此处,以上所连接的fgfr2融合基因也指作“野生型fgfr2融合基因”。该flag表位标记的肽序列是h2n-dykddddk-cooh(分子量:1,012da)。此处,fgfr2、txlna和kctd1的每个cdna的多核苷酸序列分别对应于seqidno:7、9和11,并且通过fgfr2、txlna和kctd1编码的肽序列分别对应于seqidno:8、10和12。接着构建了具有野生型fgfr2融合基因的逆转录病毒,其中在编码fgfr2激酶区域的两个氨基酸发生了进一步突变。该突变意味着在位置568处的酪氨酸残基被苯丙氨酸取代(y568f)并且在位置569处的酪氨酸残基被苯丙氨酸取代(y569f)。此处,将该野生型fgfr2融合基因通过经受上述突变所获得的基因也指作“kd突变fgfr2融合基因”这些逆转录病毒均被感染至小鼠永生成纤维细胞系nih3t3的细胞以将该野生型fgfr2融合基因或者该kd突变fgfr2融合基因转染入该细胞,以获得稳定表达由每个融合基因编码的蛋白的细胞系。cdna克隆:pmxs载体(细胞生物实验室公司(cellbiolabs)),plat-e逆转录病毒包装细胞(细胞生物实验室公司(cellbiolabs))测试实例1:免疫印迹分析首先,使用逆转录病毒将野生型fgfr2融合基因或kd突变fgfr2融合基因转染进小鼠成纤维细胞系nih3t3,并且将这些得到的细胞系培养于液体培养基。使这些培养的细胞系经受血清饥饿,并且然后在提取总蛋白之前使用含有fgfr抑制剂的培养基进行处理。此处,由fgfr2-bicc12型编码的蛋白、由fgfr2-txlna编码的蛋白和由fgfr2-kctd1编码的蛋白分别示于seqidno:6、2和4。对于这些得到的总蛋白,使用各种抗体通过蛋白质印迹分析对该融合基因的下游信号进行分析。装置:westernbreeze化学发光免疫检测试剂盒(生命技术公司(lifetechnologies))fgfr抑制剂:bgj398(s2183,selleckchemicals公司),储存于10mmdmso溶液pd173074(s1264,selleckchemicals公司),储存于10mmdmso溶液化合物a(储存于20mmdmso溶液)抗体:flag(#635691,克罗泰克实验室有限公司(clontechlaboratories,inc.))phosphofgfr-y653/654(#3476,日本细胞信号技术有限公司(cellsignalingtechnologyjapan,k.k.))phosphoakt1-s473(#4060,日本细胞信号技术有限公司(cellsignalingtechnologyjapan,k.k.))akt-pan(#4691,日本细胞信号技术有限公司(cellsignalingtechnologyjapan,k.k.))phosphostat3-y705(#9145,日本细胞信号技术有限公司(cellsignalingtechnologyjapan,k.k.))stat3(#610189,美国bd公司(bectondickinsonandcompany))phosphomapk-t202/y204(#9106,日本细胞信号技术有限公司(cellsignalingtechnologyjapan,k.k.))mapk(#4695,日本细胞信号技术有限公司(cellsignalingtechnologyjapan,k.k.))β-肌动蛋白(#a5441,西格玛奥德里奇有限责任公司(sigma-aldrichco.llc))。抗体芯片:pathscanrtk信号抗体芯片(化学发光示值读数)(#7982,日本细胞信号技术有限公司(cellsignalingtechnologyjapan,k.k.))所得结果示于图2中。如图2所示,发现mapk基因的磷酸化(mapk基因的活化)依赖于fgfr2激酶活性来发生。即,转染了fgfr2融合基因的nih3t3细胞具有非贴壁依赖性生长能力。在图2中,“野生”意指野生型fgfr2突变的fgfr2融合基因,并且“kd”意指kd突变的fgfr2融合基因。接着,向转染了fgfr2融合基因的nih3t3细胞系加入该fgfr抑制剂后(该fgfr抑制剂的终浓度:0.2μm或0.5μm),使该细胞系经受蛋白质印迹分析并且类似地提取总蛋白。所得结果示于图3中。如图3所示,通过该fgfr抑制剂的处理,fgfr的磷酸化受到抑制,并且mapk的磷酸化受到显著抑制。在图3中,“bg”是指bgj398,“pd”是指pd173074,并且“e9”是指化合物a。具体地,例如,“bg-0.2”意味着添加bgj398使得该终浓度是0.2μm。此外,这些总蛋白类似地提取自未转染该fgfr2融合基因的nih3t3细胞系以及转染了fgfr2-bicc12型、fgfr2-txlna或fgfr2-kctd1的nih3t3细胞系。提取所得的90μg总蛋白通过该pathscan(r)阵列以被用来分析表达的蛋白。如图4所示,检测到磷酸化的akt(pakt-s473)、磷酸化的mapk(pmapk-t202/y204)以及磷酸化的s6核糖体蛋白(ps6-s235/236)。测试实例2:集落形成测定使用以下装置,评估fgfr抑制剂作用于fgfr2融合多肽转化能力的活性。即,将转染了fgfr2融合基因的nih3t3细胞系播种于软琼脂培养基中(培养基中琼脂的浓度:4mg/ml),并且将fgfr抑制剂添加入该培养基(该fgfr抑制剂的终浓度:0.2μm),并且对这种非贴壁依赖性集落形成能力进行评估。装置:cytoselect96-孔细胞转化芯片试剂盒(cba-130,细胞生物实验室公司(cellbiolabs))fgfr抑制剂:bgj398(s2183,elleckchemicals公司),储存于10mmdmso溶液pd173074(s1264,elleckchemicals公司),储存于10mmdmso溶液化合物a(储存于20mmdmso溶液)这些所得的结果示于图5和图6。如图5和图6所示,在这些fgfr2融合基因中,受到fgfr2-txlna和fgfr2-kctd1转染的这些nih3t3细胞的非贴壁依赖性生长受到fgfr抑制剂的添加的显著抑制。另一方面,当使用bgj398或pd173074作为fgfr抑制剂时,受到fgfr2-bicc12型转染的nih3t3细胞的非贴壁依赖性生长几乎不受抑制,而当使用化合物a作为fgfr抑制剂时,它受到显著抑制。在图5和图6中,“bg”是指bgj398,“pd”是指pd173074,并且“e9”是指化合物a。如图7所示,当增加bgj398或pd173074使得该终浓度为1.0μm时,非贴壁依赖性生长受到抑制。在图7中,“bg”是指bgj398,并且“pd”是指pd173074。测试实例3:ic50值的计算(通过集落形成测定)将受到fgfr2融合基因转染的不同nih3t3细胞系在5%co2培养箱(37℃)中用含有10%fbs和青霉素/链霉素(日本和光纯药工业株式会社(wakopurechemicalindustries))的d-mem(日本和光纯药工业株式会社(wakopurechemicalindustries))培养基进行培养和维持。向96孔板(住友培科公司(sumitomobakelite))的每个孔添加50μl含有0.66%琼脂培养基(difco琼脂诺布尔,日本碧迪公司(difcoagarnoble,japanbectondickinson))的d-mem介质(西格玛公司(sigma))(含有10%fbs和青霉素/链霉素)。制备该细胞悬浮液使得该细胞数目是4×104个细胞/ml(通过制备使得表达fgfr2-txlna的细胞的细胞数目是8×104个细胞/ml),将该细胞悬浮液与等量的0.66%琼脂培养基溶液混合,并且使每层50μl的该所得混合物堆积且在4℃下通过冷却30分钟进行凝固。将该板恢复室温后,使每层50μl的0.66%琼脂培养基溶液进一步堆积。将50μl稀释于dmem培养基(含10%fbs)的化合物a添加于各孔,并且置于该5%co2培养箱中(37℃)培养14天。将10μl细胞计数试剂盒(细胞计数试剂盒-8,同仁化学研究所(dojindolaboratories))添加于各孔并置于5%co2培养箱(37℃)中培养1到2小时以得到显色。使用多标签分析仪(arvo,铂金埃尔默有限公司(perkinelmer,inc.))测量450nm处的吸光度。假设化合物a不存在时的吸光度是100%且没有细胞的孔的吸光度是0%,确定化合物a存在时的吸光度。确定抑制细胞生长50%(ic50值)所需的化合物a的浓度,并在表1中展示。[表1]测试实例4:在皮下移植模型小鼠中的抗肿瘤活性(1)皮下移植模型小鼠的制备将转染了各fgfr2融合基因(fgfr2-bicc12型、fgfr2-kctd1、fgfr2-txlna)的nih3t3细胞系培养于含有10%fbs和青霉素/链霉素的dmem培养基中。将d-pbs(-)(和光纯药工业(wakopurechemicalindustries))添加于所得的培养基使得细胞数目是1×107个细胞/ml,以制备各个细胞悬浮液。将这些细胞悬浮液中的每个的100μl皮下移植于7周龄裸鼠(株系:balb/cajcl-nu/nu,雌性,日本clea公司(cleajapan,inc.))的右肋区域以制备fgfr2-bicc12型移植模型小鼠、fgfr2-kctd1移植模型小鼠以及fgfr2-txlna移植模型小鼠。移植六天后,使用数显卡尺(商标名:digimatic(tm)caliper,日本三丰公司(mitutoyocorporation))测量肿瘤的宽度和长度。基于肿瘤的宽度和长度,通过以下计算公式计算肿瘤的体积。肿瘤体积(mm3)=长度(mm)×宽度(mm)×宽度(mm)/2(2)化合物a溶液的制备化合物a溶于注射用水中,并且避光储存于4℃的下直到给药前。当以20ml/kg的剂量对小鼠进行给药时,制备该溶液使得化合物a的剂量是6.25mg/kg、12.5mg/kg、25mg/kg和50mg/kg。(3)药物溶液的给药给药的第一天,基于肿瘤的体积对小鼠进行分组使得这些组的肿瘤体积平均值彼此几乎相等。每个组小鼠的数目是5。将化合物a溶液对该化合物a给药组的小鼠以20ml/kg的剂量每天一次进行持续地口服给药。另一方面,向对照组中的小鼠进行仅溶剂(注射用水)的类似给药。对fgfr2-bicc12型或fgfr2-kctd1移植模型小鼠实行为期7天的给药,并且对fgfr2-txlna移植模型小鼠实行11天。在给药的第一天和最后一天,对对照组和化合物a给药组中的每只小鼠进行体重测量。计算了最后一天的体重与第一天的体重之比(相对体重:rbw)。当化合物a给药组rbw/对照组rbw是0.9或更高,判断该剂量是安全的。对应的剂量是6.25mg/kg、12.5mg/kg、25mg/kg以及50mg/kg。在给药的最后一天,对肿瘤体积也进行了测量。计算了化合物a给药组的小鼠肿瘤体积相对于对照组的小鼠肿瘤体积的百分比(t/c)(%)。每只移植模型小鼠中的t/c(%)结果展示于表2到表4。[表2]fgfr2-bicc12型移植模型小鼠化合物at/c(%)6.25mg/kg80*12.5mg/kg71**25mg/kg68**50mg/kg52**统计学显著性*:p<0.05**:p<0.01[表3]fgfr2-txlna移植模型小鼠化合物at/c(%)6.25mg/kg54**12.5mg/kg43**25mg/kg15**50mg/kg6**统计学显著性**:p<0.01[表4]fgfr2-kctd1移植模型小鼠化合物at/c(%)6.25mg/kg8912.5mg/kg5625mg/kg39*50mg/kg19**统计学显著性*:p<0.05**:p<0.01。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1