胸膜肺炎放线杆菌菌影疫苗的制作方法
本发明属于微生物学和免疫学领域,具体涉及胸膜肺炎放线杆菌菌影疫苗。
背景技术:
猪传染性胸膜肺炎(Porcine contagious pleuropneumonia,PCP)是由猪胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,APP)引起的一种高度传染性、致死性的呼吸道疾病。该病原菌血清型较多,可感染各年龄段猪,且分布范围广,给养猪业带来了极大的经济损失。
现有技术中,每种血清型的APP灭活疫苗只能保护同一血清型的APP菌株攻击,显著提高了疫苗防疫成本。
技术实现要素:
本发明的目的是提供一种胸膜肺炎放线杆菌菌影疫苗,不仅能够完全保护同一血清型胸膜肺炎放线杆菌的攻击,而且能够对其它血清型提供良好的交叉免疫保护,显著降低了疫苗防疫成本。
本发明的目的采用如下技术方案实现:
胸膜肺炎放线杆菌菌影疫苗,含有胸膜肺炎放线杆菌血清1型Shope株菌影。
在本发明中,所述疫苗中的菌数至少为1×109CFU/mL。
在本发明中,所述疫苗是将菌影悬浮液与矿物油按照体积比为1:2.5-3.5混合、乳化后获得的。
在本发明中,所述菌影是将胸膜肺炎放线杆菌血清1型Shope株采用NaOH处理后得到。
优选的技术方案中,NaOH处理时的温度为30-40℃。
优选的技术方案中,所述菌影采用如下方法制备:将培养12-24h的胸膜肺炎放线杆菌血清1型Shope株采用缓冲液悬浮,得到浓度为1×108CFU/mL~1×109CFU/mL的活菌悬浮液;在所述活菌悬浮液中加入2-4mg/ml的NaOH溶液处理40-80min,离心取沉淀,得到菌影;所述活菌悬浮液与NaOH溶液的体积比为1:1。
优选的技术方案中,所述菌影采用如下方法制备:将培养24-72h的胸膜肺炎放线杆菌血清1型Shope株采用缓冲液悬浮,得到浓度为1×108CFU/mL~1×109CFU/mL的活菌悬浮液;在所述活菌悬浮液中加入3.5-6.5mg/ml的NaOH溶液处理55-80min,离心取沉淀,得到菌影;所述活菌悬浮液与NaOH溶液的体积比为1:1。
优选的技术方案中,培养48-72h的胸膜肺炎放线杆菌血清1型Shope株采用4.5-6.5mg/ml的NaOH溶液处理;培养24-48h的胸膜肺炎放线杆菌血清1型Shope株采用3.5-5.5mg/ml的NaOH溶液处理。
有益效果:本发明胸膜肺炎放线杆菌菌影疫苗具有良好的免疫保护效力,可以刺激机体产生高滴度的抗体,不仅能完全保护同一血清型菌株的攻击,而且能够对其它血清型提供良好的交叉免疫保护,显著降低了防疫成本。本发明利用单一的化学试剂替代传统方法来制备胸膜肺炎放线杆菌菌影,提供了一种新的胸膜肺炎放线杆菌菌影制备方法,取得了良好的效果,并且操作简单、快速而高效,显著降低了生产成本。
附图说明
图1最小抑菌浓度的NaOH溶液不同处理时间对培养12h菌液裂解率的影响。
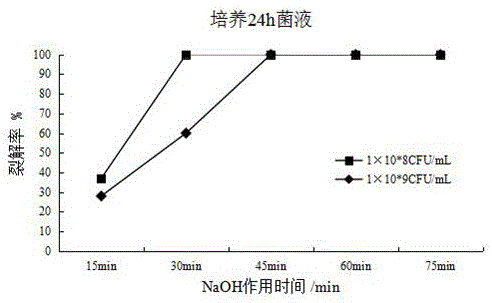
图2最小抑菌浓度的NaOH溶液不同处理时间对培养24h菌液裂解率的影响。
图3最小抑菌浓度的NaOH溶液不同处理时间对培养48h菌液裂解率的影响。
图4最小抑菌浓度的NaOH溶液不同处理时间对培养72h菌液裂解率的影响。
图5APP血清1型Shope株菌影扫描电镜观察,其中图5(B)是未处理的细菌,图5(A)是经NaOH处理制备的菌影。
具体实施方式
下面实施例用于对本发明的进一步说明,但不用来限制本发明的范围。
实施例1制备胸膜肺炎放线杆菌血清1型Shope株菌影
1.细菌的培养
由于APP血清1型Shope株培养72h后,生长已经进入衰亡期,繁殖越来越慢,菌体易发生肿胀或衰变,菌液中存在大量死亡细菌,NaOH与之反应后菌体极易发生皱缩。因此,本发明研究如何将培养时间分别12h、24h、48h、72h的细菌制备成菌影。
将APP血清1型Shope株(邱索平,何孔旺,刘中勇,林志雄,陈文。猪胸膜肺炎放线杆菌PCR快速分型系统的建立及应用。中国动物检疫,2011,28(8):41-45)从冻存管中接入含有0.01%(质量百分浓度)NAD(烟酰胺腺嘌呤二核苷酸)的THB培养基,在37℃条件下培养14-18h,然后按照接种量为2%接入含有0.01%(质量百分浓度)NAD(烟酰胺腺嘌呤二核苷酸)的THB培养基,在37℃、振荡条件下进行培养,培养时间为12h、24h、48h、72h,分别取菌液。
对上述不同培养时间收获的菌液进行如下处理:菌液在4~8℃、9000rpm条件下离心15min,弃上清,用无菌pH 7.4的PBS缓冲液(PBS缓冲液是含有3.2mM Na2HPO4、0.5mM KH2PO4、1.3mM KCl和135mM NaCl的水溶液)洗涤三次后重悬,将不同培养时间收获的菌液均调整至菌数为1×108CFU/mL和1×109CFU/mL。
2.NaOH的抑菌试验
用含有0.01%(质量百分浓度)NAD(烟酰胺腺嘌呤二核苷酸)的THB培养基稀释起始浓度为30mg/ml的NaOH溶液,将其浓度分别调至30mg/mL、25mg/mL、20mg/mL、17.5mg/mL、15mg/mL、12.5mg/mL、10mg/mL、7.5mg/mL、5mg/mL和2.5mg/mL。在96孔微量培养板(8行×12列)中检测不同浓度的NaOH溶液对不同培养时间、不同浓度菌液的抑制作用。每孔中加入100μL菌液和100μLNaOH溶液,然后在37℃孵育24h,读取OD600值。NaOH溶液浓度的考察范围为30mg/mL、15mg/mL、12.5mg/mL、10mg/mL、8.75mg/mL、7.5mg/mL、6.25mg/mL、5mg/mL、3.75mg/mL、2.5mg/mL;菌液培养时间的考察范围为12h、24h、48h和72h;菌液浓度的考察范围为1×108CFU/mL、1×109CFU/mL。阴性对照孔加200μL含有0.01%NAD的THB培养基;阳性对照孔加100μL菌悬液和100μL含有0.01%NAD的THB培养基。
3.最小抑菌浓度的判定
判定标准:孵育24h后,某条件(此处条件是指培养时间和浓度)菌液采用NaOH溶液处理后的OD600值与同样条件菌液的阳性对照孔的OD600值相比无升高,达到上述效果的NaOH溶液的最低浓度为该条件菌液的NaOH最小抑菌浓度。不同培养时间的不同浓度菌液所对应的NaOH最小抑菌浓度如表1所示。结果表明,处理前细菌培养时间越长,对应的NaOH最小抑菌浓度值越高;处理时菌液浓度的高低对其最小抑菌浓度值没有影响,相同培养时间的不同浓度菌液对应的NaOH最小抑菌浓度相同。
表1 NaOH对APP血清1型Shope株的最小抑菌浓度
结合OD600值和电镜观察结果,可见NaOH最小抑菌浓度不仅能够抑制细菌的生长繁殖,并且在裂解细胞时最大程度的避免了细胞因破损严重而导致菌数的减少;若NaOH浓度过高,会引起细菌外膜破损严重甚至完全裂解,失去细菌的形态;若NaOH浓度过低,则达不到能够水解蛋白的浓度,起不到裂解作用,细菌保持原有的成分与活性。
4.菌影制备时NaOH溶液的处理时间
将不同培养时间(12h、24h、48h和72h)的不同浓度菌液(1×108CFU/mL、1×109CFU/mL)与对应的最小抑菌浓度NaOH溶液等体积混合,考察37℃孵育不同时间(15,30,45,60,75min)对制备菌影的影响,用无菌PBS缓冲液代替NaOH溶液与菌液混合作为对照。取100μL经NaOH处理的菌液和加入PBS缓冲液的对照菌液涂于THB(含0.1‰NAD)固体培养基,37℃培养24h,数活菌数,实验平行重复3次取平均值。
制备菌影中NaOH处理的最短时间判定标准:通过平板活菌计数检测NaOH处理后细菌的存活情况,未能检测到活菌存在的最短处理时间为NaOH制备菌影的最短处理时间。
不同培养时间的不同浓度菌液与其对应的最小抑菌浓度NaOH作用,制备菌影所需最短时间如表2所示。结果表明,处理前菌液培养时间越长、菌液浓度越高,制备菌影的时间越长。
表2制备APP菌影中采用最小抑菌浓度NaOH溶液处理的最短时间
5.菌影的保存
NaOH处理后,菌液在4~8℃、9000rpm条件下离心15min,弃上清,用无菌pH 7.4的PBS缓冲液反复洗涤三次后重悬,4℃保存至使用。
实施例2胸膜肺炎放线杆菌血清1型Shope株菌影的制备效果
按照实施例1中方法将培养12h、24h、48h、72h的APP血清1型Shope株调整为两种浓度菌液(1×108CFU/mL、1×109CFU/mL)。将各条件(培养时间、浓度)菌液采用与其对应的最小抑菌浓度NaOH溶液在37℃处理15、30、45、60、75min,离心,取沉淀采用无菌pH 7.4的PBS缓冲液反复洗涤三次后重悬。菌液与NaOH溶液体积比为1:1。对照菌液是在100μL各条件菌液中加入100μL含有0.01%NAD的THB培养基。检测各处理条件下细菌的裂解率,同时进行扫描电镜(ScanningElectronMicroscope,SEM)观察。
1.裂解率
按照如下公式计算裂解率:裂解率=(1-NaOH处理后菌液的CFU/对照菌液的CFU)×100%。
如图1-4所示,各条件(培养时间、浓度)的菌液在其对应最小抑菌浓度NaOH溶液的作用下,60min内裂解率均可达到100%;处理前细菌培养时间越短,菌液浓度越小,裂解完全的时间就越短。
培养时间为12h,浓度为1×108CFU/mL~1×109CFU/mL的菌液,采用2.5mg/mLNaOH溶液处理45~75min,菌体的裂解率达到100%。培养时间为24h,浓度为1×108CFU/mL~1×109CFU/mL的菌液,采用3.75mg/mL NaOH溶液处理45~75min,菌体的裂解率达到100%。培养时间为48h,浓度为1×108CFU/mL~1×109CFU/mL的菌液,采用5mg/mLNaOH溶液处理60~75min,菌体的裂解率达到100%。培养时间为72h,浓度为1×108CFU/mL~1×109CFU/mL的菌液,采用6.25mg/mLNaOH溶液处理60~75min,菌体的裂解率达到100%。
2.扫描电镜观察
分别取经NaOH处理制备的菌影和未处理的菌体,以终浓度为2.5%的戊二醛在4℃固定12h,经多步乙醇脱水,丙酮脱水等常规步骤处理后用扫描电镜进行观察。结果如图5所示,与未处理的细菌(图5(B))相比,经NaOH处理制备的菌影(图5(A)),外膜孔道明显,菌体保留完整的细胞外膜结构,外膜中仍然包含脂多糖和肽聚糖等结构,这些细胞表面结构能够被机体巨噬细胞和抗原递呈细胞识别,进而刺激机体产生免疫保护反应。
在上述实验中,发现培养时间为12、24、48、72h的APP血清1型Shope株采用与其对应的最小抑菌浓度NaOH溶液处理15-75min,当裂解率达到100%时,细菌均形成了菌影,外膜孔道明显,菌体保留完整的细胞外膜结构,外膜中仍然包含脂多糖和肽聚糖等结构。由于培养至12-24h的APP血清1型Shope株生长处于稳定期,细菌繁殖速度渐趋下降,活菌数保持相对稳定,细胞膜结构形态完好;且菌液培养时间短,很大程度上节约菌影处理前的时间,提高了制备的效率;因此,细菌在处理前培养12-24h是制备菌影的最佳阶段。
实施例3胸膜肺炎放线杆菌菌影疫苗的免疫效力试验
1.疫苗制备
(1)对照疫苗的制备
将APP血清1型Shope株、3型S1421株、5a型K17株、7型WF83株(邱索平,何孔旺,刘中勇,林志雄,陈文。猪胸膜肺炎放线杆菌PCR快速分型系统的建立及应用。中国动物检疫,2011,28(8):41-45)菌液分别采用甲醛灭活,然后将灭活菌液与矿物油按照体积比为1:3混合、乳化,得到血清型1型、3型、5a型、7型菌株的油乳剂灭活苗(分别缩写为S1灭活苗、S3灭活苗、S5a灭活苗、S7灭活苗)。各灭活苗的菌数均为1×109CFU/mL。
(2)S1菌影疫苗的制备
按照实施例1中方法培养APP血清1型Shope株,收获培养12h的细菌发酵液,离心,取沉淀用无菌pH 7.4的PBS缓冲液(PBS缓冲液是含有3.2mM Na2HPO4、0.5mM KH2PO4、1.3mM KCl和135mM NaCl的水溶液)洗涤三次后重悬调整菌数为1×109CFU/mL。将1×109CFU/mL的菌液与2.5mg/mL的NaOH溶液等体积混合,在37℃孵育45min,然后离心,取沉淀采用无菌pH 7.4的PBS缓冲液洗涤三次后重悬,得到菌数为4×109CFU/mL的菌影悬浮液。
将菌数为4×109CFU/mL的菌影悬浮液与矿物油按照体积比为1:3混合、乳化,制成1型菌影疫苗(缩写为S1菌影疫苗)。S1菌影疫苗的菌数为1×109CFU/mL。
2.免疫保护试验
将180只5周龄Balb/C小鼠分为15个小组,每个小组12只。随机选择3个小组作为1型攻毒组,3型、5a型、7型攻毒组分别有4个小组。1型攻毒组中的前两个小组分别免疫S1菌影疫苗和S1灭活苗,免疫方式为腹腔免疫,免疫剂量均为0.1mL/只,一免后14d二免,第三小组为不免疫空白对照组。3型攻毒组的前三个小组分别免疫S1菌影疫苗、S1灭活苗和S3灭活苗,免疫方式为腹腔免疫,免疫剂量均为0.1mL/只,一免后14d二免,第四小组为不免疫空白对照组。5a型攻毒组的前三个小组分别免疫S1菌影疫苗、S1灭活苗和S5a灭活苗,免疫方式为腹腔免疫,免疫剂量均为0.1mL/只,一免后14d二免,第四小组为不免疫空白对照组。7型攻毒组的前三个小组分别S1菌影疫苗、S1灭活苗和S7灭活苗,免疫方式为腹腔免疫,免疫剂量均为0.1mL/只,一免后14d二免,第四小组为不免疫空白对照组。
1型、3型、5a型、7型攻毒组Balb/C小鼠均在二免后14天,采用与其组名对应的血清型菌株进行腹腔攻毒,攻毒剂量为各菌株的最小致死量。各攻毒组免疫和攻毒情况见表3-表6。
3.免疫保护结果
从表3可见,S1菌影疫苗和S1灭活苗对APP血清1型Shope株攻毒的保护率都可达100%。
表3 1型攻毒组分组、免疫及攻毒结果
从表4可见,S1菌影疫苗对异型的APP血清3型S1421株攻毒的保护率可达41.7%,不仅高于S1灭活苗对异型的保护率,也高于同型S3灭活苗的保护率。
表4 3型攻毒组分组、免疫及攻毒结果
从表5可见,S1灭活苗对异型的APP血清5a型K17株没有交叉保护性,而S1菌影疫苗可提供66.7%的保护率,且显著高于同型S5a灭活苗的保护率。
表5 5a型攻毒组分组、免疫及攻毒结果
从表6可见,S1灭活苗对异型的APP血清7型WF83株没有交叉保护性,而S1菌影疫苗可提供50%的保护率,与同型S7灭活苗的保护率相当。
表6 7型攻毒组分组、免疫及攻毒结果
4.抗体滴度
上述实验中免疫S1菌影疫苗的小组和不免疫的小组(空白对照组)于免疫后0d、7d、14d、21d、28d分别采血,分离血清,用Shopes株全菌抗原包被酶标板,进行ELISA抗体效价检测,结果见表7。
表7 S1菌影疫苗免疫后抗体效价
从表7可见,与不免疫的空白对照组相比,S1菌影疫苗免疫后14d抗体开始转阳,并且逐渐升高,在28d时比值可达6.4。
从以上结果可知,本发明的胸膜肺炎菌影疫苗可以刺激机体产生高滴度的抗体,不仅可完全保护同型菌株的攻击,而且对其它几个APP主要血清型(3型、5a型、7型)也起到良好的交叉保护作用。
- 还没有人留言评论。精彩留言会获得点赞!